Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Sociedad Química del Perú
versión impresa ISSN 1810-634X
Rev. Soc. Quím. Perú vol.82 no.4 Lima oct./dic. 2016
TRABAJOS ORIGINALES
Estudio de la biosorción de plomo divalente de soluciones acuosas usando biomasa modificada de marlo de maíz (Zea mays)
Study of lead divalent biosorption from aqueous solutions using corncob biomass modified (Zea mays)
Carmencita Lavado Meza*a , Franklin Oré Jiménezb
a Facultad de Ingeniería Ambiental de la Universidad Continental, Av. San Carlos 1980 - Huancayo, e-mail:clavado@continental.edu.pe
b Facultad de Ingeniería Ambiental, Universidad Nacional de Ingeniería, Av. Túpac Amaru 210 - Rímac. Lima-Perú
RESUMEN
Se estudió la remoción de los iones de Pb(II) de soluciones acuosas utilizando la biomasa del marlo de maíz modificado químicamente con una solución 0,2 M de NaOH, mediante un sistema batch, lográndose incrementar la capacidad de adsorción en un 40% frente a su similar sin modificar (ZM). El marlo de maíz modificado (MZM) se caracterizó por espectroscopía infrarroja con transformadas de Fourier (FTIR) determinándose la presencia de grupos funcionales como OH y grupos carboxílicos los cuales estarían favoreciendo el proceso de biosorción, se determinó el área superficial siendo esta igual a 2,2 m2/g. Asimismo, se evaluó la capacidad de adsorción del MZM en función del tiempo de contacto, dosis del biosorbente, pH y concentración inicial de la solución de Pb (II). Las condiciones óptimas para la remoción de Pb(II) fueron 4g/L de MZM, tiempo de agitación de 60 minutos y pH igual a 5,0. Los datos cinéticos se ajustaron al modelo de Pseudo Segundo Orden, los datos experimentales de equilibrio se ajustaron mejor al modelo Langmuir, lo que indicaría una biosorción en monocapa. El MZM posee una capacidad máxima de biosorción de 12,44 mg/g.
Palabras clave: Plomo, biosorción, marlo de maíz modificado, biosorbentes de bajo costo.
ABSTRACT
Removing ions Pb (II) was investigated from aqueous solutions using biomass corn cob chemically modified with a 0,2 M NaOH solution, using a batch system, achieving 40% increase in adsorption capacity compared to similar unmodified (ZM). The corncob modified (MZM) was characterized by infrared spectroscopy Fourier transform (FTIR) determining presence of functional groups such as OH and carboxylic groups which would favor biosorption process, the surface area was determined to be the equal to 2,2 m2/g. Likewise, adsorption capacity versus time MZM contact biosorbent dose, pH and initial concentrationof Pb (II) solution were evaluated. The optimal conditions for the removal of Pb (II) were 4g/L MZM, stirring time 60 minutes and pH equal to 5,0. The kinetic data were fitted to the model of Pseudo Second Order, experimental equilibrium data were better adjusted to the Langmuir model, which would indicate a monolayer biosorption. The MZM has a maximum capacity of biosorption of 12,44 mg / g.
Key words: Lead, biosorption , modified corncob , low cost biosorbents.
INTRODUCCIÓN
La contaminación del agua con metales pesados es uno de los problemas ambientales más severos, debido a su toxicidad, persistencia y bioacumulación, convirtiéndose, así, en un riesgo para la salud humana y el medio ambiente.1
El plomo es un metal pesado muy tóxico, sus efectos sobre la salud humana incluyen anemia, hipertensión, esterilidad, daño a los riñones y retardo mental.2 Algunos métodos convencionales utilizados para la remoción de plomo de aguas residuales son: filtración con membrana, precipitación química e intercambio iónico, estas tecnologías muchas veces resultan no ser utilizadas por el alto costo de operación.3 La biosorción se puede definir como la retención de iones por material biológico no vivo a través de mecanismos fisicoquímicos, el proceso comprende la fase sólida (biosorbente) y la fase líquida (solvente, comúnmente agua) la cual contiene la especie disuelta a ser removida.4 La biosorción se presenta como un método atractivo debido a las ventajas que presenta, como bajo costo, ya que, generalmente se emplea biomasa sin aplicación industrial como restos orgánicos industriales y desechos agrícolas; asimismo, el material puede regenerarse, se puede retener el metal en presencia de otros cationes y es de fácil operación.5 Estudios recientes muestran óptimos resultados cuando el material (biomasa) presenta componentes estructurales como proteínas, polisacaráridos o nucleótidos con diversos grupos funcionales como carbonilos, carboxilos, hidroxilos y grupos aminos o amidas; estos grupos tienen la capacidad de enlazar con los iones disueltos en la solución por atracción electrostática. Los materiales lignocelulósicos contienen uno o más de los grupos mencionados, donde la capacidad de interacción de estos con los iones depende del pH, temperatura, fuerza iónica del medio, características químicas del metal, así como la capacidad adsorbente, la cual, a su vez, depende de la especie periodo estival y zona geográfica. La modificación de la biomasa, ya sea química o física, busca incrementar el área superficial específica (entre el material bioadsorbente y el ion y/o entre el número de cargas y actividad de los grupos enlazantes) y de esta manera darle un valor agregado a la biomasa.6
El marlo de maíz (Zea mayz) es un material lignocelulósico de desecho que se encuentra en abundancia en la región Junín, en Perú, por lo que se plantea la posibilidad de usarlo como biosorbente.
El presente estudio tuvo por objetivo investigar la capacidad de la biomasa modificada químicamente del marlo de maíz para remover Pb (II) de soluciones acuosas, determinar la influencia del pH, dosis de biosorbente, tiempo de adsorción y correlacionar los datos experimentales de equilibrio y cinética de biosorción con los modelos matemáticos
respectivos.
PARTE EXPERIMENTAL
Preparación del biosorbente y la solución de Pb
El marlo de maíz fue recolectado en el distrito de Sicaya de la región Junín en Perú. Para la eliminación de impurezas se lavó el marlo de maíz con abundante agua destilada. Luego el biosorbente fue trasferido a un horno y secado a 60 °C por 24 horas. Las muestras secas fueron molidas y tamizadas con malla 70 µm. Una cantidad de esta biomasa (MZ) fue puesta en contacto con una solución de NaOH (0,2 M) por un espacio de 6 horas con agitación constante, posteriormente se lavó con abundante agua destilada hasta pH constante, finalmente se secó en un horno a 60 oC para obtener la biomasa modificada (MZM). Las soluciones de Pb (II) fueron preparadas disolviendo sal anhidra de nitrato de plomo, Pb (NO ) , (Scharlau,
Lead (II) grade ACS, 99,5%) en agua desionizada.
Caracterización del biosorbente
El área superficial se obtuvo mediante adsorción de N (99,9% pureza) a 77 K en un equipo de adsorción Micromeritics, modelo Gemini VII (serie t). Para la determinación del área superficial y volumen de microporo se utilizaron las ecuaciones de BET (Brunauer- Emmett- Teller) y DR (Dubinin-Radushkevich). Los grupos funcionales en el biosorbente se estudiaron por espectroscopía infrarroja con transformadas de Fourier (FTIR) en un espectrofotómetro SHIMADZU FTIR- 8700; para ello se empleó 0,002 gr de biosorbente y 0,2 gr de KBr, las muestras se homogenizaron y pulverizaron en un mortero de ágata y secadas por 48 h a 60 oC en un horno para luego ser analizadas en un rango espectral de 4000 a 400 cm-1.
Ensayos de biosorción
La biosorción de los iones de Pb(II) de soluciones acuosas se llevó a cabo en un sistema batch, utilizando 100 mL de muestra de solución de Pb(II); los parámetros de velocidad de agitación (150 rpm) y temperatura (20 °C) se mantuvieron constantes.
Se estableció la dosis del biosorbente, utilizando cantidades diferentes del marlo de maíz (0,1; 0,2; 0,4 y 0,8 g) en 100 mL de la solución. Para determinar el equilibrio cinético, se trabajó a diferentes intervalos de tiempo en un rango de 1-180 min. El equilibrio de sorción se evaluó a diferentes concentraciones iniciales del adsorbato en un rango de 5-70 mg/L de Pb(II). El estudio de la influencia del pH se realizó ajustando pH de la solución inicial en un rango de 2-6 utilizando soluciones 0,1 M NaOH y HNO . En cada uno de los casos luego del experimento, las fases se separaron por filtración utilizando papel filtro Wattman Nº 40. La concentración final del plomo en la solución en equilibrio (Ce) se determinó por absorción atómica con un espectrofotómetro marca SHIMADZU modelo AAS 6800 a una longitud de onda de 283,3nm.
La cantidad de iones de plomo retenidos por el biosorbente (q , mg/g) y el porcentaje de biosorción se calcularon mediante las ecuaciones 01 y 02, respectivamente.

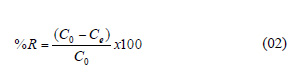
donde: C y C son las concentraciones inicial y final de la solución de los iones de plomo (mg/L) antes y después de la biosorción, respectivamente, M es la masa del biosorbente (g), y V es el volumen de la solución (L).
RESULTADOS Y DISCUSIÓN
Caracterización del biosorbente
Análisis próximo. En la tabla 1 se muestran los resultados del análisis próximo del marlo de maíz modificado.
Análisis textural. El análisis de las propiedades texturales se realizó a través de la determinación y análisis de las isotermas de adsorción de N en el sistema sólido-gas y utilizando las ecuaciones BET. Los resultados se muestran en la tabla 2.
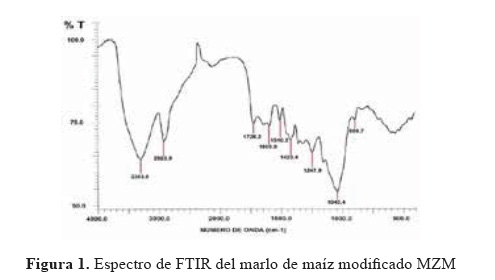
Espectroscopía infrarroja con transformada de Fourier (FTIR).
En la Figura 1 se muestra el espectro del marlo de maíz modificado MZM, donde se reconocen los siguientes grupos: la banda ancha a 3303,8 cm-1, es atribuida a los grupos hidroxilos (-OH), la banda a 2924,9 cm-1 fue asignada a los alcanos (-CH -), los picos intensos a 1726,2 y 1247,9 cm-1 son debidos a la vibración de tensión y flexión en el plano del grupo de los esteres (=C-O-C), la banda a 1620,8 cm-1 es característica del estiramiento asimétrico del doble enlace del carboxilo C=O, la banda a 1510,2 cm-1 es asignada al grupo de los aminos (-NH-), el pico a 1420,4 cm-1 corresponde al estiramiento vibracional del ácido carboxílico (COOH) y la banda a 1043,4 cm-1 fue asignada a los anhídridos. Todas las bandas mencionadas son características en materiales lignocelulósicos.7
Biosorción de plomo
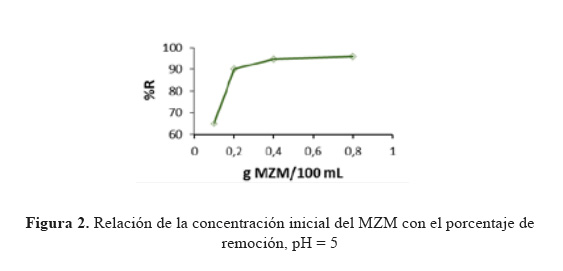
Efecto de la concentración del biosorbente. El efecto de la concentración del biosorbente fue estudiado usando 100 mL de una solución de Pb(II) y diferentes concentraciones del biosorbente. En la Figura 2 se observa el incremento del porcentaje de biosorción a medida que va aumentando la dosis del biosorbente.
Este incremento está relacionado al aumento del área de contacto del sólido adsorbente con el adsorbato, de esta manera va aumentando el número de los sitios de biosorción disponibles. Se observa también que un aumento de la concentración del biosorbente después de 4 g/L no provoca un cambio sustancial en el porcentaje de biosorción motivo por el cual la dosis que se usa en los ensayos próximos es de 4 g/L.
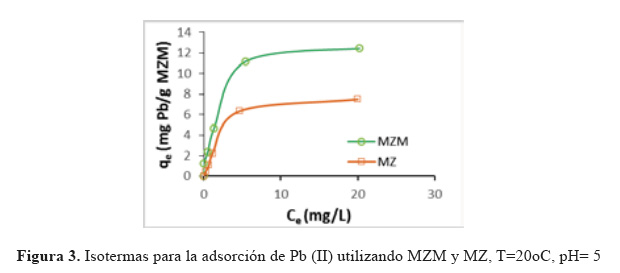
Isotermas de adsorción. Las isotermas de biosorción, representa la cantidad de Pb II (mg) retenido por el biosorbente (g) y describen la manera cómo interactúa el adsorbato con la superficie del material adsorbente.
La isoterma fue obtenida graficando la capacidad de adsorción (q ) expresada en mg de Pb(II))/g de biomasa (MZM) versus la concentración del Pb(II) en equilibrio (C ) y se muestran en la Figura 3. En esta se observa que la curvatura inicial de la isoterma se va separando a medida que se incrementa el valor de C , lo que estaría indicando que las moléculas de Pb(II) tienen más dificultad para encontrar un sitio activo de adsorción. La capacidad de adsorción se incrementa hasta casi alcanzar una condición estable de 12,44 mg Pb(II)/g. Asimismo, se muestra la comparación de la isoterma de biomasa sin modificar (MZ) con la isoterma de la biomasa modificada (MZM) donde se observa que la capacidad de absorción (q ) se incrementa en aproximadamente un 40%, esto se atribuye al aumento de los sitios de adsorción después que la biomasa ha sido modificada.
Correlación de los valores experimentales con los modelos de isotermas. Los datos experimentales fueron correlacionados con dos modelos de isotermas. El modelo de Langmuir asume una sorción del soluto en monocapa con una energía de sorción homogénea.8 Este modelo es expresado mediante la siguiente ecuación:
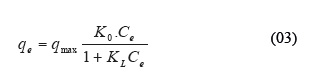
donde: q (mg/g) es la capacidad de sorción en el equilibrio y qmax (mg/g), es la capacidad de sorción en monocapa, K , es una constante que representa la afinidad entre el adsorbato y el adsorbente, C (mg/L), es la concentración del adsorbato en el equilibrio. Los valores de qmax, QO y KL se hallaron luego de graficar Ce/qe versus Ce (Figura 4A). El modelo de Freundlich es una expresión empírica que asume la sorción del soluto en multicapas, considerando que las energías de sorción son heterogéneas.9 El modelo de Freundlich es expresado mediante la ecuación 04.

donde KF (L/g) es una co nstante de la adsorción en equilibrio y n es una constante característica asociada al grado de favorabilidad de la adsorción. Estos valores se hallaron luego de graficar log q e versus log Ce (Figura 4B).
En la tabla 3 se puede observar las constantes de ambos modelos hallados a partir de las ecuaciones linealizadas de las isotermas de la Figura 4. Al examinar las correlaciones se observa que los valores experimentales se ajustan mejor al modelo de Langmuir, el cual explica una sorción en monocapa en centros activos energéticamente homogéneos. Para el modelo de Freundlich, según Kadiverlu10, los valores de n en un rango de 1<n<10 indican una adsorción favorable del adsorbato sobre el adsorbente, el valor de 3,41 se encuentra dentro del rango, lo que indicaría que el ión Pb(II) se retiene favorablemente en la superficie de la biomasa MZM.
El modelo de Langmuir puede explicar la característica de la isoterma en términos del valor de RL el cual es un parámetro de equilibrio definido por la ecuación 05.

Hall et all11 reportaron en sus investigaciones que el valor de RL indica la forma de la isoterma donde si 0<RL<1 esta es favorable. La tabla 4 muestra los valores de RL obtenidos de la adsorción de plomo. Se puede apreciar que los valores de RL se encuentran en el rango en todos los casos, lo que indica que la isoterma es favorable y esa tendencia es mayor cuanto más pequeño sean los valores de RL.
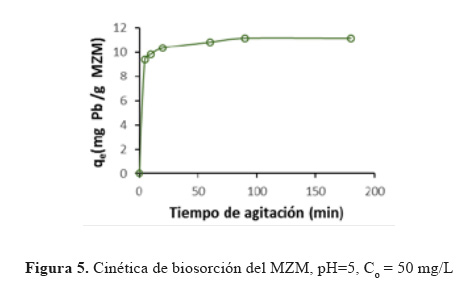
Cinética de biosorción. El proceso de biosorción es dependiente del tiempo y es muy importante saber su comportamiento sobre todo para diseñar el reactor. La biosorción se da en dos etapas: la primera es la más rápida y se lleva a cabo en la superficie de la biomasa, la fase lenta ocurre por difusión del metal en la parte interna de la biomasa.12 En la Figura 5 se muestra el efecto del tiempo de contacto sobre capacidad de adsorción de Pb(II) sobre la biomasa MZM. Se observa que la biosorción es rápida durante los primeros cinco minutos como resultado de la disponibilidad de los sitios de adsorción en MZM, pero el equilibrio se alcanza aproximadamente en 90 minutos, resultados similares reportaron Barka et al.13
Correlación de los datos cinéticos. En el proceso de biosorción los parámetros cinéticos proporcionan importante información para el diseño y modelamiento del proceso. Los datos experimentales obtenidos fueron correlacionados en base a dos modelos diferentes: La ecuación de pseudo primer orden (ecuación de Lagergren) describe la adsorción en sistemas sólido-líquido, basado en la capacidad de sorción de los sólidos.13 Está dada mediante la siguiente ecuación:

donde: qt y qe (mg/g) en cualquier tiempo (t) y en el equilibrio (e) y k1es la constante de velocidad de primer orden (min-1). Este modelo permite obtener la constante de velocidad de pseudo primer orden (k1), considerando que la velocidad de adsorción depende únicamente de la concentración inicial del adsorbato. El modelo de pseudo segundo orden describe la cinética de quimisorción de soluciones líquidas y asume que los iones metálicos se adsorben en dos sitios distintos de sorción de la superficie adsorbente2. Está dado por:
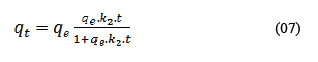
donde k2 es la constante de velocidad de segundo orden (min-1), y se utiliza para calcular la velocidad inicial h (mg/g min), determinada por:

Los valores de las consta ntes de velocidad de los modelos cinéticos en la tabla 5. Al analizar los valores de R2 se determinó que el modelo de pseudo segundo orden es el que mejor se ajusta a los datos experimentales lo que permite establecer que el proceso de adsorción de Pb(II) sobre la biomasa MZM está regida por una reacción de pseudo segundo orden.
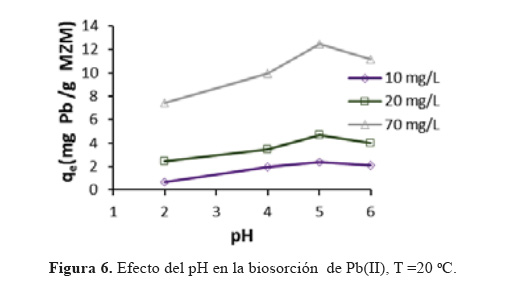
Efecto del pH. Se puede considerar que el pH de la solución es el parámtro más importante que influye en la capacidad de adsorción de metales pesados de un adsorbato sobre la superficie de la biomasa, ya que influye grandemente en las interacciones electrostáticas superficiales entre la biomasa y las diferentes especies químicas puestas en contacto.7. En la Figura 6 se muestra la influencia del pH inicial de la solución sobre la remoción de Pb(II), a diferentes concentraciones iniciales del adsorbato. Para todas las concentraciones iniciales, está claro que, para valores bajos de pH la capacidad de remoción es bastante baja. La capacidad de adsorción de Pb(II) se incrementa con el aumento del valor del pH, alcanzándose una máxima adsorción a pH 5. A valores mayores la capacidad de adsorción disminuye, no se realizaron ensayos a pH mayores que 6 ya que a partir de este valor el plomo empieza a precipitar. Este comportamiento se puede explicar debido a que la pared celular del MZM contiene una cadena de grupos funcionales de ácidos débiles, grupos OH y carboxílicos característicos de materiales lignocelulósicos (esto se puede corroborar con los resultados de FTIR presentados anteriormente). La biosorción se podría estar llevando a cabo debido a dos mecanismos: intercambio iónico e interacciones electrostáticas. A pH<5,0 la especie dominante es el Pb(II) por lo que a valores bajos de pH disminuye la remoción, ya que se tiene una mayor cantidad de iones H3O+ los cuales estarían competiendo con los iones de Pb(II) por los sitios de intercambio en el sistema y a la vez se da una fuerza de repulsión ya que la superficie se encontraría cargada positivamente. Conforme el pH se va incrementando, más grupos funcionales (carboxílicos e hidroxílicos) están disociados y se convierten en provechosos enlazantes de iones Pb(II) debido a que hay menos competencia de iones H+ en la solución y por ende hay una fuerza de atracción entre el metal Pb(II) con la superficie del biosorbente. A pH mayores que 5,0, la especie dominante es Pb(OH)2 lo que favorece a la precipitación del Pb(II).14
CONCLUSIONES
- Se modificó la biomasa proveniente del marlo de maíz con una solución de NaOH logrando un biosorbente con buena capacidad de biosorción de plomo de hasta 12,44 mg Pb/g, lográndose mejorar la capacidad de adsorción en un 40% sobre su similar sin modificar (MZ).
- Se caracterizó el biosorbente MZM cuya área superficial es de 2,2 m2/g y se determinó por FTIR la presencia de grupos funcionales como OH- y grupos carboxílicos los cuales estarían favoreciendo el proceso de biosorción, a través de mecanismo como la interacción electrostática e intercambio iónico entre el adsorbato y superficie del biosorbente.
- Se determinó las condiciones óptimas para la remoción de Pb(II) las cuales fueron de 4g/L de biosorbente, tiempo de agitación de 60 minutos y pH 5,0
- El modelo de las isotermas que tuvo mejor ajuste fue el de Langmuir el cual indica una biosorción en monocapa con un capacidad máxima de saturación de 12,44 mg/g, y para la cinética el modelo que mejor se ajustó a los datos experimentales fue el de pseudo segundo orden.
AGRADECIMIENTOS
Los autores agradecen el apoyo brindado para la elaboración de este trabajo de investigación, a la ingeniera Edith Solano del laboratorio de análisis instrumental de la Universidad Nacional del Centro del Perú. Asimismo, se hace extensivo el agradecimiento al doctor Gino Picasso del laboratorio de investigación de fisicoquímica, Facultad de Ciencias, de la Universidad Nacional de Ingeniería por los análisis de área superficial realizados.
REFERENCIAS BIBLIOGRÁFICAS
1. Stanley E. Manahan. Environmental Chemistry. Eighth Edition. New York: CRC Press, 2005 [ Links ]
2. García G, Colin A. Biosorption of lead by maize (Zea mays) stalk sponge. J Environ Manage. 2010; 91(11): 2079-2086 [ Links ]
3. Hengpeng Y, Zhijuan Y. Adsorption of Pb(II) onto Modified Rice Bran. Nat Resour. 2010; 1:104-109. [ Links ]
4. dos Santos WNL, Cavalcante DD, da Silva EGP, das Virgens CF, Dias F de S. Biosorption of Pb(II) and Cd(II) ions by Agave sisalana (sisal fiber). Microchem J. 2011;97(2):269-73. [ Links ]
5. Ronda A, Calero M, Blázquez G, Pérez A, Martín-Lara MA. Optimization of the use of a biosorbent to remove heavy metals: Regeneration and reuse of exhausted biosorbent. J Taiwan Inst Chem Eng. 2015;51:109-18. [ Links ]
6. Villalobos E, Ramírez l, Aguilar N, Rubio H, Pinedo C, Vélez Sánchez C. Remoción de plomo en solución acuosa por la cáscara de naranja (Citrus sinensis). Investigación y Ciencia. 2014; 62:5-10. [ Links ]
7. Taşar S, Kaya F, Özer A. Biosorption of lead(II) ions from aqueous solution by peanut shells: Equilibrium, thermodynamic and kinetic studies. J Environ Chem Eng. 2014; 2
8. López-Mesas M, Navarrete ER, Carrillo F, Palet C. Bioseparation of Pb(II) and Cd(II) from aqueous solution using cork waste biomass. Modeling and optimization of the parameters of the biosorption step. Chem Eng J. 2011;174(1):9-17. [ Links ]
9. Tunali Akar S, Arslan S, Alp T, Arslan D, Akar T. Biosorption potential of the waste biomaterial obtained from Cucumis melo for the removal of Pb2+ ions from aqueous media: Equilibrium, kinetic, thermodynamic and mechanism analysis. Chem Eng J. 2012;185–186:82-90. [ Links ]
10. Kadirvelu K, Thamaraiselvi K, Namasivayam C. Adsorption of nickel(II) from aqueous solution onto activated carbon prepared from coirpith. Sep Purif Technol. 2001;24(3):497-505. [ Links ]
11. Hall KR, Eagleton LC, Acrivos A, Vermeulen T. Pore- and solid-diffusion kinetics in fixed-bed adsorption under constant-pattern conditions. Ind Eng Chem Res Fundam. 1996: 5(2):212-219. [ Links ]
12. García-Rosales G, Colín-Cruz A. Biosorption of lead by maize (Zea mays) stalk sponge. J Environ Manage. 2010;91(11):2079-86. [ Links ]
13. Barka N, Abdennouri M, El Makhfouk M, Qourzal S. Biosorption characteristics of cadmium and lead onto eco-friendly dried cactus (Opuntia ficus indica) cladodes. J Environ Chem Eng. 2013;1(3):144-9. [ Links ]
14. Boparai HK, Joseph M, O’Carroll DM. Kinetics and thermodynamics of cadmium ion removal by adsorption onto nano zerovalent iron particles. Journal of Hazardous Materials. 15 de febrero de 2011;186(1):458-65.
15. Sekar M, Sakthi V, Rengaraj S. Kinetics and equilibrium adsorption study of lead(II) onto activated carbon prepared from coconut shell. J Colloid Interface Sci. 2004;279(2):307-13. [ Links ]
Recibido el 18.07.2016
Aprobado el 21.12.2016