Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de la Sociedad Química del Perú
Print version ISSN 1810-634X
Rev. Soc. Quím. Perú vol.82 no.4 Lima Oct./dic. 2016
TRABAJOS ORIGINALES
Optimización del proceso Fenton en el tratamiento de lixiviados de rellenos sanitarios
Fenton process optimization in the treatment of landfill leachates lixiviated
Medina Valderrama, Carlos Javier1*, Montero del Águila, Edgar Michel1, Cruz Pio, Liz Erika2
1 Laboratorio de Fisicoquímica, Facultad de Ingenería Química e Industrias Alimentarias. Universidad Nacional Pedro Ruiz Gallo. Lambayeque - Perú, javier.quimico@hotmail.com
2 Laboratorio de Microbiología Industrial y Biotecnología Alimentaria, Facultad de Ciencias Biológicas, Universidad Nacional Mayor de San Marcos. Lima - Perú.
RESUMEN
En el presente estudio se optimizó el proceso Fenton en el tratamiento de los lixiviados del relleno sanitario "Aguas de las Vírgenes", Huancayo-Perú. Los parámetros evaluados fueron: DBO5, DQO, alcalinidad, dureza, pH, conductividad, sólidos totales, turbidez, Pb y Cd. Las muestras fueron tratadas en un sistema de jarras con agitación y para optimizar los valores de aplicación del proceso Fenton se utilizó el diseño Box – Behnken y la metodología de superficies de respuesta. Los valores óptimos se determinaron en dos temporadas, en época de lluvia (pH = 3,19, FeSO4 = 1645,55 mg/L y H2O2 = 1096,55 mg/L) y en época de estiaje (pH = 3,26, FeSO4 = 1788,61 mg/L y H2O2 = 1180,83 mg/L). El indicador de biodegradabilidad obtenido fue 0,568 y 0,329 en época de lluvia y estiaje, respectivamente, con una eliminación cercana al 42% de la DQO en ambas épocas de estudio. El proceso Fenton es una alternativa eficaz para tratamiento de sustancias persistentes en lixiviados y puede ser aplicado como post-tratamiento.
Palabras clave: proceso Fenton, lixiviado, aguas residuales, carga orgánica.
ABSTRACT
In this study Fenton process was optimized in the treatment of landfill leachates "Aguas de las Virgenes", Huancayo-Perú. The parameters tested were BOD5, COD, alkalinity, hardness, pH, conductivity, total solids, turbidity, Pb and Cd. Samples were treated in a system of jars with stirring and to optimize the application values the Box – Behnken design and response surface methodology were used. The values of optimal concentrations were determined in two seasons: rainy seasons (pH = 3.19, 1645.55 mg/L of FeSO4 and 1096.55 mg/L of H2O2) and dry seasons (pH = 3.26, 1788.61 mg/L of FeSO4 and 1180.83 mg/L of H2O2). The optimal reaction time was 20 minutes for both seasons. The Biodegradability indicator was 0.568 and 0.329 in rainy seasons and dry seasons, respectively, with a near elimination of 42% of the COD in both periods. Fenton process is an effective alternative for treatment persistent substances in leachates and can be applied post treatment.
Key words: Fenton process, leachate, landfill, organic load.
INTRODUCCIÓN
Los lixiviados son fluidos que brotan a la superficie o se infiltran hacia el terreno donde se encuentra instalado un relleno sanitario o un vertedero de basura, y arrastran a su paso material disuelto, en suspensión fija o volátil1. Lamentablemente, se utilizan zonas aledañas a los ríos, lagos y acuíferos, como vertederos de residuos sólidos municipales, industriales y comerciales, sobrepasando su nivel de amortiguamiento natural y creando una amenaza latente tanto para el medioambiente como para las personas que puedan hacer uso del agua2. Por ello, estos lixiviados se deben impermeabilizar, drenar adecuadamente, colectar y tratar, ya que existen numerosos reportes del impacto negativo que estos provocan3. Los lixiviados varían según el tipo de residuos que se confinan, nivel de precipitación en el lugar, grado de compactación, velocidades de descomposición química, flujo volumétrico, escurrimiento, evapotranspiración y condiciones de manejo del lixiviado; teniendo en cuenta todo esto, es difícil formular un sistema de tratamiento generalizado1. Una opción atractiva para tratar dichos residuos es la aplicación de Procesos de Oxidación Avanzados, entre ellos, el proceso Fenton, una alternativa viable, efectiva y a costos relativamente bajos que puede ser utilizado como pre o post tratamiento biológico4. El proceso Fenton ocurre cuando se agrega un catalizador de sal ferrosa soluble en agua y peróxido de hidrógeno en un medio ácido, sin necesidad de recurrir a altas presiones, temperaturas o equipos sofisticados4. El responsable de los procesos oxidativos es el radical oxidrilo (OH•), que reacciona rápidamente con muchos compuestos orgánicos (R) de manera no selectiva debido a su elevado potencial de oxidación (2,8 V)5. También es de vital importancia tener en cuenta la dosis correcta de los reactivos a utilizar. Por ello, diversos autores han utilizado el análisis de superficie de respuesta (SR) ya que es el más eficiente y representan mejor los efectos de la interacción entre las variables estudiadas y determinan con mayor precisión la combinación de los niveles que produce el óptimo del proceso6,7. Además, tras la aplicación del proceso Fenton ocurre un cambio estructural sobre los compuestos orgánicos, esto facilita un eventual proceso biológico posterior a elección, pues la oxidación parcial (disminución de la toxicidad del efluente) o la total (formación de sustancias inocuas) hacen posible una descarga segura del efluente sin ningún tratamiento posterior o su conversión en sustancias más fácilmente biodegradables6,7. El proceso Fenton ha sido aplicado para tratar lixiviados de rellenos sanitarios1,3.
En el Perú, el proceso Fenton se ha utilizado en el tratamiento de aguas residuales de una refinería de petróleo6 y en efluentes procedentes de la industria textil8,9. Sin embargo, hasta ahora no se ha utilizado este proceso en el tratamiento de lixiviados de rellenos sanitarios de nuestro país. Los lixiviados generados del relleno sanitario "Aguas de las Vírgenes" (RSAV), no reciben ningún tipo de tratamiento y cuando alcanzan su capacidad máxima, estos son recirculados mediante bombeo hacia el relleno sanitario, la cual agrava el problema en la época de lluvia. Además, tiene una antigüedad de más de 30 años y no tiene un sistema de impermeabilización del suelo, contaminando cuerpos de aguas subterráneos y poniendo en peligro la salud de los habitantes de zonas aledañas. Por ello, los objetivos de este trabajo fueron determinar las características fisicoquímicas del lixiviado del RSAV, calcular su biodegradabilidad, para luego encontrar la dosis óptima de adición del reactivo Fenton y pH tanto para época de lluvia como para la de estiaje.
PARTE EXPERIMENTAL
Toma de muestras de lixiviados
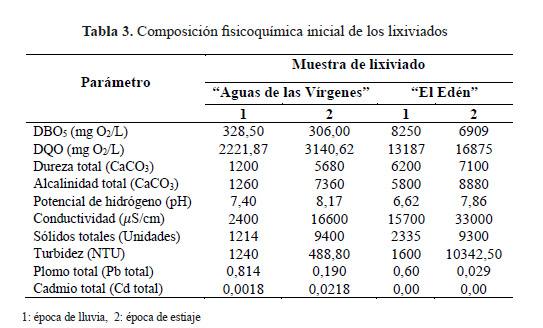
Las muestras fueron colectadas del relleno sanitario "Aguas de las Vírgenes" (RSAV), ubicado en Huancayo, Perú. Se realizaron dos muestreos de las pozas de almacenamiento de lixiviados en la época de lluvia (marzo 2014) y en la época de estiaje (junio 2014). De las tres pozas existentes, se tomaron muestras al azar y se homogenizaron para obtener un volumen de 25 litros de lixiviado para cada época de estudio. Para analizar la reproducibilidad, se tomaron muestras del relleno sanitario "El Edén" (RSE) en los mismos períodos de estudio.
Análisis de las muestras
Los lixiviados fueron pre-filtrados utilizando papel filtro 125 mm de diámetro (Whatman), con el fin de remover partículas grandes, restos orgánicos y para mantener la uniformidad de las muestras. Estas, fueron caracterizadas antes y después del tratamiento Fenton. Se determinaron los siguientes parámetros: pH, demanda bioquímica de oxígeno (DBO ), demanda química de oxígeno (DQO), alcalinidad, dureza, conductividad, sólidos totales (ST), turbidez, plomo (Pb) y cadmio (Cd). Para ello, se emplearon las técnicas establecidas por el Standard Methods10. Además, se utilizó un equipo de prueba de jarras con agitación donde se llevaron a cabo las reacciones.
Determinación de la dosis óptima
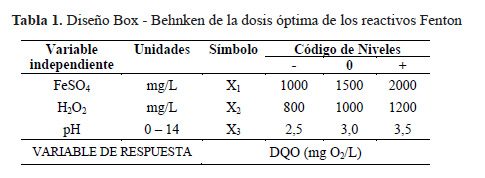
Para determinar la dosis óptima, se empleó el diseño Box - Behnken que contempla tres factores y tres niveles11, para ello se utilizó el programa Statgraphics 5.1 Plus. Se evaluó el efecto de la combinación de tres variables independientes: sulfato ferroso, peróxido de hidrógeno y pH, codificados como X , X y X (Tabla 1). Cada variable se representó en tres niveles: un nivel alto (+), un nivel intermedio (0) y un nivel bajo (-). Como variable de respuesta se utilizó la remoción de contaminantes medidos como DQO.
Oxidación Fenton
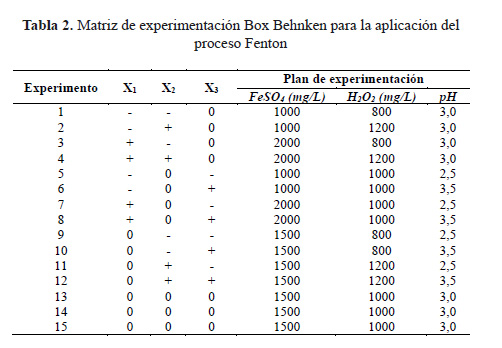
Para estimar el valor óptimo de pH y la dosis óptima del reactivo de Fenton se realizaron 15 ensayos iniciales con dos réplicas en cada época de estudio (Tabla 2). Cada variable se representó de la misma manera que en apartado anterior. El pH de la muestra (500 mL de lixiviado) fue medido utilizando el equipo pHmetro HANNA HI 22113. El pH se ajustó con ácido sulfúrico concentrado (H2SO4 , 96,6% p/p de pureza, ACS Fermont) y se adicionó sulfato ferroso (FeSO4.7H2O, 99% p/p de pureza, Merck), se homogenizó durante 5 minutos a 50 rpm, luego se disminuyó a 30 rpm y finalmente se adicionó peróxido de hidrógeno (H2O2, 30% V/V, Merck), evitando la formación excesiva de espumas. Los valores de pH y la dosis del reactivo Fenton fueron aplicados de acuerdo a la matriz de experimentación (Tabla 2).
Se tomaron alícuotas de las muestras cada 20 minutos durante una hora. El pH se elevó a un valor de 7 con hidróxido de sodio (NaOH, 98 87% p/p de pureza, Loba Chemie). La reacción se detuvo con óxido de manganeso (Merck). Inmediatamente, 2 mL de los lixiviados se colocaron en un vial de análisis de DQO (Merck) y tras su agitación se ubicaron en un termorreactor Laviband ET108 a 150 °C durante dos horas. Transcurrido este tiempo, se efectuaron las lecturas correspondientes en un espectrofotómetro UV-VIS 1203 (Shimadzu) a una longitud de onda de 620 nm. A partir de estos valores se determinó el porcentaje de remoción de DQO.
Tiempo óptimo de contacto del reactivo de Fenton
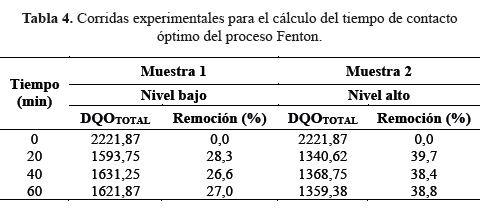
Para el cálculo del tiempo de contacto, se tomaron los valores altos y bajos del reactivo Fenton según la Tabla 1, con un pH ajustado a 3. Ambos niveles estudiados a una presión y temperatura ambiente. Alícuotas de los lixiviados fueron tomadas a 0, 20, 40 y 60 minutos. Luego el pH se ajustó a 7 con NaOH 5M y se agregó 0,5 g de MnO2 que favoreció la precipitación del fierro y detuvo la reacción.
Índice de Biodegradabilidad (IB) de los lixiviados
El IB se obtuvo tras calcular el ratio de los valores de DBO5 y DQO. Esta relación indicó
qué fracción de la materia orgánica total existente en la muestra puede descomponerse biológicamente. Así, muestras fácilmente biodegradables presentan valores de IB > 0,60. Muestras parcialmente biodegradables presentan valores de IB entre 0,41 – 0,59 y aquellas con contenido orgánico persistente y que no son biodegradables presentan valores de IB < 0,412.
Porcentaje de remoción de DQO
El cálculo del porcentaje de remoción de DQO se realizó con la siguiente fórmula:
Remoción de DQO (%) = [(DQOINICIAL– DQOREMANENTE) / DQOINICIAL] *100.
Los datos de remoción de DQO fueron analizados con el programa Statgraphics 5.1 Plus. El punto óptimo se calculó aplicando la metodología de Superficie de Respuesta (SR). Las medias se contrastaron utilizando el método de la diferencia mínima significativa, con un nivel de significación de P < 0,05.
RESULTADOS Y DISCUSIÓN
Caracterización fisicoquímica de los lixiviados crudos
En la Tabla 3 se muestran los resultados de la caracterización inicial de los lixiviados del RSAV y RSE. En la época de estiaje se observa un incremento en todos los parámetros medidos en los lixiviados de RSAV, menos la DBO que disminuyó ligeramente. Similares tendencias se observaron en los lixiviados de RSE. Esto podría explicarse por qué en el mes de marzo del 2014 se registró en Huancayo una precipitación acumulativa de 179,7 mm21, que propició una dilución de los lixiviados y por ende la disminución de las concentraciones de los contaminantes. Mientras que en época de estiaje, los lixiviados se concentraron por efecto de la evaporación, lo que influyó en el incremento del 30% de DQO, respecto a la época de lluvia en lixiviados de RSAV y del 22% en la muestra comparativa de RSE. Esto debido a que en junio del 2014 se registró 0,3 mm de precipitación acumulativa13. Sin embargo, los niveles de radiación solar fueron relativamente altos13 y propiciaron la evaporación de la humedad del relleno y por ende la concentración de los lixiviados generados. En general, los lixiviados del RSAV presentaron menores valores de DQO en ambas épocas de estudio en comparación con las del RSE, esto se debe a que este último es más joven que el estudiado.
Asimismo, no se observaron cambios importantes en el pH de los lixiviados entre ambas épocas de estudio, ya que la diferencia fue de 0,77 unidades para los lixiviados del RSAV y de 1,44 para los lixiviados del RSE. También, valores de pH comprendidos entre 6,5 y 8,8 han sido reportados previamente por Méndez y col.1,3 y Primo5.
En la época de estiaje, la conductividad se incrementó en 85% y 52% en los lixiviados del RSAV y RSE, respectivamente, mientras que en época de lluvia sufrieron una gran dilución. Similares valores de conductividad obtuvieron Méndez y col.1 y Escudero2. Los parámetros de alcalinidad total, dureza total, turbidez y sólidos totales coinciden con los valores citados por Méndez y col.1,3 y Primo5. En cuanto al contenido de metales pesados en la época de lluvia, se observó que la presencia de plomo fue mayor en los lixiviados del RSAV y RSE (80% más que en época de estiaje). Mientras que en época de estiaje se observó el cadmio en pequeñas concentraciones en los lixiviados del RSAV. No obstante, este metal no fue detectado en los lixiviados del RSE. La presencia de estos metales es propia de los lixiviados que arrastran a su paso; sin embargo, la existencia de relaves mineros en las cercanías de dichos rellenos también podrían contribuir en el incremento de sus concentraciones, sobre todo durante el mes de marzo cuando los vientos favorecen su movilización.
Optimización del tiempo de contacto del reactivo de Fenton
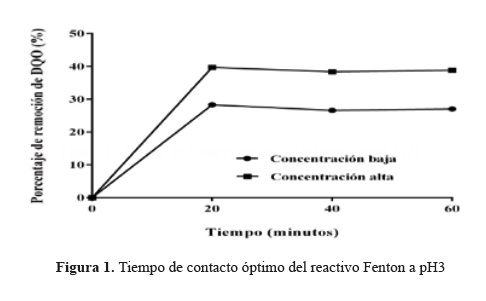
En la Tabla 4 se muestran los valores de remoción de DQO en dos niveles, bajo y alto. El nivel bajo del reactivo Fenton con FeSO (1000 mg/L), H O (800 mg/L) a pH 2,5 y el nivel alto del reactivo Fenton con FeSO (2000 mg/L), H O (1200 mg/L) a pH 3,5. Se observó que a partir de los 20 minutos los porcentajes de remoción muestran un comportamiento asintótico (Figura 1) y conforme avanza el tiempo de contacto, estos porcentajes de remoción promedio de DQO presentaron un comportamiento constante. Por ello, se determinó como óptimo el tiempo de 20 minutos. Valores muy próximos también fueron reportados previamente por Méndez y col1,3.
Condiciones óptimas de aplicación del proceso Fenton
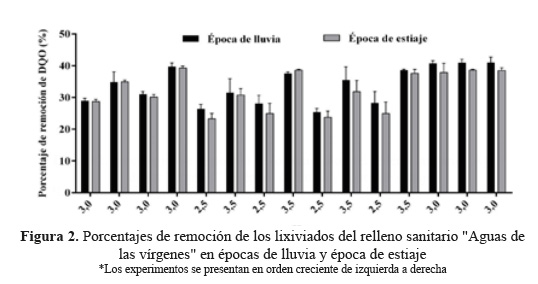
En la Figura 2 se muestran los porcentajes de remoción de DQO a las condiciones establecidas según el diseño experimental Box ambas épocas de estudio Se realizó una corrida inicial con dos réplicas para minimizar el ruido experimental, haciendo un total de 45 ensayos para el período de experimentación. En época de lluvia como en la época de estiaje, se observaron tendencias similares y se detallan a continuación: *los experimentos 5, 7, 9 y 11 presentaron valores bajos de remoción de DQO, debido a que los valores de pH no fueron los óptimos, esto puede explicarse desde tres puntos de vista: primero, el [Fe(H2O)]+2 formado reaccionó lentamente con el H2O2 y produjo menos radicales OH; segundo, el efecto de barrido del H+ sobre el OH fue más importante a pH bajo y tercero, que el pH ácido inhibió la reacción entre el Fe+3 y el H2O2 14. Valores de pH por encima de óptimo también obstaculizaron el proceso Fenton (Figura 2). *Los experimentos 8, 10 y 12 muestran remociones aceptables que no están muy alejadas del valor óptimo, sin embargo, estos valores de pH son próximo a 4 se inicia el proceso Fenton de inhibición en fase homogénea14.
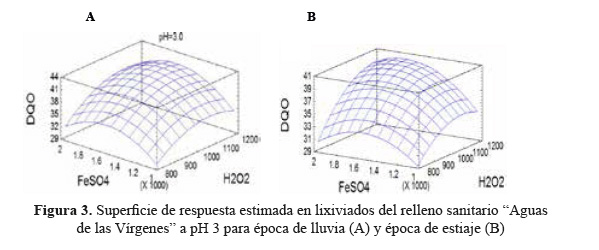
Las condiciones óptimas del proceso Fenton, para la época de lluvia y estiaje en lixiviados del RSAV, se calcularon con el software Statgraphics 5.1 plus, se seleccionó y se adecuó el diseño Box - Behnken. Se obtuvo una SR para la remoción de DQOTOTAL como se muestra en la Figura 3 (A y B). El comportamiento tridimensional en ambas épocas de estudio se ajustó a un modelo de segundo orden, lo que supone un punto óptimo del proceso Fenton sobre los lixiviados.
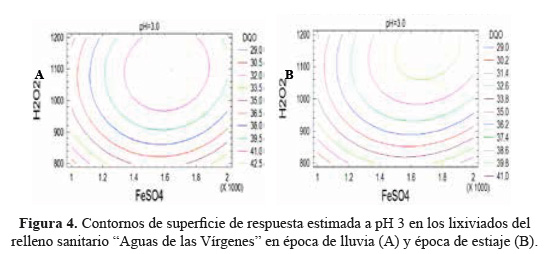
En la Figura 4 (A y B), se muestran las proyecciones bidimensionales de la SR para la época de lluvia y de estiaje. Cada línea de contorno indicó un número infinito de combinaciones de las cantidades de reactivo de Fenton y pHs para la degradación de lixiviados.
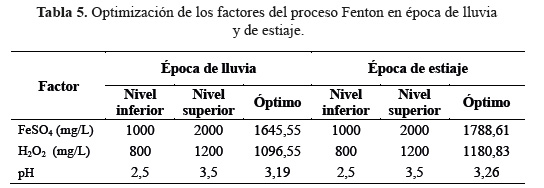
Los puntos dentro de las elipses más pequeñas de la figura de contornos (Figura 4A y 4B) representaron los valores óptimos de la aplicación del proceso Fenton. Para la época de lluvia correspondió a 1645,55 g/mL de sulfato ferroso, 1096,55 g/mL de peróxido de hidrógeno y 3,19 para el pH (figura 4A). Mientras que para la época de estiaje correspondió a 1788,61 mg/L de sulfato ferroso, 1180,83 mg/L de peróxido de hidrógeno y 3,26 para el pH (Figura 4B). Los valores óptimos del pH en época de lluvia y estiaje fueron muy próximos al valor de 3 (Tabla 5), reportado como el ideal por Méndez y col.1 y Primo5.
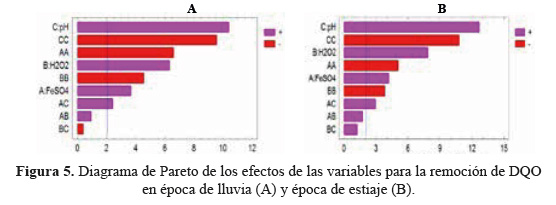
Siete de los efectos que influyen en el porcentaje de remoción de la DQO del RSAV en ambas épocas de estudio fueron estadísticamente significativos a un 95% de nivel confianza. Además, el R2 ajustado en época de lluvia y estiaje fue 87,8% y 90,3%, respectivamente, esto indicó que la remoción de DQO depende fuertemente del pH, la concentración de sulfato ferroso y peróxido de hidrógeno, las interacciones y efectos cuadráticos, tal como se puede apreciar en el diagrama de Pareto de la Figura 5A y 5B. La longitud de cada barra es proporcional al efecto estandarizado (el efecto estimado dividido por su error estándar) y los efectos fueron significativos, ya superaron la línea vertical.
De lo expresado anteriormente, se estableció que el pH fue el factor de gran importancia para el buen desempeño del proceso Fenton en época de lluvia y de estiaje, seguido por la adecuada dosificación de sulfato ferroso y peróxido de hidrógeno.
El modelo matemático que representó mejor el comportamiento del nuevo sistema para la época de lluvia es el siguiente (Ec. 1):
DQO = - 325.742 + 0.031966 A + 0.166792 B + 157.183 C – 1.78*10-5 A2 +
6*10-5 AB + 6.2667*10-3 AC – 7.66667*10-5 C2 – 2.66667*10-3 BC – 25.7333 C2 (Ec. 1)
Mientras que para la época de estiaje, el modelo matemático del nuevo sistema fue el siguiente (Ec. 2):
DQO = - 274.56 + 9.71667* 10-3 A + 9.76597*10-2 B + 153.442*C - 1.26278*10-5 A2
+ 1.05*10-5 AB + 7.06667*10-3 AC - 5.95486*10-5 C2 + 7.41667*10-3 BC - 26.7944 C2 (Ec. 2)
En estas ecuaciones, A, B y C representan al FeSO , H O y pH, respectivamente. No se observó la dispersión de los datos. Además, el modelo de regresión propuesto fue aceptable, pues el error estándar de la estimación presentó una desviación normal con residuos de 2,24 y 2,086 en época de lluvia y de estiaje, respectivamente. Por otro lado, el error absoluto de la media fue 1,52 y 1,39 en época de lluvia y de estiaje, respectivamente, considerándose aceptable para ambos períodos.
Tratamiento Fenton con los parámetros optimizados
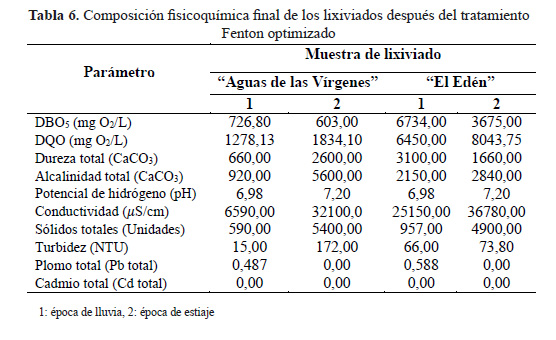
Tras aplicar los parámetros optimizados, se observó una mejora en la mayoría de los parámetros fisicoquímicos de los lixiviados del RSAV tanto en época de lluvia como en época de estiaje (Tabla 6).
El cambio de pH (medio ácido) en época de lluvia, influyó en la disminución de la alcalinidad (27%), dureza total (45%), redujo el efecto tampón y la fuerza iónica de la solución, favoreciendo la floculación y precipitación de la materia coloidal presente en los lixiviados25 y por ende mejoró el valor de la turbidez (98%). También se observó una disminución de los sólidos totales (51%), plomo (40%) y cadmio (100%). La disminución o eliminación total de la concentración de metales pesados puede explicarse por la presencia de carbono orgánico coloidal en los lixiviados, y cómo estos tienen la capacidad de adsorber altas concentraciones de metales en su superficie, pueden ser eliminados conjuntamente con los coloides cuando son floculados y precipitados15.
En época de estiaje también se observó importantes reducciones en la dureza total (54%), alcalinidad (24%), sólidos totales (43%), turbidez (65%) y la totalidad de los metales pesados. Además, la conductividad se incrementó en un 63% en época de lluvia y 37% en época de estiaje. Esto puede explicarse por el hecho de que para alcanzar los pHs óptimos se necesitó la adición de más ácido en los lixiviados lo que propició el incremento de este parámetro. Además, la sal de fierro adicionada durante el tratamiento y neutralización de los lixiviados a pesar de que fue removida en forma de lodos, aún se mantuvo los remanentes iónicos en la solución15, lo que pudo ocasionar el incremento de la conductividad.
Biodegradabilidad
En la Tabla 7 se muestran los índices de biodegrabilidad antes y después del tratamiento Fenton en ambas épocas de estudio. En los lixiviados RSAV, los valores iniciales de IB tanto en época de lluvia y de estiaje fueron de 0,148 y 0,097, respectivamente.
Este hecho aunado con el bajo contenido de DBO5, en ambas épocas de muestreo, hace suponer la escasa presencia de materia biodegradable y persistente, existiendo la probabilidad de que se liberen grandes moléculas orgánicas recalcitrantes que proceden de los mismos residuos sólidos confinados2. Similares valores de IB obtuvo Escudero2 y observó que estos valores producían una inhibición del metabolismo microbiano en un proceso de oxidación biológico. Es por ello que en este estudio se optó por un tratamiento fisicoquímico para poder reducir la carga orgánica persistente no biodegradable.
Con respecto al RSE, en la época de lluvia el IB fue mayor a 0,6 lo que advirtió que eran lixiviados con material orgánico fácilmente biodegradable, mientras que en la época de estiaje el IB fue ligeramente mayor a 0,4, lo que indicó la presencia de material orgánico parcialmente biodegradable, y por lo tanto la factibilidad de aplicar el proceso Fenton como post tratamiento. Sin embargo, tras la aplicación de los parámetros optimizados, el IB de los lixiviados del RSAV incrementó en 0,420 y 0,232 en época de lluvia y en época de estiaje, respectivamente. Si bien los IB mejoraron notablemente aún existe material orgánico parcialmente biodegradable en la época de lluvia y persistente en la época de estiaje. Esto podría estar relacionado con la presencia de ácidos húmicos altamente resistentes a la degradación biológica y la antigüedad del relleno sanitario. Los lixiviados del RSE presentaron valores de IB por encima de la unidad en época de lluvia, lo que hace referencia de que el contenido orgánico presente en este lixiviado es fácilmente biodegradable. No obstante, es parcialmente biodegradable en época de estiaje.
CONCLUSIONES
Se han observado importantes diferencias en las características fisicoquímicas del RSAV en ambas épocas. En época de estiaje hubo mayor concentración de contaminantes comparado con la época de lluvia, lo que refleja la influencia de las condiciones ambientales del lugar y la naturaleza de los residuos sólidos confinados en la composición del mismo. El tiempo de contacto óptimo fue 20 minutos. La metodología de superficie de respuesta indicó que en la época de lluvia, el pH óptimo fue 3,19 y las concentraciones óptimas de sulfato ferroso y peróxido de hidrógeno fueron 1645,55 mg/L y 1096.55 mg/L, respectivamente. Mientras que en la época de estiaje el pH óptimo fue 3,26 y las concentraciones óptimas de sulfato ferroso y peróxido de hidrógeno fueron 1788,61 mg/L y 1180,83 mg/L, respectivamente. El índice de biodegradabilidad de los lixiviados del RSAV mejoró notablemente tanto para la época de lluvia (IB = 0,568) como para la de estiaje (IB = 0,329), sin embargo, dichos índices sugieren que el proceso Fenton debe ser optimizado aún más para obtener un lixiviado con mejores características biodegradables.
REFERENCIAS BIBLIOGRÁFICAS
1. Méndez RI, Castillo ER, Sauri MR, Quintal CA, Giácoman G, Jiménez B. Comparación de cuatro tratamientos fisicoquímicos de lixiviados. Rev Int Contam Ambient. 2009; 25(3):133-145. [ Links ]
2. Escudero CJ. Tratamiento de lixiviados provenientes de un vertedero de residuos sólidos urbanos mediante la aplicación de sistemas fisicoquímicos a escala laboratorio. [tesis de maestría]. Guanajato: Universidad de Guanajuato; 2012. [ Links ]
3. Méndez RI, García RB, Castillo ER, Sauri MR. Tratamiento de lixiviados por oxidación Fenton. Ingenieria e Investigación. 2010; 30(1): 80 – 85. [ Links ]
4. Hermosilla D, Cortijo M, Huang CP. Optimizing the treatment of landfill leachate by conventional Fenton and photo-Fenton processes. Sci Total Environ. 2009; 407: 3473– 3481. [ Links ]
5. Primo Martínez O. Mejoras en el tratamiento de lixiviados de vertedero de RSU mediante procesos de oxidación avanzada. [Tesis Doctoral]. Santander: Universidad de Cantabria; 2008. [ Links ]
6. Salas G, Ale N. Tratamiento de las aguas residuales de una refinería de petróleo por oxidación avanzada (AOX), usando el reactivo fenton (H O /FE2+). Rev Per Quim Ing
7. Bianco B, Michelis ID, Vegliò F. Fenton treatment of complex industrial wastewater: optimization of process conditions by surface response method. J Hazard Mater. 2011; 186: 1733–1738. [ Links ]
8. Salas G. Tratamiento por oxidación avanzada (reacción fenton) de aguas residuales de la industria textil. Rev Per Quim Ing Quim. 2010; 13 (1): 30-38. [ Links ]
9. Gamarra C, La Rosa-Toro A. Decoloración del anaranjado de metilo empleando el sistema fenton. Rev Soc Quím Perú. 2014; 80 (1): 24-34. [ Links ]
10. American Public Health Association, APHA. Standard Methods for the Examination of Water and Wastewater. 18th Ed. Washington: American Public Health Association; 1992. [ Links ]
11. Montgomery DC. Diseño y análisis de experimentos. 2ª Edición. México D.F.: Editorial Limusa Wiley; 2005: 1- 459. [ Links ]
12. Blanco Jurado J. Degradación de un efluente textil real mediante procesos Fenton y Foto-Fenton. [Tesis de Maestría]. Barcelona: Universidad Politécnica de Catalunya; 2009. [ Links ]
13. Servicio Nacional de Meteorología e Hidrología Región Junín. SENAMHI; 2014. [ Links ]
14. Deng Y, Englehardt JD. Treatment of landfill leachate by the Fenton process. Water Res. 2006; 40: 3683 – 3694. [ Links ]
15. Giácoman VG, Quintal Franco C. Influencia del cambio en el potencial de hidrógeno (pH) en la disminución de contaminantes y metales pesados del lixiviado de un relleno sanitario. XXX Congreso Interamericano de Ingeniería Sanitaria y Ambiental – AIDIS; 2006 Nov 26 – 30; Punta del Este, Uruguay.
Recibido el 21.11.2016
Aprobado el 02.01.2017