Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de la Sociedad Química del Perú
Print version ISSN 1810-634X
Rev. Soc. Quím. Perú vol.83 no.4 Lima Oct./Dec. 2017
TRABAJOS ORIGINALES
Estudio químico de las hojas de Datura candida (Pers.) Saff
Chemical Study of the Leaves of Datura candida (Pers.) Saff
Billy Cabanillas Amadoa, Víctor Reyna Pinedoa* y Virginia Torpoco Carmena
a Facultad de Ciencias, Universidad Nacional de Ingeniería, Av. Túpac Amaru 210, Lima 25, Perú. vrey26@yahoo.es
RESUMEN
De las hojas de Datura candida (Pers.) Saff, colectadas en Huancabamba (Piura), se aislaron escopolamina (1) y norescopolamina (2) como los principales alcaloides, los cuales fueron identificados mediante el análisis de sus espectros de masas y de RMN. Adicionalmente, se realizó el análisis cualitativo de los metabolitos secundarios y la cuantificación de alcaloides presentes en las hojas1.
Palabras clave: Datura candida, alcaloides tropanicos, escopolamina, norescopolamina.
ABSTRACT
From of leaves of Datura candida (Pers.) Saff collected in Huancabamba (Piura) were isolated scopolamine (1) and norscopolamine (2) as principal alkaloids. The structures were determinate by analysis of the MS and NMR data. Furthermore, the qualitative analysis and quantitative determination of alkaloids were performed.
Key words: Datura candida, tropane alkaloids, scopolamine, norscopolamine.
INTRODUCCIÓN
El género Datura, perteneciente a la familia Solanaceae, incluye cerca de nueve especies principalmente distribuidas en América central y del sur2. Estas especies son consideradas una rica fuente de alcaloides tropánicos de interés medicinal, siendo los principales la escopolamina y la hiosciamina, los cuales son utilizados como agentes anticolinérgicos que actúan sobre el sistema nervioso parasimpático3. No obstante que se ha conseguido la síntesis total de estos alcaloides, hasta la fecha la escopolamina y varios alcaloides tropánicos son producidos principalmente en plantas con ayuda de la ingeniería genética3,4.
Las especies del género Datura son utilizadas tradicionalmente como plantas ornamentales y también son empleadas en la medicina tradicional. Datura candida (o Brugmansia candida) es una planta utilizada tradicionalmente para tratar traumatismos, dolores reumáticos, diarreas o úlceras5,6.
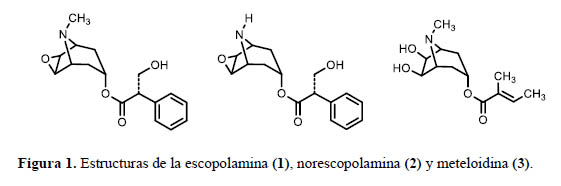
En la bibliografía se reportan estudios realizados a ejemplares de Datura candida cultivados en Australia e Inglaterra que difieren en la composición de alcaloides7-9. En todos los casos se reporta a la escopolamina (1) como el alcaloide principal (figura 1).
A continuación, se describe el estudio cualitativo, cuantitativo y el aislamiento e identificación de los dos principales alcaloides presentes en las hojas de D. candida.
PARTE EXPERIMENTAL
Materiales y equipos
El contenido total de alcaloides se determinó con un potenciómetro Mach EC20. Los espectros de masas fueron registrados en un espectrómetro Waters-Micromass. Las cromatografías en columna se realizaron sobre óxido de aluminio Merck 90 de grados de actividad II-III y silica gel SDS 60A (35-70 μm). Para las cromatografías en capa fina se utilizaron placas de silica Kieselgel 60 F254, 0,2 mm (Riedel de Haën), mientras que para las cromatografías en capa preparativa se emplearon placas de silica F254, 2mm (Merck). Se utilizó el reactivo de Dragendorff modificado por Munier10 como revelador. El espectro de masas se registró en un espectrómetro de masas Waters – Micromass Tipo ESI – TOF, modo de ionización ESI / Alta Resolución (Laboratorio de Espectrometría del ICSN-CNRS); los espectros de 1H-RMN, 13C-RMN, 1H – 1H COSY, 1H – 13C HMQC y 1H – 13C HMBC en un equipo RMN Bruker AC-300 (300 MHz) en el Institute de Chimie des Substances Naturelles (ICSN-CNRS), de Gif-Sur-Yvette, Francia.
Material vegetal
Las hojas de D. candida se colectaron en la provincia de Huancabamba, departamento de Piura, en julio de 2001 y fueron identificadas por la Blga. Joaquina Albán Castillo (UNMSM). Los catálogos de los especímenes fueron depositados en el Museo de Historia Natural de la Universidad Mayor de San Marcos.
Las hojas se secaron en estufa a 40 °C, durante cinco días. La muestra seca se pulverizó a grano fino en un molino doméstico.
Análisis cualitativo
El análisis cualitativo (marcha fitoquímica) se realizó por triplicado según el método descrito por Rondina & Coussio11.
Análisis cuantitativo de alcaloides
El contenido total de alcaloides en las hojas de D. candida se determinó mediante el método de titulación potenciométrica propuesto por Hoet & Ríos12.
Aislamiento de alcaloides
Las hojas de D. candida secas y pulverizadas (150 g) se desengrasaron con n-hexano (300 mL x 3) mediante agitación continua. El solvente se eliminó mediante filtración y la muestra vegetal se secó a temperatura ambiente. El sólido resultante se maceró en MeOH (300 mL x 3) durante 24 h, luego se filtró y el solvente se eliminó a presión reducida, obteniéndose un extracto sólido de color verde oscuro (12,6 g). El extracto se disolvió en 20 mL de CHCl3 y se extrajo con HCl 1N (100 mL x 3). Las soluciones ácidas obtenidas se juntaron y se alcalinizaron con NH3 15N (110 mL) hasta alcanzar un pH 11, y luego se extrajeron con CHCl3 (100 mL x 3) y CH2Cl2(100 mL x 2). Ambos extractos orgánicos fueron combinados y el solvente fue evaporado obteniéndose el extracto bruto de alcaloides (EBA) bajo la forma de una resina de color marrón (153 mg). Este mismo procedimiento de extracción fue repetido obteniéndose cuatro fracciones adicionales (119, 135, 1964 y 827 mg, respectivamente). Del cuarto extracto se tomaron 1560 mg que fueron fraccionados mediante cromatografía en columna sobre óxido de aluminio utilizando una mezcla CH2Cl2 -MeOH de polaridad creciente según el método descrito por Griffin7, obteniéndose en total siete fracciones(A1-7). Sin embargo, la mayor parte del extracto se eluyó con CH2Cl2 sin mayor separación, obteniéndose 1190 mg en la fracción A1. Debido a ello, se decidió realizar una segunda cromatografía en columna utilizando sílica gel como absorbente. Para ello, se tomó una parte de esta fracción A1 (482 mg) y la columna se eluyó con una mezcla de polaridad creciente de CH2Cl2-MeOH, obteniéndose en total cuatro fracciones (A1B1-4). Las dos fracciones con mayor masa, A1B2(195 mg) y A1B3(83 mg), mostraron una composición similar según sus espectros 1H-RMN. Por ello, toda la fracción A1B3(83 mg) y un aparte de la fracción A1B2(70 mg) fueron purificadas, por separado, mediante cromatografía en capa fina preparativa utilizando CHCl3-EtOH-NH3(100:10:1) como eluente, consiguiéndose aislar dos compuestos, escopolamina 1 (65 mg) y norescopolamina 2 (18 mg), como resinas de color pardo.
RESULTADOS Y DISCUSIÓN
Análisis cualitativo
El análisis cualitativo mostró que las hojas de D. candida contienen los siguientes grupos de compuestos: aminogrupos primarios y/o secundarios, grupos fenólicos libres, triterpenos y esteroides, alcaloides, catequinas, taninos y saponinas.
Análisis cuantitativo de alcaloides
La determinación del contenido del total de alcaloides arrojó un valor de 0,45 % en base a muestra seca. En la literatura se reportan contenidos de alcaloides muy variables. En 1966, Griffin7 reporta un contenido total de alcaloides de 0,62 % en las hojas de D. candida cultivada en Brisbane (Australia). Posteriormente, Bristol et al.8 encontraron que las partes aéreas de muestras de D. candida (Pers.) Saff., cultivadas en Nottingham (Inglaterra) y en Hawaii (EE. UU), contienen cantidades de alcaloides que varían entre 0,30 – 0,43 %.
Identificación estructural de los principales alcaloides
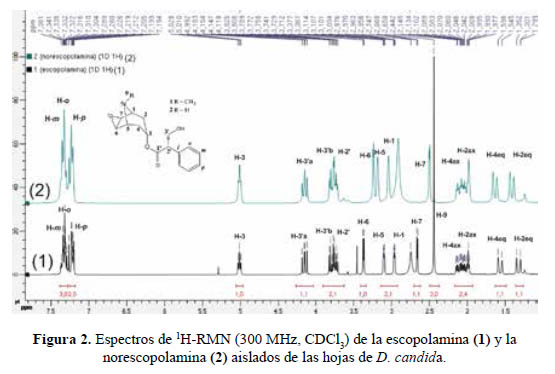
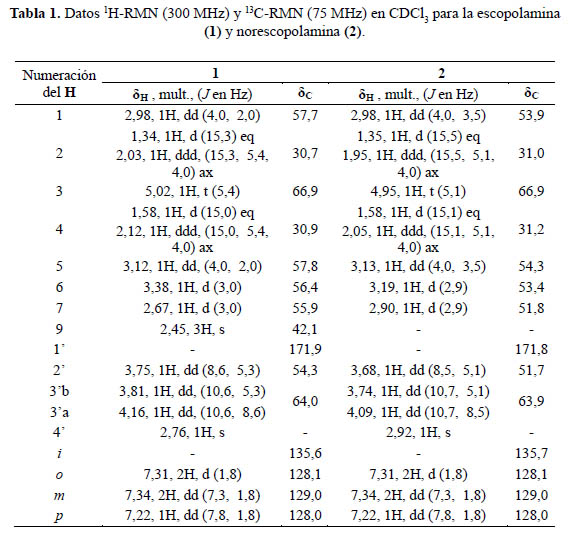
El compuesto 1, mostró en su espectro de masas ESI-MS un pico de ion molecular a m/z 304 [M+H]+ correspondiente con la fórmula C17H22NO4. El espectro de1H-RMN en CDCl3(figura 2) exhibe en el rango δH 0 - 5 ppm la presencia de un grupo metilo, tres metilenos y seis metinos, y en el rango a δH 7,19 – 7,37 ppm muestra los cinco protones aromáticos del anillo bencénico monosusbtituido. Los valores exactos de δH de cada uno de estos protones están indicados en la tabla 1.
El espectro de 13C-RMN muestra una señal que indica la presencia de un carbonilo de una función éster a δC 171,9 ppm. Asimismo, la presencia de solo cuatro señales a δC 135,6, 128,1, 129,0 y 128,0 ppm afianza la hipótesis de la presencia del anillo aromático. Esta suposición sería luego confirmada por el análisis de los espectros COSY, HMBC y HSQC. Las correlaciones observadas en estos espectros permitieron también determinar la existencia de un anillo de tropano como parte de la molécula. De esta manera se logró determinar que la estructura del compuesto 1 corresponde a la escopolamina. De igual manera, se verificó que los desplazamientos químicos observados en los espectros de 1H-RMN y 13C-RMN están en concordancia con aquellas correspondientes a la escopolamina publicadas por Sarazin et al.13.
El compuesto 2 exhibió en su espectro de masa ESI-MS un pico de ion molecular a m/z 290 [M+H]+ concordante con la fórmula C16H20NO4 . Sus espectros de 1H-RMN y 13C- RMN mostraron similitud con aquellos para la escopolamina, excepto por las señales a δH 2.45 ppm y δC 42.1 ppm. El análisis de las correlaciones mostradas sobre los espectros COSY, HMBC y HSQC permitió determinar que el compuesto 2 es la norescopolamina.
Los alcaloides aislados en las diferentes muestras de D. candida reportados en la literatura, también presentan variación. La muestra estudiada por Griffin7 contiene como alcaloides principales escopolamina y meteloidina, junto con pequeñas cantidades de norescopolamina y norhiosciamia. Bristol et al.8 encontraron que las partes aéreas de D. candida (Pers.) Saff., contienen principalmente escopolamina, además de pequeñas cantidades de norescopolamina, meteloidina, atropina, oscina y noratropina. Estos resultados indican que existe poca diferencia cualitativa entre los alcaloides de esta planta y de la especie estrechamente relacionada de D. candida sens. lat. publicada por Griffin. Por otro lado, Evans & El Imann9 estudiaron las partes aéreas de una muestra D. candida, denominada "Flinthan Hall" y aislaron escopolamina como el alcaloide principal junto con otros alcaloides, pero no menciona la presencia de norescopolamina ni meteloidina como en los casos anteriores. Estos resultados tan diferentes se explican si se tiene en cuenta que la especie D. candida es una planta que en el proceso de su cultivo puede ser modificada taxonómicamente, alterando la forma de sus hojas, flores y frutos, cambios que se dan también a nivel citológico y en su composición química, por lo que estos diferentes "cultivares" resultan tan diferenciados en su composición química.
La identificación de escopolamina y norescopolamina como los principales alcaloides en la muestra de D. candida sugiere cierta similitud en cuanto a la composición de las muestras de Griffin y Bristol. El buen contenido de alcaloides (0,45 %) y la identificación de la escopolamina como el principal alcaloide en nuestra muestra de D. candida, sustenta el uso de esta planta como una potencial fuente natural de este alcaloide para su explotación comercial de manera similar como sucede en otros países4. Además, la identificación de la norescopolamina como el segundo alcaloide mayoritario resulta importante, dado que la escopolamina puede sintetizarse a partir de este en una sola etapa14.
CONCLUSIONES
A partir de las hojas de D. candida, colectada en Perú, se aislaron escopolamina y norescopolamina como los alcaloides principales, los cuales fueron identificados mediante sus espectros de masas y de resonancia magnética nuclear. En el análisis cualitativo de las hojas se verificó la presencia de: aminogrupos primarios y/o secundarios, grupos fenólicos libres, triterpenos y esteroides, alcaloides, catequinas, taninos y saponinas. Asimismo, se determinó que las hojas contienen un porcentaje de alcaloides totales de 0,45 %.
AGRADECIMIENTOS
Agradecemos al señor Francisco Guerrero P., herbolario residente en la ciudad de Huancabamba (Piura, Perú) por el apoyo en la colecta del material vegetal; a la Dra. Biol. Joaquina Albán C. (Museo de Historia Natural, Universidad Nacional Mayor de San Marcos) por la determinación botánica del material vegetal; al Dr. Christian Marazano, Director de Investigación, y al Dr. Bernard Delpech, investigador, por el apoyo y facilidades brindadas al Bach. Billy Cabanillas A., en el Institute de Chimie des Substances Naturelles (ICSN- CNRS), de Gif-Sur-Yvette, Francia, para la purificación cromatográfica de los extractos de alcaloides, así como para la obtención de los espectros de masas y de resonancia magnética nuclear 1H-RMN, 13C-RMN, 1H – 1H COSY, 1H – 13C HMQC y 1H – 13C HMBC; al Instituto General de Investigación de la UNI y al Instituto de Investigación de la Facultad de Ciencias – UNI, por el apoyo económico que nos brindaron para la realización de este trabajo de investigación, desde la colecta del material vegetal hasta la obtención de los extractos de alcaloides.
BIBLIOGRAFÍA
1. Cabanillas B. Estudio químico de las hojas de la misha rastrera (Datura candida), [Tesis de Licenciatura] Lima, Perú: Universidad Nacional de Ingeniería; 2008. [ Links ]
2. Albretch K. Tropical Flowering Plants: a guide to identification and cultivation. Portland, OR:Timber Press. Inc.; 2003. [ Links ]
3. Hashimoto T, Yun J-D, Yamada Y. Production of tropane alkaloids in genetically engineered root cultures. Phytochemistry. 1993; 32 (3): 713-718. [ Links ]
4. Palazón J, Navarro-Ocaña A, Hernandez-Vazquez L, Hossein M. Application of metabolic engineering to the Production of scopolamine. Molecules. 2008; 13(8): 1722- 1742. [ Links ]
5 Bussmann RW, Sharon D. Traditional medicinal plant use in Northern Peru: tracking two thousand years of healing culture. J Ethnobio Ethnomed. 2006; 2: 47-54. [ Links ]
6. De Feo V. Ethnomedical field study in northern peruvian andes with particular reference to divination practices. J Ethnopharmacol. 2003; 85(2-3): 243-256. [ Links ]
7. Griffin WJ. Alkaloids in Datura, Section Brugmansia. The peach flowered form of Datura candida sens. lat. Planta Med. 1966; 14: 468-474. [ Links ]
8. Bristol M, Evans W, Lampard J. The alkaloids of the genus Datura, Section Brugmansia. Part VI. Tree Datura drugs (Datura Candida cvs.) of the Colombian Sibundoy. Lloydia. 1969; 32: 123-130. [ Links ]
9. El Imam YMA, Evans WC. Alkaloids of a Datura candida cultivar, D. aurea and various hybrids. Fitoterapia. 1990; 16(2): 148-152. [ Links ]
10. Randerath, K. Cromatographie sur couches minces. Paris: Gauthier – Villars; 1971. [ Links ]
11. Rondina R, Coussio J. Estudio fitoquímico de plantas medicinales argentinas. Revista de Investigación Agropecuaria-INTA. 1969; 5(22): 351-366. [ Links ]
12. Hoet P, Ríos M. Estudio cuantitativo de los alcaloides totales en Datura stramonium del Perú. Metodología. Bol Soc Quím Perú. 1980; 46: 113-121. [ Links ]
13. Sarazin C, Goethals G, Séquin J, Barbotin, J-N. Spectral reassignment and structure elucidation of scopolamine free base through two-dimensional NMR techniques. Magn Reson Chem. 1991; 29(4) : 291-300. [ Links ]
14. Mulholland GK, Jewett DM, Tooringian SA. Routine synthesis of N-[11C-methyl] scopolamine by phosphite mediated reductive methylation with [11C] formaldehyde. Appt Radiat Isot. 1988; 39(5):373-379. [ Links ]
Recibido: 03-10-17
Aprobado: 18-12-17