Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Sociedad Química del Perú
versión impresa ISSN 1810-634X
Rev. Soc. Quím. Perú vol.84 no.1 Lima ene./mar. 2018
TRABAJOS ORIGINALES
Obtención de extractos de hojas de Annona muricata L. (Guanábana) inducidos por su efecto inhibidor de la corrosión
Obtaining and phytochemical study of extracts of Annona muricata (Guanábana) induced by its corrosion inhibiting effect
Abel Vergara Sotomayor1*, Karín Páucar Cuba1, Carlos Morales Comettant1, Olivio Castro Mandujano2, Pedro Pizarro Solís1, José Díaz Rosado3
1 Gabinete de Corrosión. Laboratorio N°23. Facultad de Ingeniería Química y Textil. Universidad Nacional de Ingeniería. Av. Túpac Amaru 210. Rímac. Lima. 25. avergara@uni.edu.pe
2 Laboratorio de Fisicoquímica. Sección Química. Facultad de Ciencias. Pontificia Universidad Católica del Perú. Av. Universitaria 1801. San Miguel. Lima 32.
3 Facultad de Ciencias. Universidad Nacional de Ingeniería. Av. Túpac Amaru 210. Rímac. Lima. 25.
RESUMEN
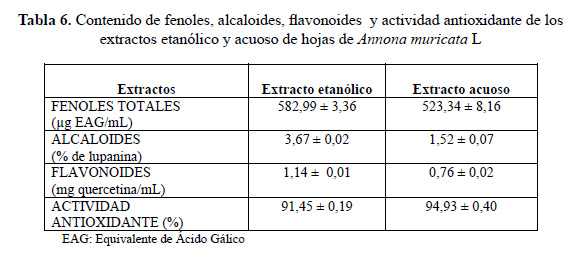
En el presente estudio fueron obtenidos los extractos etanólico y acuoso de las hojas de Annona muricata L. Las condiciones de extracción se establecieron a partir del contenido de sólidos solubles totales y el efecto inhibidor de la corrosión obtenido a partir de la resistencia a la polarización, R (Ω•cm2), del acero 1008 en una solución de HCl 1M en ausencia y presencia del extracto inhibidor. Los extractos con mayor efecto inhibidor de corrosión fueron caracterizados por tamizaje fitoquímico, cuantificación de fenoles totales, alcaloides, flavonoides y actividad antioxidante (DPPH). El extracto etanólico presentó un efecto inhibidor de la corrosión 1,5 veces mayor que el extracto acuoso. El tamizaje fitoquímico estableció que ambos extractos contienen principalmente fenoles, alcaloides, flavonoides, taninos y lactonas sesquiterpenoides. Entre los extractos estudiados, el extracto etanólico presentó el mayor contenido en fenoles totales (582,99 y 523,34 µg EAG /mL EE), alcaloides (3,76 y 1,52 % lupanina) y flavonoides (1,14 y 0,76 mg quercetina/mL de extracto), pero la menor actividad antioxidante (91,45 y 94,93 % de DPPH). Las imágenes obtenidas por SEM y el análisis EDS para el acero expuesto a la solución ácida en ausencia y presencia del extracto inhibidor evidenciaron su carácter protector contra la corrosión.
Palabras clave: Annona muricata, extracto, alcaloides, carbón steel.
ABSTRACT
In the present study, the ethanolic and aqueous extracts of the leaves of Annona muricata L. were obtained. The extraction conditions were established from the total soluble solids content and the corrosion inhibiting effect obtained from the polarization resistance, R (Ω • cm2), of the steel 1008, in a 1 Molar solution of HCl in the absence and presence of the inhibitor extract. The extracts with greater corrosion inhibiting effect were characterized by phytochemical screening, quantification of total phenols, alkaloids, flavonoids and antioxidant activity (DPPH). The ethanolic extract had a 1.5 times greater corrosion inhibiting effect than the aqueous extract. The phytochemical screening established that both extracts contain a wide variety of secondary metabolites, such as phenols, alkaloids, flavonoids, tannins and sesquiterpenoid lactones. Among the studied extracts, the ethanolic extract had the highest content in total phenols (582.99 and 523.34 μg EAG / mL EE), alkaloids (3.76 and 1.52 % lupanin) and flavonoids (1.14 and 0.76 mg quercetin/mL of extract), but the lowest antioxidant activity (91.45 and 94.93 % of DPPH). The images obtained by SEM and the EDS analysis for the steel exposed to the acid solution in the absence and presence of the inhibitor extract showed its protective against corrosion.
Key words: Annona muricata, extract, alkaloids, carbon steel.
INTRODUCCIÓN
La Annona muricata L. (guanábana) es una especie frutícola perteneciente a la familia de las Annonaceas, originaria de América tropical y subtropical. En Perú, la presencia de la Annona muricata (guanábana) data de los años 1200 a.c. con su representación en la cerámica de nuestras antiguas culturas y actualmente su cultivo se realiza en los departamentos de Loreto, San Martín, Ucayali y parte de Cajamarca, y bajo riego en la costa, en Lambayeque, La Libertad, Junín, Ica y Lima; con una exportación que se ha incrementando en los últimos años1. Debido al interés taxonómico y farmacológico, las investigaciones químicas sobre los extractos de diferentes partes de esta planta (pulpa, hojas y cáscaras, entre otros, mantienen su especial interés)2,3. A través de diferentes estudios se ha permitido evidenciar la presencia de compuestos fenólicos, alcaloides, flavonoides y taninos, entre otros compuestos orgánicos4-6 que, en general, contienen en su estructura la presencia de anillos o cadenas largas de carbono, radicales OH o elementos como el oxígeno o nitrógeno. La presencia de estos metabolitos secundarios en extractos de hojas, tallos, raíces, frutos y cáscaras, entre otros, en diferentes plantas viene siendo de mucho interés en la comunidad científica para la obtención de inhibidores ecológico de la corrosión de metales en diferentes medios corrosivos7. Dentro de las principales técnicas usadas para su evaluación se tiene: ensayos gravimétricos, resistencia a la polarización lineal (RPL), curvas de polarización (pendientes de Tafel) e impedancia electroquímica, entre otras8-10. A nivel internacional existen muy pocas investigaciones sobre extractos etanólico o acuoso de la Annona muricata L. (guanábana) usados como inhibidores de la corrosión10 y en Perú este campo aún es incipiente11. Por tal motivo, en la presente investigación se pretendió obtener in situ los extractos etanólico y acuoso con las mejores propiedades de inhibición usando la variación de la medida de la resistencia a la polarización, (Ω•cm2) como parámetro electroquímico para cuantificar el proceso de extracción de metabolitos secundarios que aporten poder de inhibición de la corrosión del acero en medio ácido, para ello, también se harán mediciones del contenido de sólidos solubles totales y la composición fitoquímica de los extractos.
PARTE EXPERIMENTAL
Muestra
Las hojas de Annona muricata L. fueron recolectadas en el Vivero "FORTU", ubicado en el kilómetro 23 de la Panamericana Sur, departamento de Lima.
Taxonomía
Una parte de la planta fue llevada al Museo de Historia Natural de la UNMSM para su identificación. Según el Sistema de Clasificación de Cronquist (1988) la especie vegetal en estudio es Annona muricata L. (Constancia No 2-USM-2015).
Acondicionamiento de la muestra
Las hojas recolectadas de Annona fueron secadas a temperatura ambiente sobre corriente de aire natural. Luego fueron molidas en un molino manual y reducidas hasta pasar por Malla Tyler N°10 y almacenadas en bolsas de papel en un desecador.
Materiales y equipos
El solvente etanol usado fue de grado analítico 99,9 % (Darmstadt, Merk), el agua destilada tuvo pH 6,5. El ácido clorhídrico, 37 % (Darmstadt, Merck) y los demás reactivos fueron de Sigma-Aldrich.
Para la determinación del contenido de humedad se utilizó una estufa EC 55 Ecocell. El análisis elemental se realizó con un CHNS 2400 Serie II de Perkin Elmer. La obtención de los extractos se realizó por agitación/calentamiento usando un termorregulador digital Arex Velp Scientifica. La medición de los sólidos solubles totales en balanza analítica TE214S Sartorius 0,1 mg. La densidad y pH se midieron usando un picnómetro Weld de 5 ml DIN Witeg y un pHmetro Hanna Instruments, respectivamente. Las medidas de la resistencia a la polarización (R ) se midieron usando un potenciostato/galvanostato/ZRA Reference 600 de Gamry Instruments y una celda conformada por un electrodo auxiliar de platino de Metrohm, UK y un electrodo de referencia de Calomel sat. de Gamry Instruments. La cuantificación de fenoles, flavonoides y la actividad antioxidante se realizaron en un espectrofotómetro Helios Z UV-Visible del CCA de la Facultad de Farmacia y Bioquímica de la UNMSM.
Caracterización fisicoquímica de hojas de la Annona muricata L. Contenido de humedad
En un crisol se masó 1,0000 g de hojas y se llevó a estufa a temperatura de 104°C hasta que la variación de masas sea igual a 0,1 mg., se realizaron mediciones por triplicado12,13.
Contenido de cenizas
Se masó por triplicado 2,0000 g de hojas en crisoles. La temperatura de la mufla se elevó hasta 350°C durante una hora, 550°C durante la siguiente hora y 700°C una hora más. Se verificó la calcinación de la muestra con la observación de un color blanco de las cenizas. Los crisoles fueron enfriados en desecador, luego masados y por diferencia de masas se obtuvo el porcentaje de cenizas del material12, 13,14.
Análisis elemental (C.H. N y S)
Se masaron 2,00 mg. de hojas, se encapsularon en estaño y se introdujeron al instrumento. La muestra pasó a una cámara de combustión, los gases fueron arrastrados a una cámara de reducción donde se transformó a dióxido de carbono, agua, dióxido de nitrógeno y dióxido de azufre. Estos gases fueron separados en una columna cromatográfica y leídos en un detector TCD. El instrumento fue calibrado con cisteína15.
Obtención de los extractos etanólico y acuoso, medición de sólidos solubles totales y de la resistencia a la polarización (Rp)
Obtención de los extractos etanólico y acuoso
a) En un vaso de precipitado conteniendo 100 mL de solvente etanol o agua y manteniendo el tiempo de agitación magnética constante, se adicionaron diferentes masas de hojas a temperatura ambiente y a diferentes temperaturas.
b) Transcurrido el tiempo de agitación se realizó la filtración al vacío de cada uno de los extractos.
c) El volumen filtrado fue enrasado con solvente etanol o agua hasta completar el volumen de 100 mL.
d) Medición de los sólidos solubles totales, se realizó masando 80 mL del extracto en una placa petri y secando en una estufa a 40 ± 1°C hasta variación de la masa en 0,1 mg. Las mediciones se realizaron por triplicado16.
Medición de la resistencia a la polarización (R )
La medición se realizó usando un potenciostato y un sistema de tres electrodos. Un electrodo de referencia de calomel saturado (ECS), un electrodo auxiliar de platino y un electrodo de trabajo (acero al carbono). El electrodo de trabajo consistió en planchas de acero al carbono SAE 1008 de 2,5 x 5,0 x 0,02 cm las cuales fueron desbastadas sucesivamente usando lija de N°80 hasta N°1000, fueron limpiadas usando baño ultrasonido y secados con alcohol isopropílico antes de la exposición de 0,7238 cm2 a una solución corrosiva de HCl 1M en ausencia y presencia del extracto inhibidor (2 % en volumen del extracto etanólico o acuoso de las hojas de Annona muricata L.). La medición de la resistencia a la polarización (R ) se midió en un rango de ± 20 mV del potencial de reposo y a una velocidad de barrido de 0,166 mV/s17. El potencial de reposo se obtuvo después de 1h de inmersión de la muestra en solución ácida con y sin inhibidor. En todos los casos las mediciones se realizaron por duplicado. El método RPL, desarrollado por Stern y colaboradores8, se basa en que las curvas de polarización de una celda de corrosión en un pequeño entorno del potencial de corrosión son prácticamente rectas. Esencialmente, este método consiste en la medida de la corriente, I (A) entre el electrodo de trabajo y el electrodo auxiliar, correspondiente a una pequeña modificación del potencial, E (V) a partir del potencial de corrosión, Ecorr(V). La resistencia a la polarización R (Ω) viene dada por (ΔI/ΔE), con lo cual, siendo: Icorr= B/R , donde Bes una constante que varía entre límites muy estrechos y permite establecer una relacióninversamente proporcional entre Icorr y Rp .
Si se divide Icorr por el área (cm2) de la muestra, se tiene la densidad de corriente, icorr (A•cm-2),la cual está relacionada directamente proporcional con la velocidad de corrosión, Vcorr y, por tanto, también, inversamente proporcional a R (Ω•cm2). Así, la eficiencia de inhibición de un inhibidor de corrosión, también puede ser estimada a partir de la relación18,19:
Eficiencia de inhibición (%) = (Rp-Rp*)/Rp x 100
Donde: R * y R son la resistencia a la polarización en ausencia y presencia del inhibidor, respectivamente.
Caracterización fisicoquímica y fitoquímica de los extractos
Densidad, índice de refracción y pH
La medida de densidad de los extractos se realizó midiendo la masa de un picnómetro de Weld de 5 mL sin y con extracto a 20°C. Para la medición del índice de refracción se utilizó un refractómetro en el cual se colocó sobre el medidor aproximadamente 0,3 mL del solvente usado para la extracción y se ajustó a cero. Se adicionó 0,3 mL del extracto a analizar y se anotó el valor medido. Para la medición de pH, previamente se calibró el equipo con soluciones tampón de pH 4,01 y 7,01. La medición del pH se realizó usando 20 mL de cada extracto. Las mediciones en todos los casos se realizaron por triplicado16.
Tamizaje fitoquímico
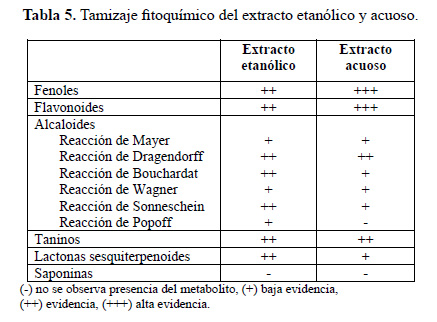
Se empleó diferentes reacciones específicas sobre el extracto para identificar la presencia de metabolitos secundarios: fenoles, taninos, saponinas, flavonoides, lactonas sesquiterpénicas (reacción de Legal) y alcaloides (Mayer, Dragendorff, Bouchadart, Wagner, Sonneschein y Popoff)10,16,20.
Contenido de fenoles totales
La concentración de fenoles totales fue medida por espectrofotometría UV-Visible, basándose en una reacción colorimétrica de óxido-reducción. El agente oxidante utilizado fue el reactivo de Folin-Ciocalteu. Se utilizó ácido gálico como estándar para preparar una solución madre de 100 ppm (0,1mg/mL)21. Todo esto sobre la base como solvente el agua destilada.
Contenido de alcaloides
Para la extracción de los alcaloides se utilizó 100 mL de extracto etanólico o acuoso de las hojas y se filtró sobre papel Whatman N° 2. Se concentró en rotavapor a 60°C por 5 horas hasta 1/10 de su volumen inicial. Se agregó 15 mL de HCl 10 % y se llevó a baño maría a 60°C por 30 minutos. Tras agitación constante, se enfrió y filtró. El filtrado fue trasvasado a una pera de decantación, se agregó éter de petróleo y se extrajo la parte acuosa (el alcaloide en forma de sal). Luego se alcalinizó con NaOH 1N hasta pH = 12 y se dejó en reposo por 24 horas. Se extrajo el alcaloide en forma básica con tres porciones de 15 mL de diclorometano en una pera de decantación. Se dejó en reposo por 1 día. Se separó la fase orgánica y se evaporó hasta ¼ del volumen inicial. Se tomó una alícuota de 1 mL para reconstituir en medio ácido. Para la cuantificación volumétrica se tomó una alícuota de 1 mL y se reconstituyó con 10 mL de ácido acético, luego se agregaron 5 mL de ácido fórmico, 3 mL de anhídrido acético y 3 gotas de cristal violeta. Se valoró con ácido perclórico 0,01N hasta el punto de equivalencia (cambio de coloración, de azul a verde)10,22.
Cuantificación de flavonoides
Para la cuantificación se tomó una alícuota de 1 mL del extracto etanólico y 0,5 mL de extracto acuoso, se agregó 200 µL de acetato de sodio y 200 µL de solución de nitrato de aluminio al 10 % y se enrasó con etanol en una fiola de 25 mL. Se dejó en reposo 40 minutos y se realizó la lectura a 415 nm en el espectrofotómetro UV-Visible23. Este procedimiento toma como base el etanol grado 96.
Actividad antioxidante
La actividad antioxidante se determinó a través del ensayo del radical DPPH basado en el método propuesto por Brand-Williams15,24. El método consiste en que este radical tiene un electrón desapareado y es de color azul violeta decolorándose hacia amarillo pálido por una reacción con una sustancia antioxidante. La absorbancia fue medida espectroscópicamente a 517 nm. La diferencia de absorbancias, permite obtener el porcentaje de captación de radicales libres. Para la preparación de solución patrón (A) se masó 0,002 g de reactivo 2,2-difenil-1-picril hidrazilo (DPPH) y se diluyó con metanol en una fiola de 10 mL. Se tomó una alícuota de 2,5 mL y se llevó a una fiola de 25 mL la cual fue enrasada con metanol. De esta manera se obtuvo una solución patrón de 20 ppm. Para la preparación de solución control 1 % (B) se masó 0,1 g de vitamina C y se llevó a una fiola de 10 mL. Se enrasó con agua destilada. La preparación de la muestra problema (C) se realizó tomando una alícuota de 0,1 mL y se diluyó en una fiola de 10 mL con agua destilada. Para realizar, la medida de la actividad antioxidante o absorvancia correspondiente, los reactivos A, B y C se prepararan de la siguiente forma:
- Mezclar 1,5 mL de metanol con 3 mL de solución A. (Absorvancia patrón de referencia)
- Mezclar 1,5 mL sol. B con 3 mL de solución A. (Absorvancia de control)
- Mezclar 1,5 mL sol. B con 3 mL de Metanol. (Absorvancia blanco de control)
- Mezclar 1,5 mL sol. C con 3 mL de sol. A. (Absorvancia m.p.)
- Mezclar 1,5 mL sol. C con 3 mL de Metanol. (Absorvancia blanco m.p.)
Evaluación superficial
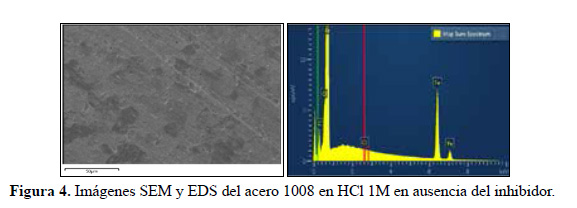
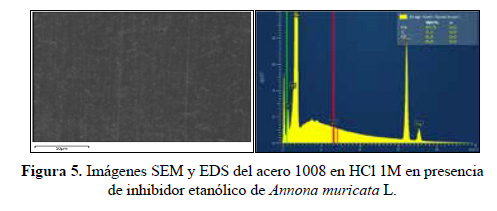
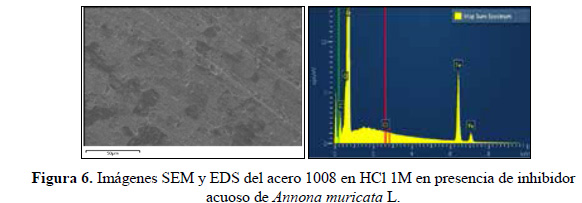
Las muestras de acero después de su inmersión en la solución acuosa de HCl 1M, durante 2 horas, en ausencia y presencia del extracto inhibidor etanólico y acuoso, fueron lavados con agua, secados con alcohol isopropílico y almacenados en desecador hasta su evaluación. La evaluación superficial de las muestras de acero se realizó en un microscopio electrónico de barrido (SEM), EVO MA10 Carl Zeiss y el análisis de los elementos sobre su superficie a través de la espectroscopia de energías dispersivas (EDS)25.
RESULTADOS Y DISCUSIÓN
Caracterización fisicoquímica.
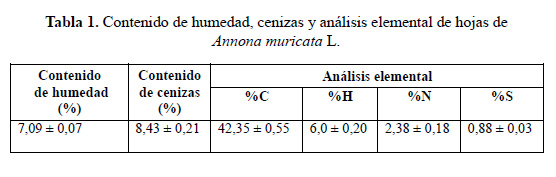
La caracterización inicial de las hojas de Annona muricata L., a partir del contenido de humedad, cenizas y el análisis elemental se muestra en la tabla 1.
El contenido de humedad y cenizas se encuentra dentro de los valores típicos para hojas de Annona muricata L. reportado por otros autores26.
Determinación de sólidos totales de los extractos etanólico y acuoso y medidas de resistencia a la polarización lineal (RPL).
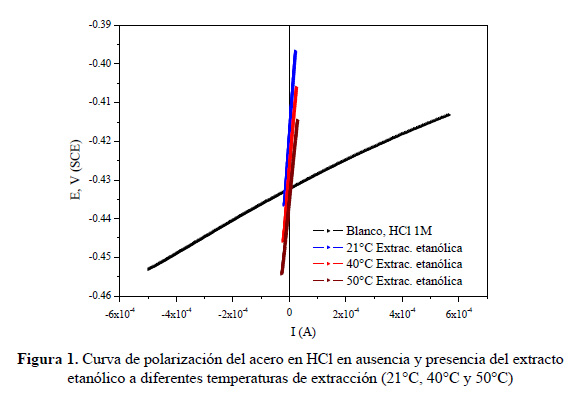
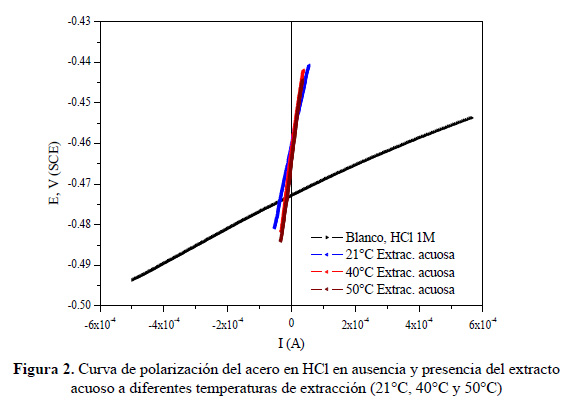
Las figuras 1 y 2 muestran las curvas de polarización del acero en medio HCl 1M en ausencia (blanco) y presencia del inhibidor obtenido a partir de los extractos etanólico y acuoso de las hojas de Annona muricata L. a diferentes condiciones de temperatura de extracción. La linealidad de las curvas permite determinar los valores de resistencia a la polarización, Rp (Ω), del acero en medio ácido.
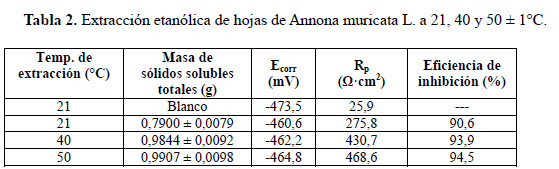
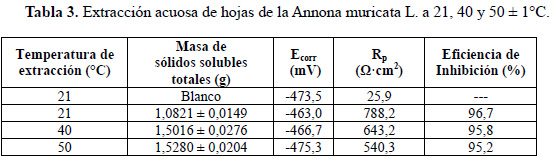
En las tablas 2 y 3 se reporta el contenido de sólidos solubles totales, el potencial de corrosión (Ecorrr), la resistencia a la polarización (Rp) y la eficiencia de inhibición (%) de los extractos etanólico y acuoso obtenidos por agitación a diferentes condiciones de temperatura de extracción. Para la solución acuosa de HCl 1M sin inhibidor el valor de Rp fue de 25,9 Ω•cm2 a un potencial (Ecorr) de -473,5 mV.
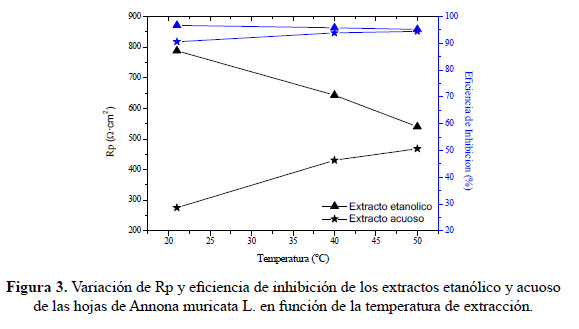
A diferentes temperaturas de extracción, un apreciable incremento del valor de Rp(Ω•cm2) fue mostrado como producto de la adición de 2 % v/v del extracto inhibidor a la solución corrosiva de HCl 1M sobre el acero, respecto a la solución sin inhibidor. Este resultado evidencia el efecto inhibidor de corrosión de los extractos etanólico y acuoso de las hojas de Annona muricata L., siendo las eficiencias de inhibición de la corrosión alcanzadas superiores al 90 %. La adición de los extractos inhibidores de la corrosión, en general, afectó el potencial de corrosión hacia valores más anódicos. A temperatura ambiente, 21°C, el extracto inhibidor etanólico alcanzó un valor de 1,5 veces mayor de Rp que el acuoso, lo cual está asociado al mayor contenido de sólidos solubles totales obtenidos. Un contenido de sólidos solubles total similar fue alcanzado por los extractos etanólico y acuoso a 21°C y 50°C, respectivamente con valores de Rp de 788,2 y 468,2 Ω•cm2, respectivamente. En la figura 3 se muestra que un incremento de hasta 30°C en la temperatura de extracción produce un ligero decremento en la eficiencia de inhibición para el extracto etanólico mientras que para el extracto acuoso se observa un incremento del 5 %.
Caracterización fisicoquímica y fitoquímica de los extractos
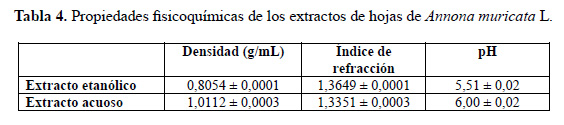
En la tabla 4 se presenta la caracterización inicial de los extractos etanólico y acuoso de hojas de Annona muricata L. obtenidos por agitación con los mayores valores obtenidos de R , 788,2 y 468,6 Ω•cm2, respectivamente; asociados a un mayor efecto inhibidor.
Comparando los valores de densidad e índice de refracción de los extractos obtenidos en la tabla 4 y de los solventes puros27,28, esto es densidad de 0,7852 e índice de refracción de 1,3592 para el solvente etanol, y densidad de 0,9971 e índice de refracción de 1,3328 para el solvente agua; se comprueba que la extracción de metabolitos secundarios se llevó a cabo a las condiciones de extracción previamente establecidas.
Los extractos etanólico y acuoso con los mayores valores de R fueron caracterizados desde el punto de vista fitoquímico (tablas 5 y 6). Del tamizaje fitoquímico de los extractos etanólico y acuoso se observa que los extractos contienen fenoles, alcaloides, taninos, flavonoides, principalmente. En relación a los valores de fenoles totales reportados en los extractos etanólico y acuoso, estos son similares a los reportados para plantas de Annona muricata L. de origen africano6. La actividad antioxidante expresada como captación al radical DPPH de los extractos etanólico o acuoso fue mayor al 90 %, siendo ligeramente mayor el del extracto acuoso, ver tabla 6.
Evaluación superficial
Las figuras 4, 5 y 6 muestran las imágenes SEM y EDS de la superficie de las muestras de acero 1008 expuestas en HCl 1M en ausencia y en presencia de los extractos obtenidos de las hojas de Annona muricata L. Las imágenes SEM muestran la reducción del deterioro superficial que experimentaron las muestras de acero en presencia de los extractos, confirmando la capacidad inhibidora de la corrosión de estos extractos frente al medio agresivo HCl 1M, el cual produjo un severo daño del acero. Los espectros EDS muestran una reducción del porcentaje en masa de Fe en ausencia del inhibidor de 95,6 % en comparación con la presencia de los extractos inhibidores de 97,5 % y 97,3 % para el extracto etanólico y acuoso, respectivamente.
CONCLUSIONES
La agitación magnética permitió la obtención de extractos con poder de inhibición de la corrosión a partir de las hojas de Annona muricata L. que crecen en la ciudad de Lima.
Las condiciones de extracción óptima de metabolitos secundarios de las hojas de Annona muricata L. que aportan poder de inhibición de la corrosión como función de la variación de sólidos solubles totales y la temperatura se establecieron in situ, indirectamente con el seguimiento en el cambio del valor de Rp de los extractos.
Los extractos etanólico y acuoso obtenidos presentaron propiedades inhibidoras de la corrosión debido a la presencia de metabolitos secundarios que, según el tamizaje fitoquímico y las cuantificaciones realizadas, están relacionados con la presencia de fenoles, alcaloides y flavonoides, principalmente.
El mayor efecto inhibidor de la corrosión para el acero, en solución ácida HCl 1M, se alcanzó con el extracto etanólico obtenido a 21°C y el extracto acuoso obtenido a 50°C.
Las imágenes SEM y EDS evidenciaron la reducción del daño superficial del acero debido a la capacidad protectora de la corrosión que produjeron los extractos etanólico y acuoso.
AGRADECIMIENTO
A FINCYT por el apoyo económico brindado en el proyecto de investigación 371-PNICP- PIAP-2014 y al CCA de la Facultad de Farmacia y Bioquímica de la UNMSM.
REFRERENCIAS BIBLIOGRÁFICAS
1. Moreno M. La Guanábana: producto de exportación. Rev AZ Gest. 2012; 8: 12-13. [ Links ]
2. Amiel D, Amiel J. Metodologías usadas en la investigación de plantas antitumorales: descripción y comentarios. Rev Cie. 2007; 4 (5): 19-26. [ Links ]
3. Barahona V. Evaluación de la actividad antioxidante y valor nutraceutico de las hojas y frutos de la Guanábana (Annona muricata). [Tesis de grado]. Riobamba, Ecuador: Escuela Superior Politécnica de Chimborazo; 2013. [ Links ]
4. Sandoval L, Ettiene G, Pérez-Pérez E, Fuenmayor M, Raga J, Silva N. Determinación de flavonoides en frutos de Annona muricata L. provenientes de plantas diferentes empleando cromatografía líquida de alta resolución. Rev Facu Agron. 2014; 1: 785- 800. [ Links ]
5. Moncada M, Giraldo A, Landazuri P. Actividad antioxidante de los extractos etanólicos y acuosos de la cáscara y la semilla de Annona muricata y de las hojas brownea ariza. Rev Asoc Colomb Cie Bio. 2012; 24: 143 - 151. [ Links ]
6. Gordillo J, Ortiz D, Larrahondo J, Sánchez M, Pachón H. Actividad antioxidante en guanábana (Annona muricata l.): una revisión bibliográfica. Bol Latin Car Plant Medic Arom. 2012; 11 (2): 111 - 126. [ Links ]
7. Kesavan D, Gopiraman M, Sulochana N. Green inhibitors for Corrosion of Metals: A Review. Chem Sci Rev Let. 2012, 1 (1): 1-8. [ Links ]
8. González J. Control de la Corrosión estudio y medida por técnicas electroquímicas. Madrid: CSIC; 1989. [ Links ]
9. Esparza B. Evaluación de inhibidores de corrosión en medio ácido amargo. [Tesis]. Pachuca: Instituto de Ciencias Básicas e Ingeniería; 2007. [ Links ]
10. Rosaline J, Leema A, Raja S. A study on the phytochemical analysis and corrosion inhibition on mild steel by Annona Muricata L. leaves extract in 1 N hydrochloric acid. Der Chem Sin. 2012; 3 (3): 582-588. [ Links ]
11. Vergara A, Paucar K, Pizarro P, Jara A. Alcaloides del extracto de hojas de Annona muricata L. y su uso como inhibidor de la corrosión del acero en medio ácido. Proyecto de investigación FIQT-UNI; 2013. [ Links ]
12. American Society for testing and materials.ASTM D2216-10, Laboratory Determination of Water (Moisture) Content of Soil and Rock by Mass. West Conshohocken, PA: ASTM International; 2010. [ Links ]
13. Vidaurre M, Querevalú L, De Los Rios E, Ruiz S. Características farmacognósticas de las hojas de Capparis avicennifolia. Rev Med Val. 2007; 4 (2): 122. [ Links ]
14. American Society for testing and materials. ASTM D2974-14, Standard Test Methods for Moisture, Ash, and Organic Matter of Peat and Other Organic Soils. West Conshohocken, PA: ASTM International; 2014. [ Links ]
15. García R. Estudio sobre la capacidad antioxidante de extractos de hoja de Moringa oleifera de diferente origen geográfico. Coruña: UDC; 2017. [ Links ]
16. Ochoa A, Marin J, Rivero D, Aguilera E. Caracterización física, físico-química y química de extractos totales de hojas frescas de Petiveria alliacea L. con acción antimicrobiana. Rev Mex Cienc Farm. 2013; 44 (1): 52-59 [ Links ]
17. American Society for testing and materials. ASTM G59-97(2014), Standard Test Method for Conducting Potentiodynamic Polarization Resistance Measurements. West Conshohocken, PA: ASTM International; 2014. [ Links ]
18. García R. Inhibidores de corrosión de acero en medios ácidos a partir de extractos naturales. [Tesis Doctoral]. México: CENIM; 2014. [ Links ]
19. Lebrini M, Robert F, Roos C. Inhibitive Effect of Siparuna Guianensis Extracts on the Corrosion of Low Carbon Steel in Acidic Media. Int J Electrochem Sci. 2011; 6: 5249 – 5264. [ Links ]
20. Arroyo A, Bonilla R, Tomás Ch, Huamán M. Estudio fitoquímico del extracto etanólico y de las fracciones de las hojas de Piper Aduncum "Matico". Rev Per Quím Ing Quím. 2011; 14 (1): 62-67. [ Links ]
21. Singleton VL, Rossi JA. Colorimetry of total phenolics with phosphomolybdic phosphotungstic acid reagents. Am J Enol Viti. 1965; 16: 144-158. [ Links ]
22. Lock de Ugaz O. Métodos en el estudio de productos naturales. 2aed.. Lima: PUCP; 1994. [ Links ]
23. Kostennikova Z. UV spectrophotometric quantitative determination of flavonoid in calendula tincture. Farmatsiya. 1983; 33 (6): 83-86. [ Links ]
24. Brand W, Cuvelier M, Berset C. Use of a free radical method to evaluate antioxidant activity LWT. Food Sci Tech. 1995; 28 (1): 25-30. [ Links ]
25. Okoronkwo A, Olusegun S, Olaniran O. Acid extract of Gliricidia sepium leaves as green corrosion inhibitor for mild steel in HCl solutions. Afr Corros J. 2015; 1 (1): 30-3. [ Links ]
26. Vit P, Santiago B, Pérez-Pérez E. Composición química y actividad antioxidante de pulpa, hojas y semilla de Guanábana. Annona muricata L. Interciencia, 2014; 39 (5): 350-353. [ Links ]
27. Anouti M, Caillon-Caravanier. M, Dridi. Y, Jacquemin J, Hardacre C, Lemordant D. Liquid densities, heat capacities, refractive index and excess quantities for protic ionic liquids + water binary system. J Chem Thermodyn. 2009; 41: 799-808. [ Links ]
28. Orge B, Rodríguez A, Canosa. J, Marino. G, Iglesias. M, Tojo J. Variation of densities, refractive indices and speeds of sound with temperature of methanol or ethanol with hexane, heptanes and octane. J Chem Eng Data. 1999; 44: 1041-1047. [ Links ]
Recibido el 26-10-17
Aprobado el 13-02-18