Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Sociedad Química del Perú
versión impresa ISSN 1810-634X
Rev. Soc. Quím. Perú vol.84 no.2 Lima abr./jun. 2018
TRABAJOS ORIGINALES
Aislamiento del ácido lecanórico y ácido úsnico del liquen Umbilicaria calvescens Nyl.
Isolation of lecanoric acid and usnic acid from lichen Umbilicaria calvescens Nyl.
Judith Ramos Chávez1*, Elena A. Cóndor Cuyubamba2
1* Facultad de Ciencias, Universidad Nacional de Ingeniería, Av. Túpac Amaru 210 Rímac, Lima-Perú, judirach@hotmail.com
2 Facultad de Ciencias de la UNI.
RESUMEN
A partir del liquen Umbilicaria calvescens Nyl. se realizó el aislamiento de los compuestos liquénicos mayoritarios: ácido úsnico y ácido lecanórico. El aislamiento de los compuestos liquénicos fue mediante la cromatografía en columna (CC) y cromatografía en capa fina (CCF) de los extractos en acetona y n-hexano del liquen. Cristales amarillos fueron obtenidos del extracto en n-hexano, mientras que un sólido blanco fue obtenido del extracto acetónico. Los cristales obtenidos fueron identificados por sus características físicas y por los espectros UV, IR, EM, 1H-RMN y 13C-RMN.
Palabras clave: ácido úsnico, ácido lecanórico, Umbilicaria calvescens Nyl., líquenes.
ABSTRACT
From the lichen Umbilicaria calvescens Nyl., was made the isolation of the major lichen compounds: usnic acid and lecanoric acid. Isolation of lichen compounds was performed by column chromatography (CC) and thin layer chromatography (CCF) of the extracts made in acetone and hexane. Yellow crystals were obtained from the n-hexane extract, while a white solid was obtained from the acetone extract. The crystals obtained were identified by their physical characteristics and by the UV, IR, MS, 1H-NMR and 13C-NMR spectra.
Key words: usnic acid, lecanoric acid, Umbilicaria calvescens Nyl., lichens.
INTRODUCCIÓN
Los líquenes son seres muy complejos originados por la simbiosis entre un hongo heterótrofo (micobionte) y un alga autótrofa (fotobionte). De esta interacción mutualista se originan los talos liquénicos con morfología, anatomía, fisiología y ecología específica, presentando de esta forma características únicas de las dos partes1.
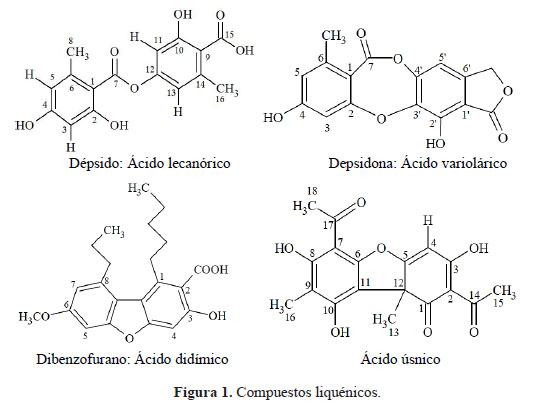
Teniendo en cuenta la diversidad en ecosistemas presentes en el Perú, la proliferación de distintas especies liquénicas es favorable, sin embargo, los estudios químicos (liquenoquímica), biológicos y fisicoquímicos a nivel de sus extractos y sus metabolitos secundarios son escasos. No obstante, a nivel mundial, estos extractos son usados para tratar algunas enfermedades respiratorias, estomacales y afecciones renales en el campo de la medicina tradicional. Dentro de los metabolitos secundarios que sólo se encuentran en los líquenes, tenemos a los compuestos liquénicos, los cuales presentan actividades antioxidantes, antimicótica, antiinflamatoria, entre otros. Estos se clasifican como dépsidos, depsidonas, dibenzofuranos y ácidos úsnicos1,2 (Figura 1).
El liquen Umbilicaria calvescens Nyl. es del tipo folioso y de talo umbilicado monofilo con la cara superior de color crema o marrón dependiendo. La médula del liquen es de un color blanco o rosa carmín, debido a la presencia de minerales, y presenta apotecios negros de tipo girodisco de menos de 2 mm de diámetro. Asimismo, la distribución geográfica para el género Umbilicaria es mayormente en las zonas árticas3.
El enfoque de este trabajo es el aislamiento e identificación de los compuestos liquénicos mayoritarios en el liquen Umbilicaria calvescens Nyl., siendo este el primer trabajo realizado para esta especie.
PARTE EXPERIMENTAL
Los equipos e instrumentos utilizados fueron: un equipo de punto de fusión Thermo Fisher Scientific 9100; una lámpara UV MODEL UVGL-58/Spectroline 254-366 nm; un espectrofotómetro IRPrestige-21 SHIMADZU; un espectrofotómetro SHIMADZU UV-1800; un espectrómetro de masas MS ADVION COMPACT y un espectrómetro de resonancia magnética nuclear Bruker Avance 400 MHz.
Recolección, secado y molienda de la muestra
La especie liquénica fue recolectada en el camino al nevado de Huaytapallana (aprox. entre los km 17 y 18 de la vía Palián), con una altitud entre los 4000 - 4500 msnm, en el distrito y provincia de Huancayo, departamento de Junín. La determinación botánica de la especie liquénica fue realizada por el Blgo. Ángel M. Ramírez Ordaya en los ambientes del Museo de Historia Natural de la Universidad Nacional Mayor de San Marcos; siendo identificada como la especie liquénica Umbilicaria calvescens Nyl.
La especie liquénica (previamente limpiada) se secó en una estufa a 40°C durante 24 horas; luego se pulverizó por medio de una picadora doméstica.
Aislamiento de los compuestos liquénicos
Extracción. 500 g del liquen seco y molido fue macerado en 1,7 litros de n-hexano a temperatura ambiente durante 24 horas; luego, se filtró y se concentró, este procedimiento se repitió dos veces, obteniéndose 840 mg de EBO (rotulado como fracción H). El residuo sólido es nuevamente macerado en 1,8 litros de acetona a temperatura ambiente durante 24 horas; luego, se filtró y se concentró, repitiéndose dos veces la maceración; al final se obtuvo 82,75 g de EBO (rotulado como fracción A).
Separación por CC. Se realizó un análisis preliminar por CCF a las fracciones A y H.
Fracción A. Se realizaron tres CC usando sílica gel (SIGMA-ALDRICH, tamaño de poro 60 Å, tamaño de partícula 35-75 µm) como fase estacionaria y como eluentes éter de petróleo: acetato de etilo en la relación de: 0:100, 25:75 y 50:50 en la primera, segunda y tercera CC, respectivamente. En la primera CC se trabajó con 500 mg de la fracción A, obteniéndose 5 sub-fracciones (rotulados como G1-G5), los cuales se concentraron. En la segunda CC se empleó la fracción G3 (mayoritario), obteniéndose 7 sub-fracciones (rotulados como S1-S7) los cuales fueron concentrados, siendo la fracción S6 de mayor cantidad por lo que se realizó una tercera CC, en donde se recolectó 4 sub-fracciones (rotulados como T1-T4), los cuales fueron concentrados.
De acuerdo a la CCF y al punto de fusión de las fracciones obtenidas se observó valores similares en las fracciones G4, S5 y T3 por lo que se juntaron y se rotuló como compuesto A. Este compuesto fue recristalizado en acetona: agua (1:1), obteniéndose 206 mg de un precipitado blanco.
Fracción H. Se realizaron dos CC. En la primera CC se empleó la fracción H (840 mg) y como eluyentes la mezcla de acetato de etilo: éter de petróleo (mezclas desde 15:85 hasta 100:0), recolectándose 7 sub-fracciones (rotulados como I1-I7). La fracción I3 (340 mg) fue purificado nuevamente por CC en acetato de etilo: éter de petróleo (30:70), obteniéndose 4 sub-fracciones, (rotulados como U1-U4), los cuales fueron concentrados, y se obtuvo en la fracción U3 un sólido amarillo (rotulado como compuesto B). Este compuesto fue recristalizado en etanol, obteniéndose 86 mg de producto (en forma de cristales amarillos). Adicionalmente, la CCF del compuesto B presentó un Rf = 0,62 (sistema etanol: acetona (1:1)), el cual coincidía con el valor del patrón de ácido úsnico (98 %, SIGMA-ALDRICH).
La identificación de los compuestos codificados como A y B fue mediante la interpretación de los espectros UV, IR, EM, 1H-RMN y 13C-RMN.
RESULTADOS Y DISCUSIÓN
Compuesto A. Sólido de color blanco, soluble en metanol y acetona, poco soluble en cloroformo; su punto de fusión varía entre 182°C - 184°C; la reactividad frente al Ca(ClO)2 da una coloración rojiza (característico en compuestos que presentan dos grupos hidroxilo (posición meta) en uno de sus anillos); y presentó un Rf = 0,29 en el sistema n-hexano: acetato de etilo (80:20) al ser revelado con H2SO4 al 10 %.
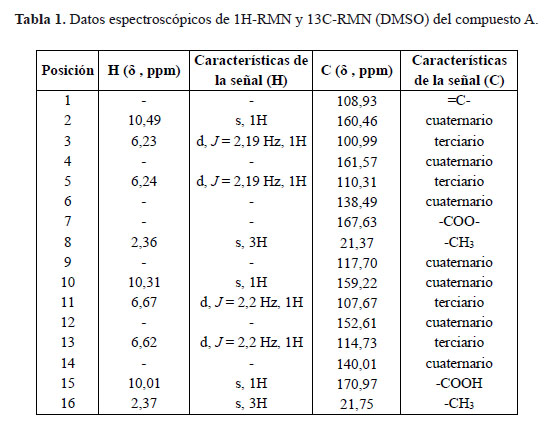
El espectro UV indicó tres bandas de máxima absorción a 213, 270,8 y 304,2 nm. En el espectro IR se identificaron cinco bandas correspondientes al OH a 3533,6 cm-1, CH a 2980 cm-1, C=O a 1658,8 cm-1, C=C a 1606,7 cm-1 y OH (carboxílico) a 1240,2 cm-1. El espectro de masas obtenido por la técnica APCI en modo negativo, exhibió un ión molecular [M-H]- a 317 m/z, concordante para la fórmula molecular C16H14O7 (318 uma). En los espectros de 1H-RMN y 13C-RMN se identificaron las señales de los diferentes hidrógenos y de los 16 carbonos, los cuales están resumidos en la Tabla 1.
Considerando los datos espectroscópicos obtenidos y su comparación con las referencias bibliográficas, se concluye que el compuesto A es el ácido lecanórico4.
Compuesto B. Cristales en forma de agujas de color amarillo, soluble en acetona, poco soluble en etanol; su punto de fusión varía entre 204°C - 205°C; y presentó un Rf = 0,62 en el sistema etanol: acetona (1:1) al ser revelado con H2SO4 al 10 %.
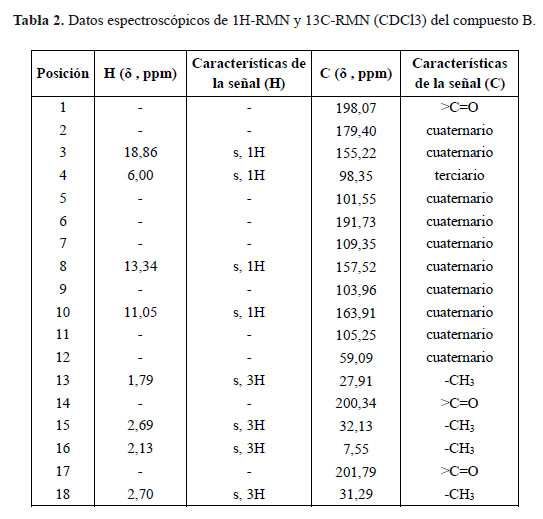
En el espectro UV se tienen dos bandas a 233,7 y 283,8 nm. En el espectro IR se identificaron las bandas correspondientes al OH a 3086,2 cm-1, CH a 2913,4 cm-1, C=O a 1691,6 cm-1, C=C a 1629,8 cm-1 y C-O-C a 1284 cm-1. El espectro de masas (técnica APCI en modo negativo) exhibió un ión molecular [M-H]- a 343 m/z (pico base), concordante para la fórmula molecular C18H16O7 (344 uma). En los espectros de 1H-RMN y 13C-RMN se identificaron las señales de los diferentes hidrógenos y de los 18 carbonos, los cuales se resumen en la Tabla 2.
Considerando los datos espectroscópicos obtenidos y su comparación con los reportados en la bibliografía, se concluye que este compuesto es el ácido úsnico5, 6.
CONCLUSIONES
En el estudio químico del liquen Umbilicaria calvescens Nyl. se aislaron los compuestos liquénicos mayoritarios del ácido úsnico y ácido lecanórico, los cuales fueron identificados por la interpretación de sus espectros de UV, IR, EM, 1H-RMN y 13C-RMN; siendo este el primer trabajo realizado para esta especie.
AGRADECIMIENTO
Se agradece al M.Sc. Pedro Baldera Aguayo y al Departamento de Investigación de la Universidad de Columbia por la obtención de los espectros de masas (EM), 1H-RMN y 13C-RMN de los compuestos aislados.
Se agradece a la Unidad de Investigación (UDI) de la Facultad de Ciencias de la Universidad Nacional de Ingeniería, por el apoyo económico brindado para la realización de este trabajo de investigación.
REFERENCIAS BIBLIOGRÁFICAS
1. Cernava T, Berg G, Grube M. High Life Expectancy of Bacteria on Lichens. Microb Ecol. 2016; 72(3): 510-513. [ Links ]
2. Fernández C, Gómez MP, Crespo A. Antioxidant potential of lichen species and their secondary metabolites. A systematic review. Pharm Biol. 2016; 54(1): 1-17. [ Links ]
3. Ramos D, Ramirez A, Durand K & Huallpa J. Diversidad de Líquenes en el Anexo de Tuctumpaya, Distrito de Pocsi, Arequipa, Perú. Arnaldoa. 2013; 20 (1): 129-154. [ Links ]
4. Martino D. Estudio Químico Martino D. Estudio Químico Flavopunctelia flaventior (Stirt.) Hale. [Tesis de Licenciatura]. Lima: Facultad de Ciencias, Escuela Profesional de Química, UNI; 2015. [ Links ]
5. Cóndor E. Estudio Químico de los líquenes Xanthoparmelia tasmanica y Xanthomendoza mendozae. [Tesis de Maestría]. Lima: Facultad de Ciencias, Escuela Profesional de Química, UNI; 2012. [ Links ]
6. Viteri R. Estudio Fitoquímico del extracto etanólico del liquen Usnea antarctica, procedente de la Antártida. [Tesis de Maestría]. San Antonio de los Altos, Venezuelea: Instituto Venezolano de Investigaciones Científicas; 2015. [ Links ]
Recibido el 13-10-17
Aprobado el 21-05-18