Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Sociedad Química del Perú
versión impresa ISSN 1810-634X
Rev. Soc. Quím. Perú vol.84 no.2 Lima abr./jun. 2018
TRABAJOS ORIGINALES
Evaluación de la capacidad acumuladora de Cd(II), Pb(II) y Cr(VI) por colonias de Nostoc commune "Murmunta"
Evaluation of the sorption capacity of Cd(II), Pb(II) AND Cr(VI) by colonies of Nostoc commune "Murmunta"
Stamber Ramírez Revilla*a, Jeaneth Medina Pérezb, José Villanueva Salasb
*aUniversidad Tecnológica del Perú (UTP), Avda. Tacna y Arica 160. Arequipa-Perú. sramirezr@utp.edu.pe
b Laboratorio del Proyecto Mercurio, Facultad de Ciencias Farmacéuticas, Bioquímicas y Biotecnológicas, Universidad Católica de Santa María (UCSM), Urb. San José s/n Umacollo, Arequipa-Perú.
RESUMEN
En este estudio se evaluó la acumulación de Cd(II), Pb(II) y Cr(VI) por colonias de Nostoc commune "murmunta", llevada a cabo en cultivos hidropónicos, la cuantificación de Cd(II) y Pb(II) fue realizada por voltamperometría de redisolución anódica y la del Cr(VI) por espectrofotometría con difenilcarbazida. Un total de 330 colonias de cianobacterias fueron distribuidas en 10 grupos experimentales. Para la determinación de la acumulación de Cd(II) y Pb(II) se tomaron muestras del líquido interno de las colonias de cianobacterias, seleccionadas en forma aleatoria, cada tres días por un periodo de 21 días y para el caso del Cr(VI) cada cuatro días por un periodo de 28 días.
Los resultados demostraron que las colonias se desarrollan en un medio sin condiciones exigentes, ni tratamientos previos y son de fácil recolección. La mayor concentración acumulada de Pb(II) fue de 80,40 mg/L en el duodécimo día (contenedor 160 mg/L) equivalente a 3589,29 mg/kg de murmunta seca; Cd(II) de 65,70 mg/L en el noveno día (contenedor 160 mg/L) equivalente a 2906,25 mg/kg de murmunta seca y Cr(VI) de 4,52 mg/L al duodécimo día (contenedor 30 mg/L) equivalente a 201,64 mg/kg de murmunta seca.
Palabras clave: Nostoc commune, acumulación, Cd(II), Pb(II), Cr(VI).
ABSTRACT
This study evaluated the accumulation of Cd(II), Pb(II) and Cr(VI) by colonies of Nostoc commune "murmunta", carried out in hydroponics, the quantification of Cd(II) and Pb(II) was performed by Anodic Stripping voltammetry and for Cr(VI) by spectrophotometry with diphenylcarbazide. A total of 330 colonies of cyanobacteria were distributed in 10 experimental groups. For the determination of the accumulation of Cd(II) and Pb(II) samples were taken from the internal fluid of the colonies of cyanobacteria, selected at random, every 3 days for a period of 21 days and in the case of the Cr(VI) every 4 days for a period of 28 days.
The results demonstrated that the colonies develop without being subjected to strict growing conditions or prior treatments and are very easy to collect. The greatest concentration of accumulated Pb(II) was 80,40 mg/L on the twelfth day (container with 160 mg/L), equivalent to 3589,29 mg/kg of dry murmunta; Cd(II) was 65,70 mg/L on the ninth day (container 160 mg/L), equivalent to 2906,25 mg/kg of dry murmunta and Cr(VI) was 4,52 mg/L on the twelfth day (container 30 mg/L), equivalent to 201,64 mg/kg of dry murmunta.
Key words: Nostoc commune, accumulation, cadmium, lead, chromium.
INTRODUCCIÓN
La emisión constante al ambiente de sustancias contaminantes, proceden de actividades industriales, mineras, agropecuarias, artesanales y domésticas1. Hoy tenemos un sin número de sustancias químicas y biológicas en el ambiente que significan un riesgo para la salud porque se encuentran en altas concentraciones o debido a su naturaleza tóxica2.
El Perú es un país privilegiado por su biodiversidad y todas las riquezas naturales que posee, una de ellas son los yacimientos mineros, gran fuente de riqueza y trabajo para todos los peruanos, pero también son la principal fuente de destrucción de ecosistemas y uno de los problemas más resaltantes es la contaminación del agua, provocando, en muchos casos, la desertificación de ricos valles y la extinción de diversas especies.
En los últimos años se han empezado diversas investigaciones que dan como resultado alternativas para prevenir y restaurar los daños ocasionados por el crecimiento industrial. Una de ellas es la biorremediación, donde se remueve y degrada los contaminantes localizados en suelos y lechos acuáticos3.
La fitorremediación es una tecnología barata y con gran potencialidad en el saneamiento y recuperación de suelos4. La ficorremediación es una técnica novedosa, de bajo costo y efectiva que utiliza algas para limpiar aguas residuales, ofreciendo un método muy simple y económico en comparación con los otros tratamientos convencionales5.
Ficorremediación comprende varias aplicaciones: (i) eliminación de nutrientes de aguas residuales, municipales y efluentes ricos en materia orgánica; (ii) eliminación de compuestos nutrientes y xenobióticos con la ayuda de biosorbentes a base de algas; (iii) tratamiento de aguas residuales ácidas y metálicas; (iv) captación de CO2; (v) transformación y degradación de xenobióticos; y (vi) detección de compuestos tóxicos con la ayuda de biosensores basados en algas6.
El Nostoc está formado por colonias de cianobacterias verde azuladas, verde oliva o marrón. El color verde viene de su contenido de clorofila, el azul, de un pigmento denominado Ficocianina, que tiene relación con la fotosíntesis. Algunos contienen Ficoeritrina, pigmento rojo, que al mezclarse con los otros generan la coloración marrón7.
El objetivo del presente trabajo fue determinar la capacidad acumuladora de colonias de Nostoc commune sobre lechos acuáticos contaminados con Cd(II), Cr(VI) y Pb(II), teniendo en cuenta que es un alga que no necesita de medios exigentes para su crecimiento ni tratamientos previos y que la encontramos abundantemente como parte de la biodiversidad de nuestro país, por lo que su utilización es adecuada y económica.
PARTE EXPERIMENTAL
Material biológico
Para la evaluación del presente estudio se utilizó colonias de cianobacterias Nostoc commune "murmunta", adquiridas en un mercado local, hidratadas por 24 h en agua destilada y mantenidas en contenedores de polietileno de alta densidad en medio hidropónico y temperatura ambiente hasta su empleo. Las colonias fueron mantenidas con fotoperiodos de luz indirecta de 10 a 12 h por día.
Equipos y reactivos
Todos los reactivos químicos usados fueron de grado analítico o superior: solución estándar de Cd(II) y Pb(II) (1000 ppm) CertiPUR (Merck), dicromato de potasio (Merck), buffer acetato de sodio pH 4,60, ácido nítrico (Merck), ácido sulfúrico 0,20 M y solución de difenilcarbazida en acetona 5000 ppm. Todas las soluciones fueron preparadas con agua calidad ultrapura (18,2 MΩ) obtenida con un equipo EASY pure II.
Las determinaciones de Cd(II) y Pb(II) fueron realizadas usando una estación voltamperométrica 757 VA COMPUTRACE de Metrohm, que consta de un electrodo de gota colgante de mercurio (HMDE), un electrodo auxiliar de platino y un electrodo de referencia Ag/AgCl/KCl 3 M. Para las determinaciones de Cr(VI) se hizo uso de un espectrofotómetro Cary 60 UV-Vis (Agilent).
Contaminación de las colonias
Se seleccionó un total de 330 cianobacterias y se repartió aleatoriamente 30 a cada contenedor al cual se le agregó 1,5 L de medio hidropónico. Una vez colocadas las cianobacterias en cada contenedor se procedió a determinar los valores basales de Cd(II), Cr(VI) y Pb(II). Luego se procedió a contaminar cada contenedor: Grupo "A" y "B" Cd(II) (80 y 160 ppm, respectivamente); Grupo "C" y "D" Pb(II) (80 y 160 ppm, respectivamente); Grupo "E" Cd(II) y Pb(II) (80 ppm c/u); Grupo "F" Cr(VI) (10 ppm); Grupo "G" Cr(VI) (20 ppm); Grupo "H" Cr(VI) (30 ppm) y los Grupos "I" y "J" como controles. Se tomaron muestras de las colonias aleatoriamente cada tres días para determinar Cd(II) y Pb(II) por un periodo de 21 días y para el Cr(VI) cada cuatro días por un periodo de 28 días.
Tratamiento de las muestras
Las colonias de Nostoc commune seleccionadas aleatoriamente fueron secadas externamente con papel filtro; con una jeringa se extrajo 100 µL de líquido interno y se trasladó a un microtubo de centrífuga, sometiéndolo a 8000 rpm durante 8 minutos.
Previo a la determinación de Cd(II) y Pb(II), los sobrenadantes fueron tratadas en un sistema de digestión por fotólisis UV con el fin de eliminar el material orgánico que contenían, para lo que en cada tubo de digestión se colocó 50 de muestra, 20 de peróxido de hidrógeno, 50 de ácido nítrico y 5,0 mL de agua ultrapura, tras una hora de digestión se traspasaron las muestras a una fiola de 10 mL enrasándose con agua ultrapura.
Determinación voltamperométrica de Cd(II) y Pb(II)
Un volumen de 100 μL de muestra tratada y 10,0 mL de buffer fueron transferidos a la celda voltamperométrica, las concentraciones de Cd(II) y Pb(II) presentes fueron determinados por voltamperometría de redisolución anódica. Los parámetros voltamperométricos comprenden: potencial de deposición -0,9 V; tiempo de deposición 30 s; velocidad de barrido 30 mV/s; amplitud de pulso 0,05 V y tiempo de pulso 0,04 s. La curva corriente potencial fue registrada en el intervalo potencial de -0,2 a -0,8 V.
Determinación de Cr(VI) por espectrofotometría
Para las muestras a las que se les determinó Cr(VI), una vez centrifugadas se tomó una alícuota de 100 µL y se la llevó a una fiola de 10 mL, añadiéndosele 1,5 mL de H2SO4 0,2 M y 200 μL de solución de difenilcarbazida, y tras 2 minutos de reacción se procedió a leer en un espectrofotómetro a una longitud de onda de 540 nm.
RESULTADOS Y DISCUSIÓN
En el presente trabajo se evaluó la capacidad acumuladora de Cd(II), Pb(II) y Cr(VI) de las colonias del Nostoc commune "murmunta", las cuales fueron cultivadas en medio hidropónico. Antes de proceder a las lecturas, tanto voltamperométricas como espectrofotométricas, se procedió a validar ambos métodos.
Una vez que se contó con los métodos debidamente validados se determinó las concentraciones basales de Cd(II), Pb(II) y Cr(VI) en Nostoc commune, los resultados fueron 9,37, 15,30 y 0,32 ppm, respectivamente. Luego se contaminó el medio hidropónico con estos metales en las concentraciones ya descritas.
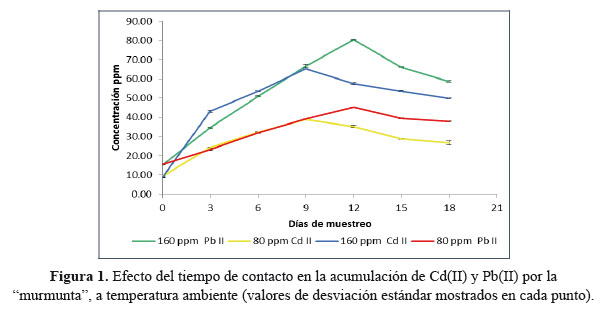
Como se observa en la Figura 1 la mayor concentración de Pb(II) acumulado se logró en el depósito que contenía 160 ppm de Pb(II), alcanzando un valor de 80,40 ppm (50,35% de remoción, equivalente a 3589,9 mg de Pb(II)/kg de cianobacteria seca) en el 12avo día de análisis, al mismo día de análisis se logró la mayor absorción en el contenedor de 80 ppm de Pb(II) que corresponde a 45,20 ppm (56,5 % de remoción, equivalente a 2017,86 mg de Pb(II)/kg de cianobacteria seca), por lo que el 12avo día corresponde al día óptimo de máxima absorción de Pb(II) por la murmunta.
En el caso del Cd(II) el día óptimo de acumulación es el 9no alcanzándose valores de 38,90 ppm (48,6 % de remoción, 1736,61 mg/kg cianobacteria seca) y 65,10 ppm (40,7 % de remoción, 2906,25 mg/kg cianobacteria seca) para los contenedores de 80 y 160 ppm de Cd(II), respectivamente.
En comparación, los mayores porcentajes de acumulación se lograron en el contenedor de 80 ppm de Pb(II) mostrando así una mayor afinidad de la murmunta por el Pb(II) sobre el Cd(II).
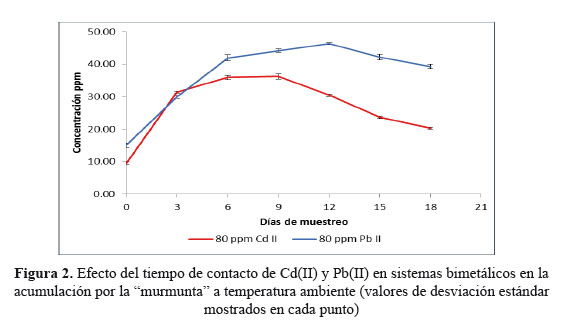
Dado los resultados anteriores y para determinar si existía competencia entre los metales estudiados se contaminó un contenedor con ambos metales a 80 ppm de Cd(II) y 80 ppm de Pb(II).
La Figura 2 demuestra que no existe competencia para la acumulación de ambos metales en la murmunta siendo las máximas concentraciones (46,2 ppm de Pb(II) y 36,2 ppm de Cd(II)) similares a las de los contenedores que contenían un solo metal, mostrándose una vez más que el día 12avo de experimentación resulta el óptimo para Pb(II) y el día 9no para Cd(II).
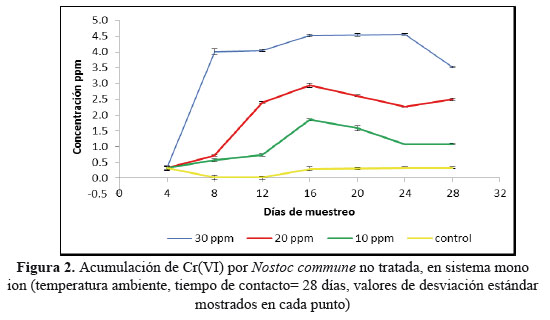
En la Figura 3 se observa los resultados obtenidos de los distintos días de muestreo para la determinación de Cr(VI), los depósitos fueron contaminados a 10, 20 y 30 ppm , como se observa fueron 7 puntos tomados cada 4 días haciendo un total de 28 días de experimentación.
Como se muestra existe una relación directa entre la concentración de Cr(VI) presente en el depósito y la concentración de Cr(VI) dentro de la murmunta, puesto que las murmuntas colocadas en el contenedor con 30 ppm de Cr(VI) mostraron la mayor acumulación del metal llegando en el 12avo día a captar 4,52 ppm de Cr(VI) (equivalente a 201,64 mg de Cr(VI) por kilogramo de cianobacteria seca, 15,07 % de remoción).
Posterior al 12avo día se observó una baja notoria de la concentración del metal en estudio, esto probablemente por un mecanismo de regeneración de la murmunta y que puede verse apoyado por el hecho de que al 28avo día de experimentación estas volvieron a mostrar un alza en la cantidad de Cr(VI) acumulado, notándose un mejor aspecto en las colonias restantes e incluso nuevas colonias.
Dado que al tomar el líquido interno de las cianobacterias para analizar las concentraciones captadas de Cd(II), Pb(II) y Cr(VI), se evidenció que a mayor concentración de metal colocada se produce una mayor acumulación dentro de la cianobacteria, se presume que el mecanismo de captación es de acumulación pasiva por gradiente de concentración.
En todos los contenedores contaminados con Cd(II), Pb(II) y Cr(VI) donde se colocaron las colonias de Nostoc commune se observó que cuando alcanzan su máxima concentración ya sea al noveno día en el caso del Cd(II), al duodécimo día en el Pb(II) o al duodécimo día para Cr(VI), estas concentraciones empiezan a disminuir en los siguientes días, por lo que se presume que una vez alcanzado su máximo nivel de acumulación para no morirse ni intoxicarse por completo eliminan poco a poco pequeñas cantidades del metal que después se vuelven a absorber cuando ya están recuperadas y se encuentran en buen estado.
A pesar de no haberse reportado estudios con la misma especie (Nostoc commune), existen estudios 8,9,10 que demuestran la afinidad de otras especies de la misma familia Nostocaceae por el Pb(II) en los que este tipo de cianobacteria es centrifugada o secada y tamizada para obtener su biomasa, nuestro trabajo reporta la capacidad del Nostoc commune en su estado hidratado y sin alteraciones de ningún tipo, por lo que constituye una alternativa de biorremediación económica además de ecoamigable.
Se ha encontrado que las cianobacterias producen diversos tipos de exopolisacáridos (EPS), los que juegan un rol importante en la estabilización de las células secadas al aire, por lo que Nostoc commune puede resistir la desecación extrema y restaurar fácilmente su actividad metabólica después de la rehidratación11; asimismo, muchas veces estos EPS presentan sustituyentes como grupos acilo, aminoácidos o sulfatos en sus esqueletos12 y dado que cargas negativas estarán presentes en EPS, las cianobacterias productoras de EPS como el Nostoc commune podrían considerarse como agentes quelantes para la eliminación de iones de metales pesados con carga positiva de soluciones acuosas.
CONCLUSIONES
Los resultados de este estudio muestran que las colonias de Nostoc commune hidratadas y sin previo tratamiento son algas biorremediadoras debido a que acumulan y absorben Cd(II), Cr(VI) y Pb(II) del medio donde se encuentran, este estudio se llevó a cabo en sistemas batch mono y bimetálico, evidenciando mayor afinidad de la cianobacteria por el Pb(II) en comparación con el Cd(II) y Cr(VI) y no mostrando competición en sistemas bimetálicos de Cd(II) y Pb(II).
Asimismo, se observó una relación directa entre la concentración colocada por cada grupo y la concentración del analito dentro de la "murmunta", hasta alcanzar un valor máximo para posteriormente iniciar un descenso corto y luego continuar su proceso de remoción de metales pesados, al parecer como un mecanismo de defensa propio, es así que la utilización de la especie Nostoc commune constituye una alternativa de biorremediación económica además de ecoamigable.
REFERENCIAS BIBLIOGRÁFICAS
1. Delgadillo AE, González CA, Prieto F, Villagómez R, Acevedo O. Fitorremediación: Una alternativa para eliminar la contaminación. Trop Subtrop Agroecosyst. 2011; 14(2): 597 - 612. [ Links ]
2. Chung B. Control de los Contaminantes Químicos en el Perú. Rev Peru Med Exp Salud Publica 2008; 4(25): 413-418. [ Links ]
3. Torres Rodríguez D. El papel de los microorganismos en la biodegradación de compuestos tóxicos. Ecosistemas. [Internet] 2003, XII ( mayo-agosto) : [Fecha de consulta: 03 de febrero de 2018] Disponible en: http://www.redalyc.org/articulo.oa?id=54012219 [ Links ]
4. Marrero Coto J, Amores Sánchez I, Coto Pérez O. Fitorremediación, una tecnología que involucra a plantas y microorganismos en el saneamiento ambiental. ICIDCA. 2012; 46(3): 52-61. [ Links ]
5. Azarpira H, Dhumal K, Pondhe G. Application of phycoremediation technology in the treatment of sewage water to reduce pollution load. Adv Environment Biol. 2014; 8(7): 2419-2423. [ Links ]
6. Ahmad F, Khan A, Yasar A. Comparative Phycoremediation of Sewage Water by Various Species of Algae. Proc Pakistan Acad Sci. 2013; 50(2): 131-139. [ Links ]
7. Ponce E. Nostoc: un alimento diferente y su presencia en la precordillera de Arica. IDESIA. 2014; 32(2): 115-118. [ Links ]
8. Nabanita C, Amita B, Ruma P. Accumulation of lead by free and immobilized cyanobacteria with special reference to accumulation factor and recovery. Bioresour Technol. 2011; 102(5): 4191-4195. [ Links ]
9. Grupta K, Rastogi A. Biosorption of lead (II) from aqueous solutions by non - living algal biomass Oedogonium sp. and Nostoc sp. - A comparative study. Colloids Surf B Biointerfaces. 2008; 64(2): 170-178. [ Links ]
10. Grupta VK, Rastogi A. Sorption and desorption studies of chromium(VI) from nonviable cyanobacterium Nostoc muscorum biomass. J Hazard Mat. 2008; 154(1-3): 347-354. [ Links ]
11. Wang Hong-Bin, Wu Sheng-Jun, Liu Dou. Preparation of polysaccharides from cyanobacteria Nostoc commune and their antioxidant activities. Carbohydr Polym. 2014; 99: 553–555. [ Links ]
12. Bhunia B, Prasad Uday US, Oinam G, Mondal A, Bandyopadhyay TK, Tiwari ON. Characterization, genetic regulation and production of cyanobacterial exopolysaccharides and its applicability for heavy metal removal. Carbohydr Polym. 2018;179:228-243. [ Links ]
Recibido el 06-03-18
Aprobado el 07-05-18