Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Sociedad Química del Perú
versión impresa ISSN 1810-634X
Rev. Soc. Quím. Perú vol.84 no.2 Lima abr./jun. 2018
TRABAJOS ORIGINALES
Desarrollo de electrodos de bajo costo basado en óxidos metálicos para la generación de cloro
Development of Anpdic Electrodes Based on Low Cost Metal Oxides for the Generation of Free Chlorine
Daniel Bazán Aristaa, Angélica María Baena Moncadaa, Adolfo La Rosa-Toro Gómeza*
a Universidad Nacional de Ingeniería, Av. Túpac Amaru s/n, Rímac, Lima 25, Perú toro@uni.edu.pe
RESUMEN
Se prepararon electrodos de SnO2 dopados con Sb soportados en láminas porosas de titanio mediante impregnación, sinterización y descomposición térmica de soluciones precursoras con diferentes porcentajes en masa de Sn y Sb (Sn:Sb = 9:1 y Sn:Sb = 7:3). Estos fueron recubiertos por una capa de ß-PbO2 obtenida por el método de electrodeposición anódica a una temperatura de 65 °C y una densidad de corriente 30 mA cm-2, durante 30 minutos. Los electrodos fueron caracterizados por espectroscopía Raman, microscopía electrónica de barrido y voltamperometria cíclica. Los resultados obtenidos mostraron que el recubrimiento con mayor contenido de estaño brinda las condiciones óptimas para la formación de la inter-capa entre el Ti y el PbO2, como la formación de una película homogénea, bajos sobrepotenciales para la reacción de evolución de cloro y estabilidad a pH neutro. La película de PbO2 electro-sintetizada presentó estructura piramidal y de acuerdo al espectro Ramanpresenta la fase dominate de Plattnerite [β-PbO2], desarrolla bajos sobrepotenciales para la reacción de evolución de cloro con un tiempo de vida determinado por cronopotenciometría de 171,75 horas en electrólisis en NaCl al 6 % empleando una densidad de corriente de 30 mA cm-2.
Palabras clave: dióxido de estaño, dióxido de plomo, reacción de oxidación de cloro, tiempo de vida.
ABSTRACT
SnO2 electrodes doped with Sb were prepared, supported on porous titanium sheets by impregnation, sintering and thermal decomposition of precursor solutions with different mass percentages of Sn and Sb (Sn: Sb = 9:1 and Sn: Sb = 7:3). The electrodes were coated with a layer of ß-PbO2 obtained by anodic electrodeposition method at 65 ° C and a current density of 30 mA cm-2, for 30 minutes. The electrodes were characterized by Raman spectroscopy, scanning electron microscopy, and cyclic voltammetry. The results obtained showed that the catalyst with the highest content of Sn provides the optimal conditions for the interlayer formation between Ti and PbO2, such as the formation of a homogeneous film, low overpotentials for the chlorine evolution reaction and stability at neutral pH. The synthesized PbO2 film presented a pyramidal shape morphology, according to the Raman spectrum; it has the Plattnerite form [β- PbO2]. In addition to low overpotentials for the chlorine evolution reaction, with a life time determined by Cronopotenciometric measurements of 171.75 hours in NaCl at 6% and with a current density of 30 mA cm-2.
Key words: tin dioxide, lead dioxide, chlorine oxidation reaction, lifetime
INTRODUCCIÓN
En la actualidad, la producción electroquímica mundial de cloro es un proceso que consume grandes cantidades de energía y emplea electrodos basados en metales nobles, por lo que es necesario optimizar el proceso empleando elcetrodos de bajo costo y de buena eficiencia anódica. Los anodos dimensionalmente estables son electrodos que se emplean para la producción industrial de cloro1. Los electrodos de Ti/SnO2-Sb2O3 son uno de los materiales más prometedores para ser empleados en el proceso de oxidación electroquímica, estos materiales presentan altos sobrepotenciales para la reacción de evolución de oxígeno, comportamiento que se encuentra asociado a la generación de radicales hidroxilo; la elevada eficiencia obtenida se le atribuye a la buena conductividad del componente de óxido de antimonio; además de tener bajo costo y baja toxicidad. Sin embargo, presentan la desventaja de tener un tiempo de vida muy corto1–3. En este contexto, el material del ánodo juega un papel crítico, porque este deberá ser inocuo, de bajo costo y deberá tener un tiempo de vida útil.
El óxido de plomo existe en dos estados de oxidación, Pb4+ (PbO2) y Pb2+ (PbO), toma dos formas cristalinas, tetragonal (β-PbO2, α-PbO) y ortorrómbico (β-PbO2, α-PbO)4,5. El óxido de plomo ha sido usado como material anódico, es de bajo costo, estable y fácil de preparar, además posee altos sobrepotenciales para la reacción de evolución de oxígeno6. Muchos investigadores han hecho un gran esfuerzo por aumentar el desempeño de los electrodos de PbO2, como la adición de una capa interna (SnO2-Sb) entre el titanio y el PbO2, o la incorporación de un dopante metálico o no metálico7,8. Otros estudios han demostrado que el uso de un sustrato de Ti poroso tiene un papel importante en el desempeño del PbO29.
En este trabajo se utilizó el método de descomposición térmica como método de síntesis para obtener los óxidos de estaño dopados con antimonio sobre las placas de Ti porosas, donde se probó dos proporciones diferentes de Sn:Sb 9:1 y Sn:Sb 7:3, siendo más estable el electrodo con mayor porcentaje de Sn; posteriormente, se electrodepositó una película de ß-PbO2 sobre la superficie de SnO2-Sb2O3. Los óxidos depositados fueron evaluados frente a la reacción de evolución de cloro por voltamperometría cíclica, y el tiempo de vida útil a pH neutro por cronopotenciometría.
PARTE EXPERIMENTAL
Preparación de electrodos de Ti/SnO2-Sb2O3/PbO2(EA-SnxSby/Pb)
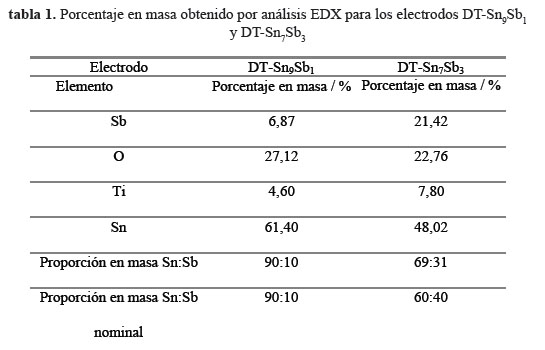
Como soporte se utilizó titanio poroso (99,99 %, Goodfellow) (tamaño: 40 mm x 5 mm x 0,5 mm). Las láminas de titanio fueron tratadas con ácido oxálico al 10 % (C2H2O4.2H2O; 99,9 %, J.T.BAKER) en ebullición, y se lavó con agua ultrapura (Sistema MILLIPORE Q MILLI PLUS, 18,2 mΩ cm-1 a 25 °C). La capa interna de SnO2-Sb2O3 fue depositada por descomposición térmica sobre el titanio poroso Ti/SnO2-Sb2O3, denotado como TD-SnxSby, partiendo de una solución de SnCl2.2H2O (98-101 %, Fermont), SbCl3 (>99 %, Merck) y HCl concentrado (36-37 %, Merck), se utilizó como solvente etanol (89-91 %, Fermont)10,11. Los porcentajes nominales de los precursores fueron (en moles) DT-Sn9Sb1 (Sn:Sb=9:1) y DT-Sn6Sb4 (Sn:Sb=6:4). El electrodo poroso de titanio fue impregnado con la solución precursora utilizando un pincel, con posterior secado a 80 ºC por un periodo de 5 min. Luego se realizó un tratamiento térmico a 400 ºC por 10 min en presencia de oxígeno. El proceso se repitio 30 veces hasta alcanzar una carga másica entre 1.1-1.6 mg cm-2. Al alcanzar la carga másica deseada se realizó un tratamiento final a 500 ºC durante 1 h10. Finalmente se obtuvo como producto una capa intermedia de SnO2-Sb2O3.
Una vez obtenidos los electrodos de DT-SnxSby, se procedió a electrodepositar una capa de β-PbO2 para obtener electrodos del tipo Ti/SnO2-Sb2O3/PbO2 (EA-Sn9Sb1/Pb65). Para el depósito de la película de PbO2 sobre los electrodos de DT-SnxSby se utilizó un área efectiva de 1 cm2, el depósito se hizo en modo galvanostático en una celda electrolítica de un solo compartimento12, utilizando como catodo acero inoxidable, con una separación entre electrodos de 1 cm. La solución electrolítica empleada fue Pb(NO3)2 0,5 mol L-1 (>99,0 %, ACS reagent SIGMA-ALDRICH) y el pH se ajusto a 1 con HNO3 (62-63%, pro analysis)12. Se realizó un estudio del proceso de electrodeposición variando las densidades de corriente desde 5 hasta 30 mA cm-2, también se estudió el depósito a diferentes velocidades de agitación desde 0 a 450 rpm y dos temperaturas distintas 25 y 65 °C11. Los electrodos obtenidos fueron lavados con agua desionizadas y secados en estufa13.
Caracterización fisicoquímica
Para estudiar la morfología y hacer un análisis elemental se utilizó un microscopio electrónico de barrido (SEM, JEOL, JSM-6390A) equipado con un analizador de dispersión de rayos x (EDX). Las medidas de dispersión Raman fueron obtenidas con un espectrómetro HORIBA Scientific, utilizando un laser de Ar a una longitud de onda de 632 nm.
Caracterización electroquímica
Los experimentos electroquímicos fueron llevados a cabo en una celda de electroquímica de tres electrodos, usando un electrodo de referencia de Ag/AgCl y grafito como electrodo auxiliar. En este estudio el electrodo de trabajo consistió en un electrodo de Ti modificado (DT-SnxSby, EA-Sn9Sb1/Pb65). Las medidas electroquímicas fueron realizadas con un potenciostato-galvanostato Ivium STAT en electrolito previamente burbujeado con nitrógeno para desplazar el oxígeno disuelto. En este trabajo todos los potenciales son reportados versus el electrodo de referencia Ag/AgCl (KCl 3 mol L-1). NaNO3 0.2 mol L-1 (99,5 %, MERCK) fue usado como electrolito soporte. Se realizaron voltamperometrías cíclicas y se hicieron adiciones de NaCl para observar el comportamiento del electrodo frente a la generación de cloro. NaCl fue adicionado al electrolito soporte para obtener una concentración final de 0, 1000, 5000 y 10000 ppm.
Evaluación de la estabilidad anódica de los electrodos (tiempo de vida)
La estabilidad anódica frente la evolución de cloro fue evaluada mediante cronopotenciometría en 2000 mL de NaCl 6% w/v, las medidas fueron realizadas a pH 7 usando un potenciómetro S/M PL-700PV, el área expuesta de los electrodos fue de 1 cm2 y se impuso una corriente constante de 150 mA.cm-2 para todos los electrodos a 25 °C. El análisis por cronopotenciometría fue utilizado para registrar el incremento de potencial de los electrodos y se utilizó un Datalogging Hantek 365A, con electrodo de referencia de Ag/AgCl (KCl 3 mol L-1).
RESULTADOS Y DISCUSIÓN
Síntesis y caracterización de los electrodos DT- SnxSby
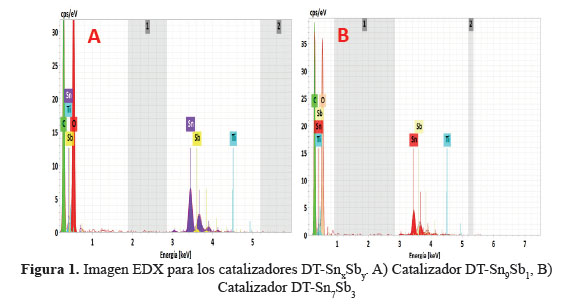
Una lámina de titanio porosa fue utilizada como sustrato, primero se desengrasó con acetona sumergiéndolo durante 10 min, posteriormente se atacó químicamente con ácido oxálico al 10 % w/t durante una hora en ebullición. El tratamiento produjo una superficie rugosa de color gris apropiada para el anclaje de los óxidos. Para obtener los óxidos metálicos se empleó sales precursoras de SnCl2.2H2O y SbCl3 en una relación de Sn/Sb 6:4 y Sn/Sb 9:1 en masa, las cuales fueron disueltas en etanol, HCl fue adicionado para asegurar la completa disolución de las sales. Las soluciones precursoras fueron impregnadas en el sustrato poroso de titanio mediante pintado, mojando bien la superficie sin dejar excesos, seguido de un secado a 80 ºC durante 5 minutos para eliminar el solvente y posterior tratamiento térmico a 400 ºC entre capa y capa, con un tratamiento final a 500 °C durante una hora con el propósito de obtener la sinterización de los óxidos. El análisis de EDX mostró que las composiciones en masa de los óxidos obtenidos eran Sn/Sb 9:1 para el primer electrodo y Sn/Sb 7:3 para el segundo electrodo (tabla 1). En la figura 1 se puede observar las imágenes SEM de los electrodos sintetizados, para el electrodo de DT-Sn9Sb1 (figura 2 A y B) se observa una película homogénea y de mejor calidad que el obtenido con el electrodo DT-Sn7Sb3 (figura 1 C y D), donde se observa huecos y fragmentos grandes dentro de la película.
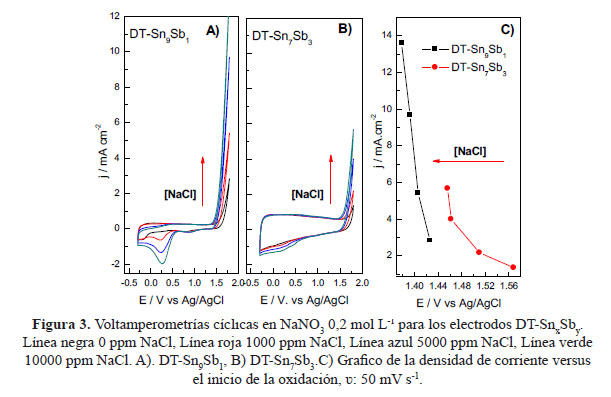
Las voltamperometrías cíclicas en NaNO3 mol L-1, de ambos electrodos, se muestran en la figura 3, se puede observar que el potencial de inicio para la reacción de evolución de oxígeno (REO) son 1,43 V y 1,56 V para DT-Sn9Sb1 y DT-Sn7Sb3, respectivamente. Para observar la actividad catalítica para la reacción de evolución de Cl2 de acuerdo con:
Se realizaron adiciones de NaCl, se puede apreciar en la figura 2 A) y B) un aumento de corriente, a medida que aumenta la concentración de NaCl, a menores concentraciones de NaCl el sobrepotencial para la REO es mayor, indicando una mayor inhibición para la oxidación de oxígeno3. También se observa una disminución en el potencial de inicio de la oxidación cuando se agregan 1000 ppm NaCl de 0,01 y 0,05 V para DT-Sn9Sb1 y DT-Sn7Sb3, respectivamente, este comportamiento puede ser atribuido al hecho de que la corriente de oxidación corresponde no solo a la formación de oxígeno, involucrando también a la evolución de cloro, ambos procesos ocurren de forma simultánea y en competencia. En la figura 3C se puede apreciar un gráfico de la densidad de corriente versus en potencial de inicio de la oxidación, en donde se puede observar que el electrodo DT-Sn9Sb1, presenta menores sobrepotenciales para la reacción de evolución de cloro y densidades de corriente de pico más altas que el electrodo DT-Sn7Sb3.
Síntesis y caracterización del electrodo EA-Sn9Sb1/Pb65.
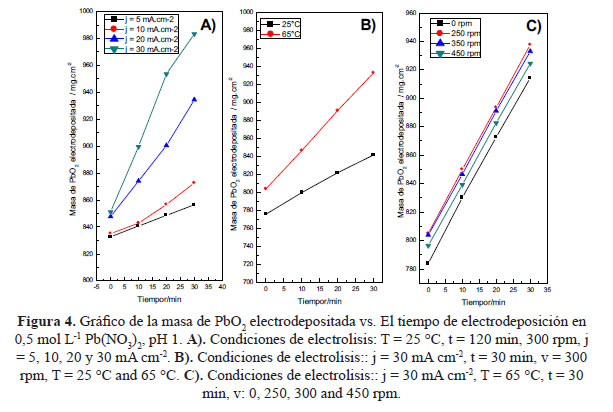
La electrodeposición de PbO2 sobre los electrodos de DT-SnxSby se realizó en una celda electrolítica usando dos láminas de acero como cátodo. El ánodo (DT-SnxSby) se colocó entre las dos láminas durante el proceso de deposición anódica. De acuerdo a los resultados obtenidos durante la caracterización morfológica y electroquímica de los electrodos DT-Sn9Sb1 y DT-Sn7Sb3, se observó que el electrodo de DT-Sn10Sb1 mostró un mejor cubrimiento de la película de PbO2 depositada, buena adhesión al sustrato y excelente cubrimiento superficial, además de menores sobrepotenciales para la reacción de evolución de cloro. Por estas razones se eligió el electrodo DT-Sn9Sb1 para la electrodeposición del PbO2. La formulación de la solución electrolítica de Pb2+ genera una película de PbO2 de buena calidad a 25 °C. La deposición del film de PbO2 inicialmente se realizó a 25 ºC, 300 rpm y se varió la densidad de corriente con la finalidad de evaluar las condiciones óptimas para obtener una buena cobertura del sustrato, se usaron densidades de 5, 10, 20 y 30 mA cm-2. En la figura 4 se observa que la cantidad de masa electrodepositada es proporcional a la corriente aplicada, como consecuencia se obtiene una línea recta.
De acuerdo a los test preliminares, la velocidad de masa de PbO2 electrodepositada no depende de la velocidad de agitación de la solución electrolítica (figura 4C), la masa de PbO2 se mantiene casi constante para todas las velocidades probadas. La cantidad de PbO2 depende de la densidad de corriente aplicada, además, la morfología de la película de PbO2 depende de la densidad de corriente, de la concentración de Pb (II) y la temperatura de la solución electrolítica11.
El tiempo de electrolisis no afecta la capa activa de PbO2, y se mantiene la forma típica piramidal reportada por otros autores14 pero tiene un pequeño efecto sobre el tipo de cristal, pero no influencia la estructura o el tamaño del cristal. Un buen cubrimiento superficial del sustrato se alcanza después de 10 minutos. Se eligió un periodo de 30 minutos para la electrodeposición del PbO211. De esta forma se garantiza la cobertura del sustrato y se obtiene un electrodo de Pb2O poroso. Otros autores emplearon tiempos de 60 a 120 minutos de electrolisis conllevando a conseguir un mayor espesor, factor que puede incidir en un mayor tiempo de vida útil13,15.
La masa de PbO2 obtenida a 25 °C fue de 841,51 mg cm-2, mientras que a 65 °C se obtuvo una masa de 934,32 mg cm-2 de PbO2. Según la literatura a 25 °C la película obtenida está compuesta de partículas casi esféricas poco homogéneas, por encima de los 45 °C la película obtenida se basa en cristales con forma piramidal. La literatura considera la temperatura de 65 °C como la temperatura óptima para la electrodeposición11.
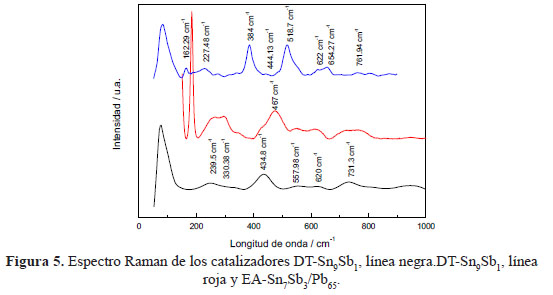
En la figura 5 se observa el espectro Raman para los electrodos DT-SnxSby y el electrodo EA-Sn9Sb1-Pb65. El espectro del DT-Sn9Sb1 muestra tres picos a 439,32, 668,53 y 744,93 cm-1, estos picos están relacionados con la estructura tipo rutilo del SnO2, existe un corrimiento a bajas longitudes de onda debido, probablemente, al reemplazo de iones Sn2+ por iones Sb2+ en la red cristalina16. El espectro Raman del catalizador DT-Sn7Sb3 presenta dos picos adicionales en comparación con el DT-Sn9Sb1, un pico a 184 cm-1 y a 467 cm-1, estos picos son debidos al aumento de la concentración de antimonio en la síntesis de este óxido metálico y podría ser asignado a la forma Senarmontite (Sb2O3 cúbica)17. En el electrodo EA-Sn9Sb1/Pb65 se observan tres picos adiconales a 425,85, 510,84 y 653,87 cm-1 asignados a la forma Plattnerite [β-PbO2]18.
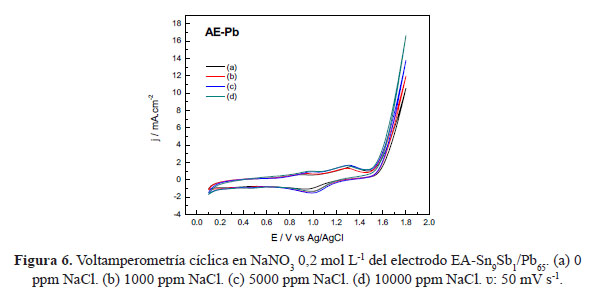
Se realizaron experimentos de voltamperometría cíclica del electrodo AE-Sn9Sb1/Pb65 para observar la estabilidad y el aumento de actividad frente a la producción de cloro en comparación con el electrodo TD-Sn9Sb1. El estudio se realizó utilizando NaNO3 como electrolito soporte y con adiciones de diferentes cantidades de NaCl. En la figura 6 se observa la respuesta electroquímica para el electrodo EA-Sn9Sb1/Pb, se produce un corrimiento a potenciales negativos, y la corriente de pico se incrementa cuando se aumenta la concentración de NaCl. Sin embargo, el potencial de inicio para la oxidación se mantiene igual que el obtenido con el electrodo TD-Sn9Sb1 como se observa en la figura 3. Se puede apreciar un incremento de corriente para la evolución de cloro en el electrodo EA-Sn9Sb1/Pb65 de 16,51 µA, en comparación con el valor obtenido en electrodo de TD-Sn9Sb1 (13,54 µA).
Estabilidad electroquímica
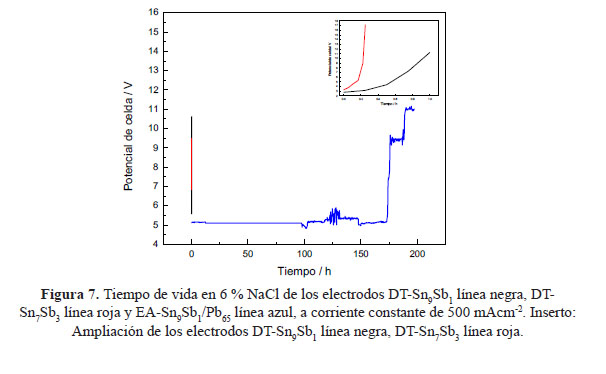
Es importante conocer la estabilidad de los electrodos sintetizados para la evolución de cloro a pH 7. La estabilidad electroquímica fue evaluada en NaCl 6 %, pH 7; a una corriente constante de 150 mA cm-2, los experimentos de tiempo de vida acelerada se realizaron por cronopotenciometría. En la figura 7 se puede observar la cronopotenciometría de los electrodos sintetizados, la desactivación se alcanza después de 1 y 0,25 horas para DT-Sn9Sb1 y DT-Sn7Sb3, respectivamente. Estos electrodos no son adecuados para trabajar por periodos prolongados de tiempo, dado que no son estables en estas condiciones de operación, indicando que no es posible utilizarlos para la reacción de evolución de cloro. Se eligió trabajar con el electrodo DT-Sn9Sb1 como soporte para la electrodeposición de la película de PbO2, debido a que es más estable que el DT-Sn7Sb3 a pH = 7. El electrodo EA-Sn9Sb1/Pb65 muestra un potencial constante a pH 7 durante 171,75 horas, después de este periodo hay un incremento significativo de voltaje desde 5,15 a 9,42 V, indicando la desactivación del electrodo. Resultados similares se han obtenido con electrodos de Ti/Sb–SnO2/Pb3O4 con un tiempo de vida de 180 horas en NaCl 0,5 mol L-1 19. Con base en estos resultados es posible la aplicación del electrodo de EA-Sn9Sb1/Pb65, para la obtención de cloro en condiciones de pH neutro.
CONCLUSIONES
En este trabajo de investigación se evaluaron dos proporciones de Sn:Sb para determinar la relación adecuada para la formación de la película que servirá como intercapa entre el titanio y el óxido de plomo. Los resultados mostraron que el electrodo de DT-Sn9Sb1 presentó las mejores características: Formación de una película homogénea, bajos sobrepotenciales para la reacción de evolución de cloro, y mayores densidades de corriente de pico en comparación al electrodo DT-Sn7Sb3, permitiendo su empleo como sustrato para la electrodeposición del PbO2. La electrodeposición de PbO2 se realizó a 30 mA cm-2, 65 °C, 300 rpm, se obtuvo una película con una forma típica piramidal, por espectroscopía Raman se determinó la fase de Plattnerite [β-PbO2]. Los tres electrodos sintetizados son activos para la reacción de evolución de cloro, sin embargo, los electrodos de DT-SnxSby no presentaron tiempos de vida adecuados para su utilización, mientras que, el electrodo EA-Sn9Sb1/Pb65 muestra un potencial constante a pH 7 durante 171,75 horas, siendo una buena propuesta como catalizador para reacción de evolución de cloro.
AGRADECIMIENTO
Los autores agradecen el soporte económico brindado por Cienciactiva bajo el convenio FONDECYT 209-2015 y el apoyo del Dr. Clemente Luyo en los análisis de caracterización SEM y EDX.
REFERENCIAS BIBLIOGRÁFICAS
1. Zeradjanin AR, La Mantia F, Masa J, Schuhmann W. Utilization of the catalyst layer of dimensionally stable anodes—Interplay of morphology and active surface area. Electrochim Acta. 2012;82:408–14. [ Links ]
2. Comninellis C. Electrocatalysis in the electrochemical conversion/combustion of organic pollutants for waste water treatment. Electrochim Acta. 1994;39(11–12):1857–62. [ Links ]
3. Shao D, Li X, Xu H, Yan W. An improved stable Ti/Sb–SnO2 electrode with high performance in electrochemical oxidation processes. RSC Adv. 2014;4(41):21230–7. [ Links ]
4. D’Antonio P, Santoro A. Powder neutron diffraction study of chemically prepared β-lead dioxide. Acta Crystallogr Sect B. 1980;36(10):2394–7.
5. Filatov S, Bendeliani N, Albert B, Kopf J, Dyuzeva T, Lityagina L. High-pressure synthesis of α-PbO2 and its crystal structure at 293, 203, and 113 K from single crystal diffraction data. Solid state Sci. 2005;7(11):1363–8. [ Links ]
6. Zhou M, Dai Q, Lei L, Ma C, Wang D. Long life modified lead dioxide anode for organic wastewater treatment: electrochemical characteristics and degradation mechanism. Environ Sci Technol. 2005;39(1):363–70. [ Links ]
7. Ding H, Feng Y, Liu J. Preparation and properties of Ti/SnO2–Sb2O5 electrodes by electrodeposition. Mater Lett. 2007;61(27):4920–3. [ Links ]
8. Ye Z-G, Meng H-M, Sun D-B. Electrochemical impedance spectroscopic (EIS) investigation of the oxygen evolution reaction mechanism of Ti/IrO2 + MnO2 electrodes in 0.5 m H2SO4 solution. J Electroanal Chem. 2008;621(1):49–54. [ Links ]
9. Braga NA, Cairo CAA, Almeida EC, Baldan MR, Ferreiraa NG. From micro to nanocrystalline transition in the diamond formation on porous pure titanium. Diam Relat Mater. 2008;17(11):1891–6. [ Links ]
10. Qiao Q, Wang L, Shi J, Jin J, Li Y. Properties of Fluoride-Doped β-PbO2 Electrodes and their Electrocatalytic Activities in Degradation of Acid Orange II. Int J Electrochem Sci. 2015;10:10639–50. [ Links ]
11. Zhao W, Xing J, Chen D, Jin D, Shen J. Electrochemical degradation of Musk ketone in aqueous solutions using a novel porous Ti/SnO2-Sb2O3/PbO2 electrodes. J Electroanal Chem. 2016;775:179–88. [ Links ]
12. Zhang W, Kong H, Lin H, Lu H, Huang W, Yin J, et al. Fabrication, characterization and electrocatalytic application of a lead dioxide electrode with porous titanium substrate. J Alloys Compd. 2015;650:705–11. [ Links ]
13. Li X, Xu H, Yan W. Fabrication and characterization of PbO2 electrode modified with polyvinylidene fluoride (PVDF). Appl Surf Sci. 2016;389:278–86. [ Links ]
14. Hao X, Quansheng Y, Dan S, Honghui Y, Jidong L, Jiangtao F, et al. Fabrication and characterization of PbO2 electrode modified with [Fe(CN)6]3− and its application on electrochemical degradation of alkali lignin. J Hazard Mater. 2015;286:509–16.
15. Shen Y, Li F, Li S, Liu D, Fan L, Zhang Y. Electrochemically enhanced photocatalytic degradation of organic pollutant on β-PbO2-TNT/Ti/TNT bifunctional electrode. Int J Electrochem Sci. 2012;7:8702–12. [ Links ]
16. Müller V, Rasp M, Štefanić G, Ba J, Günther S, Rathousky J, et al. Highly Conducting Nanosized Monodispersed Antimony-Doped Tin Oxide Particles Synthesized via Nonaqueous Sol− Gel Procedure. Chem Mater. 2009;21(21):5229–36.
17. Cody CA, DiCarlo L, Darlington RK. Vibrational and thermal study of antimony oxides. Inorg Chem. 1979;18(6):1572–6. [ Links ]
18. Burgio L, Clark RJH, Firth S. Raman spectroscopy as a means for the identification of plattnerite (PbO2), of lead pigments and of their degradation products. Analyst. 2001;126(2):222–7. [ Links ]
19. Shao D, Yan W, Cao L, Li X, Xu H. High-performance Ti/Sb–SnO2/Pb3O4 electrodes for chlorine evolution: Preparation and characteristics. J Hazard Mater. 2014;267:238–44. [ Links ]
Recibido: 12-07-18
Aprobado: 17-07-18