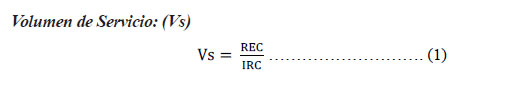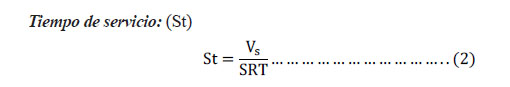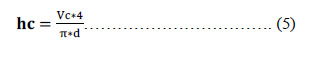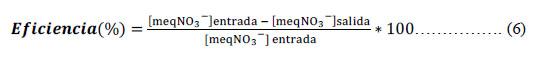Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Sociedad Química del Perú
versión impresa ISSN 1810-634X
Rev. Soc. Quím. Perú vol.85 no.2 Lima abr./jun. 2019
TRABAJOS ORIGINALES
Eficiencia de la resina lewatit monoplus m 600 en la remoción de nitratos en aguas para consumo humano
Efficiency of the lewatit monoplus m 600 resin in the removal of water nitrates for human consumption
Tania E. Guerrero Vejaranoa*, Óscar G. Anaya Fernándezb
a Universidad Nacional Agraria de la Selva -Carretera Centra km 1.21 Tingo María. Cp 10131 Perú. taniaguerrero@unas.edu.pe
b Ministerio de Vivienda
RESUMEN
En varias partes del mundo las fuentes de agua son contaminadas por nitratos, principalmente por actividades antropogénicas, siendo una potencial amenaza para la salud, la presente investigación tuvo como objetivo determinar la eficiencia de la resina convencional de intercambio iónico LEWATIT MonoPlus M 600 (aniónica de base fuerte) en la remoción de nitratos, se utilizó el método de espectroscopia Uv-Vis para la cuantificación de nitratos, asimismo se construyó las columnas de intercambio iónico con diámetro de 1", 0,05 L de volumen de resina y una altura de columna de 40 cm, donde se evaluó la eficiencia de las columnas de intercambio iónico, se manejó dos variables, el tiempo de operación y diferentes concentraciones de nitratos. Se determinó que la mayor eficiencia de la resina fue de 99,55 %, a una concentración de 6,45 meq de NO (400 ppm) en un tiempo de 30 min. La eficiencia más baja de 18,61 % se encontró para la concentración de 16,13 meq de NO3-(1000 ppm) en 120 min de operación de la columna. En el análisis de las aguas de Tingo María se determinó que el Pozo 5 de Villa Potokar fue el único que supera los límites máximos permisibles tal como lo indican los estándares de calidad ambiental nacional de agua (10 ppm de NO3 de N total o 45 ppm de NO3) con una concentración de 52,76 ppm, por lo tanto, no es apta para consumo humano sin previo tratamiento.
Palabras clave: Nitratos, resinas de intercambio iónico, eficiencia
ABSTRACT
In several parts of the world the water sources are contaminated by nitrates, mainly by anthropogenic activities, being a potential threat to health, the present investigation had as objective to determine the efficiency of the conventional ion exchange resin LEWATIT MonoPlus M 600 (anionic strong base) in nitrate removal, the Uv-Vis spectroscopy method was used for the quantification of nitrates, as well as the ion exchange columns with a diameter of 1", 0.05 L of resin volume and a height of 40 cm column, where the efficiency of the ion exchange columns was evaluated, two variables were managed, the operation time and different concentrations of nitrates. It was determined that the highest efficiency of the resin was 99.55 %, at a concentration of 6.45 meq of NO (400 ppm) in a time of 30 min. The lowest efficiency of 18.61 % was found for the concentration of 16.13 meq of NO3- (1000 ppm) in 120 min of column operation. In the analysis of the waters of Tingo María it was determined that Well 5 of Villa Potokar was the only one that exceeds the maximum permissible limits as indicated by the national environmental water quality standards (10 ppm of NO of total N or 45 ppm of NO3) with a concentration of 52.76 ppm, therefore it is not suitable for human consumption without previous treatment
Key words: Nitrates, ion exchange resins, efficiency
INTRODUCCIÓN
Generalmente, las fuentes de aguas subterráneas y superficiales son contaminadas, en algunos lugares el agua subterránea sirve como la única fuente de agua potable en las comunidades rurales y las zonas urbanas. Las actividades antropogénicas como la agricultura, la explosión demográfica y la industria generan contaminantes tóxicos tales como aniones inorgánicos, iones metálicos, productos químicos orgánicos sintéticos, residuos orgánicos, etc., que cada año se incrementa sustancialmente que afecta directamente a la calidad de las fuentes de agua. Muchos aniones inorgánicos son tóxicos y nocivos para los seres humanos, principalmente los que no se perciben a simple vista en el agua potable debido a la gran solubilidad que pueden tener en el agua, esto aumenta los posibles riesgos para la salud1. Dentro de lo aniones inorgánicos peligroso para los seres vivos están los nitratos (NO3 ). El aumento de los niveles de NO3 se asocia especialmente al uso intensivo de fertilizantes en la agricultura, lo que ha llevado a una mayor contaminación de las fuentes de agua subterránea y superficial2. Los nitratos no se unen fácilmente al suelo, por lo que se lixivian fácilmente, la contaminación del agua ocurre por escorrentía agrícola y urbana, eliminación de aguas residuales no tratadas, desperdicios industriales, fugas de pozos sépticos, lixiviados de vertederos, estiércol animal, desechos de extracción de aire NOx de los dispositivos de control de la contaminación del aire3. Estos aniones son una gran amenaza para la salud de animales y seres humanos. En seres humanos causa dos efectos para la salud: inducción del "síndrome del bebé azul" (metahemoglobinemia), especialmente en lactantes y formación potencial de nitrosaminas cancerígenas4. Los nitratos, debido a su alta solubilidad en agua5, un contaminante difícil de eliminarlo en las fuentes de agua en el mundo, en algunos lugares la fuentes de agua tienen capacidad natural de eliminarlos como algunas cuencas donde hay una interface agua dulce y salada, las reacciones de oxidación y reducción pueden atenuar estos contaminantes6, pero por lo general es una preocupación mundial, existen varios reportes de investigaciones para eliminar aniones inorgánicos como los NO , dentro de ellos tenemos el carbón activado que muestra poca adsorción hacia los aniones inorgánicos como los NO 7, las arcillas capturan cationes y aniones ya sea a través de iones de intercambio, adsorción o ambos sobre todo tienen acción cuando son tratadas con surfactantes8, así como también los hidróxidos dobles en capas (LDH), remueven materiales inorgánicos con propiedades deseables para eliminar los contaminantes aniónicos del agua como los NO , con una eliminación era de 85,5 %9, la zeolita cubierta con una capa de quitosano protonada con ácido fue probada satisfactoriamente para eliminar NO3-10. El uso de materiales de desecho agrícola ha sido estudiado para la eliminación de NO3- a partir de soluciones acuosas11y las resinas de intercambio iónico Purolite A 520 son muy eficientes en la remoción de nitratos10. Generalmente, hay varios tipos de resinas de intercambio iónico que se ofertan en el mercado, sin embargo, no todas presentan la misma eficiencia, dicha información es importante para la elegir la resina adecuada, ya que son procesos costosos, en este trabajo se presentan los resultados de la resina convencional aniónica de base fuerte con resultados prometedores a un costo mucho más bajo en donde el objetivo principal fue determinar la eficiencia de la resina antes mencionada.
PARTE EXPERIMENTAL
1.1. Lugar de ejecución: Se realizó en la Universidad Nacional Agraria de la Selva, Facultad de Recursos Naturales Renovables, Laboratorio de Fitoquímica y Tratamiento de Aguas Residuales.
1.2. Equipos: Bomba peristáltica, espectrofotómetro AQUAMATE ORION 8000 UV– visible, cronómetro. Materiales: material de uso común de laboratorio, tubería de PVC categoría 10 de 1’’, tapas rosca para tubería de PVC, mangueras, recipiente de plástico de 16 litros. Reactivos: Resina de intercambio iónico LEWATIT MonoPlus M 600 (aniónica de base fuerte), Solución de cloruro de sodio ACS; ISO; Reag. Ph Eur adquirido de Merck, nitrato de potasio (KNO3) ACS, ISO, Reag. Ph Eur. Adquirido de Merck
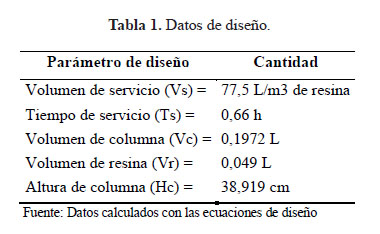
1.3. Diseño y construcción de la columna: Para el diseño y construcción de la columna se tomaron las siguientes consideraciones12,13.
Donde: Vs: Volumen de servicio (L/m3), volumen de agua en litros que puede soportar un metro cúbico de resina hasta su regeneración. REC: Capacidad de la resina (kg/m3). IRC: Concentración del ion a eliminar (kg/L)
Donde: St: Tiempo de servicio. SRT: Caudal de flujo de servicio = L/h/m3
Donde: Vol: Volumen de resina (L). Q: Flujo total L/h (5,8 L/h)
Determinación del volumen de la columna: (Vc)
Vc = Vol* FE ……………………. (4)
Donde: FE = 4 (para resinas aniónicas de base fuerte).
Determinación de la altura de la columna
Vc= volumen de columna (L). d= diámetro de la tubería en la columna a utilizar (1") h = altura de la columna (cm)
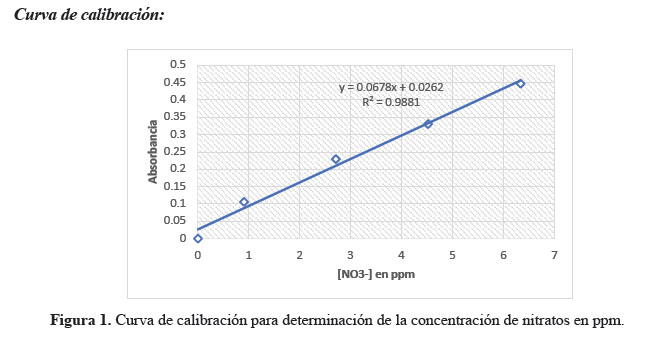
1.4. Construcción de la curva de calibración para medir la concentración de nitratos: Se pesó 0,18452 g KNO , se aforo a un volumen de 250, se tomó 25 mL de la solución madre y se aforo a 250 mL, a partir de esta solución intermedia se preparó 5 estándares de 0; 0,90; 2,71; 4,52; 6,33 ppm, Los mismos que fueron tratados con 1 mL de HCl 0,1 N, se dejó reposar 30 minutos antes de aforarlos a 50 mL. Se realizó las lecturas en el espectrofotómetro utilizando las cubetas de cuarzo a una longitud de onda de 220 nm.
1.5. Colección de las muestras de agua de Tingo María: Las muestras se tomaron el 16/08/2013 en dos pozos de Castillo Grande, el 04/11/2013 en Brisas del Huallaga, y Villa Potokar, 12/11/2013 en la quebrada Cocheros y Naranjal. Para las muestras de agua de pozo se utilizó el muestreo simple o de sondeo a 4,5 metros de profundidad y para aguas superficiales el muestreo integrado, en ambos casos, fue manual y se siguió la cadena de vigilancia (etiquetado, sellado y registro), las muestras se almacenaron en botellas de vidrio hasta ser analizadas en el laboratorio el mismo día, se tomaron tres muestras por punto de muestreo.
1.6. Determinación de la eficiencia de la columna de resinas de intercambio iónico: La eficiencia de la columna se evaluó a un caudal establecido, se tomó muestras en la salida de la columna, a diferentes tiempos de trabajo tales como: 30, 60, 90 y 120 minutos, en las cuales se determinó la concentración de nitratos a cada muestra recogida y se analizó la concentración de nitratos por triplicado con el espectrofotómetro UV-VIS, la eficiencia se calculó con la siguiente fórmula
Donde: meq NO3- : miliequivalentes de nitratos
Variables independientes: Tiempo de operación: 30 min, 60 min, 90 min y 120 min.
Concentración de nitratos: 16,13; 12,9; 9,68 y 6,45 meq.
Variables dependientes: Eficiencia de la remoción de nitratos, disminución de meq NO3-
El diseño experimental fue DCA con arreglo factorial de 4x4. El análisis estadístico de los datos se realizó con el software estadístico R
1.7. Análisis de las aguas de Tingo María: Se analizó la concentración de nitratos (NO ) de las aguas de consumo de Tingo María, antes y después de ingresar a la columna de intercambio iónico con el método antes descrito dentro de ellas esta: agua subterránea de pozo del centro poblado menor de Castillo Grande, asentamiento humano Brisas del Huallaga, Lotización Villa Potokar y de la ciudad universitaria
1.8. Determinación de la capacidad real de la resina, volumen de agua de regeneración y lavado
Determinación de la capacidad real de la resina: Se calculó la capacidad real de la resina, con la cantidad de gramos que ha atrapado ésta durante el proceso hasta su límite. Conociendo el caudal de trabajo y la concentración de las aguas, se procede a realizar los cálculos para determinar la capacidad experimental de la resina
Donde: C: capacidad real de la resina (g/L) Tc: Tiempo de ruptura (h); Q: Caudal de entrada del agua a la columna (L/h); [NO3 -]: Concentración de nitratos (g/L); Vol: Volumen de resina (L)
Después de determinar la capacidad de remoción experimental de la resina, se comparó con la capacidad de remoción teórica y se determinó la capacidad real de la resina.
Determinación del volumen de agua de regeneración y lavado: Para regenerar la resina se utilizó una solución de NaCl al 10 %, el volumen se estimó estequimetricamente según el ratio de regeneración (Rg)
RESULTADOS Y DISCUSIÓN
Diseño y construcción de la columna:
En el diseño de las columnas de intercambio iónico se consideró los criterios del Manual de Ingeniero Químico13, el diseño coincide con un reporte de columnas hechas a partir de cloruro de polivinilo (PVC) con 1" de diámetro, 16 cm de longitud con un volumen de 0,06 mL con resina macroporosa de intercambio catiónico, o LayneRT (Layne Christensen Co., The Woodlands, TX) y una resina de intercambio de aniones modificada con nanopartículas de óxido ferroso12, en la presente investigación se usó 0,05L de resina a diferencia de lo reportado la cantidad de resina depende de la densidad y las propiedades de las mismas13.
La curva de calibración cumple con la Ley de Beer como se observa en la figura 1, con un coeficiente de correlación R2 óptimo cercano a 1, por lo tanto, se puede asegurar la confiabilidad de los resultados de las concentraciones de nitratos reportados.
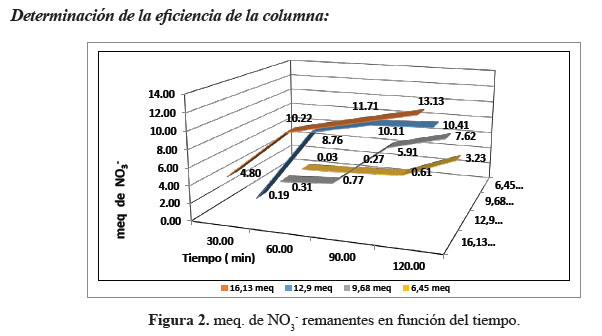
La cinética de remoción de meq NO3 - depende de la concentración inicial de la solución que ingresa a cada columna, el tiempo de operación, el pH y la capacidad de la resina o absorbente utilizado. La concentración de 6 ,45 meq de NO3 - presentó 0,61 y 3,23 meq de NO3 - remanentes a los 90 y 120 minutos, respectivamente, la columna tiene buena capacidad de eliminación hasta los 90 min., luego baja su capacidad en un 50 %, aproximadamente. La concentración de 9,68 meq presentó 0,77 meq remanentes a los 60 min, su capacidad de intercambio es óptimo hasta ese tiempo. La concentración de 12,9 meq a los 30 min presentó 0,19 meq remanentes y la concentración de 16,13 meq de 4,80 meq, se aprecia que la capacidad de intercambio de la primera es óptima hasta los 30 min y la segunda debido a la alta concentración de meq no realiza el intercambio iónico de manera eficiente (figura 2). Los tiempos ya mencionados alcanzan una considerable eliminación de nitratos, la resina es óptima para remover los nitratos si comparamos con los reportes siguientes. La capacidad de adsorción de la tela de carbono tratada con ácido para remover NO3 - y NO3 -, fue de 2,03 y 1,01 mmol/g, respectivamente7. Entre todas las organoarcillas, HDTMA QLD-bentonita modificada mostraron mejor resultado: H-B-2CEC y H-B-4CEC podrían eliminar 0,20 meq y 0,24 meq de NO3 -/g de organoarcilla, respectivamente8. Los hidróxidos dobles preparados (Ni-Fe) fue estudiado su potencial para eliminar NO3 - usando agua de mar enriquecida NO3 - a una concentración de 40 mol/dm3, donde la máxima de NO3 - fue de 0,33 mmol/g cuando
se añadió LDH (Ni-Fe)9. La Chitosan cubierta con zeolita (Ch-Z) protonado con HCl, tiene capacidad de intercambio iónico para NO3 - de 0,74 mmol NO3 -g de Ch-Z10. Las resinas y adsorbentes antes mencionados tienen poca capacidad de intercambio iónico a diferencia de la resina de intercambio iónico selectiva para nitrato Purolite A 520E14 que tiene una alta capacidad de intercambio iónico, la idea es dar otras alternativas a la resina especifica considerando los costos y la accesibilidad de la misma sobre todo para zonas rurales y urbanas donde las fuentes de agua, principalmente las subterráneas son contaminadas por nitratos.
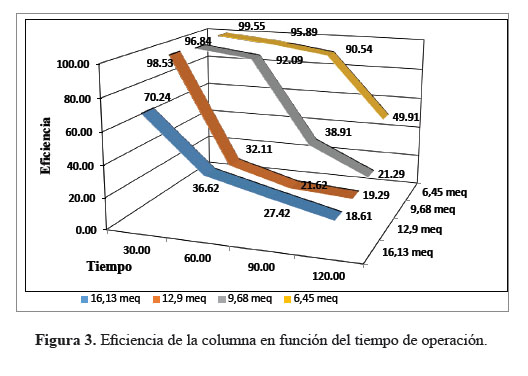
Después de analizar los meq de NO3 - remanentes en función del tiempo, se evaluó la eficiencia de las columnas de intercambio iónico con la resina antes mencionada y extrapolar datos respecto a que tan eficientes son a diferentes concentraciones y hasta que tiempo de operación trabaja de manera óptima el intercambio iónico, estos datos son importantes para los interesados en remover nitratos que como ya se dijo causan problemas de salud. Se determinó que 6,45 meq de NO3 - presentó un buen intercambio iónico hasta los 90 min con una eficiencia de 90,54 %, 9,68 meq de NO3 - hasta los 60 min tuvo una eficiencia de 92,09 %, 12,9 meq de NO3 - con 98,53 % de eficiencia a los 30 min y finalmente la solución más concentrada que se evaluó de 16,13 meq con una eficiencia de 70,24 % (figura 2). Uno de los absorbentes de arcilla, montmorrillonita de calcio activada por HCl mostró hasta una capacidad de eliminación de NO3 -, hasta 22,28%8. La eliminación de NO3 - con Hidróxidos de doble capa (LDH) se encontró que era 85,5 % bajo ciertas condiciones, usando 0,3 g de LDH en 100mL de solución de NO3 - con una concentración inicial de 10 mg/L9. La resina ALR- AE, presentó una capacidad de absorción de 87,2 %, el proceso fue de aproximadamente 10 min15. Las columnas de intercambio iónico presentan una buena eficiencia, considerando que se usó concentraciones muy altas con respecto a las concentraciones que normalmente se encuentran las fuentes de agua ya sea subterránea o superficial.
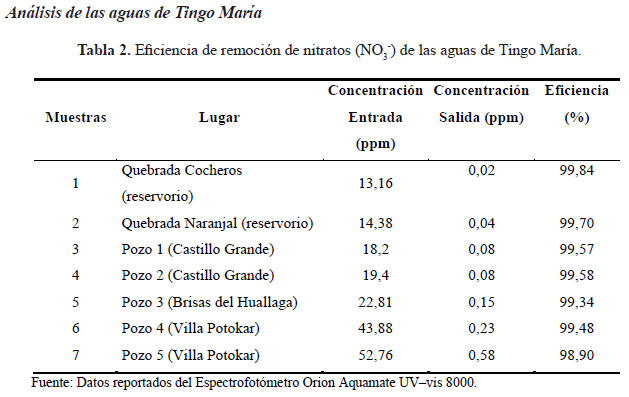
Después de analizar la concentración de NO3 - en las aguas subterráneas y las quebradas, la mayoría están por debajo de 45 ppm, que es el límite máximo permisible tal como lo indica los estándares de calidad ambiental nacional de agua (10 ppm de NO3 - de N total o 45 ppm de NO ), el único que supera los límites máximos permisibles es el Pozo 5 con una concentración de 52,76 ppm. Asimismo, la columna operó eficientemente con un promedio de aproximadamente 99 % de remoción de nitratos en las aguas de Tingo María.
Determinación de la capacidad de la resina, volumen de agua de regeneración y lavado
Se obtuvo que la resina atrapa 69,9 g/L por lo tanto, la capacidad real de la resina es de 1,112 eq/L, aproximándose al dato teórico del fabricante de 1,25 eq/L. Se determinó que el agua del primer lavado fue aproximadamente 0,5 L por espacio de 10 min, seguido de una generación con NaCl al 10 % con un volumen de 1,2 L durante 10 min y finalmente el lavado 2 con 1,5 L de agua durante 15 min.
CONCLUSIONES
Se determinó que la mayor eficiencia de la resina de intercambio iónico LEWATIT MonoPlus M 600 (aniónica de base fuerte) fue de 99,55 %, para la concentración de 6,45 meq de NO3 - (400 ppm) en un tiempo de 30 min. La eficiencia más baja de 18,61 % se encontró en la concentración de 16,13 meq de NO3 -(1000 ppm) en 120 min de operación de la columna. Asimismo, se puede concluir que la resina antes mencionada presenta una considerable capacidad de intercambio iónico a las siguientes condiciones de concentración de meq de NO3 -: 12,9 con una eficiencia de 96,84 % hasta los 30 min, 9,68 con eficiencia de 92,09 % hasta los 60 min y finalmente para 6,45 con una eficiencia de 90,54 % a los 90 min. Estos datos sirven para extrapolar resultados sobre concentraciones de nitratos a evaluar y estimar el tiempo de operación óptima de la columna. Se obtuvo que la capacidad real de la resina es de 1,112 eq/L, aproximándose al dato teórico del fabricante de 1,25 eq/L.
En el análisis de las aguas de Tingo María se determinó que el Pozo 5 de Villa Potokar fue el único que supera los límites máximos permisibles, tal como lo indica los estándares de calidad ambiental nacional de agua (10 ppm de NO3 de N total o 45 ppm de NO3) con una concentración de 52,76 ppm, por lo tanto, no es apta para consumo humano sin previo tratamiento.
AGRADECIMIENTOS
Se agradece al Ing. José Luis Paredes Salazar, por el apoyo sobre información de la resina a utilizar y su apoyo con el Laboratorio de Análisis de Tratamiento de Aguas, de igual manera al técnico del laboratorio Carlos Remigio Salazar Salazar.
REFERENCIAS BIBLIOGRÁFICAS
1. Velizarov S, Crespo JG, Reis MA. Removal of inorganic anions from drinking water supplies by membrane bio/processes. Rev Environ Sci Bio. 2004; 3: 361–380 [ Links ]
2. Rao EVSP, Puttanna K. Nitrates, agriculture and environment. Curr Sci. 2000; 79:1163– 1168 [ Links ]
3. Romano N, Zeng C. Evaluating the newly proposed protocol of incorporated potassium in nitrate toxicity experiments at different salinities: a case study with the tiger prawn, Penaeus monodon, juveniles. Aquaculture. 2009; 289:304–309. [ Links ]
4. Majumdar D, Gupta N. Nitrate pollution of groundwater and associated human health disorders. Ind J Environ Hlth. 2000; 42:28–39. [ Links ]
5. Thomson TS. Nitrate concentration in private rural drinking water supplies in Saskatchewan, Canada. Bull Environ Cont Toxicol. 2001; 66:64–70. [ Links ]
6. Valiente N, Carrey R, Otero N, Soler A, Sanz D, Muñoz-Martín A, et al. A multi-isotopic approach to investigate the influence of land use on nitrate removal in a highly saline lake-aquifer system Albacete, Spain 2018 Science of the Total Environment 631–632 (2018) 649–659
7. Afkhami A, Madrakian T, Karimi Z. The effect of acid treatment of carbón cloth on the adsorption of nitrite and nitrate ions. J Hazard Mater. 2007; 144:427–431. [ Links ]
8. Bhattacharyya KG, Gupta SS. Adsorption of a few heavy metals on natural and modified kaolinite and montmorillonite: a review. Adv Colloid Interf Sci. 2008; 140:114–131. [ Links ]
9. Xi Y, Mallavarapu M, Naidu R. Preparation, characterization of surfactants modified clay minerals and nitrate adsorption. Appl Clay Sci. 2010; 48:92–96. [ Links ]
10. Schick J, Caullet P, Paillaud J, Patarin J, Mangold-Callarec C. Batch-wise nitrate removal from water on a surfactant-modified zeolite. Micro Meso Mater. 2010; 132:395–400. [ Links ]
11. Orlando US, Baes AU, Nishijima W, Okada M. A new procedure to produce lignocellulosic anion exchangers from agricultural waste materials. Bioresour Technol. 2002; 83:195–198. [ Links ]
12. William A, Ileana W, Wiprächtigerc M, Kara L. Effects of operating and design parameters on ion exchange columns for nutrient recovery from urine. Environ Sci Water Res Technol. 2018: 4: 828-838. [ Links ]
13. Perry RH, Green DW. Manual del Ingeniero Químico. 6ta Edición. Madrid: Editorial McGraw-Hill; 2001. 2577 p. [ Links ]
14. Saba S, Nalan K, Ümran Y, Muserref A, Mithat Y. Removal of nitrate from aqueous solution by nitrate selective ion exchange resins. React Funct Polym. 2006; 66:1206– 1214. [ Links ]
15. Xing X, Baoyu G, Yaqing Z, Suhong C, Xin T, Qinyan Y, et al. Nitrate removal from aqueous solution by Arundo donax L. reed based anion exchange resin. J Hazard Mater. 2012; 203-204:86– [ Links ] 92
Recibido el 28-11-18
Aprobado el 06-06-19