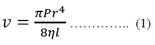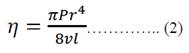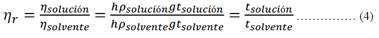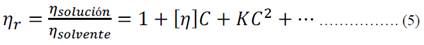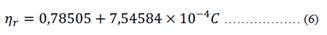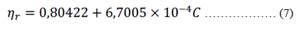Introducción
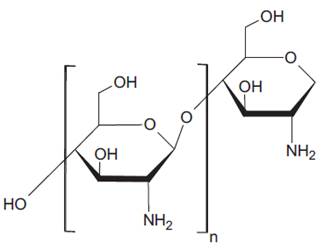
El quitosano es un poliaminosacárido lineal que deriva de la N-desacetilación por tratamiento alcalino de la quitina (constituyente del exoesqueleto de crustáceos, camarones o insectos). Esta N-desacetilación casi nunca se completa llegando en casos más óptimos este índice entre 75 - 95 %, cuya estructura química1,2,3 se aprecia en la figura 1. La presencia de grupos amino libres a lo largo de la cadena permite que esta macromolécula (o biopolímero) se disuelva en disolventes ácidos diluidos debido a la protonación4,5 de estos grupos.
La presencia del quitosano (polímero) en el agua (solvente) genera como resultado un aumento de la viscosidad inclusive a muy bajas concentraciones. Este efecto depende de la concentración del polímero y la naturaleza del solvente. El agua permite que la macromolécula pueda hallarse desenrollada y alargada; es decir, es capaz de extender las cadenas lineales, así como desagregar6,7,8 dichas cadenas.
La viscosidad (η) es la propiedad que caracteriza la resistencia que ofrece un fluido al flujo9. En las mediciones, la velocidad de flujo de un fluido en tubo capilar depende de las dimensiones de éste (radio y longitud), de la velocidad del fluido, de la diferencia de presión entre los extremos del tubo y de la temperatura. Para hallar la relación de estas magnitudes, se mide el flujo que pasa por cualquier punto del tubo capilar por unidad de tiempo. Finalmente, esta relación se demuestra en la fórmula de Poiseuille10 expresada en la ecuación 1.
Donde v es la velocidad de flujo; P, presión que ejerce el fluido dentro del capilar; r, radio transversal interno del capilar; η, la viscosidad del fluido y l, longitud del capilar.
Despejando la ecuación de Poiseuille se tiene la ecuación 2.
Al considerar la presión, P como el producto de la altura, h del tubo capilar; la densidad del fluido, ρ y la fuerza de gravedad, g debido a que son constantes la altura del capilar y la fuerza de gravedad. Para soluciones diluidas no se presentan diferencias significativas de la densidad respecto al solvente, por lo que se halla la viscosidad relativa.
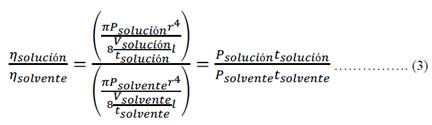
La viscosidad relativa (ηr) es la relación entre la viscosidad de la solución y la viscosidad del solvente10. Ambas viscosidades se miden en un viscosímetro capilar de precisión. La viscosidad relativa se define con la ecuación (4).
La viscosidad relativa se determina midiendo los tiempos de flujo del solvente y de las soluciones diluidas. La viscosidad relativa presenta una dependencia frente a la concentración según la ecuación 5.
Donde [η] y K son constantes. Para C=0, ηr= 1 ya que ηsolución= ηsolvente; para bajas concentraciones (soluciones diluidas) se presenta una dependencia lineal mientras que a mayores concentraciones la dependencia es parabólica. La unidad física de viscosidad es el pascal por segundo (Pa.s) según el Sistema Internacional (S.I.), también se emplea como unidad el poise (1P = 1g/cm.s = 0,1 Pa.s), pero para fines de cálculo se emplea su submúltiplo el centipoise (1cP = 10-3 Pa.s) debido a que el agua tiene una viscosidad de 1,002 cP a 20°C.
Parte experimental
Reactivos
Quitosano en polvo (patrón) grado alimentario de 90,3 % de pureza, solución de ácido clorhídrico (HCl) 0,1N, agua desionizada y etanol al 96 % v/v (empleado para la limpieza del viscosímetro de Ostwald después de las mediciones, así como para el resto del material de vidrio).
Aparatos y materiales
Balanza analítica electrónica digital ± 0,1 mg M-Power-Sartorius, pH/mV-metro con microprocesador PHS-25CW-TKR (calibrado con buffers pH 4,00 y pH 6,86 y protocolos normalizados), agitador magnético de 230V-Fisher Scientific, cronómetro ± 0,01 seg. F-201 WA-1A-Casio, viscosímetro de Ostwald (bulbo superior de 6,2 mL; bulbo inferior de 9 mL; ɸinterno= 0,55 ± 0,02 mm, termómetro de mercurio ± 0,1°C (-10 a 100°C).
Muestras.
Se prepararon soluciones de quitosano a concentraciones desde 461 mg/ litro hasta 9138 mg/litro en volúmenes de 10 mL HCl 0,1N. Cada solución se preparó bajo agitación magnética durante 20 minutos. Culminadas las disoluciones en medio ácido se tomaron lecturas de pH. Estas lecturas tuvieron por objetivo corroborar que el polímero se encuentre en forma iónica11, mas no formando sales, lo cual es un estado idóneo para el estudio central realizado. Las condiciones de preparación quedan especificadas en la tabla 1.
Determinación de viscosidad.
El equipo de determinación de viscosidad se muestra la figura 2. Se procedió a medir los tiempos de flujo de las soluciones de la tabla 1, a 20°C, 30°C, 40°C y 50°C (±0,1°C). Los tiempos de flujo fueron tomados por quintuplicado después de esperar cuatro minutos luego de alcanzar el equilibrio térmico.
RESULTADOS Y DISCUSIÓN
En la figura 3 se muestra la gráfica de influencia de la temperatura sobre la viscosidad relativa de las soluciones de quitosano. Esta influencia ha permitido ver el comportamiento de interacción molecular entre el polímero catiónico y el ácido fuerte diluido en el rango de temperatura entre 20 a 50°C12, 13, 14. Se observó que existe un comportamiento lineal frente a la concentración hasta 9138 mg/litro.
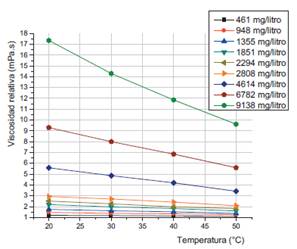
Figura 3 Influencia de la temperatura de equilibrio del sistema sobre la viscosidad relativa soluciones de quitosano.
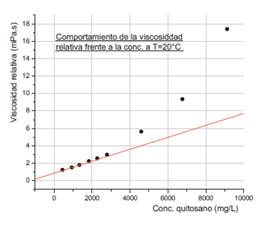
De la figura 3, se tomaron en cuenta por criterios de norma internacional (AOAC) los valores de viscosidad a 20°C. Es así que se puede evidenciar una tendencia de comportamiento lineal16,17,18 entre las concentraciones y las viscosidades hasta 2808 mg/litro mostrados en la tabla 2 y figura 4. Es de notar también que a viscosidades superiores a 2808 mg/litro la dependencia de temperatura con la viscosidad tiene una tendencia parabólica (figura 4).
Tabla 2 Valores de coeficientes de viscosidad de soluciones de quitosano a 20°C.
| Concentración (mg / litro) | ηr (mPa.s) |
|---|---|
| 461 | 1,193 |
| 948 | 1,470 |
| 1355 | 1,750 |
| 1851 | 2,187 |
| 2294 | 2,517 |
| 2808 | 2,930 |
| 4614 | 5,587 |
| 6782 | 9,305 |
| 9138 | 17,360 |
Utilizando los datos de la tabla 2 se realizó una regresión lineal con las seis primeras concentraciones, resultando una dependencia lineal cuyo valor de r2 fue de 0,995 y valor de pendiente 7,55 x 10-4. Como resultado quedó establecida una curva de calibración que responde a la ecuación lineal 6 y la figura 5. Esta dependencia lineal está enmarcada en el contexto de las soluciones ideales10,15.
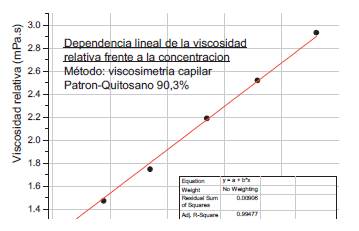
Figura 5 Curva de calibración de dependencia lineal de la viscosidad relativa frente a la concentración para soluciones diluidas a 20°C.
Establecida la curva de calibración se procedió a realizar los ensayos para determinar la concentración desconocida de dos muestras problema de quitosano en polvo. En dichos ensayos se midieron los tiempos de flujo bajo las mismas condiciones de trabajo ya establecidas. Previamente se reprodujo la curva de calibración (figura 5) trabajada con el estándar de quitosano (patrón) como muestra la figura 6.
Figura 6 Reproducción de la curva de calibración empleada en la determinación de concentración de quitosano.
De la última gráfica realizada la regresión lineal se obtuvo la ecuación lineal 7.
Medidos los tiempos de flujo del solvente y de las soluciones problema se procedió a calcular las viscosidades relativas, cuyos coeficientes reemplazados en la ecuación 7 se obtiene los valores de concentración de quitosano tal como muestra la tabla 3.
Tabla 3 Valores de concentración de quitosano obtenidos para la determinación de concentración desconocida de quitosano.
| Muestra | pH | ηr (mPa.s) | Concentración preparada (mg/litro) | Concentración determinada por viscosimetría con ecuación 7 (mg/litro) | Porcentaje de recuperación (%) |
|---|---|---|---|---|---|
| M1 | 1,25 | 1,529 | 1147 | 1082 | 94,3 |
| M2 | 1,24 | 1,898 | 1643 | 1633 | 99,4 |
Obtenidas las concentraciones se evidencia que ambos valores se ubican dentro del rango de concentraciones patrón establecido en la curva de calibración.
CONCLUSIONES
Se ha puesto en evidencia una dependencia lineal de la viscosidad relativa respecto de la concentración en soluciones de quitosano en el rango de 460,53 mg/L a 2808,33 mg/L. Además, se ha corroborado que a mayor dilución del polímero existe una aproximación a las condiciones de soluciones ideales.
La dependencia más importante para una temperatura dada fue la de viscosidad relativa (ηr) frente a la concentración (concordante con la ecuación de Poiseuille) sustentada en la figura 5 con r2=0,995.
Los resultados obtenidos para el análisis del contenido de quitosano en polvo fueron consistentes y equiparables con los de las fichas técnicas del producto.
Esta propuesta puede ser aplicable para la determinación de la pureza de quitosano en muestras en polvo.