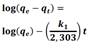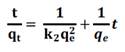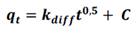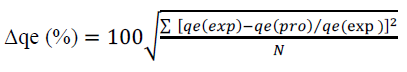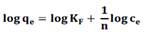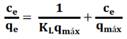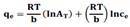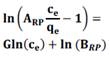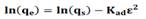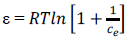INTRODUCCIÓN
El mercurio es considerado uno de los elementos con mayor presencia y toxicidad en el ambiente, junto con el plomo y el arsénico. El mercurio no es biodegradable y puede ser transportado a través de la cadena alimenticia.
Las principales fuentes de contaminación por mercurio en el medio acuático son las industrias de cloro-álcali, pinturas, papel, refinación de petróleo, procesamiento de caucho y fertilizantes, principalmente.
Estudios recientes en los que se ha utilizado óxidos metálicos de manganeso, hierro, titanio, aluminio y cerio han mostrado una adsorción o retención significativa y selectiva hacia muchos iones metálicos tóxicos, constituyéndose así en adsorbentes prometedores para la remoción de metales de sistemas acuosos1. Sin embargo, debido a esto, los óxidos metálicos se aglomeran y su alta capacidad de selectividad se reduce o se pierde. A pesar de que los óxidos de manganeso son considerados unos importantes removedores de trazas metálicas de diversos metales en medios acuosos2 hay muy poca información acerca de la remoción de mercurio. Para mejorar el uso de los óxidos metálicos en tratamientos de aguas residuales se investigan métodos en los cuales estos compuestos se impregnan en soportes con alta porosidad, estabilidad térmica y frente a medios ácidos y básicos3. Por tal motivo, en la literatura se encuentra la preparación de diversos compósitos de grafeno y óxidos metálicos empleados en la remoción de metales4, sin embargo, dichos métodos de síntesis son poco reproducibles a gran escala.
Estudios previos han demostrado que el carbón activado preparado a partir de semillas de aguaje (Mauritia flexuosa) tiene una alta capacidad de remoción de metales pesados5,6. La modificación del carbón activado con nitrato de manganeso mediante una impregnación húmeda para adsorber cobre y plomo revela que la adsorción se incrementó hasta en un 30 %, en el caso del plomo la capacidad de adsorción se incrementó de 2,94 a 3,31 mg/g y para el cobre de 0,68 a 0,91 mg/g7.
PARTE EXPERIMENTAL
Materiales y métodos Materia prima
Las semillas de aguaje fueron obtenidas de la ciudad de Pucallpa, provincia de Ucayali, Perú. Fue eliminado cualquier residuo orgánico de las semillas, las cuales fueron secadas a 80 °C y luego partidas hasta obtener un tamaño de particular menor que 10 mm.
Preparación y modificación del carbón activado
El carbón activado seleccionado fue preparado de acuerdo al método presentado en un trabajo previo5. Se seleccionó el carbón activado AG0.75_600, que significa que fue preparado con un grado de impregnación de 0.75gH3PO4/gPRECURSOR y fue activado a 600 °C. El carbón activado empleado para la modificación fue el que presentó una mayor remoción de Cd, Cr y Pb5,6. La muestra AG0.75_600 en adelante será denominada muestra sin modificar SMOD. Posteriormente, SMOD fue modificada con nitrato de manganeso.
La modificación con nitrato de manganeso se realizó mediante una impregnación húmeda. Se prepararon dos soluciones de manganeso a partir de Mn(NO3)2.4H2O (Merck, grado P.A.) a un pH de 3 y 9 aproximadamente. Se colocó 20 mL de la solución preparada previamente a una concentración establecida y se mezcló con 80 mg de CA (carbón activado). La mezcla se realizó bajo un baño de ultrasonido. Luego, las mezclas fueron colocadas bajo agitación constante a 40 °C por 1 hora. Las mezclas se dejaron enfriar y luego dejadas en agitación durante toda una noche. Después de un proceso de filtración el CA se secó a 60 °C en una estufa durante toda una noche. Las muestras secas se colocaron dentro de un reactor tubular en una atmósfera inerte y la temperatura fue llevada a 250 °C a una velocidad de 5 °C/min. El CA modificado a pH 3 y pH 9 serán denominados MOD_pH3 y MOD_pH9, respectivamente.
Caracterización fisicoquímica Ensayos de adsorción-desorción de N2
Las propiedades texturales del carbón activado fueron caracterizadas por la técnica de adsorción-desorción de N2 empleando un equipo Micromeritics GEMINI VII, modelo 2390. Se cuantificó la cantidad de N2 gaseoso retenida en la superficie del carbón activado a una temperatura de 77 K hasta alcanzar una presión relativa de 1. El área superficial total fue calculada de acuerdo al método BET. El área microporosa fue calculada por el método t-plot. El área mesoporosa fue obtenida por la diferencia entre el área superficial total y el área microporosa.
Titulación Boehm
La determinación de los grupos funcionales ácidos de la superficie del CA fue realizada por el método de titulación BOEHM. Se realizó la preparación de tres soluciones 0,05 M de NaOH (Scharlau, ACS), NaHCO3 (J.T. Backer, ACS) y Na2CO3 (Fisher Chemical, ACS), respectivamente. Se pesó 125 mg de cada CA y se mezclaron por 24_horas bajo agitación constante con 20 mL de cada una de las soluciones preparadas anteriormente. Se filtró y las soluciones remanentes fueron tituladas con 0,05 M de_HCl (Merck, P.A.) estandarizado previamente de acuerdo al método ASTM E200-08.
Determinación del punto de carga cero
Se determinó el punto de carga cero de la superficie preparando soluciones de diversos pH en un rango de 2 a 8. Se mezcló 50 mg de CA con 20 mL de las soluciones preparadas previamente y se mantuvo bajo agitación constante por 24_horas. Luego, la mezcla se filtró y se determinó su pH empleando un potenciómetro marca WTW, modelo 537 y un electrodo de pH de Ag/AgCl con electrolito líquido de KCl 0,1 M marca SenTix, modelo 81. Se generó una gráfica de los datos del pH inicial y pH final de las soluciones, la curva obtenida corta el eje X, siendo el punto de corte sobre el eje X el punto de carga cero.
Difracción de rayos X
La determinación de los óxidos formados en la superficie del CA se realizó mediante el análisis de rayos X de los CA modificados en un difractómetro marca Bruker, modelo D8- Focus, con una fuente de radiación CuK α y una longitud de onda de radiación de rayos X de 1,5406 Å.
Ensayos de análisis elemental
Se realizó la determinación del contenido de manganeso presente en los CA modificados mediante un tratamiento de digestión ácida de los mismos y su posterior análisis en un equipo ICP-OES marca Perkin Elmer, modelo Optima 3000DV.
Microscopía electrónica de barrido
Se realizó un análisis SEM con un equipo FEI modelo QUANTA 650 y el análisis EDS por medio de una plataforma INCA 250 EDS con un detector XMax de 20 mm acoplado al equipo.
Experimentos de adsorción
Todas las soluciones de mercurio fueron preparadas a partir de un estándar de mercurio de 1000 mg/L (Merck, CertiPur). Para la determinación de mercurio se empleó la técnica de espectroscopia de absorción atómica mediante la generación de vapor frío (AAS-CV) basado en el método EPA 245.1.
Ensayos cinéticos
Se empleó una solución estándar de mercurio de 1000 mg/L (Merck, grado Certipur). Para los ensayos de cinética de adsorción se empleó 20 mL de una solución de 5 ppm de mercurio y 12 mg de CA a temperatura ambiente y un pH de 2 y 3,5. Se mantuvieron en agitación constante por un tiempo determinado (entre 5 y 1400 min).
A fin de entender los mecanismos de adsorción, los resultados experimentales se ajustaron a los modelos de pseudo primer orden, pseudo segundo orden y difusión intraparticular que se presentan en la tabla 1.
Ensayos de isotermas
Los ensayos para las isotermas se realizaron empleando un tiempo de contacto de 4 horas en un rango de concentraciones de 10 a 40 ppm para un pH de 2 y de 10 a 70_ppm para un pH de 3,5.
Los resultados experimentales se ajustaron a los modelos de Langmuir, Freundlich, Redlich- Peterson y Temkin que se presentan en la tabla 2.
Tabla 1 Modelos cinéticos de adsorción.
La desviación estándar normalizada entre los valores experimentales y los valores predichos por los modelos fue empleada para evaluar el modelo que presentaba el mejor ajuste. La desviación estándar normalizada fue calculada de la siguiente manera:
donde, qe(exp) es el valor experimental, qe(pro) es el valor correspondiente al qe pronosticado de acuerdo a la ecuación bajo estudio, N es el número de mediciones. En este estudio el menor valor obtenido de desviación estándar normalizado indicó el mejor ajuste de los resultados experimentales.
Tabla 2 Modelos de isotermas de adsorción.
RESULTADOS Y DISCUSIÓN
Caracterización fisicoquímica Ensayos de adsorción-desorción de N2
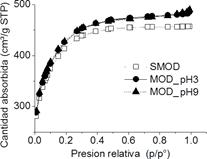
En el análisis textural mediante la técnica BET se observa que las muestras presentan una isoterma de adsorción de N2 del Tipo I correspondiente a materiales microporosos (figura 1).
Se puede observar que el área superficial total y tamaño de poro se incrementa en el caso de los CA modificados pero no de manera significativa, siendo mayor para el caso de MOD_ pH9 (tabla 3).
Tabla 3 Análisis texturales del CA sin modificar y modificado.
| Muestra | Area (m2/g) | Tamaño de poro | |||
|---|---|---|---|---|---|
| Total | Microporosa | Mesoporosa | (nm) | ||
| SMOD | 1484,42 | 1353,04 | 131,38 | 1,08 | |
| MOD_pH 3 | 1529,66 | 1388,03 | 141,63 | 1,12 | |
| MOD_pH9 | 1537,36 | 1384,19 | 153,17 | 1,14 | |
Titulación Boehm
La acidez superficial total de los CA fue muy similar entre ellos (tabla 4). En los CA modificados se observa una disminución de los grupos carboxílicos y un incremento de los grupos fenólicos respecto a SMOD. La disminución de los grupos carboxílicos y lactónicos y el aumento de los grupos fenólicos confieren un carácter básico a la superficie del carbón activado. Los valores de titulación Boehm son referenciales y sirven para la comparación entre los CA preparados.
Determinación del punto de carga cero
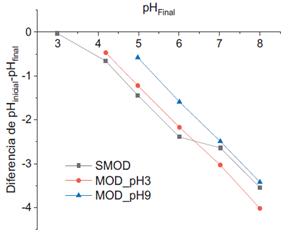
Como se indicó anteriormente, el punto de carga cero se determinó a partir de las curvas generadas con los pH iniciales y finales de cada solución que estuvo en contacto con el CA. Las curvas obtenidas se presentan a continuación:
Las ecuaciones de las curvas obtenidas a partir de dichos puntos se presentan a continuación:
SMOD: y= -0,7049x+2,1158
MOD_pH3: y= -0,9221x+3,3875
MOD_pH9: y= -0,9355x+4,0632
El valor de potencial de carga cero se obtiene al igualar a cero el valor de “y”. El punto de carga cero se incrementó en los CA modificados, alcanzando el máximo en MOD_pH9 (tabla 5). Esto indica que los CA modificados presentan una superficie cargada negativamente a pH mayores; de esta manera se ve favorecida la adsorción de metales al aumentar el pH de la solución. Esto se puede atribuir al incremento del carácter básico de la superficie del carbón activado debido al incremento de los grupos fenólicos con respecto a los otros grupos funcionales presentes en su superficie8.
Tabla 5 . Punto de carga cero de la superficie de los CA.
| Muestra | SMOD | MOD _ pH3 | MOD _pH9 |
|---|---|---|---|
| pHpzc | 3,00 | 3,67 | 4,35 |
Lalhmunsiama et al.7 reportaron la adsorción de Cu2+ y Pb2+ sobre carbón activado modificado con óxidos de manganeso cuya carga cero de superficie fue 6,2. Se determinó que la adsorción de Cu2+ y Pb2+ es menor a pH más ácidos. Se ha reportado en zeolitas modificadas9 con manganeso un pHpzc de 3,8 y en arena modificada10 con manganeso un valor de 6,28. Se ha reportado que la presencia de óxidos de manganeso mejora las propiedades redox e incrementa la cantidad de oxígeno adsorbido en la superficie de materiales11 como el CeO - ZrO2. Los óxidos de manganeso sin soporte no presentan estas características debido a su mayor tamaño de partícula12. Faulconer y Mazyck13 indican que tanto los grupos funcionales oxigenados como el punto de carga zero son factores determinantes en la adsorción de Hg(II).
Difracción de rayos X
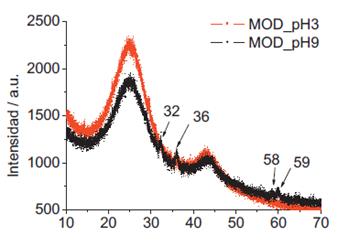
Se observa en la figura 3, el análisis de DRX de las muestras de CA, la predominancia de dos picos anchos en 2θ entre 20° y 30° y esto se debe a la estructura amorfa del carbón activado14. Se puede observar débiles picos de difracción a 2θ a 32°, 36° 58° y 59° en la muestra modificada en medio básico que corresponden a los cristales de Mn3O4. La falta de picos en el carbón modificado en medio ácido puede deberse al menor contenido de manganeso impregnado sobre la superficie del carbón, lo cual fue confirmado con los datos obtenidos por ICP OES sobre el contenido de Mn en los carbones modificados. Los resultados son similares a los obtenidos por Tang, Q. et al.15.
Se ha reportado en arenas modificadas16 con manganeso la presencia principalmente de vernadita (δ-MnO2) y mediante el empleo de espectroscopía de fotoelectrones emitidos por rayos X se ha determinado una valencia mixta de Mn+3 y Mn+4.
Ensayos de análisis elemental
Los análisis elementales por ICP-OES han determinado un incremento en el contenido de manganeso en los carbones modificados a pH 9 (tabla 6).
Microscopía electrónica de barrido
Las imágenes de microscopía electrónica de barrido se presentan en la figura 4.
En la figura 4 - A se presenta la microfotografía obtenida de la muestra SMOD. La figura_4-A y B presenta la microfotografía obtenida de la muestra MOD_pH3 y MOD_pH9. Se puede observar que la muestra SMOD presenta porosidad muy desarrollada con un tamaño promedio de poro de 8 µm. Del otro lado, las muestras MOD_ pH3 y MOD_pH9 (figura 4-B y C) muestran una superficie con presencia de óxidos de manganeso. Como se puede observar en la tabla 3 el área superficial total aumenta ligeramente al igual que su área mesoporosa y que el tamaño de poro. Los ligeros cambios en la morfología del material se pueden atribuir al tratamiento poco severo realizado para la modificación con óxido de manganeso del CA.
Ensayos cinéticos e isotermas
La composición del Hg(II) en soluciones acuosas es complejo y varía de acuerdo al pH presentándose como especie dominante a un pH ˂ 3,0. El compuesto Hg(OH)2 se vuelve dominante a un pH > 5,0. En el rango de pH de 3 a 5 podemos encontrar las especies9 Hg(II), HgOH+ y Hg(OH)2.
Ensayos cinéticos
Los parámetros obtenidos para los modelos cinéticos se presentan en la tabla 7. Los resultados se ajustaron al modelo de pseudo segundo orden, lo cual indicaría que la etapa limitante es el proceso de sorción en vez del de difusión. La capacidad de adsorción se incrementó con el aumento del pH de la solución de 2 a 3,5. La menor capacidad de adsorción en una solución de pH_2 se atribuye a la competencia entre los iones H+ contra los Hg(II) por el mismo sitio activo del adsorbente.
Tabla 7 . Parámetros cinéticos.
| Muestra | Pseudo primer orden | Pseudo segundo orden | |||||
|---|---|---|---|---|---|---|---|
| qe | k1 | R2 | qe | k2 | R2 | ||
| Solución pH 2 | |||||||
| SMOD | 3,178 | 0,008 | 0,631 | 7,71 | 0,006 | 1,00 | |
| MOD_pH3 | - | - | - | 7,61 | 0,021 | 1,00 | |
| MOD_pH9 | 3,004 | 0,007 | 0,809 | 7,57 | 0,014 | 1,00 | |
| Solución pH 3,5 | |||||||
| SMOD | 8,98 | 0,042 | 0,76 | 8,07 | 0,010 | 1,00 | |
| MOD_pH3 | 5,82 | 0,030 | 0,96 | 7,72 | 0,012 | 1,00 | |
| MOD_pH9 | 8,93 | 0,041 | 0,79 | 8,21 | 0,010 | 1,00 | |
Leyenda: Unidades qe = mg g-1 y K1 = min-1, K2 = g mg-1 min-1.
La adsorción de mercurio está relacionada principalmente a la captura de sus especies catiónicas, y en menor medida de sus especies aniónicas que se encuentran en pH básicos. Las especies HgOH+ y Hg(II) son capturadas en mayor medida que las HgCl+.15 A condiciones ácidas (pH 3-5), el efecto del pH en la remoción de Hg(II) se da mediante repulsión electrostática debido a que se espera que el adsorbente y adsorbato se encuentran cargados positivamente. Sin embargo, al disminuir la concentración de H+, manteniendo constante la concentración de Hg2+, produce un incremento en su remoción debido a la disminución de la competencia con los iones H+ por los sitios de sorción y al cambio de la carga de la superficie del CA al pasar su punto de carga cero15,16,17,18.
La muestra SMOD presenta una mayor capacidad de adsorción a pH 2 siendo superada por la muestra MOD_pH9 al incrementarse el pH de la solución a 3,5. Se puede observar un incremento de los grupos fenólicos en MOD_pH9, además, que presenta un mayor número de sitios activos debido a la presencia de los óxidos de manganeso. Se ha reportado que existe una fuerte interacción del mercurio con los grupos MnO2 o MnOOH.
La formación de MnO2=Hg(II) o MnOOH=Hg(II) puede ocurrir durante el proceso de sorción19,20 por medio de un intercambio de ligandos o la formación de complejos en la superficie del carbón activado modificado con óxido de manganeso20. El incremento del pH disminuye el efecto competitivo de los iones H+. Además, la superficie del carbón activado se carga negativamente al estar sobre su punto de carga cero. Se puede observar que la muestra SMOD tiene un pHPZC de 3 y la muestra MOD_pH9 de 4,75 (tabla_5), lo cual estaría favoreciendo la adsorción en la muestra SMOD. La capacidad de adsorción en los ensayos de cinética fue de 8,00 y 8,14 mg/g para el SMOD y MOD_pH9, lo cual está acorde con los resultados cinéticos del modelo de pseudo segundo orden (tabla_7). Además, si bien la diferencia es muy pequeña, el método de determinación de Hg alcanza límites de detección de 0,1 µg/L de mercurio con un valor de incertidumbre estimada de 0,3 µg/L. El Hg(II) presenta una toxicidad alta a muy pequeñas concentraciones, por tal motivo, es de suma importancia la remoción total del mercurio, asimismo, las pequeñas diferencias en las concentraciones presentes en el agua tienen una importancia indiscutible.
De acuerdo al modelo de pseudo segundo orden, la velocidad de adsorción es determinada por las reacciones químicas. Al inicio, el proceso de adsorción es rápido debido a la mayor cantidad de sitios activos presentes en la superficie del CA que pueden combinarse con el Hg(II).
La velocidad de adsorción disminuye con el incremento del tiempo de adsorción debido a la reducción de sitios activos sobre la superficie del CA y la disminución del gradiente de concentración entre la interfaz sólido-líquido (figura 5).
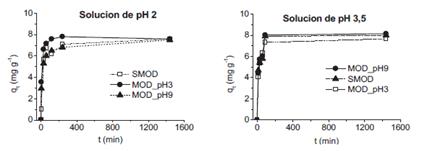
Figura 5 Curvas cinéticas de adsorción de mercurio en las muestras seleccionadas en una solución de pH 2 y 3,5.
Arshadi1 y Lu et al.21 encontraron que el mejor ajuste al modelo de pseudo segundo orden. Lu et al.21 mostraron que el modelo cinético de adsorción de pseudo segundo orden presentó un mejor ajuste, sugiriendo que el proceso de adsorción ocurre en dos etapas; una primera etapa consistiría en una rápida propagación del Hg(II) sobre la superficie del carbón activado, seguido de una etapa lenta en la cual el Hg(II) pasa al interior de los microporos y se combina con los sitios activos internos. Además, reportaron que el área superficial específica no tuvo mayor influencia en la adsorción del mercurio.
Modelo de difusión intraparticular
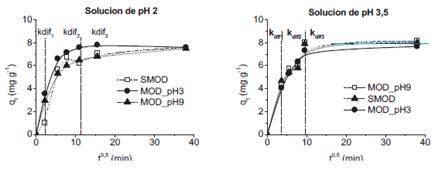
No se observó una relación lineal entre las variables qt y t1/2; sin embargo, se pudo diferenciar tres etapas diferentes.
En la primera etapa se observa una velocidad de adsorción alta, en esta etapa solo existe la resistencia externa de transferencia de masas del CA. En la segunda etapa disminuye la velocidad de adsorción, sin embargo, no se observa intercepción con el origen indicando que la difusión intraparticular no es el factor limitante (figura 6). En la última etapa se alcanza el equilibrio y la difusión intraparticular disminuye drásticamente debido a la extremadamente baja concentración del analito remanente en la solución (tabla 8).
Tabla 8. Parámetros de difusión intraparticular a distintos pH.
| Muestra | kdif1 | kdif2 | kdif3 | C1 | C2 | C3 | R1 2 | R2 2 | R3 2 |
|---|---|---|---|---|---|---|---|---|---|
| Solución pH 2 | |||||||||
| SMOD | 0,46 | 0,58 | 0,04 | 0,00 | 1,05 | 6,03 | 1,00 | 0,67 | 0,75 |
| MOD_pH3 | 1,59 | 0,45 | 0,00 | 0,00 | 3,27 | 7,73 | 1,00 | 0,82 | 0,13 |
| MOD_pH9 | 1,32 | 0,40 | 0,04 | 0,00 | 2,55 | 6,18 | 1,00 | 0,88 | 0,98 |
| Solución pH 3.5 | |||||||||
| SMOD | 1,30 | 0,26 | 0,04 | 0,00 | 3,84 | 6,45 | 1,00 | 0,94 | 0,33 |
| MOD_pH3 | 1,13 | 0,55 | 0,03 | 0,00 | 2,17 | 6,57 | 1,00 | 0,99 | 0,54 |
| MOD_pH9 | 1,23 | 0,38 | 0,04 | 0,00 | 3,27 | 6,64 | 1,00 | 0,84 | 0,34 |
Leyenda: Unidades de Kdif1, Kdif2, Kdif3 = mg g-1 min -1/2.
Isotermas de adsorción
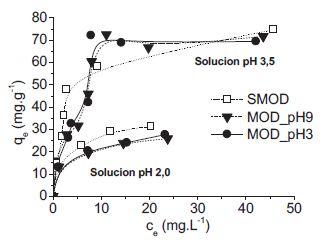
Los ensayos de isotermas en una solución a pH 2 dieron una máxima capacidad de adsorción para SMOD, siendo similares los resultados para los carbones modificados (tabla 9). El modelo de Freundlich presentó un coeficiente de correlación alto y una menor desviación estándar normalizada. Por tal motivo, puede establecer que el proceso de adsorción de mercurio se llevó a cabo en sitios activos heterogéneos y con la formación de multicapas.
Los ensayos de isotermas en una solución a pH 3,5 (figura 7) dieron como resultado una capacidad de adsorción similar para las muestras SMOD y MOD_pH9. Se evidencia un proceso de adsorción con tendencia al tipo Freundlich. Estos resultados son comparables con los obtenidos por Rao et al.22.
Tabla 9 . Resultados experimentales de las isotermas de adsorción.
| Medio | Solución pH 2 | Solución pH 3.5 | ||||
|---|---|---|---|---|---|---|
| Muestra | SMOD | MOD _pH3 | MOD _pH9 | SMOD | MOD _pH3 | MOD _pH9 |
| Freundlich | ||||||
| KF | 15,65 | 12,83 | 12,59 | 23,15 | 19,87 | 23,98 |
| 1/n 0,23 | 0,24 | 0,23 | 0,36 | 0,41 | 0,33 | |
| r2 | 1,00 | 1,00 | 1,00 | 0,96 | 0,93 | 0,96 |
| % ΔE | 3,17 | 1,68 | 1,91 | 27,09 | 22,47 | 20,52 |
| Langmuir | ||||||
| qm | 33,62 | 29,39 | 27,79 | 79,66 | 76,52 | 78,29 |
| KL | 0,56 | 0,43 | 0,46 | 0,33 | 0,27 | 0,27 |
| r2 | 0,992 | 0,987 | 0,994 | 0,998 | 0,976 | 0,973 |
| % ΔE | 18,71 | 17,52 | 14,91 | 13,02 | 26,13 | 33,83 |
| Temkin | ||||||
| B | 0,48 | 0,54 | 0,57 | 0,17 | 0,16 | 0,20 |
| AT | 20,73 | 15,11 | 16,56 | 4,84 | 3,93 | 8,35 |
| r2 | 0,97 | 0,98 | 0,98 | 0,92 | 0,75 | 0,77 |
| % ΔE | 5,71 | 4,71 | 4,42 | 19,08 | 26,74 | 30,64 |
| Redlich Peterson | ||||||
| G | 0,79 | 0,78 | 0,78 | 0,78 | 0,82 | 1,00 |
| ARP | 265 | 200 | 270 | 42 | 42 | 79 |
| BRP | 15,89 | 14,68 | 20,58 | 1,03 | 1,05 | 1,37 |
| r2 | 1,00 | 1,00 | 1,00 | 0,93 | 0,94 | 0,94 |
| % ΔE | 4,24 | 2,04 | 2,08 | 26,60 | 29,24 | 217,23 |
| Dubinin-Radushkevich | ||||||
| qs | 27,86 | 24,22 | 23,25 | 56,60 | 50,11 | 44,95 |
| E | 1749,15 | 1420,39 | 1355,00 | 1153,36 | 1628,29 | 2721,04 |
| r2 | 0,86 | 0,87 | 0,87 | 0,85 | 0,62 | 0,58 |
| % ΔE | 57,66 | 57,58 | 57,23 | 80,57 | 47,02 | 78,86 |
Lu et al.21 reportaron que el mercurio presentó un mejor ajuste con el modelo de Langmuir. Arshadi et al. indicaron que el modelo de Langmuir-Freundlich mostró un mejor ajuste para la remoción de mercurio empleando partículas de cloruro de manganeso. Asasian et al.23 reportaron un mejor ajuste con el modelo de Freundlich para la remoción de mercurio.
CONCLUSIONES
El presente estudio muestra que el empleo de ultrasonido y una solución de nitrato de manganeso a pH 9 favorecen la formación de óxidos metálicos en la superficie del carbón activado.
Las cinéticas de adsorción fueron del tipo de pseudo segundo orden. Además, el mecanismo de adsorción predominantemente es del tipo Freundlich de acuerdo a las isotermas de adsorción.
Los carbones modificados con óxido de manganeso presentaron un aumento de su carga cero, siendo la adsorción de mercurio más efectiva pasando el punto de carga cero de dichos carbones. Los CA modificados presentaron un incremento en su punto de carga cero debido al incremento de los grupos fenólicos en su superficie.
La adsorción de mercurio fue mayor en el carbón activado modificado en comparación con el carbón activado sin modificar a un pH mayor al punto de su carga cero. El CA MOD_pH9 alcanzó una mayor capacidad de adsorción que MOD_pH3.