Introducción
La familia Nictaginaceae comprende cerca de 30 géneros y 400 especies, con distribución pantropical, principalmente en las regiones tropicales y subtropicales del nuevo mundo. La familia incluye arbustos, árboles y raramente lianas o hierbas. A través de los estudios moleculares se han determinado siete tribus que conforman la familia: Boldoeae, Bougainvilleae, Caribeeae, Colignonieae, Leucastereae, Nyctagineae y Pisonieae1. En el Perú se distribuyen 11 géneros con 53 especies, la mayoría son arbustos o hierbas2. Dentro del género Colignonia están las especies C. glomerata Griseb, C. ovalifolia Heimerl, C. parviflora, C. pentoptera J.E. Bohlin, C. rufopilosa Kuntze, C. scandens Benth. La especie objetivo de nuestro estudio, Colignonia parviflora subsp. biumbellata es un arbusto que crece en la región andina del Perú, puede ser encontrada en el Cusco (Chinchero), Lima (Yauyos)3, La libertad4, Moquegua (Cuenca río Ilo-Moquegua)5, la especie es popularmente conocida con los nombres de “saqta”, “sacha paraqai” y tradicionalmente los pobladores de la región de Chincheros de la provincia de Anta del departamento del Cusco, utilizan las ralladuras de la raíz en agua ya que forma bastante espuma que actúa como detergente y son usadas para el lavado de la lana de ovejas o alpaca para ser teñidas posteriormente, hecho que fue presenciado por los autores.
La especie en estudio no presenta estudios fitoquímicos, pero sí hay estudio de una especie próxima la C. scandens, se usa el decocto de la raíz para lavar la ropa y como depurativo de la piel en casos de sarampión, la planta es conocida con los nombres de sacha paracay, llupplunsha, jaboncillo y quinuanya. De C. scandens fueron aislados e identificados las siguientes saponinas chikusetsusaponin IV y chikusetsusaponin V6.
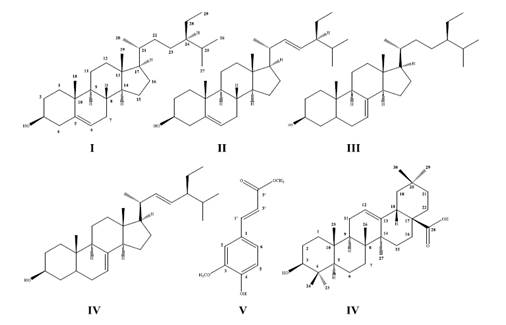
El presente trabajo reporta la identificación de 25 componentes químicos en el aceite esencial de la raíz de C. parviflora subsp. biumbellata, fueron identificados a través de la comparación de los espectros de masas con el banco de datos del sistema de CG-EM de NIST 14 y por análisis de sus espectros de masas obtenidos por cromatografía gaseosa acoplada a espectrómetro de masas. En la fase apolar del zumo de la raíz fueron identificados los ácidos grasos mayoritarios (linoleico, palmítico y 6-octadecenoico), así como también, fueron aislados e identificados los esteroides sitosterol (1), estigmasterol (2), estigmasta-7-en-3-ol(3)+ y estigmasta-7,22-dien-3-ol (4) también llamado de espinasterol, el fenil propanoide éster metílico del ácido ferúlico (5) y el ácido oleánico (6).
Parte experimental
Colecta de la muestra e identificación botánica
Fueron compradas las raíces (figura 1) en un mercado artesanal en Chinchero-Cusco (febrero de 2019) a 3780 msnm. La identificación botánica (tabla 1) fue realizada por el profesor Dr. Washington Galiano Sánchez de la Universidad Nacional de San Antonio de Abad del Cusco.
Tabla 1 Identificación taxonómica de C. parviflora subsp. biumbellata (Ball) JEBohlin.
| Clase: | Equisetopsida C. Agard |
| Subclase: | Magnoliidae Novák ex Takht. Superorden: Caryophyllanae Takht. |
| Orden: | Caryophyllales Juss. ex Bercht. & J. Presl |
| Familia: | Nyctaginaceae Juss. |
| Género: | Colignonia Endl. |
| Especie: | Colignonia parviflora subsp. biumbellata (Ball) JEBohlin |
Extracción y aislamiento de los fitoconstituyentes
Fueron adquiridos 2,547 kg de raíz fresca, la cual fue separada en dos partes, una parte (850 g) para la obtención del aceite esencial y la diferencia (1,697 kg) fue sometida a extracción del zumo (970 mL) (figura 2) en un extractor de jugos eléctrico doméstico de la marca OSTER, obteniéndose 727 g de bagazo de la raíz.
Obtención del aceite esencial.- Las raíces (850g) fueron sometidas a extracción del aceite esencial por hidrodestilación con aparato de Clevenger7, el aceite esencial fue extraído con éter de petróleo y secado con sulfato de sodio anhidro para posteriormente ser analizado por cromatografía gaseosa acoplada a espectrómetro de masas (CG-EM)8.
Partición líquida-líquida del zumo.- El zumo fue sometido a partición líquido-líquido9 para la obtención de los residuos clorofórmico (RCHCl3) 2,1535 g, residuo butanólico (RBuOH) 3,172 g y residuo acuoso (RH2O) 12,34g, las fases acuosas de los residuos fueron liofilizadas. El RCHCl3 fue sometido a fraccionamiento por cromatografía en columna abierta, usando como fase estacionaria sephadex LH-20 y los eluyentes fueron éter de petróleo (EP), diclorometano (DCM) y metanol (MeOH), así se obtuvo la fracción de éter de petróleo (FEP) 1,125 g, fracción de diclorometano (FDCM) 155,5 mg y la fracción metanólica (FMeOH) 0,873 g.
Transesterificación de los ácidos grasos.- Ochenta miligramos de la FEP fue transesterificado para determinar el ácido graso mayoritario, siguiendo el método de obtención y análisis por Díaz et al., 2011 10.
Fraccionamiento de la fracción de éter de petróleo y de diclorometano.- Las fracciones de éter de petróleo (FEP) y de diclorometano (FDCM) fueron sometidas a fraccionamiento por cromatografía en columna abierta por separado, usado como fase estacionaria sílica-gel (fase normal) y como eluyente la mezcla de los solventes (éter de petróleo, acetato de etilo, cloroformo y metanol) de polaridad creciente. Del fraccionamiento fueron obtenidos 68 y 34 subfracciones de la FEP y FDCM, respectivamente, las subfracciones fueron analizadas por separado por cromatografía de capa delgada analítica (usando como revelador H2SO4 al 25%, seguida de calentamiento) y reunidas siguiendo un patrón de similaridad. Después de ser analizados por separado se realizó la comparación final de las subfracciones de ambas columnas (FEP y FDCM) con la finalidad de obtener fracciones de mayores cantidades para realizar el aislamiento a través de cromatografía de capa delgada preparativa (placa de vidrio de 20 x 20 cm) usando como fase estacionaria sílica gel, las placas preparadas en el laboratorio tenían 1mm de espesor. Para aislar las moléculas III, IV y VI se hizo un corte lateral (~ 1,5 cm) en la placas preparativas y se reveló con H2SO4 al 25 % ya que estas moléculas no revelan bajo la luz a 254 o 356 nm de una lámpara ultravioleta.
Los compuestos I y II son una mezcla y fueron obtenidos como cristales de la reunión de las fracciones 29-30 (FEP) con la fracción 16 (FDCM), estos cristales fueron sometidos a análisis por RMN para su identificación.
De la reunión de las muestras 38-40 (FEP) y 19-20 (FDCM) se obtuvo 18,3 mg de masa, esta muestra fue sometida a cromatografía de capa delgada preparativa (CCDP) con la mezcla de EP:AcOEt en la proporción 4:1 eluido por tres veces consecutivas, de la cual se obtuvo tres subfracciones, la subfracción 2 es la mezcla de los compuestos III y IV.
La muestra 23-27 (FDCM) fue sometida a purificación a través de CCDP usando como eluente la mezcla de solventes EP:AcOEt 4:1, fue eluido por tres veces consecutivas, obteniéndose así el compuesto V.
El compuesto VI fue obtenido de la purificación por cromatografía de capa delgada preparativa de la fracción 41- 44 (FEP) (25,7 mg) usando como eluente la mezcla de EP:AcOEt en la proporción 4:1 eluido por tres veces consecutivas.
Análisis por cromatografía gaseosa acoplada a espectrómetro de masas
Análisis de los ésteres metílicos.- El análisis por cromatografía gaseosa fue realizado en un cromatógrafo a gas acoplado a un espectrómetro de masas (Shimadzu, modelo CGMS-QP2010 Ultra) con las siguientes condiciones de análisis: columna capilar Restek Rtx-5MS (30 m x 0,25 mm x 0,25 μm); temperatura del inyector 240 °C, temperatura del detector 230 °C; impacto de electrones a 70 eV, con gas de arrastre helio a un flujo de 1,23 mL/min, con split 1/5; con un programa de temperatura de 120ºC (2') - 280ºC, 2ºC/minuto; y con volumen de inyección de 3 μL.
La identificación de las sustancias componentes fue a través de la comparación de los espectros de masas con el banco de datos del sistema de CG-EM de NIST 14 lib. y con la inyección de los siguientes patrones: ésteres metílicos (Mixture for GC, 37 component fame, Lot: LRAC1814, Sigma-Aldrich).
Análisis de los aceites esenciales.- El análisis por cromatografía gaseosa fue realizado en un cromatógrafo a gas acoplado a un espectrómetro de masas (Shimadzu, modelo CGMS- QP2010 Ultra) con las siguientes condiciones de análisis: columna capilar Restek Rtx-5MS (30 m x 0,25 mm x 0,25 μm); temperatura del inyector 260 °C, temperatura del detector 260 °C; impacto de electrones a 70 eV, con gas de arrastre helio a un flujo de 1,48 mL/min, con split 1/5; con un programa de temperatura de 80ºC (5') - 280ºC (5'), 8ºC/minuto; y con volumen de inyección de 3 μL.
La identificación de las sustancias componentes fue a través de la comparación de los espectros de masas con el banco de datos del sistema de CG-EM de NIST 14 lib y por análisis de sus espectros de masas obtenidos por cromatografía gaseosa acoplada a espectrómetro de masas. Así como, con la inyección de los siguientes patrones: hidrocarburos (Mixture for GC, C8-C40 alkanes calibration, Lot LRAC1880 Sigma-Aldrich).
Análisis por resonancia magnética nuclear
Los espectros de resonancia magnética nuclear de 1H y de 13C fueron registrados en un espectrómetro Bruker de 500 MHz, operando a 500 MHz para los espectros de hidrógeno y para la obtención de los espectros de carbono 13 operaba a 125 MHz. Los espectros fueron obtenidos en cloroformo y metanol deuterados (CDCl3 y CD3OD) de la marca MERCK.
Resultados y discusión
De la extracción por hidrodestilación se obtuvo 42 mg de aceite esencial de la raíz de la saqta, representando ese valor el 0,0049% de rendimiento. El aceite inicialmente era transparente, con el pasar del tiempo se tornó de color amarillo claro. El análisis del aceite esencial por cromatografía gaseosa acoplada a espectrómetro de masas condujo a la identificación de 24 moléculas (tabla 2). Los compuestos mayoritarios son el p-vinil-guayacol (9,8 %) y los ésteres metílicos de los ácidos grasos linoleico (28,6 %), linolénico (12,2 %), palmítico (5,9 %). También fueron identificados otros componentes como monoterpenos, fenilpropanos, sesquiterpenos, alcoholes alifáticos, éster metílico y éster butílico de ácido graso de bajos porcentajes.
Tabla 2 . Composición química del aceite esencial de la raíz saqta, con su tiempo de retención y su porcentaje de presencia de cada componente.
| N° | T. R. | % | Nombre | N° | T. R. | % | Nombre |
| 1 | 8 857 | 0,53 | Nonanol | 13 | 15 862 | 1,04 | cis-Sesquisabineno hidrato |
| 2 | 9 342 | 0,25 | α-Terpineol | 14 | 16 419 | 1,93 | trans-Sesquisabineno hidrato |
| 3 | 10 147 | 0,26 | Geraniol | 15 | 17 282 | 0,45 | α-Acorenol |
| 4 | 11 894 | 9,77 | p-vinil-Guayacol | 16 | 17 774 | 2,42 | β-Bisabolol |
| 5 | 13 227 | 0,68 | β-Damascenona | 17 | 18 440 | 0,15 | Éster metílico del ácido mirístico |
| 6 | 13 542 | 0,20 | Metil eugenol | 18 | 18 851 | 0,12 | Xantorrizol |
| 7 | 13 784 | 1,24 | β-Ionol | 19 | 19 602 | 1,47 | Salicilato de 2-etilhexil |
| 8 | 13 886 | 0,18 | Cariofileno | 20 | 20 495 | 0,33 | Hexadecanol |
| 9 | 14 236 | 0,94 | Sesquisabineno | 21 | 21 060 | 5,85 | Éster metílico de ácido palmítico |
| 10 | 14 830 | 0,07 | γ-Curcumeno | 22 | 23 092 | 28,64 | Éster metílico de ácido linoleico |
| 11 | 15 557 | 1,01 | β-Sesquifelandreno | 23 | 23 170 | 12,22 | Éster metílico del ácido linolénico |
| 12 | 15 761 | 0,23 | Italiceno éter | 24 | 26 011 | 1,68 | Éster butílico del ácido linolénico |
T.R.: Tiempo de retención.
Los ácidos grasos libres y los triglicéridos presentes en las fracciones apolares de los extractos vegetales no son volátiles, es por esa razón que no se pueden analizar por cromatografía gaseosa. Para identificar los ácidos grasos se realiza la transesterificación. El análisis de los ésteres metílicos presentes en la FEP del RCHCl3 del zumo de la raíz saqta fresca fue realizado por cromatografía gaseosa acoplando a espectrómetro de masas. En la tabla 3 se reporta la identificación de los tres ésteres metílicos mayoritarios que representan el 84,47 %, en la que se observa el ácido linoleico como mayoritario con 45,5 %, siendo este ácido considerado como un ácido graso esencial11.
Tabla 3 . Porcentaje de la presencia de los ésteres metílicos mayoritarios en la fracción de éter de petróleo.
| N° | T. R. | % | Nombre |
| 1 | 29 785 | 20,83 | 20,83 Éster metílico del ácido palmítico |
| 2 | 37 329 | 45,49 | 45,49 Éster metílico del ácido linoleico |
| 3 | 37 551 | 18,15 | 18,15 Éster metílico del ácido 6-octadecenoico |
T.R. : Tiempo de retención.
El fraccionamiento de las fracciones de éter de petróleo y de diclorometano del residuo clorofórmico del zumo de la raíz fresca de saqta condujo al aislamiento y/o identificación de 6 metabolitos secundarios (figura 3) a través del análisis de sus espectros de RMN de 1H y RMN de 13C. Los compuestos 1-2, y 3-4 fueron obtenidos en mezcla, ambas mezclas son dos pares de esteroides muy comunes como constituyentes químicos en las plantas, pueden estar en diferentes proporciones y son inseparables, por ejemplo tenemos la mezcla de 1 y 2, fueron obtenidos de Cochlospermum vitifolium y en la proporción de 3:112.
Compuestos 1 y 2
Fue obtenido 37 mg de unos cristales transparentes. A través del análisis de sus espectros de RMN-13C (tabla 4) y RMN-1H fue determinado que el compuesto 1 es el esteroide β-sitosterol y el compuesto 2 es el estigmasterol. Por la integración de sus señales del espectro de RMN-1H podemos afirmar que los compuestos 1 y 2 se encuentran en la relación de 1:3. Los desplazamientos químicos del compuesto 1 (CDCl3, 500MHz) δ ppm: 0,69 (3H, s, H-18), 0,81 (3H, d, J = 6,7 Hz, H-26), 0,83 (3H, d, J = 6,7 Hz, H-27), 0,88 (3H,t, J = 6 Hz, H-29), 0,93 (3H, d, J = 6,4 Hz, H-21), 1,02 (3H, s, H-19), 1,24 (5H, m, H-11, 22,23, 1, 8), 1,31 (5H, m, H-1, 15, 16, 12, 2), 1,42 (2H, m, H-9, 14), 1,51 (6H, m, H-2, 12, 11, 28,24, 17), 1,68 (4H, m, H-7, 20, 15, 16), 1,84 (1H, m, H-25), 2,01 (1H, m, H-4ax), 2,26 (1H, m, H-4eq), 3,52 (1H, m, H-3), 5,35 (1H, m, H-6)13. Del compuesto 2 (CDCl3, 500 MHz) δ ppm: 0,71 (3H, s, H-18), 0,81 (3H, d, J = 6,7 Hz, H-26), 0,82 (3H, d, J = 6,7 Hz, H-27), 0,83 (3H,t, J = 6 Hz, H-29), 0,90 (3H, d, J = 6,7 Hz, H-21), 1,38 (3H, s, H-19), 3,53 (1H, m, H-3), 5,03 (1H, dd, J = 15,3, 8,5 Hz, H-23), 5,15 (1H, dd, J = 15,3, 8,55 Hz, H-22), 5,35 (1H, m, H-6)14.
Compuesto 3 y 4
Fue obtenido 9,4 mg, esta muestra se presenta como un sólido blanco. Fue identificada como una mezcla de estigmasta-7-en-3-ol (3) y estigmasta-7,22-dien-3-ol(4)por análisis de sus desplazamientos químicos de sus espectros de RMN-13C (tabla 4) y RMN-1H y por integración de sus señales se puede justificar que están en la relación de 1:7, respectivamente. Compuesto 3 (CDCl3, 500MHz) δ ppm: 0,55 (3H, s, H-18), 0,80 (3H, s,H-19), 0,81 (3H, d, J = 6,1 Hz, H-27), 0,83 (3H, d, J = 6,1 Hz, H-26), 0,86 (3H, t, J = 7,63 Hz, H-29), 0,94 (3H, d, J = 6,7 Hz, H-21), 3,61 (1H, m, H-3), 5,17 (1H, m, H-7). Compuesto 4 (CDCl3, 500MHz) δ ppm: 0,56 (3H, s, H-18), 0,81 (3H, s, H-19), 0,81 (3H, d, J = 6,1 Hz,H-23), 0,82 (3H, t, J = 7,35 Hz, H-29), 1,04 (3H, d, J = 6,72 Hz, H-21), 3,6 (1H, m, H-3),5,04 (1H, dd, J = 8,55, 15,25 Hz, H-23), 5,15 (1H, m, H-7), 5,17 (1H, dd, J = 8,55, 14,95 Hz, H-22)15.
Compuestos 5
Fue obtenido 7,2 mg de un sólido de color amarillo claro, fue identificado como el éster metílico del ácido ferúlico a través del análisis desus desplazamientos químicos de sus espectros de RMN-13C (tabla 4) y RMN-1H (CDCl , 500MHz) δ ppm: 3,81 (3H, s, H-1’’), 3,94 (3H, s, 3-OMe), 6,29 (1H, d, J = 15,9 Hz, H-2’), 6,93 (1H, d, J = 8,25 Hz, H-5),7,04 (1H, d, J = 2,1 Hz, H-2), 7,08 (1H, dd, J = 8,5, 1,55 Hz, H-6), 7,63 (1H, d, J = 16,15 Hz, H-1’)16.
Compuesto 6
Se obtuvo 12 mg de un polvo crema. Fue identificado como ácido oleánico por análisis de sus desplazamientos químicos de sus espectros de RMN-13C (tabla 4) y RMN- 1H (CD OD, 500MHz) δ ppm: 0,78 (3H, s, H-25), 0,83 (3H, s, H-29), 0,91 (6H, s, H-24 y 30), 0,95 (3H, s, H-26), 0,98 (3H, s, H-23), 1,16 (3H, s, H-27), 2,85 (1H, dd, J = 13,7, 4 Hz, H-18), 3,15 (1H, dd, J = 11,6, 4,9 Hz, H-3), 5,24 (1H, dd, J = 3,7, 3,35 Hz, H-12)17.
Tabla 4 . Desplazamiento químico del RMN de 13C (δ ppm, 125 MHz) de las moléculas identificadas en el zumo de la raíz de C. parviflora subsp. biumbellata.
| C | 1 | 2 | 3 | 4 | 6 | C | 5 | ||
| CDCl3 | CD3OD | CDCl3 | |||||||
| 1 | 37,28 | 37,28 | 37,17 | 31,17 | 38,34 | 1 | |||
| 2 | 31,68 | 31,88 | 31,52 | 31,52 | 26,56 | 2 | |||
| 3 | 71,84 | 71,84 | 71,08 | 71,08 | 79,89 | 3 | |||
| 4 | 42,24 | 42,32 | 37,17 | 38,03 | 38,34 | 4 | |||
| 5 | 140,77 | 140,77 | 40,29 | 40,29 | 56,94 | 5 | |||
| 6 | 121,72 | 121,72 | 29,66 | 29,66 | 19,68 | 6 | |||
| 7 | 31,93 | 31,93 | 117,47 | 117,47 | 33,22 | 1’ | |||
| 8 | 31,93 | 31,93 | 139,58 | 139,58 | 40,00 | 2’ | |||
| 9 | 50,16 | 50,25 | 49,48 | 49,48 | 47,94 | 3’ | |||
| 10 | 36,53 | 36,53 | 34,25 | 34,25 | 37,08 | 1’’ | |||
| 11 | 21,07 | 21,04 | 21,57 | 21,57 | 24,17 | 3OMe | |||
| 12 | 39,80 | 39,71 | 39,48 | 39,48 | 123,68 | ||||
| 13 | 42,24 | 42,32 | 43,29 | 43,29 | 145,55 | ||||
| 14 | 56,79 | 56,88 | 55,06 | 55,14 | 42,99 | ||||
| 15 | 24,32 | 24,38 | 23,02 | 23,02 | 28,04 | ||||
| 16 | 28,26 | 28,91 | 27,97 | 24,49 | 24,69 | ||||
| 17 | 56,09 | 55,99 | 56,12 | 55,94 | 47,52 | ||||
| 18 | 11,86 | 11,99 | 11,85 | 12,05 | 43,08 | ||||
| 19 | 19,39 | 19,39 | 13,04 | 13,04 | 47,52 | ||||
| 20 | 36,53 | 40,47 | 36,59 | 40,81 | 31,78 | ||||
| 21 | 18,79 | 21,22 | 18,99 | 21,38 | 34,06 | ||||
| 22 | 33,59 | 138,31 | 33,93 | 138,16 | 33,76 | ||||
| 23 | 26,12 | 129,30 | 27,19 | 129,48 | 28,91 | ||||
| 24 | 46,03 | 45,87 | 45,87 | 51,26 | 16,45 | ||||
| 25 | 29,14 | 33,97 | 29,20 | 31,88 | 16,04 | ||||
| 26 | 19,81 | 18,98 | 19,8 | 21,07 | 17,94 | ||||
| 27 | 19,39 | 21,21 | 18,99 | 18,99 | 26,56 | ||||
| 28 | 22,69 | 25,40 | 23,02 | 25,4 | 181,33 | ||||
| 29 | 12,25 | 12,05 | 12,05 | 12,25 | 34,21 | ||||
| 30 | - | - | - | - | 24,29 | ||||
Conclusiones
El estudio fitoquímico de las raíces de Colignonia parviflora subsp. biumbellata condujo a la identificación de 25 compuestos químicos en el aceite esencial, 3 ésteres metílicos en la fase apolar del zumo de la raíz y 6 metabolitos secundarios, que son compuestos ya identificados en otras plantas como lo demostramos al comparar los desplazamientos químicos de los metabolitos con la literatura correspondiente. Asimismo, los resultados obtenidos con este trabajo son por primera vez reportados para C. parviflora subsp. biumbellata.