Introducción
Las aguas naturales contienen impurezas y partículas supendidas de diversos tamaños de origen mineral u orgánico, que son responsables de la turbidez y color del agua1,2. Estos contaminantes causan serios problemas durante el proceso de potabilización del agua3.
Para sedimentar las partículas coloidales suspendidas en el agua se usa generalmente el proceso de coagulación y floculación4, que consiste en producir la sedimentación de las partículas mediante el uso de diferentes tipos de coagulantes inorgánicos, polímeros naturales y sintéticos. Entre los coagulantes inorgánicos, el más usado es el sulfato de aluminio5 por su bajo costo y manejo; sin embargo, después del proceso de floculación quedan trazas del ion de Al3+ , las cuales pueden poner en riesgo la salud pública, debido a que este ion favorece el desarrollo del mal de Alzheimer6. El proceso de coagulación-floculación produce grandes volúmenes de lodos, que también dan lugar a problemas ambientales7, debido al uso de coagulantes inorgánicos y polímeros sintéticos8. En este aspecto, el uso de biopolímeros en el proceso de coagulación floculación es de gran importancia para evitar la contaminación con aluminio y polímeros sintéticos no biodegradables9.
El quitosano es un polisacárido que en su estructura contiene a grupos aminas y se obtiene a partir de la desacetilación de la quitina. A pH inferior a 7, la mayoría de los grupos amina están protonados y pueden atraer cationes de metales9,10,11 y también pueden unirse a partículas coloidales de carga negativa12,13,14. Esta propiedad se utiliza para producir la coagulación en redes, la cual determina que el quitosano se pueda utilizar como floculante en diferentes aplicaciones, tales como: sedimentación de suspensiones sólidos en la industria de alimentos, separación de microorganismos y colorantes de efluentes textiles15,16,17.
En el presente trabajo se ha determinado los parámetros óptimos del proceso de coagulación- floculación de partículas suspendidas de yoduro de plata de carga negativa en agua, producidas por los coagulantes: sulfato de aluminio, quitosano y soluciones mixtas de sulfato de aluminio con quitosano. Utilizando los parámetros óptimos de este proceso de coagulación, se ha estudiado también la cinética del proceso de coagulación correspondiente a la acción mixta de estos coagulantes.
Parte experimental
Sistema coloidal de yoduro de plata (AgI)
Para preparar el sistema coloidal de yoduro de plata por el método de condensación química, se disolvió 3,320 g de AgNO3 (Merck) en 2,4 L de agua destilada en un vaso de 3L de capacidad y en otro vaso se disolvió 1,698 g de KI (Merck) en 1,2 L de agua destilada. Estas soluciones se mezclaron en un agitador magnético (HANNA) durante 20 min.
Solución de quitosano y sulfato de aluminio
Se pesó 1,0 g de quitosano de alto peso molecular en polvo (Sigma - Aldrich) y se disolvió en una solución de 100 mL de ácido acético al 2 % mediante agitación constante con un agitador de paletas (HANNA) a 100 rpm durante 24 h.
Para preparar una solución de 1000 ppm de Al3+, se pesó 12,33 g de sulfato de aluminio (Merck) y se disolvió en agua destilada en una fiola de un litro.
Determinación de la concentración óptima del quitosano
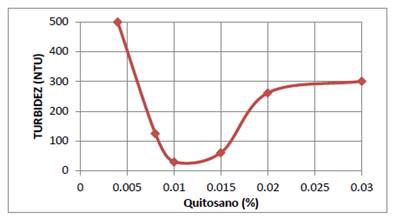
De la solución 1 % (W/V) de quitosano por dilución se prepararon las siguientes soluciones: 0,004 %; 0,008 %; 0,01 %; 0,015 %; 0,02 % y 0,03 % en fiolas de 100 mL. En los vasos del equipo de jarras se colocaron 600 mL del sistema coloidal, y se ajustó el pH a 6,0 con soluciones 0,1N de NaOH y HCl, utilizando un pH-metro Russell RL060P. A los seis vasos les se agregó sucesivamente 20 mL de las soluciones de quitosano preparadas anteriormente. Se procedió a agitar las soluciones a 100 rpm durante 3 min, y enseguida a 30 rpm durante 10 minutos, para luego dejarlo reposar durante 20 min, y después se midió la turbidez con un turbidimetro (HANNA - HI 93703). Los resultados se muestran en la figura 1. De la gráfica que se muestra en esta figura, se deduce que la concentración óptima de quitosano para producir la coagulación es 0,01 % a un pH=6 para este sistema coloidal.
Determinación del volumen óptimo de la solución 0,01 % de quitosano en la coagulación del sistema coloidal de Agl.
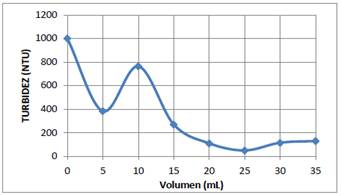
En los 6 vasos del equipo de jarras se colocaron 600 mL del sistema coloidal AgI. El pH de cada uno de los vasos se ajustó a 6 con soluciones 0,1 N de HCl y NaOH. Luego, a cada uno de los vasos de manera secuencial se agregó 5, 10, 15, 20, 25 y 30 mL de la solución de quitosano al 0,01 %, y se procedió a agitar en el equipo de jarras a 100 rpm durante 3 min, y después a 30 rpm durante 10 minutos. Se dejaron reposar las muestras durante 20 min e inmediatamente se midió la turbidez, los resultados se muestra en la figura 3.
Determinación del pH óptimo de la solución 0,01 % de quitosano
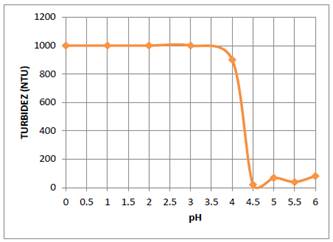
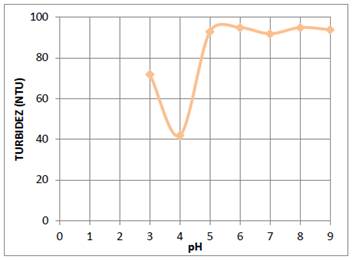
Para determinar el efecto del pH de la solución óptima de quitosano al 0,01 % en el proceso de coagulación y floculación de las partículas coloidales de AgI, se prepararon en 6 fiolas de 25 mL soluciones de quitosano a diferentes pH: 3,0; 4,0; 4,5 ; 5,0; 5,5 y 6,0. Estas soluciones en forma consecutiva se agregaron a los 6 vasos del equipo de jarras que contenían 600 mL del sistema coloidal y se procedió a agitar las soluciones a 100 rpm durante 3 min y enseguida a 30 rpm durante 10 minutos, luego se dejó reposar la mezcla obtenida durante 20 min y se midió la turbidez. Los resultados se muestran en la figura 5.
Determinación de la concentración óptima de la solución de sulfato de aluminio
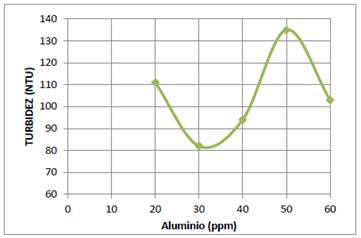
A partir de la solución de 1000 ppm de Al3+ por dilución en filolas de 100 mL, se prepararon soluciones de 10, 20, 30, 40, 50 y 60 ppm. En los 6 vasos del equipo de jarras se colocaron 600 mL del sistema coloidal y se ajustó el pH a 6. Luego se agregó 20 mL de cada una de las soluciones de sulfato de aluminio a los 6 vasos mediante agitación constante a 100 rpm durante 3 min, y después a 30 rpm durante 10 min. Se dejaron reposar durante 20 min. Enseguida se tomaron muestras para medir la turbidez. Los resultados se muestran en la gráfica de la turbidez versus la concentración, figura 2. De esta gráfica se deduce que la concentración óptima del Al3+ es 30 ppm.
Determinación del volumen óptimo de la solución 30 ppm de sulfato de aluminio
Como la concentración óptima de Al3+ para producir la coagulación del sistema coloidal con partículas de AgI de carga negativa es 30 ppm, se preparó 1L de esta solución. En los 6 vasos del equipo de jarras se colocaron 600 mL del sistema coloidal de AgI y se ajustó el pH a 6,0. En seguida a cada uno de estos vasos en forma sucesiva se agregó 5, 10, 15, 20, 25 y 30 mL de la solución de sulfato de aluminio y se procedió a agitar las soluciones primero a 100 rpm durante 3 min y después a 30 rpm durante 10 minutos. Se dejaron reposar las soluciones durante 20 min e inmediatamente se midió la turbidez. Los resultados se muestran en figura 4.
Determinación del pH óptimo de la solución 30 ppm de sulfato de alumnio
Para determinar el efecto del pH de la solución 30 ppm de Al3+ en el proceso de coagulación y floculación de las partículas coloidales de AgI, en 6 fiolas de 25 mL se prepararon soluciones de 30 ppm de Al3+ a diferentes pH: 3,0; 4,0; 5,0; 6,0; 7,0 y 8,0. Estas soluciones, en forma consecutiva, se agregaron a los 6 vasos del equipo de jarras que contenían 600 mL del sistema coloidal, y se procedió a agitar las soluciones a 100 rpm durante 3 min, y enseguida a 30 rpm durante 10 minutos. Luego se dejó reposar la mezcla obtenida durante 20 min, y después se midió la turbidez. Los resultados se muestran en la figura 6.
Determinación de la proporción óptima entre el volumen de quitosano y sulfato de aluminio en el proceso de coagulación
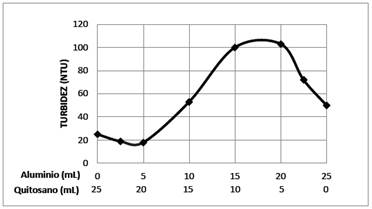
Con la finalidad de determinar esta proporción, en los 6 vasos del equipo de jarras se colocaron 600 mL del sistema coloidal de AgI y se ajustó su pH a 6,0. En seguida se agregó 2,5, 5, 10, 15, 20 y 22,5 mL en forma secuencial de la solución de sulfato de aluminio al 30 ppm y pH=4,0. La mezcla obtenida se agitó durante 3 min a 30 rpm; luego se adicionó 22,5, 20, 15, 10, 5 y 2,5 mL de la solución 0,01 % de quitosano a un pH=4,5, y se procedió agitar la mezcla a 100 rpm durante 3 minutos, y después a 30 rpm durante 10 minutos. Se dejó reposar por 20 minutos y se midió la turbidez. Los resultados se muestran en figura 7.
Cinética de la coagulación del sistema coloidal de AgI
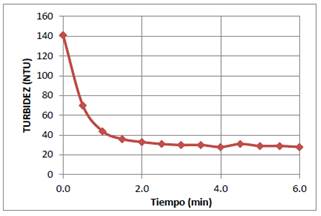
Para estudiar la cinética del proceso de coagulación, se colocó 600 mL del sistema coloidal de AgI en un vaso de 1L. En seguida se adicionó 5 mL de la solución de Al3+ de 30 ppm con un pH=4,0, agitando la mezcla a 30 rpm durante 3 min e inmediatamente se adicionó 20 mL de quitosano al 0,04 % a pH=4,5 y se procedió a agitar a 100 rpm por 3 minutos, y finalmente a 30 rpm por 10 minutos. Luego, se extrajeron periódicamente muestras de 20 mL de esta mezcla para determinar la turbidez. Los resultados se muestran en la figura 8.
Resultados y discusión
Proceso de coagulación en función de la concentración de quitosano y sulfato de aluminio
El quitosano es un polisacárido que se encuentran en gran abundancia en la naturaleza. En su estructura molecular contiene una gran cantidad de grupos amino (-NH2) y grupos hidroxilos (-OH), los cuales poseen un par de electrones libres, que se utilizan para formar quelatos con los iones de metales divalentes. Además, el grupo amino del quitosano puede ser protonado en una solución acuosa ácida, y de esta manera se transforma en un poliectrólito catiónico. Esta propiedad se utiliza para producir la coagulación de partículas de carga negativa y moléculas de colorantes aniónicos de la industria textil14-17. Por esta razón se ha utilizado el quitosano en la coagulación de partículas coloidales de carga negativa de AgI. En la figura 1 se muestra la gráfica de datos experimentales de la turbidez en función de la concentración de quitosano, determinada mediante la técnica de prueba de jarras (test de jarras). De esta gráfica se deduce que la concentración óptima para producir la coagulación de las partículas suspendidas de carga negativa de AgI es 0,01 % a un pH=6.
En la figura 2 se muestra la gráfica de la turbidez del sistema coloidal de AgI, que se encontraba a un pH=6, en función de la concentración de sulfato de aluminio. De esta gráfica se deduce que la concentración óptima de sulfato de aluminio para producir la coagulación y floculación del sistema coloidal AgI es 30 ppm.
Coagulación en función del volumen de quitosano y sulfato de aluminio
Una vez que se ha determinado la concentración óptima de la solución coagulante, es también muy importante determinar el volumen óptimo de esta solución que produce la coagulación de 600 mL del sistema coloidal. En las figura 3 y 4 se muestran los resultados experimentales obtenidos de la turbidez del sistema coloidal en función del volumen de la solución óptima de quitosano (0,01 %) y de la solución 30 ppm de sulfato de aluminio. En ambas gráficas se tiene dos mínimos locales, sin embargo los segundos mínimos dan un valor muy pequeño de la turbidez, que nos indica que prácticamente se han removido un 95 % de las partículas coloidales de AgI. Por consiguiente el volumen óptimo de la solución coagulante para ambos casos es aproximadamente de 25 mL.
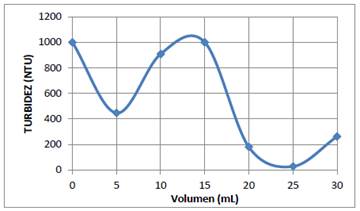
Figura 3 Turbidez del sistema coloidal de Agl en función del volumen de la solución 0,01 % de quitosano a pH=4.
Coagulación del sistema coloidal de AgI en función del pH de la solución de quitosano y sulfato de aluminio
La molécula de quitosano tiene en sus estructura una gran cantidad de grupos hidroxilo (-OH) y grupos amino (-NH2), los cuales tienen un par de electrones que pueden donar para formar complejos con los cationes de metales. Por esta razón en soluciones acuosas casi neutras se utiliza para remover cationes de metales pesados. A pH el grupo amino del quitosano se protona (-+NH ) transformándose en un polielectrólito de carga positiva18. Esta propiedad se utiliza para producir la coagulación de colorantes catiónicos y partículas coloidales de carga positiva. En el caso de la solución de sulfato de aluminio el ion coagulante es el Al3+, el cual fácilmente neutraliza a la doble capa eléctrica de las partículas coloidales de AgI. Su capacidad de coagulación también depende del pH de la solución de sulfato de aluminio y del pH del sistema coloidal. Por esta razón se estudió la influencia del pH de las soluciones óptimas de quitosano (0,01 %, V=25 mL) y sulfato de aluminio (30 ppm y V=25 mL) en la coagulación de 600 mL del sistema coloidal, que se encontraba a un pH 6. Los resultados de este estudio se reportan en las gráficas de la turbidez versus el pH que se muestran en las figuras 5 y 6. De estas gráficas se deduce que el pH óptimo de la solución 0,01 % de quitosano es 4,5 y para la solución 30 ppm de sulfato de aluminio es 4, alcanzándose una remoción de partículas coloidales de 97 %.
Proporción óptima del volumen de quitosano y sulfato de aluminio en la coagulación del sistema coloidal de AgI
En los pasos anteriores se han determinado los parámetros óptimos de las soluciones coagulantes de quitosano (concentración 0,01 %, volumen 25 mL y pH=4,5) y sulfato de aluminio (concentración 30 ppm, volumen 25 mL y pH=4), que producen la coagulación y floculación de 600 mL del sistema coloidal de AgI . Teniendo esta información se puede examinar la acción mixta del quitosano y sulfato de aluminio en la coagulación del sistema coloidal, los resultados de esta acción mixta se muestran en la figura 7. De la gráfica de la turbidez versus el volúmen de cada solución coagulante, que se ha agregado simultáneamente al sistema coloidal, se deduce que la proporción óptima de cada coagulante es 5 mL de sulfato de aluminio y 20 mL de quitosano. En este caso se alcanza el 98,2 % de remoción las partículas suspendidas de yoduro de plata.
Cinética de la coagulación del sistema coloidal de AgI por la acción mixta de sulfato de aluminio y quitosano
El estudio de la cinética del proceso de coagulación y floculación permite determinar el tiempo óptimo en que se produce la separación de las partículas coloidales suspendidas por acción de los coagulantes y floculantes. En el presente caso, como la partícula coloidal tiene carga negativa, entonces el ion que produce la neutralización de la doble capa eléctrica es el Al3+. Una vez que las partículas son neutralizadas, desaparece la repulsión electroestática entre ellas y, por consiguiente, se unen fácilmente para dar origen a la formación de coágulos de pequeñas dimensiones al inicio del proceso, y después estos coágulos se unen en flóculos que, por acción de la fuerza de gravedad precipitan. Para acelerar el proceso de floculación del sistema coloidal de AgI se ha utilizado el quitosano. Este biopolímero a través de grupos aminos protonados a bajo pH se une a las partículas coloidales de carga negativa y a los coágulos formados, dando lugar a la formación de flóculos muy pesados que precipitan rápidamente. De la gráfica de la tubidez en función del tiempo de coagulación - floculación, que se muestra en la figura 8, se deduce que la acción mixta del coagulante Al3+ y del floculante quitosano es muy rápida, pues culmina a los 3 min de haber empezado el proceso de coagulación-floculación.
Conclusiones
Mediante el uso del método de Test de Jarras y turbidimetría se ha determinado que para producir la coagulación - floculación del sistema coloidal de AgI, 600 mL a pH 6, por acción de una solución de quitosano, los parámetros óptimos son: concentración 0,01 %, volumen óptimo 25 mL y pH 4,0; para el sulfato de aluminio se tiene: concentración 30 ppm, pH 4,5 y volumen 25 mL; para la acción mixta de ambos coagulantes, considerando al sulfato de aluminio como coagulate y al quitosano como floculante se tiene: volumen de quitosano 20 mL y volumen de sulfato de aluminio 5 mL, siendo la remoción de partículas coloidales del 98 %. Del estudio de la cinética de coagulación - floculación producido por ambos coagulantes en el sistema coloidal de AgI, se ha determinado que este proceso es rápido y termina a los 3 min.