Introducción
Prosopis pallida (algarrobo) es una leguminosa que crece de manera silvestre en las regiones áridas principalmente del norte peruano desde tiempos ancestrales, produce vainas (algarrobas) de hasta 30 cm de largo, con elevado contenido de carbohidratos. Las algarrobas contienen: sacarosa 46 %, proteínas 8 %, grasas 0,7 % y fibra 32 %1.
Los carbohidratos tipo fructanos están formados por polímeros de fructosa, unidos mediante enlaces glucosídicos del tipo β (2-1), son conocidos como oligofructanos, tienen un grado de polimerización entre tres y nueve unidades de monosacáridos2. Los FOS están presentes en diversas especies vegetales como betarraga, alcachofa, entre otros. Asimismo, estos compuestos se producen por hidrólisis enzimática de inulina, levano, entre otros, o por reacciones de síntesis mediante la acción de transferasas e invertasas en un medio rico en sacarosa3. Los FOS contienen un residuo terminal de α-D-glucosa, y entre ellos destaca: 1-kestosa (GF2), 1-nistosa (GF3) y 1F-fructosilnistosa (GF4)4. Este bioproceso genera FOS y glucosa libre, siendo esta última directamente proporcional al proceso de transfructosilación.
En los últimos años, se han descrito enzimas que presentan actividad fructosiltransferasa, tales como invertasas, inulinasas, pectinasas, entre otras. Así, la pectinasa de Aspergillus aculeatus presenta actividades de pectinatranseliminasa, poligalacturonasa, pectinesterasa, β-galactosidasa, fructosiltransferasa, hemicelulasa y celulasa. Esta enzima, por presentar alta actividad fructosiltransferasa, es utilizada en la producción de FOS a partir de sacarosa. La eficiencia de conversión se mejora mediante la eliminación simultánea de glucosa a través de una reacción enzimática5. En este aspecto, la disponibilidad del extracto de algarrobo con alta concentración de carbohidratos motivó la producción de FOS con el propósito de poner en valor a los frutos subutilizados de esta leguminosa.
Parte experimental
Materiales y reactivos
Las vainas de algarrobo (algarroba) se recolectaron de la provincia de Piura, distrito de Catacaos a 28 m de altitud. Las algarrobas fueron seleccionadas, pesadas y secadas a 42 °C hasta peso constante. Luego, las vainas fueron molidas, la harina se cernió con tamices de poros 4 y 1 mm. Por otro lado, los reactivos utilizados fueron: pectinasa de Aspergillus aculeatus, Merck (EE.UU.), glucosa oxidasa, Valtek (Chile) y Fructan Kit, Megazyme (EE.UU.). Los estándares de 1-cestosa, nistosa, sacarosa, glucosa y fructosa, Sigma Chemical (EE.UU). Los otros productos químicos fueron adquiridos de Merck Peruana.
Preparación y análisis del extracto de algarrobo
En un recipiente de acero inoxidable se mezcló la harina de algarroba con agua en una relación de 1:5 (peso/volumen) y se calentó a 80 °C por 2 h. Después, la mezcla se filtró y el extracto se concentró a 50 °Brix. Al extracto se determinó los sólidos solubles totales (SST) utilizando un refractómetro manual (Giardino, Italia), la actividad de agua a 25 ºC utilizando el método AOAC 978.18. El pH se determinó con un potenciómetro digital (Hanna, Rumania). Los contenidos de azúcares se analizaron usando el método de glucosa oxidasa, DNS y Fructan kit.
Optimización de la producción de FOS
El diseño Box-Behnken se utilizó en la optimización de la producción de FOS usando pectinasa. Para ello, se consideraron cuatro factores: tiempo (h), temperatura (°C), concentraciones de enzima (mg/ml) y extracto de algarrobo (°Bx). Así, se obtuvieron 27 ensayos y seis puntos centrales que se ejecutaron en tres bloques. Los rangos de los parámetros evaluados fueron de 20 a 50 °Bx de extracto de algarrobo, pectinasa de 5 a 30 μL, tiempo de 0,5 a 18 h y temperatura de 45 a 65 °C, siendo variables independientes del proceso. El resultado de 10 de los 54 experimentos se presenta en la tabla 1. Para cada ensayo se mezcló pectinasa y extracto de algarrobo 1 mL. La enzima se inactivó a 100 °C durante 5 min. Posteriormente, las concentraciones de glucosa, azúcares reductores y FOS se determinaron usando glucosa oxidasa, DNS y Fructan Kit, respectivamente.
La metodología de superficie de respuesta se aplicó al optimizar los datos experimentales utilizando Minitab (versión 16). La ecuación de regresión permitió describir la relación entre la respuesta (FOS y glucosa libre) y los términos incluidos en el modelo, las condiciones óptimas obtenidas por el paquete estadístico fueron ensayadas y los azúcares cuantificados por HPLC.
Tabla 1 Matriz del diseño Box-Behnken para optimizar la producción de FOS.
| N° de ensayo | Tiempo (h) | Temperatura (°C) | Enzima (μl) | Extracto de algarrobo (°B) |
|---|---|---|---|---|
| 1 | 9,25 | 45 | 17,5 | 20 |
| 2 | 18,00 | 55 | 5,0 | 35 |
| 3 | 9,25 | 65 | 17,5 | 50 |
| 4 | 9,25 | 65 | 17,5 | 20 |
| 5 | 18,00 | 55 | 17,5 | 50 |
| 6 | 9,25 | 45 | 17,5 | 50 |
| 7 | 18,00 | 45 | 17,5 | 35 |
| 8 | 18,00 | 45 | 17,5 | 35 |
| 9 | 9,25 | 55 | 5,0 | 50 |
| 10 | 18,00 | 55 | 17,5 | 50 |
La significancia estadística al 95 % de confianza, en términos de la ecuación de regresión, se examinó mediante análisis de varianza (ANOVA). Se generaron gráficas de contorno y superficie de respuesta después del análisis por el mismo software.
Cuantificación de carbohidratos en condiciones óptimas de producción de FOS
Se realizó por cromatografía líquida de alto rendimiento (HPLC) con un sistema isocrático combinado con detección por índice de refracción para el análisis de carbohidratos. Se aplicaron 20 µL de muestra en una columna Aminex HPX 42- (BioRad, Richmond), con un flujo de 0,6 mL/ min, a aproximadamente 52 bars y 81,7 ºC; el solvente fue agua mili-Q. Los resultados se analizaron mediante BioCrom, versión 3,0. La interpretación y la cuantificación se realizaron comparando los tiempos de retención y la concentración de las soluciones de carbohidratos estándares. Así, sacarosa, glucosa, fructosa y fructooligosacáridos se prepararon a la concentración de 0, 0,5, 1, 2, 4, 6, 8 y 10 mg/ml.
Resultados y discusión
La harina de los frutos de Prosopis pallida es utilizada en alimentación animal y en menor proporción en humanos, esta harina contiene carbohidratos entre 40 % y 60 %, corresponde a fructuosa, glucosa y sacarosa7. Además de estos carbohidratos existen galactomananos provenientes del endospermo de las semillas, que presentan unidades de galactosa y manosa con enlaces en posición β-1,4 que unen varias ramas de D-galactosa mediante enlaces glicosidicos (1,6) cada cuatro o cinco manosas, estos últimos representarían hasta 20 % dependiendo del suelo y la variedad del cultivo5. El análisis proximal de la harina de algarrobo realizado para esta investigación presentó la siguiente composición: carbohidratos 75,5 %, proteínas 5,7 %, grasa 2,1 %, cenizas 8,1 %; y humedad 8,6 %.
Características físico químicas del extracto de algarrobo
Para obtener el extracto de algarrobo se ensayaron tres concentraciones de harina de algarrobo 10 %, 20 % y 30 %, alcanzando 15, 30 y 40 °Bx, respectivamente, después de ser concentrado a un mismo volumen, lo cual demuestra una mayor recuperación de carbohidratos al 20 % de harina. Finalmente, se preparó el extracto de algarrobo llevándolo hasta una concentración de 50°Bx. El pH y la actividad de agua fueron de 4,5 ± 0,01 y 0,9, respectivamente. Además, el extracto de algarrobo contenía sacarosa 23,82 %, glucosa 9,74 % y fructosa 10,53 % y oligosacáridos 4,5 %; estos valores comparados con el jugo de caña de azúcar que presenta: fructuosa 2,0 %, glucosa 2,0 % y sacarosa 75,0 % 6 indican que el extracto de algarrobo posee una tercera parte de sacarosa con respecto al de caña de azúcar, concentración importante para su aprovechamiento en la biosíntesis de FOS.
Asimismo, en el extracto de algarrobo se determinaron los siguientes minerales expresados en mg/kg: hierro 6, calcio 462, magnesio 372, zinc 6 y fósforo 899, lo cual indica que este producto es una fuente de carbohidratos y minerales para la alimentación.
Producción enzimática de FOS
En la actualidad, la obtención de FOS se realiza por hidrólisis enzimática de inulina y lévano o por reacciones de síntesis enzimática de hidrólisis y transferencia de fructosas a concentraciones de sacarosa mayores a 100 g/l, en estas condiciones la invertasa transfiere específicamente moléculas de fructosa a glucosa o sacarosa y forma FOS3. En la biosíntesis de FOS a partir de sacarosa se utilizan diversas enzimas comerciales tales como: inulinasas, invertasas, celulasas, levansacarasas con actividad fructosiltransferasa que catalizan la transferencia de un grupo fructosilo desde una sacarosa a diferentes aceptores, entre ellos, otra molécula de sacarosa, produciendo FOS, estas enzimas pueden estar libres o inmovilizadas, también se utilizan células vivas como Pichia pastoris transgénica, entre otros7.
En la producción de FOS a partir de sacarosa se evaluaron diferentes factores y condiciones, así Rubio et al3 utilizaron invertasa de Aspergillus niger IB56 y estudiaron el pH a 3,0; 4,0; 4,5; 5,0 y 5,5; temperaturas 20, 25, 30 y 40 ºC, concentración de sacarosa 15,0; 30,0 y 45,0
% y tiempos de incubación a 60; 90 y 120 min. La máxima producción de FOS 10,5 % la obtuvieron con sacarosa 30,0 %; a pH 5,0; 20 ºC y 60 min de reacción3. Por el contrario, Pérez- Cruz et al7 produjeron 32,2 % de FOS, principalmente1-kestosa utilizando Pichia pastoris inmovilizadas en alginato de calcio, en un biorreactor tipo tanque agitado de 5 L. A la vez, Ureta et al8 sintetizaron FOS utilizando sacarosa 20, 30 y 55 % (p/v) y Viscozyme L 3,5 %, de esta forma obtuvieron FOS 30 % de cadena corta (GF3 y GF4) con sacarosa 30 %8. En tanto, Vega et al9 utilizaron preparaciones enzimáticas comerciales, como Pectinex Ultra SP-L con 6 h de reacción, el rendimiento fue entre 58,8 a 62,6 % (g sc-FOS/100 g de sacarosa). En este aspecto, el extracto de algarrobo es un sustrato mucho más complejo en comparación a soluciones saturadas de sacarosa. Además, el seguimiento del bioproceso resultaba costoso, por ello se realizaron ensayos preliminares con diversas enzimas comerciales como inulinasa, invertasa y pectinasa con sacarosa al 30 %, y se encontraron rendimientos de 12,1
%, 11,5 %, y 14,0 % de glucosa, respectivamente. En estos experimentos se evaluaron las concentraciones de glucosa en el medio de reacción. La liberación de esta molécula fue directamente proporcional a la de síntesis de FOS.
En los últimos años, la demanda de FOS por las industrias alimentaria y farmacéutica se incrementó, por ello se busca convertir insumos alimentarios nativos con altas concentraciones de sacarosa a FOS utilizando procesos limpios y sostenibles como reacciones enzimáticas usando herramientas estadísticas para su optimización. Así, Vega et al10 analizaron temperatura, concentraciones de sacarosa y enzima (celulasas Rohapect CM) en el medio de reacción para la producción de FOS de cadena corta (sc-FOS). Las respuestas del diseño fueron las siguientes: rendimiento (g sc-FOS/100 g de sacarosa), 1-kestosa (g/100 g sc-FOS) y productividad volumétrica (g sc-FOS / L h). Las condiciones óptimas fueron 50 ° C, 6,6 U / ml de enzima, sacarosa 2,103 M en tampón de acetato 50 mM a pH 5,5, y 5 h. En estas condiciones, se lograron sGF2 de 68,2 %10. Por este lado, el método de superficie de respuesta con el diseño Box-Behnken disminuye los costos de cuantificación de FOS en el proceso, tanto por el método enzimático como por HPLC (tabla 1), los intermedios de las variables independientes fueron: 9,25 h, 55 °C, enzima 35,9 mg y extracto de algarrobo 35 °Bx.
Los porcentajes de FOS, glucosa libre y azúcares reductores de 15 de los 54 ensayos de transfructosilación se presentan en la tabla 2. En la matriz del MSR según el diseño Box-Benhen se observa que los porcentajes de glucosa tanto el menor (1,6 %) como el mayor (10,11 %) están en los ensayos N° 20 y 39, respectivamente, en las condiciones de 9,25 h, 55 °C, 17,5 µL de enzima y 35 °Bx de extracto de algarrobo. En todos los ensayos, la concentración de glucosa es directamente proporcional a la biosíntesis de fructooligosacáridos en el medio de reacción. Con respecto a la producción de FOS, fue menor en el ensayo N° 34 con 2,41 % y mayor en los ensayos N° 15, 26, 31, 39 y 41, en los que se alcanzó en los que se alcanzó una media de 13,81 % de FOS en el medio de reacción.
Tabla 2 Producción de FOS vía enzimática a partir del extracto de algarrobo según el diseño Box-Behnken del MSR.
| N° ensayo | T (h) | TR (°C) | E (μl) | CS (°Bx) | G (%) | AR (%) | FOS (%) |
|---|---|---|---|---|---|---|---|
| 1 | 9,25 | 45 | 17,5 | 20 | 4,66 | 8,94 | 11,01 |
| 2 | 18,00 | 55 | 5,0 | 35 | 8,99 | 13,15 | 11,26 |
| 3 | 9,25 | 65 | 17,5 | 50 | 6,82 | 17,45 | 11,45 |
| 4 | 9,25 | 65 | 17,5 | 20 | 4,29 | 7,87 | 12,75 |
| 5 | 18,00 | 55 | 17,5 | 50 | 8,06 | 14,02 | 9,56 |
| 6 | 9,25 | 45 | 17,5 | 50 | 5,19 | 17,28 | 12,99 |
| 7 | 18,00 | 45 | 17,5 | 35 | 8,33 | 14,87 | 12,98 |
| 8 | 18,00 | 45 | 17,5 | 35 | 8,40 | 14,56 | 13,04 |
| 9 | 9,25 | 55 | 5,0 | 50 | 8,43 | 15,78 | 12,09 |
| 10 | 18,00 | 55 | 17,5 | 50 | 8,55 | 14,11 | 8,70 |
| 11 | 9,25 | 45 | 5,0 | 35 | 9,30 | 12,33 | 9,91 |
| 12 | 9,25 | 55 | 5,0 | 50 | 8,89 | 15,97 | 12,70 |
| 13 | 9,25 | 45 | 30,0 | 35 | 7,19 | 13,49 | 7,07 |
| 14 | 9,25 | 45 | 30,0 | 35 | 7,56 | 13,84 | 7,34 |
| 15 | 9,25 | 55 | 17,5 | 35 | 9,45 | 16,03 | 13,88 |
Leyenda: T, tiempo; TR, temperatura de reacción; E, enzima; CS, concentración de sustrato o extracto de algarrobo; FOS, fructooligosacáridos; G, glucosa libre; AR, azúcares reductores libres; °Bx, grados Brix.
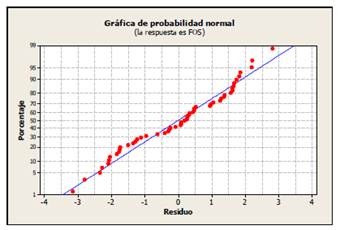
Al calcular el coeficiente de regresión de superficie del porcentaje FOS se encontró R2 de 90,36 %, R2 predictivo de 80,8 % y R2 ajustado de 86,89 %. En tanto, el porcentaje de glucosa R2 es 89,44 %, R2 predictivo 79,08 % y R2 ajustado 85,64 % (tablas 3 y 4). Los coeficientes de determinación R2 señalan que la síntesis de FOS y glucosa libre se ajustan al modelo empleado. Las interacciones tiempo-enzima y temperatura-enzima en la biosíntesis de FOS presentaron un p < 0,05 (tablas 3 y 4), por lo que es estadísticamente significativo.
Tabla 3 Coeficiente de regresión de superficie de respuesta del porcentaje FOS vs. tiempo y temperatura.
| EE del término | Coef. | Coef. | T | P |
|---|---|---|---|---|
| Constante | -559,573 | 106,026 | -5,278 | 0,000 |
| Tiempo (h) | 13,857 | 0,2360 | 5,872 | 0,000 |
| Temperatura (°C) | 18,737 | 0,3205 | 5,846 | 0,000 |
| Enzima (ul) | 0,2142 | 0,1685 | 1,271 | 0,211 |
| Algarrobo (°Bx) | 0,4960 | 0,1514 | 3,277 | 0,002 |
| Tiempo (h)*Tiempo (h) | -0,0430 | 0,0036 | -11,838 | 0,000 |
| Temperatura (°C)*Temperatura (°C) | -0,0184 | 0,0028 | -6,605 | 0,000 |
| Enzima (ul)*Enzima (ul) | -0,0176 | 0,0018 | -9,864 | 0,000 |
| Algarrobo (°Bx)*Algarrobo (°Bx) | -0,0075 | 0,0012 | -6,098 | 0,000 |
| Tiempo (h)*Temperatura (°C) | -0,0007 | 0,0037 | -0,195 | 0,846 |
| Tiempo (h)*Enzima (ul) | -0,0159 | 0,0029 | -5,422 | 0,000 |
| Tiempo (h)*Algarrobo (°Bx) | -0,0008 | 0,0024 | -0,319 | 0,751 |
| Temperatura (°C)*Enzima (ul) | 0,0082 | 0,0026 | 3,194 | 0,003 |
| Temperatura (°C)*Algarrobo (°Bx) | -0,0002 | 0,0021 | -0,076 | 0,940 |
| Enzima (ul)*Algarrobo (°Bx) | 0,0036 | 0,0017 | 2,103 | 0,042 |
| S = 0.908322 PRESS = 64.1191 | ||||
| R-cuad. = 90,36 % R-cuad.(pred.) = 80,78 % R-cuad.(ajustado) = 86,89 % |
La ecuación de segundo orden simula correctamente la síntesis de fructooligosacáridos de acuerdo al diseño Box-Behen.
Leyenda:
Análisis gráfico de la producción de FOS
Los gráficos de superficie de respuesta y contorno (figuras 2 y 3) fueron establecidos entre dos factores, mientras los demás se mantuvieron en un nivel intermedio. Asimismo, la liberación de glucosa al medio fue directamente proporcional a la biosíntesis de FOS. Este resultado permitió monitorear el proceso de biosíntesis de FOS de forma indirecta usando un método enzimático fácil, rápido y económico.
El paquete estadístico Minitab 16 fue utilizado para generar gráficas de superficie y contorno usando las variables que influyen en el proceso de transfructosilación como tiempo (h), temperatura (°C), enzima (μL) y extracto de algarrobo (°Bx) muestran los valores óptimos. Así, en la figura 2a se observa que el porcentaje más bajo de FOS (Z) se obtiene cuando la concentración de extracto de algarrobo (Y) es 20 °Bx y enzima (X) 30 μl y el más alto a intervalos de 30 a 40 °Bx y 15 a 20 µl. Paralelamente, se observa en la figura 2b que el porcentaje más alto de glucosa se obtiene en un intervalo de tiempo y temperatura de 10 a 15 h y 54 a 60 °C, respectivamente.
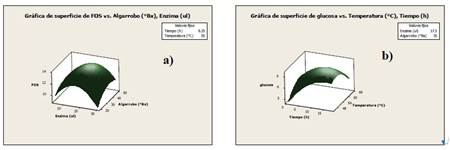
Figura 2 Gráficas de superficie de respuesta de los factores que afectan la producción de FOS a partir del extracto de algarrobo: a) porcentaje de FOS versus enzima y extracto de algarrobo; b) porcentaje de glucosa producida versus tiempo y temperatura.
La figura 3 muestra cómo el tiempo (T), la temperatura (TP), la concentración de enzima (CE) y el extracto de algarrobo (EA) afectan las reacciones de transfructosilación en la biosíntesis de FOS (Z). Las regiones más oscuras indican los valores con mayor producción de FOS, los niveles de contorno revelan un pico central en 12 h, 54 °C, 17.5 μl de enzima y 54 °Bx de extracto de algarrobo. En estas condiciones la producción de FOS (Z) fue ≥ 13 %.
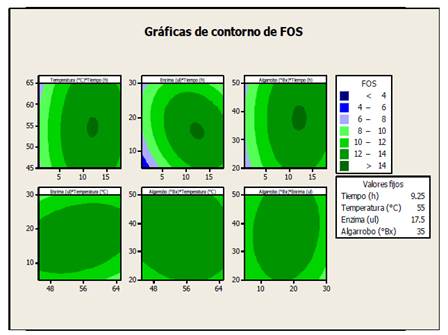
Figura 3 Gráficas de contornos del porcentaje de la producción de FOS versus tiempo, temperatura, enzima y extracto de algarrobo. a) temperatura y tiempo, b) enzima y tiempo, c) extracto y tiempo, d) enzima y temperatura, e) extracto y temperatura, f) extracto y enzima.
También se realizó la cuantificación de glucosa en el medio de reacción considerando la tabla matriz del diseño Box-Behnken, ya que la liberación de glucosa es concomitante tanto en las reacciones de hidrólisis como transfructosilación.
Tabla 4 Coeficiente de regresión de superficie de respuesta del porcentaje de glucosa vs tiempo y temperatura.
| EE del término | Coef. | Coef. | T | P |
|---|---|---|---|---|
| Constante | -812,627 | 102,620 | -7,919 | 0,000 |
| Tiempo (h) | 20,408 | 0,2284 | 8,935 | 0,000 |
| Temperatura (°C) | 22,975 | 0,3102 | 7,406 | 0,000 |
| Enzima (ul) | 0,3007 | 0,1631 | 1,844 | 0,073 |
| Algarrobo (°Bx) | 0,8144 | 0,1465 | 5,558 | 0,000 |
| Tiempo (h)*Tiempo (h) | -0,0286 | 0,0035 | -8,136 | 0,000 |
| Temperatura (°C)*Temperatura (°C) | -0,0207 | 0,0027 | -7,675 | 0,000 |
| Enzima (ul)*Enzima (ul) | -0,0018 | 0,0017 | -1,030 | 0,309 |
| Algarrobo (°Bx)*Algarrobo (°Bx) | -0,0098 | 0,0012 | -8,206 | 0,000 |
| Tiempo (h)*Temperatura (°C) | -0,0176 | 0,0036 | -4,957 | 0,000 |
| Tiempo (h)*Enzima (ul) | -0,0114 | 0,0028 | -4,023 | 0,000 |
| Tiempo (h)*Algarrobo (°Bx) | -0,0040 | 0,0024 | -1,696 | 0,098 |
| Temperatura (°C)*Enzima (ul) | 0,0023 | 0,0025 | 0,911 | 0,368 |
| Temperatura (°C)*Algarrobo (°Bx) | 0,0018 | 0,0021 | 0,874 | 0,378 |
| Enzima (ul)*Algarrobo (°Bx) | -0,0070 | 0,0017 | -4,213 | 0,000 |
| S = 0.879148 PRESS = 59.6796 | ||||
| R-cuad. = 89,44 % R-cuad.(pred.) = 79,08 % R-cuad.(ajustado) = 85,64 % |
El valor expresado por el coeficiente de determinación R² indicó que el 89,44 % de variabilidad en la respuesta se explica por el diseño propuesto.
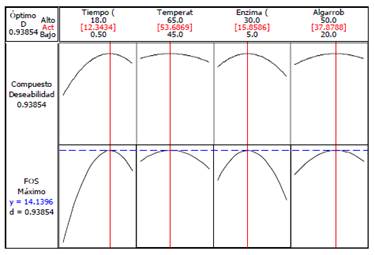
Optimización de la respuesta
De acuerdo al análisis de respuesta del porcentaje de FOS, se determinaron los parámetros de optimización que se presentan en la figura 5 con el fin de maximizar las reacciones de transfructosilación, así como obtener el mayor porcentaje de FOS en el extracto de algarrobo.
Validación del modelo para la producción de FOS
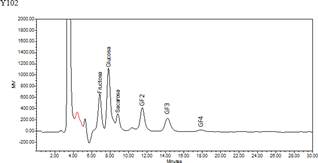
De acuerdo a los análisis y ajustes realizados se determinaron que las condiciones óptimas de producción de FOS a partir de azúcares simples son: 12 h; 54 °C; enzima 16 μl (31 mg) y extracto de algarrobo 38 °Bx, para un rendimiento teórico de 14 %, siendo el valor experimental 16,10 %. En estas condiciones se cuantificaron los carbohidratos presentes en el medio de reacción por HPLC (figura 4, tabla 5). En las muestras MP-EA0 (extracto de algarrobo crudo) y MP- EAD (extracto de algarrobo digerido) se obtuvieron 4,5 y 17,30 g de oligosacáridos totales, respectivamente, equivalentes a 16,10 g FOS por 100 g de extracto de algarrobo (tabla 5), siendo éste mayor a los reportados por Surín et al11 quienes obtuvieron 14,36 % de FOS (nistosa (GF3) 2,03 % y kestosa (GF2) 12,33 %) a partir del jarabe de Logan. En tanto, Muñoz6, utilizando jugo de caña y células permeabilizadas de Candida apícola, obtuvo FOS 4,5%.6,11.
Tabla 5 Determinación de carbohidratos en los extractos de algarrobo mediante HPLC.
| Muestra | Fructosa* | Glucosa* | Sacarosa* | Oligosacáridos (%) | |
|---|---|---|---|---|---|
| *(g/100g) | (%) | (%) | (%) | FOS* | Otros |
| MP-EAO | 8,00 | 7,40 | 18,10 | 0,00 | 4,50 |
| MP-EAD | 5,80 | 12,6 | 2,30 | 16,10 | 1,20 |
Leyenda: Donde: MP-EAO, Extracto de algarrobo inicial, MP-EAD; Extracto de algarrobo digerido.
En el cromatograma (figura 5) se muestran los tiempos de retención de FOS biosintetizado. Se observa la presencia de sc-FOS como kestosa (GF2), nistosa (GF3) y fructosilnistosa (GF4), con un mayor pico en GF2, lo cual sugiere la mayor concentración de este fructósido, similar a lo obtenido por Vega et al10 con sacarosa y Surin et al11 con el jarabe de Logan10,1.
La cuantificación de los diferentes polímeros de fructooligosacáridos producidos a partir del extracto de algarrobo por síntesis enzimática permitirá comparar mejor los resultados con los descritos por otros investigadores. Sin embargo, las condiciones óptimas de biosíntesis de FOS obtenidas en este estudio servirán para la prospección a nivel industrial y la valorización de un cultivo subutilizado para su uso como ingrediente alimentario saludable.
CONCLUSIONES
Las condiciones óptimas para la producción de FOS 16.1 % a partir del extracto de algarrobo 38 °Bx fueron Pectinex Ultra SP-L 31,6 mg a 54 °C y 12 h 20 min. De este modo, el extracto de algarrobo se convierte en un ingrediente alimentario saludable alternativo elaborado con tecnología limpia y sostenible.