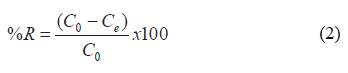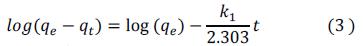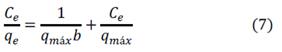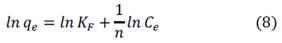INTRODUCCIÓN
Los colorantes sintéticos se usan ampliamente en todo el mundo en una amplia gama de productos de las industrias textiles, papeleras, alimentarias, cosméticas y farmacéuticas1, estos colorantes, son estables y no biodegradables y están diseñados para mantener el color en varios materiales y ser resistentes al agua, jabón y agentes oxidantes2. Las aguas residuales que contienen colorantes al ser descargadas en los recursos hídricos inhiben la penetración de la luz solar y disminuyen la acción fotosintética, así mismo estas aguas se caracterizan por poseer una alta demanda química de oxígeno (DQO), pH alto y toxicidad biológica3. La mayoría de los colorantes sintéticos son tóxicos y cancerígenos por lo que, si las aguas residuales que contienen estas sustancias no se tratan de manera efectiva, podrían ser responsables de daños ambientales graves y también representar una amenaza para la salud pública4. Los colorantes sintéticos se pueden clasificar como aniónicos, catiónicos y no iónicos. El azul de metileno (AM), clasificado en la categoría de colorante catiónico, es uno de los tintes ampliamente usados en la industria para teñir algodón, madera y seda5. El AM es tóxico, si se ingieren en grandes cantidades, produce efectos nocivos como gastritis, dolor de cabeza intenso, micción dolorosa y síndromes similares a la metahemoglobinemia, sudoración profusa, confusión mental y toxicidad respiratoria6. Por lo general, las aguas residuales coloreadas se tratan mediante procesos fisicoquímicos como ultrafiltración, coagulación, fotooxidación, pero estos tratamientos tienen limitaciones como: formación de subproductos tóxicos, para su funcionamiento requieren grandes cantidades de energía y no se adaptan a la amplia gama de tintes que existen en el mercado7, las desventajas de estos métodos han motivado a investigar métodos alternativos para la eliminación de colorantes, una de ellas es la adsorción, esta técnica se ha empleado ampliamente para la eliminación de colorantes donde se utiliza un adsorbente sólido para atraer la molécula de colorante y finalmente conducir a su eliminación del medio acuoso, el material más usado como adsorbente es el carbón activado, pero su uso es limitado debido a su alto costo y baja capacidad de regeneración, estas limitaciones llevaron a los investigadores a explorar la adsorción o biosorción usando materiales alternativos abundantes, disponibles y de bajo costo, como subproductos agrícolas (hojas, grano, semillas, raíz, etc.) hongos, plantas, algas y bacterias2. La tuna (Opuntia ficus indica) es una especie de naturaleza xerófila, de la familia de los cactáceas es nativa de México pero se naturalizó en toda la cuenca mediterránea y en las zonas templadas de América, África, Asia y Oceanía, que se encuentra en abundancia en la región sierra en Perú8. Los cladodios del cactus están constituidos principalmente por un heteropolisacárido con un peso molecular de 23104 a 3106 g/mol, el mucílago es una mezcla de polisacáridos ácidos y neutros que consisten principalmente en arabinosa; galactosa ácido galacturónico; ramnosa y xilosa, los grupos funcionales de estos compuestos podrían actuar con las moléculas de los colorantes removiéndolos de la solución matriz9. El objetivo del presente estudio fue evaluar la potencialidad de la biomasa de los cladodios de la tuna (BCT) para ser usado como biosorbente para remover el colorante azul de metileno de una solución acuosa, constituyéndose así como una alternativa eficiente para eliminar colorantes de las aguas residuales, para ello se caracterizó física y químicamente la BCT y se evaluó la influencia de la dosis de la biomasa en un volumen fijo de la solución con AM (g/L), pH y tiempo, sobre la capacidad de remoción del AM.
PARTE EXPERIMENTAL
Preparación del biosorbente
Los cladodios del cactus fueron recolectados en el distrito de Pilcomayo Región Junín, se eliminaron los residuos con abundante agua destilada, se retiraron las espinas y se cortaron en trozos pequeños y posteriormente se llevaron a secar al horno a 60ºC durante 72 horas, el material seco fue molido y tamizado a malla 70 µm, obteniéndose de esta manera la biomasa de los cladodios de la tuna (BCT).
Caracterización del biosorbente
Los grupos funcionales presentes en la superficie de biosorbente se identificaron por espectroscopia infrarroja con transformadas de Fourier (FTIR) en un Espectrofotómetro SHIMADZU FTIR- 8700 la muestra se analizó en un rango espectral de 4000 a 400 cm-1. La microscopía electrónica de barrido (SEM) modelo SU 8230Evo15, marca Hitachi, se utilizó para estudiar la morfología de la superficie del adsorbente. La determinación de los grupos ácidos se llevó a cabo siguiendo el método Boehm, descrito por Aygün et al.10 en el que se emplea una base fuerte, como el NaOH, para neutralizar los centros ácidos presentes en la superficie de la BCT, se pesó 0,25 de la BCT, se agregó 50 mL de NaOH 0,05 M (estandarizado con biftalato ácido de potasio) esta mezcla se agitó por 24 horas a una velocidad de 100 rpm, luego se tomó 20 mL de la solución remanente y se tituló con 0,05 M de HCl (estandarizado con la solución 0,05 M de KOH) usando como indicador azul de bromocresol. El punto final es indicado por el viraje de azul a verde de la solución, con el gasto obtenido (mL) se calculó los moles de grupos ácidos, los resultados se expresaron en mmolH+/g BCT. Para la determinación del pHPCC se procedió de acuerdo a lo reportado por Moghazy, et al.5 Para ello se prepararon soluciones con diferentes pH, mezclando en cada solución 50 mL de agua destilada con 0,1 g de BCT en un matraz erlenmeyer con tapa, el pH se varió con soluciones de NaOH 0,1 M y HCl 0,1 M, la mezcla se mantuvo en agitación constante (150 rpm) durante 15 min, trascurrido este tiempo se midió el pH final (pHf), todos los datos se obtuvieron por triplicado. Se graficaron los valores de ΔpH (ΔpH = pHo - pHf) versus pH inicial (pHo), el punto de carga cero (pHPCC) se obtuvo de la gráfica cuando ΔpH= 0.
Biosorción del azul de metileno
Se preparó una solución stock de AM de 500 mg/L a partir de ella se prepararon las diferentes concentraciones necesarias, la biosorción del AM se llevó a cabo en un sistema discontinuo, utilizando 50 mL de muestra de solución del colorante en matraces Erlenmeyer en un equipo de agitación múltiple marca Velp, a una velocidad 150 RPM y temperatura 20 °C, se realizó el estudio de la influencia de la dosis usando diferentes cantidades de BCT en un rango de 0,025 - 0,3 g. Para determinar el equilibrio cinético, se ensayó a diferentes intervalos de tiempo (5 -180 min). El equilibrio de biosorción se evaluó a diferentes concentraciones iniciales de AM (20-300 mg/L de AM). El estudio de la influencia del pH se realizó ajustando el pH a valores comprendidos entre 2,0 - 8,0 con soluciones de HCl y NaOH 0,1 M. Todos los experimentos se llevaron a cabo por duplicado y los resultados presentados son las medias correspondientes. En cada uno de los casos luego del experimento, las fases se separaron por filtración. Las concentraciones de colorante AM en las muestras se midieron mediante un espectrofotómetro UV (Beckman Du 64 UV/VIS) a una longitud de onda de 663 nm. La cantidad de AM retenido por el biosorbente (qe) y el porcentaje de biosorción se calcularon mediante las ecuaciones 01 y 02, respectivamente.
Donde: Co y Ce son la concentración inicial y final del AM en la solución (mg/L) antes y después de la biosorción respectivamente, M es la masa del BCT (g), y V es el volumen de la solución (L).
RESULTADOS Y DISCUSIÓN
Caracterización de la biomasa
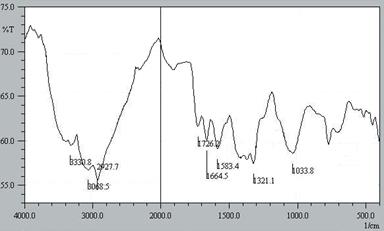
Para comprender cualquier posible interacción entre los grupos funcionales de la superficie de la BCT y el colorante MB, se estudió la BCT utilizando espectroscopía FTIR (figura 1)
El análisis espectroscópico evidenció una banda ancha en el rango espectral de 3600-3000 cm-1 que se le atribuye a las vibraciones de estiramiento del O-H y N-H, lo que indica la presencia del -OH en carboxilos y presencia de aminas2, otra banda a 2927cm-1 debido a la vibración asimétrica del enlace C-H de los grupos alifáticos, la banda a 1726 cm-1 se le atribuye a la deformación del -C=O, la banda a 1664,5 cm-1 es debido a las vibraciones del enlace C=C aromático11. La banda ancha a 1033 cm-1 se atribuye a la deformación simétrica de alquil éteres y C-O-C presentes en los polisacáridos12. Los picos a 1583,4 y 1321,1 cm-1 corresponden al estiramiento y deformación, respectivamente del enlace C-N presentes en aminas aromáticas13. La presencia de grupos hidroxilo OH, carbonilo C=O, éteres C-O-C en grupos aromáticos, aminas aromáticas, en la estructura lignocelulósica del biosorbente le confiere a la BCT capacidad para interactuar con el AM.
Se determinó la cantidad de grupos ácidos mediante el método Boehm, el cual demostró que la BCT posee una acidez total superficial de 7,34 mmolH+/g, que puede deberse a la presencia de los grupos funcionales reportados en el análisis del espectro FTIR (figura 1), los cuales podrían interactuar con el colorante catiónico AM.
La morfología de la superficie del biosorbente se caracterizó por SEM. Como se ve en la figura 2, el biosorbente exhibe una morfología de superficie heterogénea y porosa (figura 2A), tal forma estructural facilitaría el proceso de biosorción porque proporciona un área superficial. Por otro lado, después de la biosorción se observa una morfología superficial más homogénea y con menos presencia de cavidades. Esto se debería a la ocupación de la superficie biosorbente por las moléculas de colorante2.
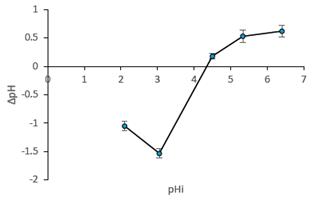
El pHPCC es el pH al cual la carga superficial neta en el biosorbente es cero, muestra la tendencia de la superficie biosorbente para cargarse positiva o negativamente dependiendo del pH, si el pH < pHPCC La superficie del biosorbente está cargada positivamente, favoreciéndose la biosorción de colorantes aniónicos, por otro lado, si el pH > pHPCC, la superficie biosorbente está cargada negativamente y esto favorece la biosorción de colorantes catiónicos14. La figura 3 muestra que el pHPCC de la BCT es 4,3. Por lo tanto a pH >4,3 la densidad de carga negativa en la superficie del biosorbente aumenta y, por lo tanto, se logra una mayor capacidad de biosorción debido a la creciente atracción electrostática entre las moléculas de colorante catiónico y los grupos funcionales del material biosorbente.
Influencia de la dosis del biosorbente
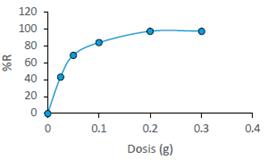
Los datos obtenidos de los experimentos con diferentes dosis de biosorbente en 50 mL de solución, se presentan en la figura 4. El aumento de la dosis de la BCT de 0,025 a 0,3g da como resultado un incremento en el rendimiento de la biosorción de 51 % a 98 %, respectivamente, este comportamiento podría deberse a un aumento en el número de posibles sitios de unión y área de superficie del biosorbente. Un aumento adicional en la concentración de biomasa sobre 0,2g/50 mL no condujo a una mejora significativa en el rendimiento de la biosorción, esto podría explicarse como consecuencia de una aglomeración parcial de biomasa, que resulta en una disminución en el área de superficie específica efectiva para la biosorción15. Se logró una máxima %R con una dosis de BCT con 0,2g/50 mL equivalente a 4g/L, motivo por lo cual esta dosis se fijó para todos los experimentos siguientes. Esta misma tendencia lo reportan Vijayaraghavan et al.7 quienes removieron AM usando una alga marina, donde alcanzaron una máxima %R con una dosis de 5g/L.
Influencia del tiempo de contacto y cinética de biosorción
Los resultados del estudio de la influencia del tiempo sobre la capacidad de biosorción, se muestran en la figura 5.
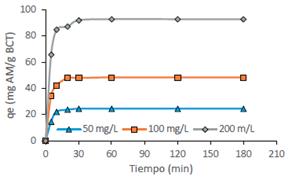
Figura 5 Efecto del tiempo de contacto sobre la biosorción de AM, masa BCT/ volumen = 4g/L, T = 20oC.
Se puede observar que para diferentes concentraciones iniciales la capacidad de biosorción aumentó rápidamente en los primeros 10 minutos y luego aumentó lentamente hasta alcanzar el equilibrio a los 120 minutos. La fase rápida inicial puede atribuirse a la existencia de una superficie descubierta de la BCT para el proceso de biosorción, posteriormente, a medida que los sitios de adsorción de la superficie se saturaron, la velocidad de biosorción disminuyó con el tiempo de contacto adicional. Por lo tanto, el tiempo de contacto óptimo se fijó en 120 minutos para el resto de los experimentos. Se observó que la cantidad de AM biosorbido aumentó con un aumento en la concentración inicial del colorante, esto puede explicarse en el supuesto que la fuerza impulsora para superar la resistencia a la transferencia de masa entre la fase sólida y líquida fue mayor en el caso de una mayor concentración de MB16. Varios investigadores informaron resultados similares de resultados para la adsorción de AM sobre residuos de eucalipto4, algas5, pepas de frutas y cáscaras de nuez10.
Estudio cinético
Con la finalidad de investigar el mecanismo del proceso de eliminación del colorante AM, los datos cinéticos de biosorción se modelaron utilizando los modelos cinéticos de difusión pseudo-primer orden, pseudo-segundo orden y de difusión intrapartícula, ecuación 3,4 y 6 14:
Donde, qt y qe es la cantidad de ion metálico retenido por unidad de masa de sorbente en un tiempo t y en el equilibrio, respectivamente (mg/g), k1 la constante cinética de primer orden (1/min), k2 (g/mg*min) es la constante de velocidad de adsorción y h es la tasa de adsorción inicial (mg/g min), kid es la constante de velocidad de difusión intraparticular (mg/g * min )½y B es una constante relacionada con el espesor de la capa límite del adsorbente (mg/g)
Los parámetros cinéticos de la ecuación de pseudo primer orden, pseudo segundo orden se calcularon luego de graficar Log (qe-qt) vs t (figura 6A), t/qt Vs t (figura 6B), y del segundo tramo lineal del gráfico qt vs t^0,5 (figura 6C), respectivamente. Los resultados se presentan en la tabla 1, como se observa, los valores del coeficiente de correlación (R2) del modelo de pseudo-segundo orden es igual a 0,999 para todos los valores de pH y las qe calculadas a partir del modelo de pseudo-segundo orden coinciden muy bien con los datos experimentales, en comparación con el modelo de primer orden. Por lo tanto, la cinética de biosorción está mejor representada por el modelo de pseudo-segundo orden y esta se basa en el supuesto de que el paso de control de la velocidad puede ser quimisorción que involucraría intercambio de electrones entre el AM y los grupos funcionales (principalmente grupos hidroxilo y carboxilo) de la BCT15, como se observa en la tabla 1, la tasa de adsorción inicial [h = k2(qe)2] aumentó con el incremento de la concentración inicial de colorante, lo que indica que la capacidad de biosorción y la tasa de biosorción fueron más altas en las etapas iniciales. Esto podría estar respaldado por el aumento de la fuerza impulsora para la transferencia de masa a concentraciones iniciales más altas que permite que más moléculas de colorante alcancen la superficie de la BCT en un tiempo más corto16. Los modelos cinéticos de pseudo primer orden y pseudo segundo orden no son suficientes para explicar el mecanismo de difusión, por lo tanto, los resultados cinéticos se analizaron adicionalmente mediante el modelo de difusión intrapartícula (figura 6C y 6D) según este modelo, si la regresión de qt versus la raíz cuadrada del tiempo (t1/2) es lineal, entonces la difusión intrapartícula está involucrada en el proceso de biosorción y si B es cero entonces la difusión intrapartícula es el único paso limitante de la velocidad. Como se muestra en la figura 6C, las gráficas no fueron lineales en todo el rango de tiempo, lo que revela que la difusión de poros no es el paso limitante de la velocidad y que tanto la adsorción superficial como la difusión intrapartícula existirían durante el proceso de biosorción17.
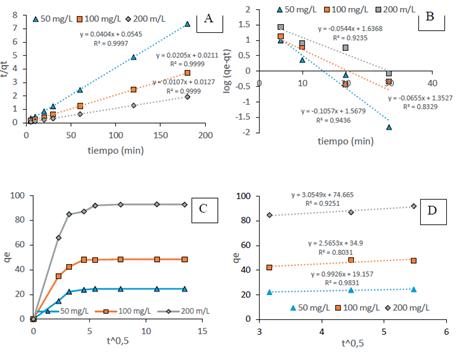
Figura 6 Cinética de biosorción del AM sobre la BCT A) pseudo primer orden B) pseudo segundo orden C) Difusión intrapartícula D) segunda porción lineal qe Vs t^0,5
Tabla 1 Parámetros cinéticos para la biosorción de AM sobre la BCT.
| Co mg/L | Pseudo primer orden | pseudo segundo orden | difusión intrapartícula | |||||||
|---|---|---|---|---|---|---|---|---|---|---|
| k1 | qe | R2 | qe | h | K2 | R2 | Kid | B | R2 | |
| 50 | 0,12 | 43,33 | 0,9235 | 24,75 | 18,35 | 0,03 | 0,9997 | 3,05 | 74,67 | 0,9251 |
| 100 | 0,15 | 22,53 | 0,8329 | 48,78 | 47,39 | 0,02 | 0,9999 | 2,57 | 34,90 | 0,8031 |
| 200 | 0,24 | 36,97 | 0,9436 | 93,46 | 78,74 | 0,01 | 0,9999 | 0,99 | 19,16 | 0,9831 |
Isotermas de adsorción
Una isoterma de adsorción describe la dependencia entre el contaminante adsorbido y el contaminante en fase acuosa en condiciones de equilibrio y temperatura constante17. La figura 5 muestra las isotermas de biosorción a diferentes valores de pH, la forma cóncava de las curvas de las isotermas indican la alta afinidad del adsorbato por el biosorbente, esta se asemeja a la isoterma del tipo L, según la clasificación de Giles et al.18 lo que sugiere una saturación progresiva del sólido sin alcanzar una capacidad límite, los datos experimentales fueron evaluados usando los modelos de isotermas de Langmuir y Freundlich, cuyas formas linealizadas se expresan en las ecuaciones 7 y 8, respectivamente5:
Donde: qe es la capacidad de biosorción en el equilibrio (mg/g); Ce es la concentración de equilibrio del AM en la fase líquida (mg/L),qmax y b son las constante de Langmuir, relacionadas con la máxima capacidad de biosorción para una monocapa completa (mg/g) y la afinidad entre el sorbente y el sorbato (L/mg), respectivamente, KF es la constante de equilibrio (L/g) y n es una constante relacionada con la afinidad entre el sorbente y el sorbato.
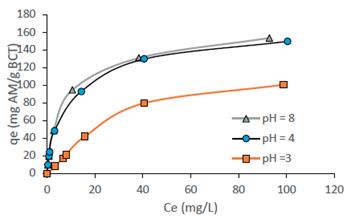
Figura 7 Isotermas del equilibrio de la biosorción de AM sobre la BCT, masa BCT/ volumen = 4g/L, T=20oC, t = 1 h.
Las constantes de Langmuir (qmax y b) y Freundlich (KF y n) se calcularon a partir de la pendiente y la intersección de los gráficos lineales Ce/qe versus Ce (figura 8A) y log qe versus log Ce (figura 8B). Los parámetros de los modelos y los coeficientes de correlación se presentan en la tabla 2. En el caso del modelo de isoterma de Langmuir, se observó una muy buena correlación con los datos de biosorción basados en los coeficientes R2, los cuales son mayores a 0,96. La isoterma de Langmuir se basa en la suposición de que los sitios activos del biosorbente son homogéneos, este resultado sugiere la cobertura en monocapa de las moléculas del AM en la superficie de la BCT. El valor 1/n (0 < 1/n <1) obtenido de la isoterma de Freundlich indica una buena capacidad de absorción del AM sobre la BCT, el factor de separación RL se calculó para las tres isotermas y todos los valores se obtuvieron entre 0,11; 0,02; 0,01 lo que indica una biosorción favorable del AM sobre la BCT. Las capacidades máximas de biosorción suponiendo una biosorción en monocapa son 156,25; 158,73 y 156, 25 mg/g a pH 3, 4 y 8, respectivamente.
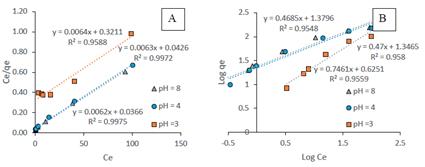
Figura 8 Estudio del equilibrio de la biosorción del AM A) Isoterma de Langmuir B) Isoterma de Freundlich
Tabla 2 Parámetros cinéticos para la biosorción de AM sobre la BCT.
| Langmuir | Freundlich | ||||||
|---|---|---|---|---|---|---|---|
| pH | qmax (mg/g) | b (L/mg) | RL | R2 | 1/n | KF (L/g) | R2 |
| 3 | 156,25 | 0,02 | 0,11 | 0,9588 | 0,75 | 4,22 | 0,9559 |
| 4 | 158,73 | 0,15 | 0,02 | 0,9972 | 0,47 | 22,21 | 0,9580 |
| 8 | 156,25 | 0,26 | 0,01 | 0,9931 | 0,29 | 38,84 | 0,6791 |
En comparación con otros estudios de biosorción del colorante AM reportados en la literatura (tabla 3), los altos valores de qmax demuestran que el material biosorbente BCT tiene un gran potencial para la eliminación del AM del medio acuoso.
Tabla 3 Comparación de biosorción de AM con otros materiales biosorbentes.
| Material biosorbente | qmax (mg/L) | Referencia |
|---|---|---|
| Residuos de poda del árbol de olivo | 129,87 | Anastopoulus et al. 19 |
| Madera de papaya | 32,25 | Rangabhashiyam et al. 20 |
| Conchas de almejas | 1,09 | Elwakeel et al. 15 |
| Residuos de pino | 129,87 | Yagub et al. 21 |
| Alga gracilaria corticata | 95,41 | Vijayaraghavan et al.7 |
| Cladodios de tuna (Opuntia ficus indica) | 158,73 | Este estudio |
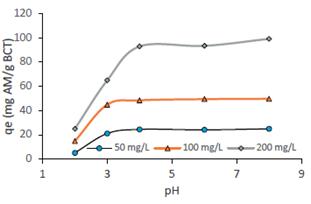
Influencia del pH
La eficiencia de la biosorción depende del pH de la solución, debido a que un cambio en el pH conduce a la variación en el grado de ionización de la molécula adsorbida y las propiedades superficiales del adsorbente. La figura 9 muestra el efecto del pH de la solución inicial sobre la capacidad de biosorción del colorante AM (qe) se observa que la cantidad adsorbida aumenta con el incremento del pH, se encontró que la cantidad de colorante adsorbido aumentó de 24,87 mg/g a 99,16 mg/g debido al cambio en el pH de 2,0 a 8 para una concentración de colorante inicial de 200 mg/L, el mismo comportamiento muestran las curvas a concentraciones iniciales menores (50 y 100 mg/L). Es evidente que se logró mayores capacidades de remoción a un valor de pH 8. El valor del punto de carga cero (pHPCC) puede proporcionar información sobre la carga superficial del biosorbente (figura 3), cuando el pH > pHPCC, la superficie de la BCT se carga negativamente por lo que podría adsorber eficazmente el colorante catiónico AM por atracción electrostática traduciéndose en el incremento de la capacidad de biosorción15, contrariamente a pH<pHpcc, la superficie da la BCT se carga positivamente disminuyendo la capacidad de biosorción por repulsión electrostática2, por otro lado, la alta capacidad de eliminación del AM a pH alto también se debería a la presencia de menos H+ que compiten por los sitios de sorción en la biomasa. El pH bajo conduce a un aumento en la concentración de iones H+ en el sistema, y la superficie de la BCT adquiere carga positiva por protonación de grupos carboxilicos y amino de la superficie lo que conlleva a la disminución de la capacidad de adsorción del colorante catiónico AM17.
Desorción
Para estudiar el potencial de reutilización del biosorbente se hicieron intentos para desorber el AM biosorbido en la BCT, para ello se empleó una solución de HCl 0,01 M como agente de desorción, con un tiempo de contacto de 120 min. El rendimiento fue de 80,2 %. Bajo condiciones ácidas fuertes, aumenta el número de sitios con carga positiva. Estos sitios con carga positiva en la superficie biosorbente favorecerían la desorción de los cationes del AM debido a la repulsión electrostática7.
CONCLUSIONES
Se investigó la remoción del AM de una solución acuosa uso la biomasa de los cladodios de la tuna (BCT) como material biosorbente. La concentración del biosorbente, el pH inicial de la solución, el tiempo de contacto jugaron un papel importante sobre la remoción del AM. Los resultados revelaron que el modelo cinético de pseudo-segundo orden se ajusta muy bien a la cinética de biosorción del AM sobre la BCT. Los datos de equilibrio de biosorción del AM coincidieron bien con el modelo de isoterma de Langmuir con una capacidad de adsorción de monocapa de 156,25 mg/g. El mecanismo de la biosorción se daría por un proceso de quimisorción e implicaría la adsorción sobre la superficie de la BCT y la difusión intrapartícula en los poros de la biomasa. Debido a que los cladodios de la tuna son un recurso natural, abundante, renovable, simple y ambientalmente amigable tiene un gran potencial para ser usado como biosorbente efectivo para la eliminación del colorante azul de metileno de los efluentes de aguas residuales.