INTRODUCCIÓN
Actualmente las algas marinas constituyen un sector importante de la economía mundial, esto se debe a las múltiples aplicaciones que tienen, entre ellas su uso en la industria alimentaria y biotecnológica. Estas, son fuente principal de ficocoloides, siendo los más representativos el agar-agar, fucanos, carragenano y alginato1.
Las algas pardas se caracterizan por encontrarse en mares templados o subpolares, predominando estas en la zona intermareal, caracterizadas por el tamaño de sus tallos y conformando así extensos bosques marinos, en donde la macroalgaMacrocystis pyriferaes una de las especies más abundante del litoral peruano y a nivel mundial2.
Asimismo, esta especie es uno de los insumos de mayor demanda en países tales como EE.UU., Japón, China, Francia y Noruega para la producción de alginato de sodio3.
El alginato es un polisacárido el cual es obtenido a partir de las macroalgas pardas y está principalmente compuesto por los ácidos β-D-manurónico (M) y α-L-gulurónico (G) figura 1, los cuales se encuentran distribuidos de manera aleatoria en la estructura de la cadena polimérica. Además, el alginato puede presentar secuencias de monómeros de los residuos M y G, así como su alternancia de los mismos obteniendo de esta manera bloques M y bloques G (homopoliméricos), y bloques MG (heteropolimérico)4.
La relación del porcentaje de la distribución de los bloques M y G depende de la especie de la cual se obtiene el alginato. Asimismo, parámetros como la localización geográfica, hábitat, y especie determinan la distribución de estos grupos teniendo efecto en las propiedades fisicoquímicas de acuerdo a la relación M/G del alginato obtenido5.
Por otro lado, las etapas para llevar a cabo la extracción del alginato influyen en el tipo de alginato obtenido, teniendo un efecto en el tamaño molecular, variación en el contenido de los ácidos urónicos, contenido de iones metálicos, y la presencia de polifenoles6.
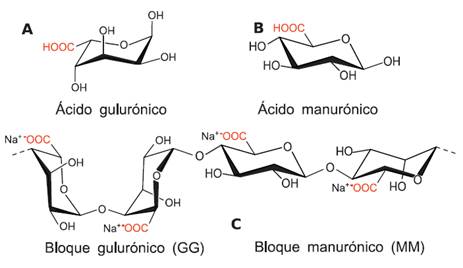
Figura 1 (A) Ácido gulurónico. (B) Ácido manurónico. (C) Composición del alginato con bloques GG y Bloques MM4.
En consecuencia, estas propiedades podrían definir el uso versátil de este polisacárido en distintos campos, así como sus derivados, presentando actividad biológica, biodegradabilidad y biocompatibilidad en sistemas vivos, en su actividad como agente anti-incrustante, intercambiador iónico (para un M/G<1), entre otros, fines de aplicación industrial4,7.
Es de este modo que, a lo largo de los últimos años, se han propuesto distintas metodologías para la extracción y purificación del alginato, mediante la obtención de ácido algínico8, a partir de la formación de geles mediante CaCl 9, implementación de un pre-tratamiento5, entre otros, las cuales en su mayoría se enfocan en optimizar el rendimiento de la extracción.
En el presente trabajo, se ha propuesto un proceso de extracción del alginato a partir del método alcalino y la formación de geles haciendo uso de CaCl2, teniendo como principal objetivo la caracterización del biopolímero mediante técnicas de IR-TF y su segunda derivada, y mediante 13C RMN en estado sólido para evaluar el contenido de los bloques M y G presentes en el alginato, lo cual nos permitirá estimar si la relación M/G es menor o mayor a 1.
PARTE EXPERIMENTAL
MATERIALES
El alginato de sodio (AlgC) fue adquirido de Sigma Aldrich Chemistry (St. Louis, MO, USA), Los solventes utilizados fueron de grado analítico adquiridos de MERCK (Darmstadt, Germany); La Macrocystis pyrifera fue colectada entre 5-10 m de profundidad a 16°C en la La Punta-Callao. Una vez llevado a cabo esto, se lavaron y almacenaron a -20°C. Las hojas que han sido usadas como materia prima para la producción de alginato fueron cortadas en trozos pequeños y secados en una estufa a 70°C por 3 h. Finalmente, esta fue molida a un tamaño menor a 1mm.
EXTRACCIÓN DEL ALGINATO
Se tomaron 50 g de alga pulverizada y se procedió a colocarla en una solución de n-hexano en relación (1:3) por 2 horas. Luego los trozos desengrasados (por el tratamiento con n-hexano) se colocaron en una mezcla etanol/formaldehido (4:1) dejando reposar por 72 h. El producto obtenido fue tratado con carbonato de sodio al 3 % a 90°C por 4h (proceso de extracción alcalino)10. Finalmente se dializó y liofilizó la fase líquida obtenida del proceso de extracción.
Asimismo, la purificación fue llevada a cabo mediante el uso de CaCl2 (formación de geles). A partir del producto obtenido se realizó un intercambio de la forma sal/ácida del alginato, variando el pH alcalino/ácido. Finalmente, el producto obtenido fue dializado y liofilizado, obteniendo un sólido blanco, AlgM6,8,11.
ESPECTROSCOPIA INFRARROJA CON TRANSFORMADA DE FOURIER (IR-TF)
El espectro infrarrojo fue obtenido usando un FT-IR IRPrestigy-21 mediante el método de reflactancia total atenuada (ATR). Los espectros fueron medidos (64 scans/muestra) en el rango de 4000-700 cm-1, con una resolución de 4,0 cm-1. La derivatización incluyó el algoritmo de Savitzky-Golay con 23 puntos de suavizado y todos los espectros fueron analizados con el software OriginLab 9.0.
13 C RMN EN ESTADO SÓLIDO
El análisis de RMN 13C en estado sólido fue llevado a cabo usando un equipo Bruker Advance III-400, operando a 9,4 T de campo magnético, ν (1 H) = 400 MHz. La 13C frecuencia de resonancia fue de 100.57 MHz con un pulso de secuencia (polarización cruzada con un ángulo mágico de spin, CP-MAS) y con una supresión total de banda (CP-MAS-TOSS). El alto poder de desacoplamiento del campo fue de 83.3KHz [P90 (1H) =3 µs] y se usó “adamantano” como patrón de referencia externo para ajustar el desplazamiento del 13C.
RESULTADOS Y DISCUSIÓN
EXTRACCIÓN DEL ALGINATO
El proceso de extracción fue propuesto a partir de los trabajos de Matsuhiro et al.12. y Hernández-Carmona et al.10 el cual consistió en 3 etapas; i. Pre-tratamiento, ii. Extracción alcalina y iii. Purificación.
El primer paso fue someter el alga pulverizada a un pre-tratamiento, que consistió en un desengrasado a partir del uso de n-hexano, seguido de una eliminación de metabolitos (taninos, polifenoles, etc.) mediante un tratamiento con la mezcla etanol/formaldehido en relación de 4/1. A partir de la muestra obtenida, se procedió a llevar a cabo la extracción en medio alcalino (carbonato de sodio al 3 %) el cual permitió extraer los polisacáridos presentes en la pared celular del alga, manteniendo una temperatura de 90°C por 4 horas, obteniéndose finalmente así un extracto impuro (figura 2) del cual se aislaron 2 fases mediante centrifugación por 30 min y finalmente el líquido obtenido, fue liofilizado para su pronta purificación.
De la purificación se obtuvo el ácido algínico, después de remover las impurezas presentes, ya que no solamente podríamos a ver aislado alginato de sodio el cual es el biopolímero en interés sino también, hemicelulosa, fucanos, carbohidratos, entre otros13. Es de este modo que se implementó dentro del proceso de purificación, la formación de geles con Ca+2 (para la selectividad del alginato) y procesos de diálisis y centrifugación para la mayor purificación del alginato14. Obteniendo, de este modo, un material blanquecino, como podemos observar en la figura 3.

Figura 2 Extracción de alginato. (A) Materia prima, alga. (b) Tratamiento alcalino. (C) Comparación antes y después del alginato extraído y su purificación. (D) Intercambio de kps, en el proceso de purificación.
El rendimiento obtenido del proceso de extracción propuesto del alga fue del 12 % para la Macrocystis pyrifera. El protocolo propuesto permitió obtener un alginato de coloración blanquecina, lo que indicaría que en el proceso se pudo eliminar gran contenido de polifenoles, presentes en el alga parda de partida. A pesar de esto, el rendimiento no fue tan alto a comparación de las obtenidas para otras algas ya reportadas15,16. Esto, posiblemente es debido, al ambiente natural, estación de la cosecha3, entre otros factores que involucran al entorno del crecimiento del alga. Asimismo, otro factor que influiría en el rendimiento, serían los pasos tomados en cada etapa del proceso de extracción, ya que cada tratamiento es determinante y no solo involucra la extracción del alginato, sino también la influencia en la degradación del mismo, debido al tratamiento de hidrólisis (ácida o básica)17 que ocurre a lo largo de la cadena del biopolímero, disminuyendo así su masa molecular modificando las propiedades que podría presentar, influenciadas estas por la secuencia de los bloques M y G y su proporción M/G presente en la cadena polimérica.
ESPECTROSCOPIA INFRARROJA CON TRANSFORMADA DE FOURIER (IR-TF)
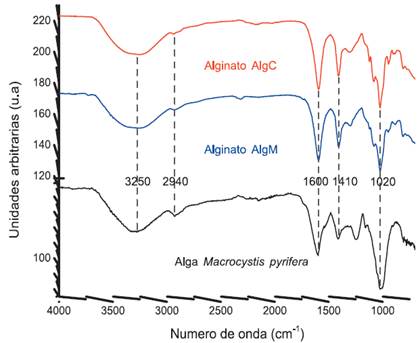
En la figura 4 presentamos los espectros del alga de partida (Macrocystis pyrifera), el alginato extraído (AlgM) y el alginato comercial de Sigma Aldrich (AlgC), de este modo podemos asignar los grupos funcionales acorde a las vibraciones que presenta la figura 4. En este caso las señales características del alginato más representativas son:
La señal alrededor de 3250 cm-1 y 2940 cm-1 correspondientes a la vibración de estiramiento del grupo funcional O-H y C-H, respectivamente, ambos presentes a lo largo de la cadena del alginato. Además, alrededor de 1600 cm-1 y 1410 cm-1 se observa la vibración antisimétrica y simétrica respectivamente, del grupo carboxilato. Entre 1300 a 1000 cm-1 podemos asociar las señales características de las vibraciones de estiramiento de C-C-H, O-C-H, C-O-C, entre otros, asociados al entorno de la piranosa, siendo la más representativa la banda 1020 cm-1 asociada a la vibración de estiramiento C-O-C de la piranosa7.
Por otro lado, en el caso del espectro de la macroalga Macrocystis pyrifera, presentamos a 1540 cm-1 una banda atribuida a la vibración de estiramiento de grupo amida (N-H), esto debido a la presencia de proteínas. Asimismo, a 1750 cm-1 asignamos la señal del grupo C=O el cual caracteriza a la presencia de lípidos. Finalmente, a 1250 cm-1 encontramos una banda que representa a la vibración de estiramiento del grupo S=O, característico a la presencia de otros polisacáridos presentes en el alga18.
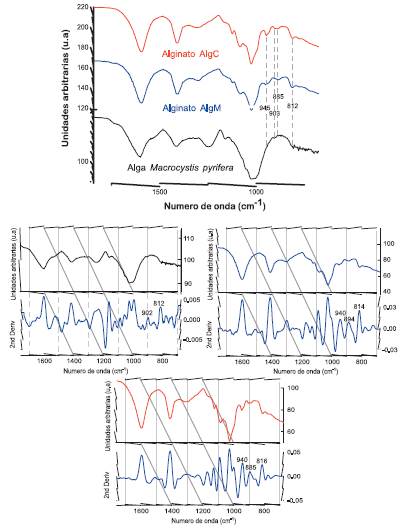
En el entorno de la huella dactilar podríamos atribuir bandas asociadas a los bloques homopoliméricos tanto de GG y MM. Evaluando las señales entre 1200 a 750 cm-1 (figura 5) observamos bandas características a 945 cm-1, la cual es asignada a las vibraciones C-O, con contribución de C-C-O debido a la deformación vibracional de los residuos de los ácidos urónicos presentes en ambos alginatos. Las bandas a 903 y 885 cm-1 son asignadas a las vibraciones de deformación de C1-H α-L-gulurónico y C1-H del β-D-manurónico. Asimismo, a 812 cm-1 ambos alginatos presentan esta banda característica de deformación de la piranosa de los bloques α-L-gulurónico7,14.
Por otro lado, para evaluar significativamente las diferencias que existen en estos espectros se procedió a realizar la 2da derivada (figura 5) para visualizar aquellas señales que no son fácilmente observables en el espectro común, tales como las interacciones para cada bloque MM y GG. Es así que tenemos para AlgM la banda a 894 cm-1 la cual es característica a la vibración de la región anomérica C1-H α-L-gulurónico a diferencia de AlgC el cual presenta una banda a 885 cm-1 característico a la vibración de la región anomérica C -H del β-D-manurónico7,11.
Ambos alginatos presentaron señales a 940 cm-1, lo cual fue asignado a la vibración de estiramiento C-O. Finalmente, en el caso del espectro de la macroalga, podemos observar las señales a 902 cm-1 y a 812 cm-1 característicos a la deformación de la piranosa de los bloques α-L-gulurónico pudiendo interpretar la presencia de los bloques GG antes de llevar a cabo el proceso de extracción del alginato.
Por lo tanto, de los resultados obtenidos, tenemos que el AlgM y AlgC presentan diferencias respecto a la relación del contenido de bloques M y G ya que se han observado diferencias en las bandas que corresponden C1-H α-L-gulurónico y C1-H del β-D-manurónico presentes en la cadena polimérica, los cuales serán mejor diferenciados mediante el ensayo de Resonancia Magnética Nuclear.
RESONANCIA MAGNÉTICA NUCLEAR EN ESTADO SÓLIDO
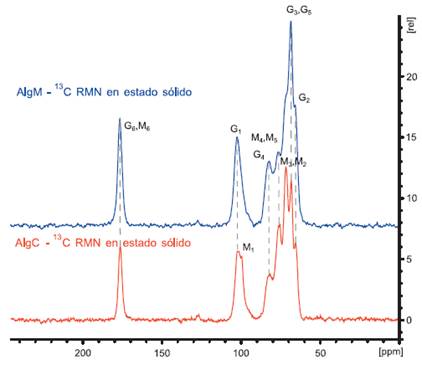
La figura 6 muestra el espectro de RMN 13C en estado sólido del AlgM y AlgC
En la tabla 1 se muestran los desplazamientos químicos obtenido a partir del RMN 13C en estado sólido de la figura 6.
Los grupos carboxilatos (160 - 180 ppm)
Puente glicosídico (90 - 110 ppm)
Entorno de la piranosa (50 - 80 ppm)
Tabla 1 Asignación de los espectros RMN 13C en estado sólido de la figura 6 tomando en consideración la estructura del alginato mostrado en la figura 7.
| Ambiente Químico | Carbonilo | Anomérico | Piranosa | ||||||
| Carbones de los grupos manurónicos (M) y gulurónicos (G) | G6 | M6 | G1 | M1 | G4 | M4 M5 | M3 M2 | G3 G5 | G2 |
| D. Químico AlgC (ppm) | 176,4 | 101,8 | 99,4 | 82,1 | 75,7 | 71,7 | 68,3 | 65,5 | |
| D. Químico AlgM (ppm) | 176,1 | 102,4 | --- | 81,6 | 75,6 | 71,6 | 68,2 | 65,4 | |
| Desplazamiento Químico (ppm)19 | 176,3 | 102,2 | 99,5 | 82,8 | 76,4 | 71,6 | 68,4 | 65,5 | |
Evaluando las diferencias entre AlgM y AlgC, obtenido de la tabla 1 y de la figura 7, tenemos que la presencia de los carbones G son más representativos en AlgM que en AlgC. Como se ha mencionado anteriormente, el entorno entre 110 - 90 ppm evalúa los carbones presentes en el puente glicosídico el cual determina la interacción y la formación de los bloques presentes. A 102,4 ppm tenemos al carbono anomérico C1-H α-L-gulurónico que se observa en el AlgM desplazándose esta señal a un campo más bajo que el que presenta AlgC a 101,8 ppm. En el espectro de este último también se observa la señal del carbono anomérico C1-H del β-D-manurónico a 99,8 ppm indicando así la presencia característica de los bloques M, lo que no se observa en el AlgM.
Asimismo, evaluando el entorno de la piranosa presentamos señales de los carbones G3-G5 los cuales son más intensos que las señales de M3 y M2 para el AlgM, soportando así la propuesta que este alginato presenta un mayor % de grupos G. A diferencia de esto tenemos que en AlgC, se presenta señales más intensas alrededor de M3 y M2 y el pico que caracteriza a G3-G5 la señal es casi indiferenciable.
Por ende, a partir de estos análisis podemos interpretar que la relación M/G para el AlgM es <1 y para el AlgC >1. De la misma manera, nos permite proponer que para el AlgM existe un mayor porcentaje de bloques G a diferencia del AlgC. A partir de estos resultados, con el AlgM se podría obtener materiales que se beneficien a partir de la propiedad de reticulación iónica a diferencia de AlgC, debido a la mayor presencia de bloques GG en la estructura del alginato de AlgM. A pesar de ello, la presencia de bloques M a diferencia de los bloques G, son menos reactivos y por tanto son más estables frente a procesos de modificación y degradación7,20.
CONCLUSIONES
Se logró extraer alginato sodio, el cual presentó un rendimiento del 12 %. Para el alginato obtenido de la macroalga (AlgM) se logró demostrar la presencia de carbones y grupos que asocian a la región anomérica del C1-H α-L-gulurónico. Asimismo, el espectro del alga, mostró bandas a 902 cm-1 y a 812 cm-1 característicos de los bloques G lo que indicaría que esta macroalga es rica en grupos gulurónicos a diferencia del alginato comercial (AlgC). Finalmente, mediante los resultados obtenidos se interpretaría que la relación M/G para AlgM seria <1 y para AlgC >1.
Es así que ambas técnicas (IR-TF y RMN en estado sólido) nos permiten diferenciar la presencia de bloques M y G, así como poder interpretar antes de llevar a cabo la extracción de alginato, la presencia de bloques gulurónicos en la macroalga.