INTRODUCCIÓN
La tuberculosis es una enfermedad causada por Mycobacterium tuberculosis, altamente contagiosa y trasmitida de persona a persona por vía aérea a través de gotas expelidas desde la garganta y pulmones de personas con tuberculosis activas1. Un creciente número de personas contraen tuberculosis, afectando cada año a 10 millones de personas y matando a 1,5 millones de ellas. El curso de la enfermedad se ve comprometido, en pacientes con sistemas inmunes comprometidos, ya sea por fármacos inmunosupresores, sustancias en abuso, o SIDA/VIH, afectando especialmente a poblaciones en África y en países asiáticos como China, India o Indonesia2. Por lo tanto, la tuberculosis es una de las principales causas actuales de muerte en el mundo.
Otro problema crítico asociado a la tuberculosis ha sido la resistencia a los fármacos, limitando la capacidad del control de la enfermedad, generando la aparición de tuberculosis multidrogo-resistente (TB-MDR) y tuberculosis extremadamente drogo-resistente (TB- XDR)3.
La pirazinamida (PZA) actúa como bactericida matando los bacilos tuberculosos semi- latentes a un pH ácido que no son destruidos por otras drogas antituberculosas. Se usa en esquemas de tratamiento de primera y segunda línea, y en paticular en combinación con isoniazida, etambutol y rifampicina en diferentes formas de dosificación4. La aparición de cepas resistentes a PZA representa un problema importante en la salud pública a nivel mundial. Por tal razón, se tiene la necesidad de identificar nuevos agentes terapéuticos que permitan superar las limitaciones actuales de los esquemas de tratamiento frente a los casos de tuberculosis drogo-resistente.
Se han reportado numerosas investigaciones de complejos metálicos con diferentes fármacos utilizando como ion metálico a Cu(II), Zn(II), Fe(II), Co(II), Ni(II), Cd(II), resultando un aumento de la actividad biológica/antimicobiana y disminución en el desarrollo de la resistencia antibiótica4,5. Por tal motivo los compuestos antituberculosos obtenidos a partir de la coordinación de un ligando con iones metálicos son potencialmente una mejora en la estrategia para el tratamiento de esta enfermedad.
Este trabajo ha planteado la síntesis de dos derivados de PZA que incluyen un centro metálico de cobalto (II), con la finalidad de obtener compuestos anti-tuberculosis con el potencial de actuar sobre cepas resistentes a PZA así como de reducir la generación de resistencia antibiótica. La caracterización de los complejos sintetizados es de fundamental importancia ya que no solo permiten el descubrimiento de la estructura molecular, sino también podrían favorecer el futuro descubrimiento de un mecanismo de acción probable.
Los complejos de cobalto exhiben un resultado prometedor inhibiendo el crecimiento de la bacteria en comparación con el fármaco libre (PZA) posiblemente debido a la presencia de los iones metálicos que alteran la estructura del fármaco mejorando aún más el rendimiento de su transporte, lo que es importante para aumentar la capacidad antituberculosa.
PARTE EXPERIMENTAL
Síntesis del complejo [Co(PZA)2Cl2]
Se disolvió 1,10 g (4,62 mmol) de cloruro de cobalto (II) hexahidratado (J.T. Baker) en 100mL de metanol (Merck) en un balón de reacción. Posteriormente se agregó al mismo balón el ligando pirazinamida (Merck) 1,14 g (9,26 mmol), previamente disuelto en 100 mL de metanol. La síntesis se llevó a cabo en reflujo por aproximadamente dos horas en constante agitación, transcurrido el tiempo de reacción se filtró y se lavó el precipitado formado con metanol caliente.
Síntesis del complejo [Co(PZA)2(NO3)2].H2O
Se disolvió 1,51 g (519 mmol) de nitrato de cobalto (II) hexahidratado (Merck) en 150 mL de metanol (Merck) en un balón de reacción. Posteriormente, se agregó al mismo balón el ligando pirazinamida (Merck) 1,28 g (10,40 mmol), previamente disuelto en 100 mL de metanol. La síntesis se llevó a cabo en reflujo por aproximadamente dos horas en constante agitación, transcurrido el tiempo de reacción se filtró y se lavó el precipitado formado con metanol caliente.
Técnicas de caracterización de los complejos
Análisis elemental de C, H y N
Se determinó el porcentaje de carbono, hidrógeno y nitrógeno en cada complejo con el analizador Perkin-Elmer 2400 Series II de la Central Analítica del Instituto de Química de la Universidad de Sao Paulo.
Espectroscopía de absorción atómica de cobalto
Se determinó el contenido de cobalto en cada complejo con el espectrofotómetro de absorción atómica Shimadzu AA-7000 de la Universidad Nacional de Ingeniería, utilizando una lámpara de cátodo hueco de cobalto a 240,7 nm. La curva de calibración se preparó en concentraciones de 0,4, 1,0 y 2,0 ppm de cobalto en ácido nítrico (Merck) 0,5 M y los complejos fueron disueltos en ácido nítrico 0,5 M para obtener una concentración aproximada de 1 ppm de cobalto.
Determinación de cloruros en el complejo [Co(PZA)2Cl2]
Se determinó el contenido de cloruros en el complejo por volumetría con el método argentométrico. Para ello, se preparó la muestra con 0,0455 g de complejo en un volumen final de 50 mL y se valoró la muestra por duplicado con nitrato de plata (Merck) 0,0481 N utilizando dicromato de potasio (Merck) como indicador.
Análisis termogravimétrico
Se realizó el análisis termogravimétrico de los complejos con el analizador TA Instruments TGA Q500 de la Central Analítica del Instituto de Química de la Universidad de Sao Paulo, la temperatura máxima de alcance fue de 950 °C.
Susceptibilidad magnética
La determinación del momento magnético se realizó mediante la medición de las masas de los complejos en una balanza SHIMADZU AW120 del Laboratorio LAQISE-BIMET del Instituto de Química de la Universidad de Sao Paulo con la aplicación de un campo magnético mediante un dispositivo elaborado en el mismo laboratorio. Este análisis se realizó midiendo por cuadruplicado la masa de los complejos antes y después de la aplicación de un campo magnético. Para la verificación de las mediciones se utilizó un patrón de tetra(tiocianato) cobaltato (II) de mercurio, Hg[Co(SCN)4] que presenta un valor de χ= 16,44 x 10-6 unidades CGS/Gauss a 20 °C midiendo su masa de la misma manera que los complejos.
Espectroscopía UV-Visible
Los espectros UV-Visible de los complejos y el ligando se obtuvieron con el espectrofotómetro Shimadzu UV-1800 de la Universidad Nacional de Ingeniería, en el rango de 200 a 900 nm. Para la medición en el rango visible se prepararon soluciones de los complejos de 0,002 M en metanol (Merck). Mientras que, para la medición en el rango ultravioleta, las concentraciones fueron de 0,001M, aproximadamente.
Espectroscopía infrarroja FTIR
Los espectros de infrarrojo de los complejos y el ligando fueron obtenidos por lectura directa con el espectrofotómetro Perkin-Elmer de la Universidad Nacional de Ingeniería, con reflectancia total atenuada (ATR) desde 400 a 4000 cm-1.
Espectroscopía Raman
Se obtuvieron los espectros de los complejos y el ligando con el espectrofotómetro Raman Horiba One Xplora de la Universidad Nacional de Ingeniería, utilizando un láser de 785 nm con una potencia de 50 mW desde 200 a 1800 cm-1.
Determinación de la concentración mínima inhibitoria (MIC)
La concentración mínima inhibitoria fue estimada cultivando tres cepas de M. tuberculosis (H37Rv, DM97 y D49N) en caldos de cultivo 7H9 enriquecidos con OADC (albumina oleica dextrosa catalasa) a pH 6 y 7 con diferentes concentraciones de pirazinamida y complejos6. La cepa H37Rv es una cepa de referencia sensible a pirazinamida; las cepas DM97 y D49N son cepas aisladas de muestras de pacientes resistentes a pirazinamida.
RESULTADOS Y DISCUSIÓN
Síntesis de los complejos [Co(PZA)2Cl2] y [Co(PZA)2(NO3)2].H2O
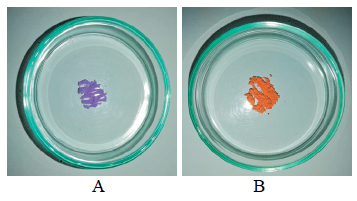
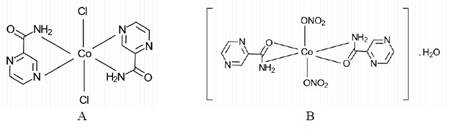
De la síntesis de los complejos [Co(PZA)2Cl2] y [Co(PZA)2(NO3)2].H2O se obtuvieron dos sólidos no cristalinos de color lila (figura 1A) y color anaranjado (figura 1B), respectivamente.
Los rendimientos de las reacciones fueron de 89 % y 55 %, respectivamente. Además, se determinó que ambos complejos se descomponen a temperaturas mayores a 240 y 260°C, respectivamente. Ambos complejos son solubles en solventes polares que apolares, a excepción de la acetona, donde ambos complejos son insolubles.
Composición química elemental de los complejos
Los resultados del análisis elemental (C, H y N), contenido de cobalto (Co) y cloruros se muestran a continuación en la tabla 1, junto a los valores calculados de acuerdo con las fórmulas moleculares propuestas.
Análisis termogravimétrico
El complejo [Co(PZA)2Cl2] se descompone en tres etapas, la pérdida total de estas tres etapas fue de 79,58, dejando como residuo el 20,42 % de la masa inicial analizada, el cual es asignado al óxido metálico formado al final del proceso5,7. De la misma manera, el complejo [Co(PZA)2(NO3)2].H2O se descompone en 4 etapas, formando un óxido de cobalto5,7 al final del proceso, el cual es asignado al residuo final de 17,46 %. En la tabla 2 se muestran los porcentajes experimental y calculado del óxido de cobalto formado (CoO) al final de la descomposición térmica de cada complejo. Las diferencias entre los porcentajes experimentales y calculados, puede deberse a la pureza de los complejos5.
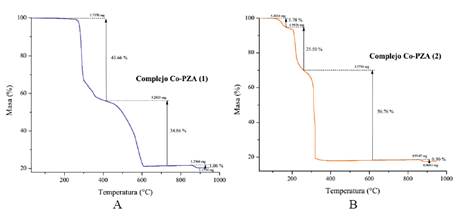
Figura 2 Curvas termogravimétricas de (A) El complejo [Co(PZA)2Cl2] (B) El complejo [Co(PZA)2(NO3)2].H2O.
Susceptibilidad magnética
Los valores del momento magnético efectivo (μeff) obtenido experimentalmente para los complejos [Co(PZA)2Cl2] y [Co(PZA)2(NO3)2].H2O fueron de 4,668 y 4,473, respectivamente. Estos valores se obtuvieron de las medidas de susceptibilidad magnética molar corregidas con las contribuciones diamagnéticas de los iones y ligandos presentes en los complejos. Las contribuciones diamagnéticas se estimaron usando las constantes de Pascal8,9 mostrados en la tabla 3.
Tabla 3 Resultados del porcentaje de óxido de cobalto formado (CoO).
| Iones / elemento / molécula | Contribución diamagnética (x10-6 unidades CGS) |
| Co2+ | -12 |
| C | -6 |
| H | -2.93 |
| O | -1.73 |
| N | -4.61 |
| Cl | -23 |
| NO3 - | -19 |
| H2O | -14 |
Con base en los valores del momento magnético efectivo obtenidos de los complejos y de acuerdo con la tabla 4, se comprueba que ambos valores corresponden al ion metálico de Co2+ con tres electrones desapareados en un entorno octaédrico8,10, es decir, un campo octaédrico débil o de espín alto con configuración t5e2 y EECC (energía de estabilización de campo cristalino) igual a 0.8Δo8.
Tabla 4 Momento magnético para algunos iones de metales de transición17.
| Iones | μeff teórico o calculado | μeff experimental |
| V4+ | 1,73 | 1,7 - 1,8 |
| Cu2+ | 1,73 | 1,7 - 2,2 |
| V3+ | 2,83 | 2,6 - 2,8 |
| Ni2+ | 2,83 | 2,8 - 4,0 |
| Cr3+ | 3,87 | ~ 3,8 |
| Co2+ | 3,87 | 4,1 - 5,2 |
| Fe2+ | 4,90 | 5,1 - 5,5 |
| Co3+ | 4,90 | ~ 5,4 |
| Mn2+ | 5,92 | ~ 5,9 |
| Fe3+ | 5,92 | ~ 5,9 |
Espectroscopía UV- Visible
El diagrama de Orgel para el ion Co2+ en campos octaédricos débiles revela que se debe observar un espectro con tres absorciones8. Transiciones desde el estado basal: 4T (F),1g a 4T (F), 4A (F) y 4T (P) provocan absorciones de banda ancha en la región del visible 2g 2g 1g y el infrarrojo cercano. La primera banda, asignada a la transición 4T (F) ↔ 4T (F), es 2g usualmente encontrada en la región de 5500 - 11000 cm-1. La segunda banda es débil (pero permitida por el spin), asignada a la transición 4T (F) ↔ 4A (F) es encontrada en la región 2g de 12000 - 17000 cm-1; la tercera banda es asignada a la transición 4T (F) ↔ 4T (P), 2P, 2G y usualmente es encontrada en la región de 16000 - 22000 cm-1 11. Los espectros UV-Visible de los complejos muestran dos bandas para cada complejo, a 320 nm (31250 cm-1) y 522 nm (19157 cm-1) para el complejo [Co(PZA) Cl ]; y a 319 nm (31347 cm-1) y 513 nm (19493 cm-1) para el complejo [Co(PZA) (NO ) ].H O. Las bandas a 320 y 319 nm (ultravioleta) de los complejos se atribuyen a la presencia del ligando debido a las transiciones electrónicas de tipo π→π* 12 y las bandas a 522 y 513 nm (visible) a la presencia del metal de transición. Estas dos últimas, son bandas de baja absorbancia opacadas por la intensidad de las bandas en la región del ultravioleta, y son asignadas a la transición 4T1g(F) ↔ 4T1g(P); debido a que las transiciones 4T (F) ↔ 4T (F) y 4T (F) ↔ 4A (F) ocurren a menor número de onda y no se observan en los espectros.
Espectroscopía infrarroja FTIR
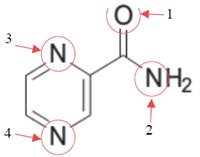
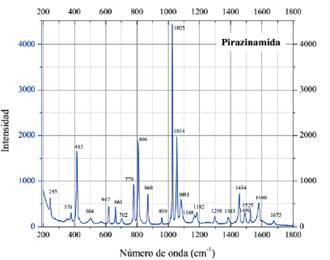
Pirazinamida tiene cuatro átomos donadores: los nitrógenos del anillo pirazina, el oxígeno del grupo carbonilo y el nitrógeno del grupo amino, por lo tanto, tiene diferentes modos de enlace al ion metálico13, es decir diferentes sitios de coordinación (figura 3 ). En algunos complejos, la coordinación de la pirazinamida al metal ocurre a través de los nitrógenos del anillo12 y otras veces a través del oxígeno de grupo carbonilo14.
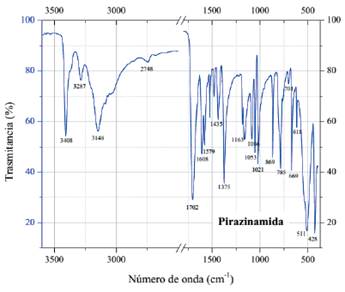
Al comparar los espectros de pirazinamida (figura 4) y el complejo [Co(PZA)2Cl2] (figura 5), se observa que hay cambios en los números de onda de los picos relacionados con el grupo funcional amida NH2 y el anillo aromático. Los cambios más resaltantes se observan en los
dos primeros picos de pirazinamida (3408 y 3148 cm-1) que corresponden al NH debido a la tensión asimétrica y simétrica de los enlaces N-H15, además también se observa que el pico de 1608 cm-1 que corresponde a la flexión de los enlaces N-H sufre un desplazamiento a 1591 cm-1 en el complejo. Así también, se observan desplazamientos y cambios morfológicos en los picos a 618, 511 y 428 cm-1 de pirazinamida hacia 639, 531 y 451 cm-1 en el complejo [Co(PZA)2Cl2] que corresponden a vibración de torsión, balanceo y flexión fuera del plano del grupo amida16. Todos estos cambios observados en el rango de 3500-3100, 1600 y de 600-400 cm-1, aproximadamente evidencian la formación de un enlace a través del nitrógeno del grupo amida con el centro metálico de cobalto. Por otro lado, también se observan desplazamientos en los picos que han sido asignados al anillo aromático16 y se observa además la aparición o intensificación en el espectro del complejo [Co(PZA) Cl ] de una vibración a 949 cm-1 que no está activa en el espectro de pirazinamida. De acuerdo con la bibliografía revisada este pico puede corresponder a una vibración del anillo aromático17 que tiene sustituciones en las posiciones 1,2 y 4 (del anillo), es decir, un anillo bencénico 1, 2 y 4 - trisustituido15 que además tiene otra vibración a 780 cm-1 y que se expresa a 785 y 793 cm-1 en pirazinamida y el complejo [Co(PZA)2Cl2], respectivamente. Por lo tanto, un enlace a través del nitrógeno en la posición 4 del anillo (tomando como posición 2 la sustitución debido al grupo amida) y el centro metálico de cobalto podría tomar lugar.
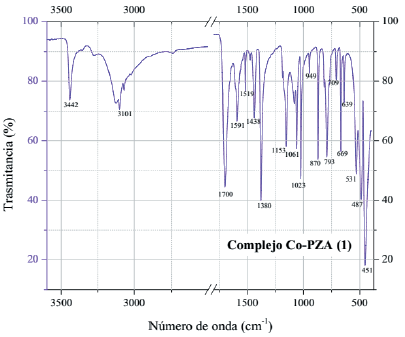
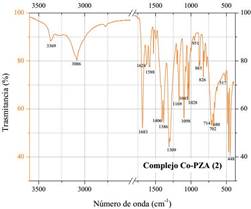
Para el complejo (Co(PZA)2(NO3)2).H2O (figura 6), se observa que hay cambios en los números de onda y morfología de los picos relacionados con el grupo funcional amida NH2 y carbonilo C=O. Si empezamos el análisis por las bandas a mayor número de onda encontramos que los picos a 3369 y 3086 cm-1 del complejo, corresponden a los desplazamientos de los picos a 3408 y 3148 cm-1 de pirazinamida, vibraciones que se deben a la tensión simétrica y asimétrica del enlace N-H15. También se observa que el pico a 3287 cm-1 de pirazinamida debido a la tensión simétrica del enlace N-H16, no aparece en el espectro del complejo [Co(PZA) (NO ) ] H2O. Además, el pico a 1608 cm-1 que corresponde a la flexión de los enlaces N-H16 sufre un desplazamiento a 1624 cm-1, así como la vibración a 1086 cm-1 por balanceo del grupo amida NH se desplaza a 1098 cm-1. Todos estos cambios mencionados anteriormente reflejan la formación de un enlace a través del nitrógeno del grupo amida y el centro metálico de cobalto del complejo [Co(PZA)2(NO3)2].H2O. Otra variación importante entre los espectros es la banda a 1683 cm-1 del complejo Co-PZA (2) proveniente del desplazamiento del pico a 1702 cm-1 de pirazinamida. El rango general para verificar la presencia de vibraciones debido al grupo funcional C=O es de 1850-1550 cm-1 debido a la tensión entre el carbono y el oxígeno de la molécula15, siendo esta su banda característica. Por lo tanto, se asigna al pico de 1702 cm-1 la vibración del enlace C=O16 en pirazinamida y al pico de 1683 cm-1 del complejo. Al verificar un desplazamiento en el espectro del complejo para la vibración más representativa de este grupo, se puede afirmar que a través del oxígeno se estaría dando lugar a un enlace con el centro metálico del complejo. Otras zonas importantes en el espectro del complejo [Co(PZA)2(NO3)2].H2O que no provienen de las vibraciones causadas por los grupos funcionales del ligando pirazinamida evidencian variaciones. La primera de ellas se da en la región de 1500-1250 cm-1 donde se observan bandas a 1406, 1386, 1309 y 1296 cm-1. En esta zona ya existen vibraciones provenientes de pirazinamida, sin embargo, de acuerdo con la literatura, también en esta zona se expresan vibraciones debido al enlace M-ONO - 18,19, la bibliografía indica que cuando se forma un enlace covalente M-O-NO -se origina un desdoblamiento de dos bandas presentes en el espectro del ion nitrato, el primer desdoblamiento ocurre con una banda aproximadamente a 1390 cm-1 la cual genera bandas a 1300 y 1500 cm-1 aproximadamente18,19. El desdoblamiento de la banda del ion nitrato al formarse el enlace M-O-NO -2 ocurre a 1406 y 1309-1296 cm-1 en el espectro del complejo [Co(PZA)2(NO3)2].H2O. El segundo desdoblamiento ocurre con una banda a 720 cm-1 (perteneciente al ion nitrato) la cual genera bandas débiles que muchas veces pasan desapercibidas en el espectro infrarrojo18. En el espectro del complejo [Co(PZA) (NO ) ].H2O existen bandas a 714 y 702 cm-1 las cuales son consideradas señales producto del desdoblamiento de la banda 720 cm-1 18,19 del ion nitrato. Por lo tanto, de acuerdo con las variaciones observadas, se deduce que la coordinación del ligando pirazinamida hacia el átomo metálico de cobalto sucede a través del nitrógeno y oxígeno del grupo amida, ocupando cuatro sitios de coordinación en total por las dos moléculas de pirazinamida presentes en el complejo. Además, también se evidencia la formación de un enlace covalente a través del oxígeno del grupo nitrato de forma monodentada.
Espectroscopía Raman
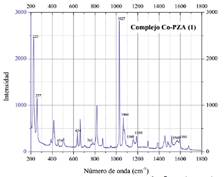
Se analizaron las variaciones en los números de onda de los picos más importantes del espectro de pirazinamida (figura 7) y de los complejos. Se observa dos picos en el espectro del complejo [Co(PZA)2Cl2] (figura 8) que no aparecen en el espectro de pirazinamida, el primero a 225 cm-1 y el segundo a 454 cm-1, de acuerdo con la bibliografía revisada para este estudio se ha encontrado que alrededor de 200 y 400 cm-1 son frecuentes las vibraciones del enlace M-Cl17. Por ejemplo, a 430 cm-1 se observa una banda para el compuesto de CoCl , además a 320 y 230 cm-1 se observan bandas para los compuestos de CoCl .2py y CoCl .4py, respectivamente (donde py representa a piridina)15. Por otro lado, J. E. Rüede y D. A. Thornton20 afirman que para un compuesto octaédrico de cobalto del tipo ML X donde L es piridina y X es cloro, existen dos vibraciones en el infrarrojo correspondientes al enlace Co-Cl los cuales aparecen a 222 y 230 cm-1. Mientras que para un compuesto de tipo tetraédrico las vibraciones para el mismo enlace aparecen a 307 y 346 cm-1 20. Por lo tanto, con la evidencia de los rangos a los que aparecen las vibraciones de un enlace tipo M-X (donde M es el metal y X es el halógeno) tanto en el espectro infrarrojo como en el Raman, en este estudio se ha asignado al enlace Co-Cl los picos de 225 y 454 cm-1 del complejo. También se observan diferencias importantes en los números de onda que corresponden a los enlaces C-C, C-H, C-N del anillo aromático. Por ejemplo, el pico a 779 cm-1 en pirazinamida se presenta como una señal de baja intensidad a 765 cm-1 en el complejo, esta vibración es asignada al enlace C-N del anillo16. Otro cambio que se observa en cuanto a las vibraciones generadas por el anillo aromático es el alejamiento entre los picos a 1168 y 1182 cm-1 de pirazinamida que en el complejo aparecen a 1160 y 1188 cm-1 duplicando su separación. Por las diferencias observadas entre los espectros que corresponden a pirazinamida y el complejo [Co(PZA)2Cl2], en este estudio se concluye que existen enlaces entre el centro metálico de cobalto y el cloro (Co-Cl) y además con un nitrógeno del grupo amida y del anillo aromático (Co-N).
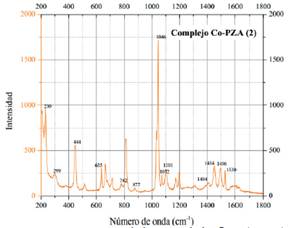
Al comparar los espectros de pirazinamida y el complejo [Co(PZA)2(NO3)2].H2O (figura 9), se observa que los cambios más significativos ocurren con las absorciones relacionadas al grupo amida como los desplazamientos de las señales de pirazinamida a 413, 617 y 1081 cm-1 18 hacia 444, 635 y 1101 cm-1 en el complejo. Otro cambio importante se observa en el pico a 1675 cm-1 de pirazinamida, este pico es característico del grupo C=O16 y se observa el cambio de su señal en el espectro del complejo [Co(PZA)2(NO3)2].H2O. De esta manera, se evidencia la formación de un enlace entre el cobalto y el oxígeno del grupo C=O. Por lo tanto, luego de analizar los cambios importantes entre los espectros de pirazinamida y el complejo, se concluye que los enlaces entre el centro metálico de cobalto y la molécula de pirazinamida suceden a través del nitrógeno del grupo amida y del oxígeno del mismo grupo.
Finalmente, en las figuras 10 (A y B) se muestran las estructuras propuestas basadas en la caracterización realizada.
Determinación de la concentración mínima inhibitoria (MIC)
Los resultados de la determinación de la MIC de pirazinamida y los complejos se muestran en la tabla 5.
Tabla 5 Resultados de la concentración mínima inhibitoria de pirazinamida y los complejos.
| Droga | pH 6 | pH 7 | ||||
| H37Rv | DM97 | D49N | H37Rv | DM97 | D49N | |
| Pirazinamida | 0,81 mM | > 6,5 mM | > 6,5 mM | > 6,5 mM | > 6,5 mM | > 6,5 mM |
| (Co(PZA)2Cl2) | 0,04 mM | 0,33 mM | 0,02 mM | 0,33 mM | 0,33 mM | 0,02 mM |
| (Co(PZA)2(NO3)2) | 0,03 mM | 0,28 mM | 0,02 mM | 0,28 mM | 0,28 mM | 0,02 mM |
La estimación cuantitativa de la MIC fue determinada usando el método de ensayo en microplaca con tetrazolium (TEMA), donde la capacidad de oxidación-reducción del colorante tetrazolium permitió los cambios colorimétricos con los que fue posible realizar la cuantificación de la MIC6. La tabla 5 muestra que los complejos inhiben el crecimiento de las cepas de M. tuberculosis sensible (H37Rv) y resistentes a pirazinamida (DM97 y D49N) tanto a pH 6 como a pH 7 en menor concentración que el fármaco libre pirazinamida, es decir, que en el ensayo en microplaca los complejos demostraron poseer mayor capacidad antimicrobiana que el fármaco libre pirazinamida, siendo el complejo [Co(PZA)2Cl2] el de mayor actividad contra M. tuberculosis in vitro.
CONCLUSIONES
Las fórmulas moleculares propuestas con base en los resultados de la caracterización para los complejos fueron [Co(PZA)2Cl2] para el complejo Co-PZA (1) y [Co(PZA)2(NO3)2].H2O para el complejo Co-PZA (2), en ambos complejos el centro metálico de cobalto se encuentra en un entorno octaédrico donde las moléculas de pirazinamida se ubican en el plano horizontal y los ligandos cloro y nitrato en el plano axial de la molécula. La determinación de la concentración mínima inhibitoria analizada para los complejos y el fármaco libre pirazinamida en cultivos de Mycobacterium tuberculosis en las cepas sensible (H37Rv) y resistentes a pirazinamida (DM97 y D49N) mostró que los complejos tienen mayor capacidad antimicrobiana que el fármaco libre (pirazinamida), siendo el complejo [Co(PZA)2Cl2] el de mayor actividad contra
M. tuberculosis.