INTRODUCCIÓN
La familia Loasaceae, en el Perú, está representada por 8 géneros y 112 especies, siendo la mayoría de ellas herbáceas y presentan pelos urticantes. El género Nasa pertenece a esta familia y es muy rica en especies que son encontradas en la región mesoandina, puna húmeda y seca y bosques muy húmedos montanos, desde 1400 hasta 4700 msnm. Nasa ranunculifolia es un arbusto efímero (noviembre - abril) y puede ser encontrada desde el sur de Cajamarca hasta La Libertad1, en la región norte del Perú es conocida bajo el nombre popular de ortiga colorada, ishanka de león y son usadas popularmente como antiinflamatorios2, por entrevistas con los locales indican que el uso como antiinflamario es frotándose la zona afectada con las partes aéreas de N. ranunculifolia.
Los aceites esenciales son mezclas complejas de compuestos volátiles, su presencia y abundancia puede verse afectada por varios factores, incluyendo el tiempo en la recolección, el estrés abiótico y bióticos. El estrés abiótico se debe principalmente a factores físicos y químicos. Condiciones como altas temperaturas, sequía, frío, alto contenido de sal, metales pesados y daño mecánico. El estrés biótico se debe principalmente a varios factores biológicos como hongos, bacterias, virus, nemátodos y plantas parasitarias3.
El objetivo del presente trabajo es el estudio, en términos de rendimiento y composición química, del aceite esencial de las partes aéreas de Nasa ranunculifolia colectadas durante cinco meses consecutivos en La Libertad (Llacuabamba). El aceite esencial fue analizado por cromatografía gaseosa acoplada a espectrómetro de masas y fueron identificados 36 componentes, de los cuales ocho compuestos están presentes en todos los meses colectados, E-β-ionona (norisopropanoide), 2-Pentadecanona (cetona alifática), fitol (diterpeno oxigenado), n-octadecanol (alcohol alifático) y cuatro alcanos, n-tricosano, n-pentacosano, heptacosano y nonacosano.
PARTE EXPERIMENTAL
Las partes aéreas de Nasa ranunculifolia (figura 1) fueron colectadas en La Libertad (Llacuabamba) a una altura de 4052 msnm (S 08°03’37,29”, W 077°26’21,3”) durante 5 meses consecutivos, desde noviembre del 2019 hasta marzo del 2020. La identificación botánica fue realizada por el Museo de Historia Natural de la Universidad Nacional Mayor de San Marcos según el Sistema de Clasificación de Cronquist (1988) y fue clasificada como: perteneciente a la división Magnoliophyta, clase Magnoliopsida, subclase Dilleniidae, orden Violales, familia Loasaceae, género Nasa y especie Nasa ranunculifolia (Kunth) (figura 1).
Las masas de las partes aéreas colectadas en los meses de noviembre 2019, diciembre 2019, enero, febrero y marzo del 2020 fueron de 849,4 g, 874 g, 139 g, 303,1 g, 925 g, respectivamente. No se pudo colectar el mes de abril del 2020 debido a la cuarentena por la pandemia de la COVID 19.

Figura 1 A: partes aéreas de Nasa ranunculifolia. B: flor de N. ranunculifolia (colectada en el mes de marzo del 2020).
Extracción de los aceites esenciales
Los aceites esenciales fueron obtenidos de las partes aéreas por hidrodestilación de 4 horas con aparato tipo Clevenger (Farmacopea), el aceite esencial fue extraído con éter de petróleo (EP) y secado con sulfato de sodio anhidro, el EP fue evaporado a temperatura ambiente y el aceite fue pesado para determinar su rendimiento y guardado en congeladora (-20 ºC) hasta su análisis por cromatografía gaseosa acoplada a espectrometría de masas (CG-EM)4.
Análisis de los aceites esenciales
Las muestras del aceite esencial fueron preparadas a una concentración de 1 mg/mL. El análisis por cromatografía gaseosa fue realizado en un cromatógrafo a gas acoplado a un espectrómetro de masas (Shimadzu, modelo CGMS-QP2010 Ultra) con las siguientes condiciones de análisis: columna capilar Restek Rtx-5MS (30 m x 0,25 mm x 0,25 μm); temperatura del inyector 260 °C, temperatura del detector 280 °C; impacto de electrones a 70 eV, con gas de arrastre helio a un flujo de 1,48 mL/min, con split 1/5; con un programa de temperatura de 80 ºC (5') - 280 ºC (5'), 8 ºC/minuto; y con volumen de inyección de 3 μL. La identificación de la composición química fue basada por la comparación de los espectros de masas con el banco de datos del sistema de CG-EM de NIST 14 lib y por análisis de sus espectros5.
RESULTADOS Y DISCUSIÓN
El aceite esencial obtenido a través de hidrodestilación de las partes aéreas de N. ranunculifolia fue transparente, el rendimiento de cada mes fue variado, como se observa en la tabla 1; los meses de diciembre y enero presentaron bajo rendimiento respecto a los otros meses debido a que las muestras estaban húmedas.
Fueron identificados un total de 36 compuestos en el aceite esencial (tabla 1), distribuidos en las siguientes categorías: Alcohol (1, 6, 7, 8, 27, 29) alcanos alifáticos (9, 30, 31, 32, 33, 34, 35, 36) aldehídos (2, 5, 10, 11, 13, 17), ésteres (3) alquenos (4), cetonas (23, 26), hidrocarburo monoterpénico (12, 14, 15, 16) monoterpenos oxigenados (18, 19, 20, 21, 22), norisoprenoide (24), sesquiterpenos oxigenados (25), diterpenos oxigenados (28).
De los 36 compuestos identificados, los primeros 23 compuestos no son constantes en todos los meses, como el acetato de butilo (3), está en bajos porcentajes (0,19 %, 0,39 % y 0,26 %) en los meses de noviembre, febrero y marzo, este compuesto es ampliamente utilizado como materia prima para lacas, tintas, adhesivos, colorantes, solventes de pinturas y en la industria cosmética6; 2-hexenal (5) es comúnmente encontrada como componente volátil de plantas y se caracteriza porque es responsable del olor a hojas verdes y contribuye con la protección de la invasión de hongos e insectos7, este aldehído está presente en los meses de febrero (0,7 %) y marzo (16,6 %); el monoterpeno oxigenado linalool (18) que confiere aroma floral amaderado cítrico está presente, solamente, en los meses de diciembre, febrero y marzo en las proporciones de 3,09 %, 1,94 % y 3,34 % respectivamente, este monoterpeno es comúnmente encontrado en el aceite esencial de muchas plantas y presenta actividad antibacteriana, antiplasmódica, antiinflamatoria, antioxidante, anticancerígena, también es considerado como un atractivo para un amplio espectro de polinizadores (abejas, mariposas, etc.) y tiene efecto sobre el sistema nervioso central8.
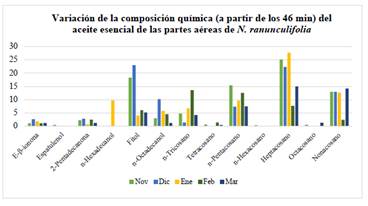
Es a partir de los 46 minutos del cromatograma que se presentan compuestos constantes todos los meses como β-ionona, la cetona 2-Pentadecanona, el diterpeno oxigenado fitol, el alcohol alifático n-Octadecanol y los alcanos n-Tricosano, n-Pentacosano, heptacosano y nonacosano, como se presenta en la figura 2.
La β-ionona es un norisopropanoide cuya biosíntesis es a través del ácido mevalónico que se encuentra ampliamente distribuido en flores, hojas, cortezas, frutos y raíces de plantas y es comúnmente producido a bajos porcentajes en plantas9, este norisopropanoide es ampliamente obtenido como la fragancia de las violetas y es ampliamente usado en la industria de los aromas, incluyendo cosméticos y no-cosméticos10. En el presente estudio, fue identificado y está en bajos porcentajes (1,12 %, 2,61 %, 1,8 %, 1,15 % y 1,25 %) durante los meses de colecta como afirma Paparella et al 2021. Presenta una amplia variedad de efectos farmacológicos como anticancerígeno, quimiopreventivo, antioxidante, antiinflamatorio y antimicrobial10, regulador del crecimiento y de defensa de las plantas que producen9.
El diterpeno oxigenado fitol se encuentra como parte de la molécula de la clorofila y es producido por casi todos los organismos fotosintéticos como algas, plantas y algunas bacterias, es usado como constituyente de fragancias ya que es encontrado también en los aceites esenciales de algunas plantas11. En el aceite esencial de las partes aéreas de N. ranunculifolia está en las proporciones de 18,28 %, 23,1 %, 4,09 %, 6,01 % y 5,2 %, respectivamente, en cada mes de colecta; las muestras colectadas en los meses de noviembre y diciembre sólo presentaban hojas, a partir de la colecta de enero comenzó a aparecer las flores en botones, es probable que la presencia sólo de hojas en N. ranunculifolia es la razón por lo que los niveles de fitol sean altos (18,28 % y 23,1 %) sólo en estos dos meses. El fitol presenta actividad ansiolítica, citotóxica, antioxidante, antiinflamatoria y antimicrobial11.
El alcohol alifático 1-octadecanol está presente los 5 meses de colecta, este alcohol es utilizado en la producción de emulsiones, aceites textiles, antiespumante y lubricantes12.
Los alcanos n-Tricosano, n-Pentacosano, heptacosano y nonacosano son de cadena larga con número de carbonos impares, son los que están presentes en todos los meses de colecta. En la figura 2 se puede observar, en los meses de noviembre, diciembre, enero y marzo, la variación (%) de los alcanos n-Tricosano, n-Pentacosano, heptacosano, mes a mes van de manera creciente, alcanzando siempre el máximo valor heptacosano; en estos mismos meses de colecta el nonacosano se mantiene prácticamente constante.
En el mes de febrero, se presentó una variación diferente ya que en este mes las proporciones van del n-Tricosano>n-Pentacosano>heptacosano>nonacosano (13,57 %, 12,59 %, 7,68 % y 2,42 %, respectivamente). Es en este mes que se presentan, solamente, los monoterpenos cis-Mirtanol y trans-Mirtanol en altos porcentajes 8,18 % y 13,27 %, respectivamente, ambos monoterpenos presentan actividad repelente contra los piojos13, también es reportado que el cis-Mirtanol presenta efecto sedante equivalente al pentobarbital14.
Tabla 1 Porcentajes de rendimiento de los aceites esenciales de las partes aéreas de N. ranunculifolia colectados durante los meses de noviembre y diciembre del 2020 y enero, febrero y marzo del 2021; así como los componentes identificados, tiempo de retención.
| Nov | Dic | Ene | Feb | Mar | |||
|---|---|---|---|---|---|---|---|
| N° | Porcentaje de rendimiento (w/w %) | 0,0034 | 0,0028 | 0,0023 | 0,0036 | 0,0034 | |
| Nombre | TR | ||||||
| 1 | 2Z-Pentenol | 3,568 | - | - | - | - | 0,36 |
| 2 | Hexanal | 4,187 | - | - | - | - | 1,59 |
| 3 | Acetato de butilo | 4,635 | 0,19 | - | - | 0,39 | 0,26 |
| 4 | 2E-Octene | 5,599 | - | - | - | - | 0,57 |
| 5 | 2E-Hexenal | 5,772 | - | - | - | 0,7 | 16,6 |
| 6 | 3Z-Hexenol | 5,953 | - | - | - | - | 5,33 |
| 7 | 2Z-Hexenol | 6,322 | - | - | - | 0,55 | 1,27 |
| 8 | n-Hexenol | 6,481 | - | - | - | - | 1,32 |
| 9 | n-Nonano | 7,727 | - | - | - | - | 0,61 |
| 10 | Heptanal | 7,848 | - | - | - | - | 0,61 |
| 11 | Benzaldehído | 10,826 | - | - | - | - | 1,54 |
| 12 | α-Felandreno | 13,371 | - | - | - | - | 1,22 |
| 13 | 2E,4E-Heptadienal | 13,877 | - | - | - | - | 1,69 |
| 14 | p-Cimeno | 14,658 | - | - | - | - | 1,01 |
| 15 | Silvestreno | 14,903 | - | - | - | - | 1,58 |
| 16 | Z-β-Ocimeno | 15,691 | - | - | - | - | 0,73 |
| 17 | Fenilacetaldehído | 15,937 | - | - | - | - | 0,94 |
| 18 | Linalool | 20,282 | - | 3,09 | - | 1,94 | 3,34 |
| 19 | Nopinona | 21,834 | - | - | - | 0,8 | - |
| 20 | trans-Vervenol | 23,173 | 0,4 | - | - | - | - |
| 21 | cis-Mirtanol | 29,747 | - | - | - | 8,18 | - |
| 22 | trans-Mirtanol | 30,212 | - | - | - | 13,27 | - |
| 23 | 3-Dodecanona | 43,391 | - | - | - | 1,57 | - |
| 24 | β-ionona | 46,031 | 1,12 | 2,61 | 1,8 | 1,15 | 1,25 |
| 25 | Espatulenol | 50,805 | 0,42 | - | - | - | |
| 26 | 2-Pentadecanona | 65,804 | 2,2 | 2,8 | 0,72 | 2,46 | 1,17 |
| 27 | n-Hexadecanol | 79,044 | - | - | 9,8 | - | |
| 28 | Fitol | 80,363 | 18,28 | 23,1 | 4,09 | 6,01 | 5,2 |
| 29 | n-Octadecanol | 85,955 | 3,01 | 10,16 | 5,75 | 4,54 | 1,18 |
| 30 | n-Tricosano | 86,455 | 4,78 | 1,35 | 6,69 | 13,57 | 4,23 |
| 31 | Tetracosano | 89,525 | 0,6 | - | - | 1,36 | 0,44 |
| 32 | n-Pentacosano | 94,389 | 15,4 | 7,41 | 9,64 | 12,59 | 7,5 |
| 33 | n-Hexacosano | 97,651 | 0,36 | - | - | - | - |
| 34 | Heptacosano | 101,75 | 25,21 | 22,41 | 27,75 | 7,68 | 15 |
| 35 | Octacosano | 104,43 | 0,56 | - | - | - | 1,28 |
| 36 | Nonacosano | 108,62 | 12,98 | 12,98 | 12,68 | 2,42 | 14,24 |
| Alcohol alifático | 3,01 | - | 15,55 | 0,55 | 9,43 | ||
| Alcano alifático | 59,89 | 44,15 | 56,76 | 37,62 | 43,30 | ||
| Aldehído | - | - | - | 0,7 | 22,03 | ||
| Ésteres | 0,19 | - | - | 0,39 | 0,26 | ||
| Alquenos | - | - | - | - | 0,57 | ||
| Cetonas | 2,2 | 2,8 | 0,72 | 4,03 | 1,17 | ||
| Hidrocarburo Monoterpénico | - | - | - | - | 4,54 | ||
| Monoterpenos oxigenados | 0,4 | 3,09 | - | 24,19 | 3,34 | ||
| Norisoprenoide | 1,12 | 2,61 | 1,8 | 1,15 | 1,25 | ||
| Sesquiterpeno oxigenado | 0,42 | - | - | - | - | ||
| Diterpeno oxigenado | 18,28 | 23,1 | 4,09 | 6,01 | 5,2 | ||
| Total de compuestos identificados (%) | 85,51 | 75,75 | 78,92 | 74,64 | 91,09 | ||
TR: tiempo de retención, Nov: noviembre, Dic: diciembre, Ene: enero, Feb: febrero, Mar: marzo
CONCLUSIONES
Con el presente trabajo se reporta, por primera vez, el estudio de la composición química del aceite esencial de las partes aéreas de N. ranunculifolia colectado por 5 meses consecutivos, en el que se observó que los 4 primeros meses la composición del aceite esencial no presenta hidrocarburos monoterpénicos, mientras que los monoterpenos oxigenados sólo no están presentes el mes de enero. Los compuestos observados constantemente presentes en todas las colectas fueron el norisoprenoide β-ionona, la cetona 2-Pentadecanona, el diterpeno oxigenado fitol, el alcohol n-Octadecano y los alcanos n-tricosano, n-Pentacosano, heptacosano y nonacosano.