INTRODUCCIÓN
La celulosa es uno de los biopolímeros más abundantes sobre la Tierra, es producido principalmente por las plantas como componente principal de su pared celular1. La celulosa es una materia prima que tiene múltiples propósitos: es material de construcción, generación de fibras textiles y fabricación de papel, además, sus derivados (ésteres, acetatos, nitratos) están implicados en diversos procesos industriales. Sin embargo, hay algunas especies de bacterias, como las de los géneros Achromobacter, Alcaligenes, Aerobacter, Agrobacterium, Azotobacter, Komagataeibacter, Pseudomonas, Rhizobium, Sarcina, Dickeya y Rhodobacter, que también pueden producir celulosa de forma extracelular2. La fórmula molecular de la celulosa bacteriana es la misma que la de la celulosa vegetal, pero sus características físicas y químicas son diferentes3. Él principal género microbiano productor y modelo de síntesis de celulosa es Komagataeibacter (antes Gluconacetobacter), perteneciente a la familia Acetobacteraceae, que son bacilos Gram negativos, aerobios obligados. Estas bacterias pueden aislarse de la superficie de muchas flores y frutos, entre ellos la caña de azúcar, además de bebidas fermentadas4,5,6. La producción de celulosa por Komagataeibacter, responde a necesidades fisiológicas. Las bacterias se adhieren al biopolímero para aumentar su exposición al oxígeno y para tomar los nutrientes contenidos en los líquidos absorbidos del ambiente, además los protege contra la radiación ultravioleta. En cultivos estáticos, la formación de celulosa se observa como una película en la interfase aire-líquido. En cultivos agitados la celulosa se agrupa en gránulos irregulares, también se observa la aparición espontánea de mutantes no productores de celulosa, esto crea inconvenientes para la producción en masa de este biopolímero7,8,9. La celulosa presenta características únicas: i) alto grado de pureza, ya que no contiene hemicelulosa ni lignina como si ocurre en la celulosa de origen vegetal; ii) alta cristalinidad; iii) excelente biodegradabilidad; iv) un alto módulo de Young (15~30 GPa), uno de los más alto de todos los materiales orgánicos; v) una gran capacidad de retención de agua, hasta cien veces su peso y vi) una excelente afinidad biológica10,11. Debido a las propiedades únicas, la celulosa ha encontrado una variedad de aplicaciones tanto en las industrias del papel, textil, alimentaria y como un biomaterial muy útil en la industria cosmética y la medicina11,12. Este trabajo tuvo como objetivo aislar bacterias de caña de azúcar capaces de producir de celulosa en condiciones de laboratorio.
PARTE EXPERIMENTAL
Recolección de muestras y procesamiento
Un total de 5 muestras de cañas de azúcar fueron colectadas del mercado mayorista Nº 1. Cada una de las muestras fueron lavadas superficialmente con agua destilada estéril, se tomaron aproximadamente 20 mL del agua de lavado y se depositaron en una botella de 500 ml conteniendo 300 mL de su propio extracto de caña. Las botellas fueron cubiertas con una gasa estéril y se dejaron incubar a temperatura ambiente por 25 días hasta la formación de una película en la superficie del extracto de caña.
Condiciones de crecimiento y aislamiento
En condiciones estériles, se tomó con el asa de siembra una alícuota de la superficie de la película y se sembró por agotamiento sobre el medio Hestrin-Schramm (HS)13. El medio contenía: 20,0 g/L de glucosa; 5,0 g/L de extracto de levadura; 5,0 g/L de peptona; 2,7 g/L de Na2HPO4; 5,7 g/L de MgSO4.7H2O; 1,15 g/L de ácido cítrico; pH final de 5,7. El medio se autoclavó a 121 ºC por 15 min. Las colonias, seleccionadas preliminarmente, fueron catalogadas y transferidas a un nuevo caldo HS e incubadas por 2 días a 30 ºC. Se aislaron colonias microbianas a partir de cada cultivo que presentó la formación de una película superficial. Este procedimiento se repitió hasta la obtención de cultivos puros. Finalmente se transfirió 0,1 ml de un cultivo puro (incubado por 2 días a 30 ºC) sobre 200 ml de caldo HS y se incubo por 6 días a 30 ºC, hasta la formación de una película superficial gruesa.
Recuperación y caracterización de la película por FT-IR
La película fue retirada del cultivo y lavada con agua del grifo, 200 ml de NaOH al 2 % (w/v) a 80 °C por 20 min y 200 ml de ácido acético al 2 % (v/v), este tratamiento se repitió tres veces; finalmente, la película fue lavada con agua destilada estéril. Luego de ese tratamiento, la película fue secada a 80 ºC en una estufa durante 2 horas14,15. La caracterización química de la película se realizó mediante espectroscopia infrarroja, FT-IR (Modelo IMPACT 410, NICOLET), a una longitud de onda entre el rango de 4000 a 400 cm-1.
Identificación de las cepas aisladas
Se realizó siguiendo la metodología propuesta por Kersters et al.16 y Komagata et al.17. La identificación consistió en la realización de las siguientes pruebas: coloración Gram, catalasa, oxidación de etanol a ácido acético, oxidación de ácido acético a CO2 y H2O, oxidación de lactato a CO2 y H2O, crecimiento sobre 3 % etanol (v/v) en presencia de 5 % de ácido acético, requerimiento de ácido acético para crecer, crecimiento en presencia de 30 % de D-glucosa, formación de ácido glucónico y la producción de celulosa.
RESULTADOS Y DISCUSIÓN
Se lograron aislar, inicialmente, 7 cepas a partir de las muestras de caña de azúcar, de las cuales solo la cepa catalogada como CBP-3,5 mostró mayor producción de una película en la superficie del medio de cultivo HS después de los dos días de incubación. De acuerdo a otros estudios, la formación de celulosa en cultivos estáticos comienza generalmente después de 2 días de incubación; sin embargo, esto puede variar dependiendo de la cepa y las condiciones de cultivo3,18. Las colonias aisladas mostraron las siguientes características morfológicas: colonias cremas-blancas, secas, lisas, convexas, con un diámetro de entre 2 a 3 mm (figura 1A). Estas características morfológicas de las colonias sobre el medio HS fueron también reportadas en otras investigaciones3,19,20. La formación de una película superficial gruesa se observó luego del sexto día de incubación (figura 1B).

Figura 1 A: Colonias aisladas de caña de azúcar pertenecientes a la cepa CBP-3,5. B: Formación de una película superficial producida por la cepa CBP-3,5 en cultivo estático sobre el medio HS durante 6 días de incubación a 30 ºC.
Luego de recuperar la película del cultivo estático (figura 2A), se realizó un lavado con agua de la película y un tratamiento con NaOH al 2 % a 80 ºC. Este tratamiento es útil para eliminar las células bacterianas adheridas a la película y restos del medio de cultivo empleado14,21, sin llegar a hidrolizar la celulosa ni formar celulosa alcalina; además, mejora la porosidad y la elasticidad de la celulosa22,23. La celulosa bacteriana es estable en soluciones básicas, pero es susceptible a hidrólisis alcalina en condiciones drásticas. Concentraciones elevadas de álcali y temperaturas iguales o superiores a 100 ºC pueden provocar la hidrólisis de la celulosa o formar celulosa alcalina, forma modificada de la celulosa24,25. Por otro lado, el tratamiento con ácido acético al 2 % permite neutralizar el efecto del tratamiento con el álcali15. Luego del tratamiento con el NaOH y el ácido acético la película se vuelve traslúcida y pierde volumen debido al tratamiento de secado en horno (figura 2B). El tratamiento con calor permite secar la película para realizar el análisis por FT-IR sin afectar su cristalinidad. Aunque la celulosa bacteriana puede calentarse hasta 325 °C antes de comenzar a quemarse11, se ha encontrado que a temperaturas de secado cercanas a los 50 °C puede llegar a afectar algunas de sus propiedades y sus posibles aplicaciones20. También se han reportado que estas temperaturas pueden producir polimorfismos de la celulosa, lo que fue se evidencia cuando se analizan los picos de absorción en los resultados de FT-IR26.
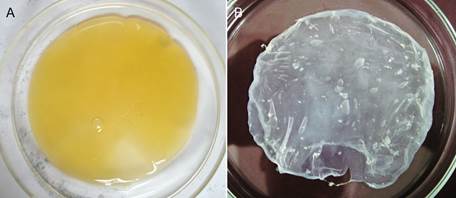
Figura 2 Película producida en cultivo estático por la cepa CBP-3,5. A: Antes del tratamiento con NaOH y ácido acético.B: Después del tratamiento y secado.
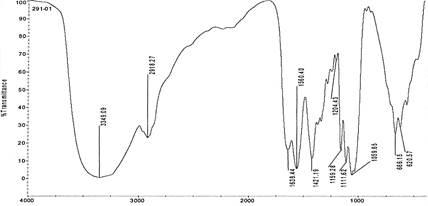
El análisis de FT-IR se utilizó para determinar los picos de absorción correspondientes a las vibraciones de enlaces en los grupos funcionales encontrados en la película11.
En la figura 3 se observa un pico a 3349,09 cm-1 correspondiente a las vibraciones de tensión del grupo OH, vibraciones de tensión de los grupos CH y CH2 a 2918,27 cm-1, vibraciones de flexión del grupo OH a 1638,44 cm-1 debido a la retención de agua por la muestra, vibraciones de tensión del grupo COO a 1560,40 cm-1, vibraciones de tensión simétricas de los grupos CH2 o en el grupo OH a 1421,19 cm-1, vibraciones de flexión simétricas del grupo OH a 1204,43 cm-1, vibraciones de tensión del grupo C-O-C a 1159,28 cm-1, vibraciones de tensión del grupo C-O y C-O-C a 1111,62 cm-1 y un pico a 1059,65 cm-1 correspondiente a las vibraciones de tensión del grupo C-O. El espectro y las vibraciones de los grupos son similares a otras celulosas de origen bacteriano y vegetal encontradas en otros estudios, esto indicaría que la película producida por la cepa CBP-3,5 se trataría de un biopolímero de celulosa20,24,25.
La metodología propuesta de Komagata et al. y Kersters et al. permite identificar las características fisiológicas y bioquímicas específicas del género Komagataeibacter, incluyendo a las especies capaces de producir celulosa16,17. Los resultados de las características fisiológicas y bioquímicas evaluadas para la identificación de la cepa CBP-3,5 se resumen en la tabla 1. Los resultados de la identificación mostraron que la cepa CBP-3,5 corresponde a la bacteria Komagataeibacter sp. Estos resultados son consistentes a los encontrados en otros estudios donde también utilizaron características fisiológicas para la identificación de esta especie bacteriana15,27.
Tabla 1 Resultados de la identificación de la cepa CBP-3,5.
| Características fisiológicas | Cepa CBP-3,5 | Komagataeibacter sp. 16,17 |
| Coloración Gram | Bacilos Gram negativos | Bacilos Gram negativos |
| Catalasa | + | + |
| Oxidación de etanol a ácido acético | + | + |
| Oxidación de ácido acético a CO2 y H2O | + | + |
| Oxidación de lactato a CO2 y H2O | + | + |
| Requerimiento de ácido acético para crecer | - | - |
| Crecimiento en 3 % etanol (v/v) en presencia de 5 % de ácido acético | - | - |
| Crecimiento en 30 % de D-glucosa | - | - |
| Formación de ácido glucónico de D-glucosa | + | + |
| Producción de celulosa | + | + |
CONCLUSIONES
En este estudio se lograron aislar 7 cepas a partir de las 5 muestras de caña de azúcar, de estas cepas solo la cepa CBP-3,5 fue capaz de producir una película superficial en condiciones estáticas de incubación. La cepa BCP-3,5 fue identificada en base a sus características fisiológicas como Komagataeibacter sp. El análisis de FT-IR de la película producida por la cepa BCP 3,5 mostró que este biopolímero tiene un espectro similar a la celulosa de origen bacteriano y vegetal.