INTRODUCCIÓN
En el desarrollo de un producto farmacéutico es necesario utilizar un método analítico específico que permita cuantificar el principio activo en una formulación, y para asegurar su confiabilidad es necesario validarlo1,2,3. Esta validación consiste en determinar diversos parámetros, que van a depender de la categoría a la que pertenezcan 4,5. Diversos organismos reguladores como la Food and Drug Administration (FDA), Agencia Nacional de Vigilancia Sanitaria (ANVISA), Agencia Española de Medicamentos y Productos Sanitarios (AEMPS); así como las referencias The United States Pharmacopeia (USP), International Conference on Harmonisation (ICH) y Asociación Española de Farmacéuticos de la Industria (AEFI), exigen y recomiendan la validación como requisito imprescindible para el cumplimiento de la Buenas Prácticas de Laboratorio (BPL)4. La cromatografía líquida de alta resolución (HPLC) posee diversas aplicaciones y, por ser una técnica automatizada, permite analizar de forma rápida y eficiente la separación, cuantificación y detección de las muestras por medio de la identificación de picos en los cromatogramas, que se pueden optimizar mediante el ajuste de múltiples variables en el método (pH de la fase móvil, concentración del buffer, flujo, temperatura de la columna, longitud de onda del detector, etc.)6,7,8,9,10,11. Al obtener un método rápido y confiable, puede ser aplicado en uso rutinario en el análisis de control de calidad y determinación de la estabilidad del medicamento12,13,14,15,16. Las plantas medicinales, y su uso en salud complementaria, son tan antiguas como la aparición de la especie humana, siendo parte de las prácticas de atención familiar y comunitaria. En la actualidad, se está volviendo a utilizar las plantas medicinales en la salud y cabe resaltar que los senósidos son un laxante natural de origen vegetal para el tratamiento de la constipación leve provocada por malos hábitos alimentarios, falta de ejercicio e inadecuada ingesta de fibra natural17,18,19.
En la presente investigación se tiene como objetivo validar un método analítico por cromatografía líquida de alta resolución para la cuantificación de senósidos en tabletas y, para ello, establecer parámetros de validación que permitan tener la confiabilidad para el uso rutinario en la determinación de calidad de medicamentos.
PARTE EXPERIMENTAL
Reactivos: Se utilizó potasio dihidrogenofosfato de Merck (Darmstadt, Alemania), ácido orto-fosfórico 85 % de Merck (Darmstadt, Alemania) y acetonitrilo de Merck (Darmstadt, Alemania).
Condiciones cromatográficas: Como fase móvil, se utilizaron dos soluciones: Solución A (Buffer fosfato pH 3,5) disolviendo 6,8 g de potasio dihidrogenofosfato, por cada 1000 mL de agua purificada, se ajustó a pH 3,5 con ácido orto-fosfórico 85 % y la Solución B: acetonitrilo. La columna cromatográfica utilizada fue L11 Fenilo de 150 mm x 4,6 mm x 5 µm, el detector UV a 274 nm, la temperatura del horno a 40 ºC, el volumen de inyección de 40 µL, la velocidad de flujo de 0,4 mL/minuto, el tiempo de retención del pico principal es de 15,0 minutos y el tiempo de cada corrida es de 50 minutos.
Tabla 1 Elución en gradiente de la fase móvil de solución A y solución B.
| Tiempo | Solución A | Solución B | Flujo |
|---|---|---|---|
| 0,0 | 92,0 | 8,0 | 0,4 mL/min. |
| 5,0 | 92,0 | 8,0 | 0,4 mL/min. |
| 15,0 | 92,0 | 8,0 | 0,4 mL/min. |
| 22,0 | 92,0 | 8,0 | 0,4 mL/min. |
| 23,0 | 92,0 | 8,0 | 1,0 mL/min. |
| 24,0 | 92,0 | 8,0 | 1,5 mL/min. |
| 33,0 | 92,0 | 8,0 | 1,5 mL/min. |
| 34,0 | 92,0 | 8,0 | 1,0 mL/min. |
| 35,0 | 92,0 | 8,0 | 0,4 mL/min. |
| 50,0 | 92,0 | 8,0 | 0,4 mL/min. |
Preparación de estándar:
Se utilizó un estándar de referencia de senósidos en solución buffer pH 3,5 a una concentración aproximada de 0,15 mg/mL que luego se filtró por una membrana de 0,45 µm.
Preparación de la muestra:
Se refrigeraron las tabletas de chocolate por 1 hora para luego fraccionarlas, se pesó una cantidad de muestra equivalente a 15 mg de senósidos en un matraz volumétrico y se le agregó 25 mL de éter de petróleo, luego se llevó a calentar en baño maría de 50 ºC, hasta completa dispersión. Se adicionó 100 mL de solución buffer fosfato pH 3,5; se calentó en baño maría a 50 ºC y se agitó de manera intermitente durante 30 minutos, se filtró de inmediato, a través de papel Whatman, (40) se dejó enfriar la solución y luego se filtró por membrana de 0,45 µm, obteniendo una concentración aproximada de 0,15 mg/mL de senósidos.
Especificidad:
Para la determinación de posibles interferencias, se analizó el placebo con el principio activo al 100 % y se determinó el grado de interferencia con respecto al análisis del principio activo, con y sin placebo, debiendo obtener resultados ± 2 % del teórico. En la determinación de interferencias de productos de degradación, se expusieron tanto placebo muestra y principio activo a diferentes tipos de estrés como luz UV, calor a 80 °C por 24 horas, hidrólisis ácida por 2 horas a 80 °C, hidrólisis alcalina por 2 horas a 80 °C, oxidación con peróxido al 30 % por 2 horas.
Linealidad e intervalo:
Para evaluar la linealidad del sistema se prepararon 5 concentraciones en el rango de 50 %, 75 %, 100 %, 125 % y 150 %. En la linealidad del método se prepararon soluciones de placebo enriquecida con principio activo en tres niveles 75 %, 100 % y 125 % 5.
Exactitud:
Para evaluar este parámetro se utilizaron las mismas muestras de la linealidad del método5.
RESULTADOS Y DISCUSIÓN
En la prueba de especificidad se evaluó las posibles interferencias originadas en la muestra, debido al estrés forzado sometido por fotolisis y termólisis, encontrándose los siguientes resultados, según tabla 2.
Tabla 2 Especificidad de posibles interferentes en senósidos en tabletas de chocolate.
| Especificidad | Muestra | Senósidos | |||||
| Peso (mg) | Añadido (mg) | hallado (mg) | Promedio hallado (mg) | % Recuperación | |||
| Determinación de posibles interferentes | Placebo | Pb1 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 |
| Pb2 | 0,00 | 0,00 | 0,00 | 0,00 | |||
| Principio activo + placebo | M1 | 25,75 | 15,89 | 15,79 | 15,77 | 98,74% | |
| 15,75 | |||||||
| M2 | 25,08 | 15,47 | 15,19 | 15,20 | |||
| 15,21 | |||||||
| Placebo | Pb1 | 0,00 | 0,00 | 0,00 | 0,0 | 0,00 | |
| 0,00 | |||||||
| Pb2 | 0,00 | 0,00 | 0,00 | 0,00 | |||
| 0,00 | |||||||
| Fotólisis | Principio activo | PA 1 | 25,01 | 15,43 | 15,62 | 15,64 | 100,01 |
| 15,65 | |||||||
| PA 2 | 25,40 | 15,67 | 15,58 | 15,58 | |||
| 15,58 | |||||||
| Principio activo + Placebo | M1 | 25,50 | 15,73 | 15,52 | 15,50 | 97,90 | |
| 15,48 | |||||||
| M2 | 25,13 | 15,51 | 15,07 | 15,09 | |||
| 15,10 | |||||||
| Placebo | Pb1 | 0,00 | 0,00 | 0,00 | 0,0 | 0,00 | |
| 0,00 | |||||||
| Pb2 | 0,00 | 0,00 | 0,00 | 0,00 | |||
| 0,00 | |||||||
| Termólisis | Principio activo | PA 1 | 25,07 | 15,47 | 15,62 | 15,62 | 100,00 |
| 15,62 | |||||||
| PA 2 | 25,15 | 15,52 | 15,40 | 15,39 | |||
| 15,38 | |||||||
| Principio activo + Placebo | M1 | 25,34 | 15,63 | 15,43 | 15,46 | 99,07 | |
| 15,48 | |||||||
| M2 | 25,05 | 15,46 | 15,36 | 15,35 | |||
| 15,33 |
Pb: placebo PA: principio activo M: muestra
En la tabla 3, se muestran los resultados del ensayo de Especificidad en Senósidos tabletas de chocolate sometidas a estrés forzado por hidrólisis acida, hidrólisis alcalina y estrés oxidativo.
Tabla 3 Especificidad de hidrólisis ácida, alcalina y oxidativa.
| Especificidad | Muestra | Senósidos | |||||
| Peso (mg) | Añadido (mg) | Hallado (mg) | Promedio hallado (mg) | % Recuperación | |||
| Hidrólisis ácida | Placebo | Pb1 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 |
| Pb2 | 0,00 | 0,00 | 0,00 | 0,00 | |||
| Principio activo | PA1 | 25,84 | 15,94 | 11,63 | 11,62 | 71,97 | |
| 11,61 | |||||||
| PA2 | 24,92 | 15,38 | 10,92 | 10,92 | |||
| 10,91 | |||||||
| Principio activo + placebo | M1 | 25,01 | 15,43 | 11,55 | 11,50 | 75,02 | |
| 11,45 | |||||||
| M2 | 25,74 | 15,88 | 11,99 | 11,99 | |||
| 11,98 | |||||||
| Hidrólisis alcalina | Placebo | Pb1 | 0,00 | 0,00 | 0,00 | 0,0 | 0,00 |
| 0,00 | |||||||
| Pb2 | 0,00 | 0,00 | 0,00 | 0,00 | |||
| 0,00 | |||||||
| Principio activo | PA 1 | 25,08 | 15,47 | 13,02 | 13,00 | 83,74 | |
| 12,98 | |||||||
| PA2 | 25,05 | 15,46 | 12,90 | 12,90 | |||
| 12,89 | |||||||
| Principio activo + Placebo | M1 | 25,03 | 15,44 | 13,23 | 13,22 | 84,70 | |
| 13,21 | |||||||
| M2 | 25,03 | 15,44 | 12,94 | 12,97 | |||
| 12,99 | |||||||
| Oxidación | Placebo | Pb1 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 |
| 0,00 | |||||||
| Pb2 | 0,00 | 0,00 | 0,00 | 0,00 | |||
| 0,00 | |||||||
| Principio activo | PA1 | 25,15 | 15,52 | 11,37 | 11,34 | 72,37 | |
| 11,31 | |||||||
| PA2 | 25,23 | 15,57 | 11,15 | 11,16 | |||
| 11,16 | |||||||
| Principio activo + Placebo | M1 | 25,16 | 15,52 | 7,03 | 7,02 | 45,25 | |
| 7,01 | |||||||
| M2 | 25,45 | 15,70 | 7,24 | 7,12 | |||
| 6,99 | |||||||
Pb: placebo PA: principio activo M: muestra
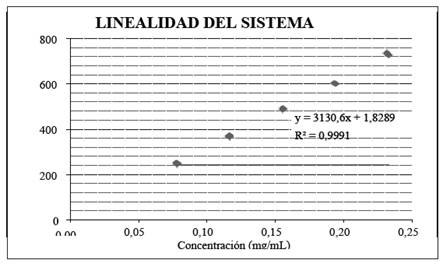
En la figura 1 , se reflejan los resultados obtenidos al evaluar el parámetro de Linealidad del sistema tomando las 5 concentraciones, con el siguiente resultado aplicando la ecuación de la recta para la verificación de la confiabilidad del sistema.
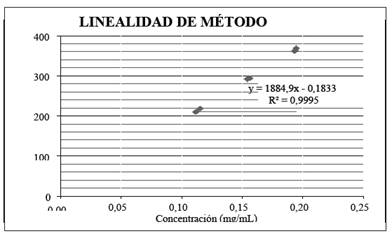
En la figura 2, se esquematiza los resultados obtenidos al evaluar el parámetro de Linealidad del método tomando las 3 concentraciones como réplicas de la muestra y preparadas por duplicado, en cada una de ellas, con el siguiente resultado, aplicando la ecuación de la recta para la verificación de la confiabilidad del método.
En la tabla 4 , se muestran los resultados de la evaluación del parámetro de Exactitud del método, para lo que se prepararon 3 concentraciones en el rango de trabajo establecido y luego de ello se analizaron los porcentajes de recuperación obtenidos para demostrar de esta forma si el método cumple con los criterios para demostrar su exactitud.
Tabla 4 Exactitud (recuperación) de senósidos en tabletas de chocolate.
| Concentración | Muestras | Peso (mg) | Senósidos añadido (mg) | Senósidos hallado (mg) | Promedio senósidos hallado | Recuperación % |
| 75% | M1 | 18,72 | 11,55 | 11,44 | 11,44 | 99,00 |
| 11,43 | ||||||
| M2 | 18,13 | 11,19 | 10,95 | 11,00 | 98,29 | |
| 11,04 | ||||||
| M3 | 18,23 | 11,25 | 11,06 | 11,04 | 98,17 | |
| 11,03 | ||||||
| 100% | M1 | 25,01 | 15,43 | 15,21 | 15,25 | 98,82 |
| 15,29 | ||||||
| M2 | 25,05 | 15,46 | 15,33 | 15,34 | 99,24 | |
| 15,35 | ||||||
| M3 | 25,34 | 15,63 | 15,36 | 15,36 | 98,24 | |
| 15,35 | ||||||
| 125% | M1 | 31,51 | 19,44 | 19,31 | 19,31 | 99,30 |
| 19,30 | ||||||
| M2 | 31,37 | 19,36 | 19,02 | 19,02 | 98,26 | |
| 19,02 | ||||||
| M3 | 31,28 | 19,30 | 18,94 | 18,93 | 98,10 | |
| 18,93 | ||||||
| Promedio: | 98,60 % | |||||
| Desviación estándar relativa: | 0,0049 | |||||
| Coeficiente de variación (%): | 0,49 % |
En la tabla 5, se muestran los resultados de la evaluación del parámetro Precisión del método y para ello se realizaron los ensayos de repetibilidad de los resultados del análisis en las mismas condiciones de seis muestras y la precisión intermedia utilizando el mismo método realizado por diferentes analistas calificados.
Tabla 5 Precisión: repetibilidad y precisión intermedia entre el analista uno y dos de senósidos en tabletas de chocolate.
| Muestras | Analista 1 | Analista 2 | ||||
| Senósidos mg/tab | Promedio Senósidos mg/tab | % | senósidos mg/tab | Promedio senósidos mg/tab | % | |
| M1 | 15,48 | 15,49 | 103,3 | 15,89 | 15,88 | 105,9 |
| 15,50 | 15,86 | |||||
| M2 | 15,36 | 15,34 | 102,3 | 15,63 | 15,61 | 104,0 |
| 15,33 | 15,59 | |||||
| M3 | 15,30 | 15,30 | 102,0 | 15,46 | 15,48 | 103,2 |
| 15,30 | 15,50 | |||||
| M4 | 15,61 | 15,60 | 104,0 | 15,57 | 15,67 | 104,5 |
| 15,59 | 15,77 | |||||
| M5 | 15,58 | 15,58 | 103,9 | 15,58 | 15,51 | 103,4 |
| 15,58 | 15,44 | |||||
| M6 | 15,38 | 15,38 | 102,5 | 15,73 | 15,70 | 104,6 |
| 15,38 | 15,67 | |||||
| Promedio: | 103,0 % | Promedio: | 104,3 % | |||
| RSD: | 0,0082 | RSD: | 0,0093 | |||
| C.V. (%): | 0,82 % | C.V. (%) | 0,93 | |||
| Promedio analista 1 y 2: | 103,6 % | |||||
| RSD del analista 1 y analista 2: | 0,0106 | |||||
| C.V. (%) del analista 1 y analista 2: | 1,06 % | |||||
C.V.: coeficiente de variación RSD.: desviación estándar relativa M: muestra
En la tabla 6, se muestran los resultados del parámetro de Robustez del método, evaluando una misma muestra en condiciones de almacenamiento de refrigeración después de 24 horas, analizados frente a estándares recientemente preparados en las mismas condiciones y así determinar si el método cumple con el parámetro requerido.
Tabla6. Robustez entre análisis inicial y final de senósidos en tabletas de chocolate.
| Muestra | Inicio | Final (después de 24 horas refrigerado) | |||||
|---|---|---|---|---|---|---|---|
| Senósidos mg/tab. | Promedio senósidos mg/tab. | % (y0) | Senósidos mg/tab. | Promedio senósidos mg/tab. | % (y1) | Diferencia ly1 - y0l | |
| M1 | 15,48 | 15,49 | 103,29 | 15,51 | 15,50 | 103,36 | 0,07 |
| 15,50 | 15,50 | ||||||
| M2 | 15,36 | 15,34 | 102,29 | 15,32 | 15,34 | 102,25 | 0,05 |
| 15,33 | 15,35 | ||||||
| M3 | 15,30 | 15,30 | 101,99 | 15,35 | 15,33 | 102,21 | 0,23 |
| 15,30 | 15,31 | ||||||
| Promedio | 15,38 | 102,52 | Promedio | 15,39 | |||
| RSD | 0,0066 | 0,0066 | RSD | 0,0064 | |||
| C.V.(%) | 0,66 % | 0,66 % | C.V.(%) | 0,64 % | |||
| Promedio de inicio y final (después de 24 horas refrigerado): | 102,56 % | ||||||
| RSD de inicio y final (después de 24 horas refrigerado): | 0,0058 | ||||||
| C.V. (%) de inicio y final (después de 24 horas refrigerado): | 0,58 % | ||||||
| Diferencia del promedio de inicio y final (después de 24 horas refrigerado): | 0,08 | ||||||
C.V.: coeficiente de variación RSD.: desviación estándar relativa M: muestra
Referente a la linealidad, debe existir una relación lineal entre la señal analítica (y) y la concentración (x); en la figura 1 y figura 2, se grafican las curvas de calibración (relación de áreas versus concentración) para el sistema y para el método, en las que se puede apreciar la ecuación de la recta: para linealidad del sistema y = 3130,6x + 1,8289 y para linealidad del método y = 1884,9x − 0,1833. De acuerdo a la AEFI5, el valor para coeficiente de correlación es recomendable que sea mayor que 0,999 y para Gary10, el valor de coeficiente de determinación debe ser mayor que 0,998; lo cual indica un ajuste aceptable de los datos a la línea de regresión, en estas condiciones los resultados para linealidad del sistema r = 0,9996 y r2 = 0,9991 y para linealidad del método r = 0,9997 y r2 = 0,9995, con estos valores se puede decir que existe un alto grado de relación entre la variable x (concentración) y la variable y (área).
En la tabla 4, se muestra que el porcentaje de recuperación del parámetro de exactitud, que es de 98,60 %, presenta un Coeficiente de Variación de 0,49 %, siendo estos resultados lo recomendado por AEFI5, donde los criterios de aceptación para la recuperación deben estar entre los valores 98,0-102,0 % y con un coeficiente de variación recomendado por USP 42- NF 3715 que debe ser menores a 2 %.
Para el análisis del parámetro de robustez, se evaluó la estabilidad de la muestra en una condición, muestras después de 24 horas en refrigeración, donde se observó que las muestras no sufren cambios con el método analítico y no afectan la reproducibilidad de los resultados, siendo el porcentaje de Coeficiente de Variación C.V. (%) de 0,58 %.
CONCLUSIONES
Se logró validar un método analítico para cuantificar senósidos en tabletas de chocolate por cromatografía líquida de alta resolución (HPLC) con una buena separación, una pureza de pico cromatográfico de 99,99 % para el pico del estándar y 99,94 % para el pico de la muestra, para lo cual se utilizó una columna cromatográfica de L11 (fenilo), 150 mm x 4,6 mm x 5 µm. Se estableció un tiempo de retención de 15 minutos, aproximadamente, para el pico principal, a una longitud de onda de 274 nm, y con un volumen de inyección de 40 µL. La gradiente de flujo establecida oscila entre 0,4 a 1,5 mL/min. Se establecieron parámetros de validación de un método analítico por cromatografía líquida de alta resolución (HPLC), demostrando que es específico, después de determinar las interferencias una vez sometida a estrés. Es lineal en concentraciones de 0,07; 0,11; 0,15; 0,19 y 0,23 mg/mL, con un coeficiente de correlación de 0,9996. La precisión se determinó con una repetibilidad y precisión intermedia que tiene un Coeficiente de Variación (C.V.) menor al 2 %. La exactitud mostró un porcentaje de recuperación de 98,60 % y la robustez con un coeficiente de variación de 0,58 %, después de 24 horas.