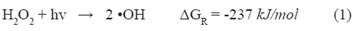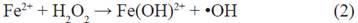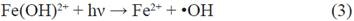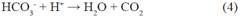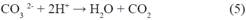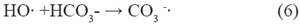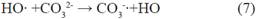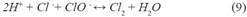INTRODUCCIÓN
El metomilo (C5H10N2O2S) es un insecticida, perteneciente a la familia de los carbamatos y es muy utilizado en el Perú para el control de diversas plagas agrícolas1. Este insecticida posee características fisicoquímicas relacionadas a su solubilidad en agua (58 mg/L) y la toxicidad que puede causar fácilmente contaminación del agua en áreas agrícolas. Por otro lado, los procesos convencionales de biotratamiento presentan limitaciones para la remoción de metomilo en agua, aunque algunos trabajos han reportado el uso de cepas bacterianas específicas como Paracoccus, Pseudomonas, Aminobacter, Flavobacterium, Alcaligenes, Bacillus, Serratia, Novosphingobium, y Trametes2.
Diferentes estudios sobre procesos para la remoción de metomilo se han concentrado en el uso de procesos avanzados de oxidación fotoquímicos y no fotoquímicos como el proceso Fenton, Foto-Fenton3,4 y fotocatálisis con TiO 5,6. El proceso fotofenton es un método que emplea un catalizador y sales de hierro que, bajo irradiación con luz ultravioleta o solar, facilitan su recuperación y reutilización, a la vez que reaccionan con peróxido de hidrógeno para la liberar OH, que oxidan a compuestos orgánicos.El proceso H2O2/UV se basa en la producción de un oxidante efectivo, el radical hidroxilo (•OH), a través de la irradiación del peróxido de hidrógeno con radiación ultravioleta, según la reacción 1 7.
La descomposición fotoinducida del peróxido de hidrógeno en agua pura se racionaliza mediante el mecanismo de cadena radical Haber-Weiss, según el cual los radicales hidroxilos originados por el clivaje homolítico del enlace O-O inician una secuencia de reacciones caracterizadas por un paso de iniciación (reacción 1), seguido de un paso de propagación dado por las otras reacciones7. El proceso de Ozonización se basa en procesos fisicoquímicos que involucran la generación y uso de especies transitorias poderosas, principalmente el radical hidroxilo8. La ozonización ha sido exitosamente utilizada para la remoción de metomilo en agua Milli-Q.
El objetivo de la presente investigación es estudiar la degradación de metomilo en aguas reales provenientes de drenes agrícolas del Sector Uraca-Corire de la Provincia de Arequipa, utilizando tres Procesos Avanzados de oxidación: Ozonización, Foto Fenton y Peróxido de hidrógeno y luz ultravioleta; de modo que se verifique la eficiencia de cada uno de estos procesos para recomendar el proceso óptimo para el tratamiento del mencionado plaguicida.
PARTE EXPERIMENTAL
Reactivos del proceso foto Fenton y H2O2/UV y Ozonización
En todos los experimentos se utilizaron los siguientes reactivos: peróxido de hidrógeno (H2O2) PANREAC ®, 30% (V/V), Metomilo (C5H10N2O2S); con una pureza ≥ 98 %, SIGMA- ALDRICH ®, ácido sulfúrico, H2SO4 6N, hidróxido de sodio (NaOH), ácido clorhídrico HCl, sulfato ferroso heptahidratado, (FeSO4 • 7H2O) HIMEDIA®, 99.5%, nitrato de sodio AR/ ACS (NaNO3), de la marca Central Drug House (P) Ltd. con una pureza del 99,5-99,8 %, carbonato de calcio (CaCO3), de la marca Central Drug House (P) Ltd. con una pureza del 99,5 %, cloruro de sodio de marca Central Drug House (P) Ltd, Yoduro de potasio al 2%. KI Merck®
Sistemas de proceso Foto Fenton, H2O2/UV y Ozonización
Para los tratamientos realizados con el proceso foto-Fenton y peróxido con UV, se dispuso de radiación artificial con lámparas tubulares fluorescentes de vapor de mercurio de baja presión Actinic BL TL TL-D marca Philips, 18W/10 1SL/25, las cuales se ubicaron en el interior de una cámara de acero inoxidable iluminando desde la parte superior, así mismo se contó con un sistema de sensores de temperatura y un protector anti-UV, traslucida en la cara anterior, un agitador magnético y un vaso reactor de cuarzo, que permite el paso de la luz hacia la solución (Figura 1).

Figura 1 Cámara real de reacción. Fuente Propia. Muestra del diseño real estructurado para las experimentaciones acoplado de un sistema de lámparas UV-A, Actinic BL TL-D 18W/10 1SL/25, marca PHILIPS.
El ozono se genera a partir de oxígeno comercial mediante un generador de ozono (Guolin, modelo CF-G-3-20g). El flujo del oxidante se dirige hacia un reactor de vidrio pyrex de 500mL que contiene la muestra a tratar donde se burbujeo continuamente el reactor por medio de un difusor de vidrio poroso. Posteriormente se dirige hacia un reactor posterior (trampa de ozono) que contiene una solución de yoduro de potasio al 2%. La concentración de ozono se ajustó mediante el método Indigo9. Para la experimentación se utilizó metomilo de marca Sigma-Aldrich. La experimentación fue llevada en tres etapas de acuerdo con el tipo de agua utilizada: agua destilada, agua simulada y agua real.
Determinación de concentraciones óptimas para la degradación de metomilo
Para los experimentos foto Fenton se desarrolló un diseño experimental de factores independientes para determinar la dosis óptima de las variables (tiempo, concentración de Fe+2 /H2O2 y pH) a intervenir en la degradación del metomilo, para lo cual en cada experimentación se realizó el diseño experimental basado en la ecuación 2, donde “t” es la cantidad de tratamientos, “r” el número de repeticiones y “N” el número de análisis:
Para los experimentos con H2O2/UV, el diseño experimental que se desarrolló fue de factores independientes para la degradación de metomilo en agua destilada (condiciones óptimas), agua simulada y agua real muestra con el proceso peróxido de hidrógeno y luz ultravioleta (H2O2/UV). En todos los experimentos se trabajó con una concentración inicial de 10 mg/L de metomilo, se comenzó con la determinación del tiempo óptimo teniendo en cuenta cinco tiempos en el último experimento (0, 1, 2, 4 y 8 min), seguido de la determinación de la concentración de peróxido de hidrógeno óptima considerando dos concentraciones 3 mg/L y 10 mg/L, para terminar, se hizo la determinación del tipo de radiación ultravioleta UV-C, UV-B y UV-A. Se realizaron tres repeticiones en todos los experimentos.
Para los experimentos con ozonización, se determinó las condiciones óptimas a través de un diseño experimental, (ver Tabla 1) para las variables pH y tiempo de contacto. Se estableció como un parámetro fijo el pH natural de las muestras de agua de los drenes objeto de estudio. Teniendo en cuenta que valores altos de pH aumenta la eficiencia en la degradación de los contaminantes orgánicos8 se seleccionó un valor de pH de 11. En el caso donde se ajustó el pH, este se realizó con NaOH 0.1 M. Los niveles establecidos para el tiempo de contacto fueron seleccionados tomando en cuenta los resultados obtenidos en los ensayos preliminares. Los experimentos realizados a pH 8 utilizaron tiempos de contacto de 5, 10, 15, 30 min mientras que a pH 11 se establecieron intervalos de tiempo de 2, 4, 8, 10 min. La concentración de ozono que se utilizó está limitada por el equipo y corresponde a la mínima concentración alcanzada de 0.07 mg/L a un flujo constante de 0.5 L/min. La concentración inicial de Metomilo de estos experimentos fue de 10mg/L.
Tabla 1 Diseño experimental para pH 8 y pH 11.
| Tratamientos | Concentración de Ozono (mg/L) | pH(unidades) | Tiempo (min) |
| 1 | 0.07 | Natural (8.0) | 5 |
| 2 | 0.07 | Natural (8.0) | 10 |
| 3 | 0.07 | Natural (8.0) | 15 |
| 4 | 0.07 | Natural (8.0) | 30 |
| 5 | 0.07 | Modificado (11.0) | 2 |
| 6 | 0.07 | Modificado (11.0) | 4 |
| 7 | 0.07 | Modificado (11.0) | 8 |
| 8 | 0.07 | Modificado (11.0) | 10 |
Caracterización fisicoquímica de las aguas reales de los drenes del sector de Uraca- Corire
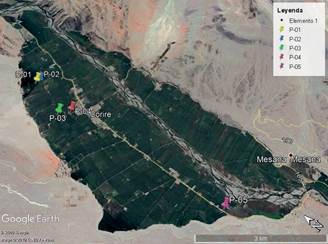
Las aguas residuales caracterizadas provienen de los drenes agrícolas del valle de Majes, distrito de Uraca-Corire, provincia y departamento de Arequipa, Perú. Se establecieron 5 estaciones de muestreo (Tabla 2) para la caracterización de fisicoquímica de aniones; cloruros, fluoruros, sulfatos, fosfatos y carbonatos del agua real.
Tabla 2 Estaciones de muestreo de aguas superficiales en Uraca-Corire.
| Código | Nombre de muestra | Coordenadas UTM WGS 84 | ||
|---|---|---|---|---|
| Zona | Este | Norte | ||
| P-01 | Efluente de la Zona 1 | 18 K | 769974 m E | 8206519 m S |
| P-02 | Efluente de la Zona 2 | 18 K | 770047 m E | 8206452 m S |
| P-03 | Confluente de la zona 3 | 18 K | 769701 m E | 8205290 m S |
| P-04 | Efluente de la Zona 4 | 18 K | 769977 m E | 8205073 m S |
| P-05 | Confluente de la zona 5 | 18 K | 770585 m E | 8200323 m S |
La estación de muestreo P-05, colector final de los drenes, fue el punto para recolectar el agua para la experiencia con agua real.
Metodología experimental para los ensayos Foto-Fenton, H2O2/UV, y Ozonización
Para los ensayos Foto-Fenton se prepararon soluciones acuosas conteniendo 2.5 mg/L de Sulfato ferroso heptahidratado (FeSO4 • 7H2O) disponible de HIMEDIA, el cual fue utilizado como fuente de Fe2+ y una concentración de metomilo de 10 mg/L El pH inicial de la solución fue ajustado a un valor de 3,6 utilizando HCl 0,1 M. Esta solución se colocó en un reactor de cuarzo con un volumen aproximado de 200 mL. Esta solución fue colocada en la cámara de irradiación agregando previamente una concentración de 10 mg/L de H2O2 (30% v/v Panreac). La temperatura promedio durante los ensayos fue de 25° C; la solución se agitó magnéticamente a 700-750 RPM. Los ensayos con agua superficial simulado contenían concentraciones de iones Fluoruro [F-] de 0.30 mg/L, Nitrato [NO3- ] de 5 mg/L y Carbonato [CO32-] de 20 mg/L.
Los experimentos de H2O2/UV se llevaron a cabo en un reactor Batch utilizando un recipiente de cuarzo de 235 mL. Las soluciones acuosas de metomilo (Sigma Aldrich) con una concentración de 10 mg/L a pH 5 se agitaron constantemente a 750 RPM por medio de un agitador magnético de cerámica (tipo SH-4C de AKMLAB) y fueron irradiadas en diferentes tiempos y diversas condiciones de concentración de peróxido de hidrógeno y tipo de radiación ultravioleta mediante el uso lámparas tubulares fluorescentes de radiación tipo UV-A, UV-B y UV-C y solución de H2O2 al 30% v/v (PANREAC) llevada a una concentración de 10 mg/L para la realización de los ensayos. Todos los experimentos se realizaron a temperatura ambiente (25°C).
Los tratamientos fueron llevados en tres etapas de acuerdo con tipo de agua utilizada: agua destilada, agua simulada y agua real. En la etapa de trabajo con agua destilada se realizó la determinación del tiempo, concentración de peróxido de hidrógeno y tipo de irradiación óptimos para posteriormente utilizar estos parámetros en los experimentos con agua simulada y agua real. En los tratamientos con agua simulada se trabajó con tres tipos diferentes de iones (carbonatos, nitratos y cloruros), con concentraciones de 20 mg/L, 5 mg/L y 60 mg/L respectivamente; con el fin de evaluar la existencia de alguna interferencia en la degradación de metomilo por parte de los aniones.
Las muestras de agua real recolectadas de los drenes agrícolas del distrito Uraca-Corire, fueron caracterizadas fisicoquímicamente tomando en cuenta los parámetros de temperatura, pH, oxígeno disuelto, conductividad eléctrica, carbonatos, cloruros, fluoruros, nitratos, sulfatos y fosfatos. Las muestras se enriquecieron con 10 ppm de metomilo y se sometieron al tratamiento de peróxido de hidrógeno y luz UV. Se realizaron dos experimentos control con el fin de determinar el efecto aislado del peróxido de hidrógeno y la radiación ultravioleta; y el efecto independiente de cada uno de los tipos de radiación (UV-A, UV-B, UV-C).
Para los ensayos de ozonización, se utilizó las condiciones óptimas obtenidas para realizar la experimentación en agua simulada. Se utilizó como matriz una solución de Metomilo a 10ppm (mg/L), en presencia de aniones: 60 ppm de Cloruros, 5 ppm de Nitratos, 20 ppm de Carbonatos, en agua simulada. Finalmente se utilizó como matriz, una solución de Metomilo a 10ppm (mg/L) en agua real proveniente de los drenes de agricultura del Sector de Uraca- Corire. Evaluando la degradación de metomilo por cromatografía líquida acoplada a un detector de masas (LC-MS/MS).
Análisis cromatográfico del metomilo
Los análisis de residuos de plaguicidas se realizaron a través de Cromatografía Líquida y Cromatografía Gaseosa cada uno acoplado a un detector de Masas Triple Cuádruplo (GC - MS/MS y LC - MS/MS). En diferentes intervalos de tiempo se extrajeron muestras para la cuantificación del metomilo residual, posteriormente se envió las muestras al laboratorio AGQ PERÚ SAC, con acreditación estándar ISO/IEC 17025:2005. El metomilo se analiza por la técnica de cromatografía líquida. La determinación de residuos de plaguicidas se basa en una extracción haciendo uso de la metodología QuEChERS10. Este método combina dos etapas, una de extracción de la muestra con acetonitrilo y diferentes sales. La columna utilizada es Columna C18 de 100 mm x 2’1 mm x 1’8 µm, las fases móviles están compuestas por Fase A: Agua (0.05% ácido fórmico + 2 molar formiato amónico) Fase B: Metanol (0.05% acido fórmico); el volumen de inyección fue de 3 uL para todas las muestras analizada con un flujo de 400 uL/min. El detector usado es el EvoQ MS- Triple Cuadrupolo.
RESULTADOS Y DISCUSIÓN
Caracterización del agua real
La caracterización fisicoquímica del agua real (Tabla 3), muestra que el agua del Valle de Majes se caracteriza por tener un pH entre 7.88 a 8.99 (agua alcalina), con una conductividad entre 109 a 700 uS/cm, una concentración de oxígeno disuelto entre 7.93-8.38 y una temperatura entre 18.6 - 20. Las mediciones para pH muestran que los puntos de muestreo P-01, P-02 y P-04, no cumplen con el Estándar Nacional de calidad del agua para la categoría 3, debido a la presencia de especies carbonatadas, que elevan el pH.
Tabla 3 Caracterización fisicoquímica de aguas provenientes de Uraca-Corire.
| Zona | Parámetros de campo | Aniones mg/L | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| OD (mg/L) | CE (µs/cm) | pH | Temp (°C) | CO32- | Cl- | F- | NO3- | SO42- | PO43- | |
| P-01 | 8.36 | 700 | 8.93 | 19.7 | 37 | 57 | 0.59 | 3.2 | 156.9 | 0.8 |
| P-02 | 8.34 | 698.5 | 8.99 | 20 | 33.5 | 55.8 | 0.34 | 2.6 | 143.8 | 0.58 |
| P-03 | 7.93 | 878 | 8.12 | 19.5 | 9 | 63.5 | 0.25 | 5.3 | 0.56 | 197.3 |
| P-04 | 8.06 | 830 | 8.51 | 19.9 | 18.5 | 63.8 | 0.27 | 4.2 | 185.5 | 0.79 |
| P-05 | 8.23 | 1097 | 7.9 | 18.6 | 10 | 81 | 0.26 | 8.4 | 259.8 | 0.67 |
En el análisis de aniones interferentes se muestra una concentración de Carbonatos (CO32) entre 9-33.7 mg/L, Cloruros (Cl-) entre 5.8-81 mg/L, Fluoruros (F-) entre 0.25-0.59 mg/L, Nitratos (NO3-) entre 2.6-8.4 mg/L, Sulfatos (SO42-) entre 0.56-259.8 mg/L y Fosfatos (PO43-) entre 0.58 - 197.3 mg/L, todos los valores presentan diferencias entre punto y punto de muestreo.
Degradación de metomilo en agua destilada proceso foto-fenton
Para determinar el tiempo de reacción óptimo, la cinética de reacción se inicia con [Fe2+/ H2O2]= 2.5/10 mg/L, pH=3.6, e irradiación UV-A. Se evaluó el progreso de la degradación en tiempos de 0, 5, 15, 30 y 60 minutos para determinar la relación entre la concentración final de metomilo frente a la concentración inicial (Figura 3).
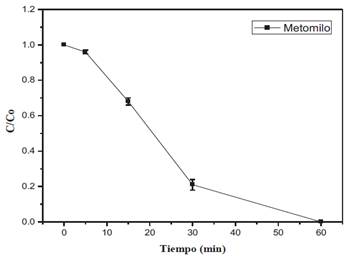
Figura 3 . Relación de la concentración final frente a la concentración inicial de metomilo degradado por fotodegradación en el tiempo, bajo condiciones experimentales [pH = 3.6, Fe2+= 2.5 ppm, H2O2 = 10 ppm].
Se determino la relación óptima de la [Fe2+/H2O2] a través de experimentos con las relaciones de [Fe2+/H O ] de (0.5/2) mg/L y (2.5/10) mg/L, en presencia de radiación UV-A y en un tiempo de 60 minutos.
La relación [Fe2+/H2 O2 ] = 2.5/10 ha degradado casi el doble del porcentaje que la relación [Fe2+/H2 O2 ] = 0.5/2 (Figura 4), esto a causa de la disponibilidad de concentración inicial del catalizador hierro y de peróxido de hidrógeno. Tal como lo demuestra Tolba et al., 201911, la ausencia de peróxido de hidrógeno retrasa la reacción alcanzando solo un 37.5% de degradación; en cuanto se aumenta las dosis de 1 mg/L a 1.5 mg/L a 2 mg/L la eficiencia incrementa directamente, sin embargo, se confirmó que la dosis 2 mg/L, es un excedente que no mejoro la eficacia del proceso.
Por ello, una relación estequiométrica directa entre la concentración inicial de metomilo y la de H2O2 tal como se desarrolla en la presente investigación, ha efectuado una degradación eficiente del metomilo, sin tener la necesidad de incrementar la concentración de peróxido de hidrógeno. En tanto la fotoreducción del Fe3+ y la formación de radical •OH se da con la irradiación de luz, acelerando el proceso como muestra la ecuación 2 y 3 12.
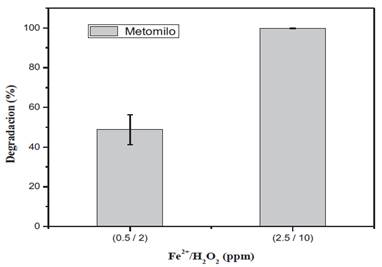
Figura 4. Determinación de la relación de Fe2+/H O Óptima para la degradación de metomilo, bajo condiciones experimentales [pH = 3.6, H2O2 = 10 ppm, t=60 min].
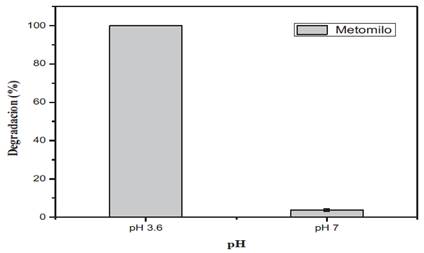
En la determinación del pH optimo, se evaluó la degradación de metomilo en medio ácido y neutro, durante un tiempo óptimo de 60 minutos, con la relación de [Fe2+/H O ]=2.5/10 mg/L y en presencia de radiación UV-A.Buitrago et al., 200013 reporta que el proceso foto-Fenton trabaja mejor a pH ácido, ya que bajo estas condiciones se generan acuacomplejos férricos altamente fotoactivos bajo radiación UV-A, siendo esta una variable significativa para el proceso, verificado en la presente investigación (Figura 5), en la que se utilizó un pH de 3.6 y obtuvo una degradación del 100%, demostrando que este pH puede ser el óptimo para la degradación de metomilo bajo estas condiciones experimentales. En tanto se ha demostrado en los resultados que a pH 7, solo se pude degradar un 3.68% de metomilo, esto se debe a que se forman óxidos de hierro que no son fotoactivos14.
Proceso H2O2/UV
El tiempo de irradiación optimo se determinó mediante el registro de la degradación de metomilo bajo irradiación UV-C, usando una solución de H2O2 10 mg/L (Figura 6). Los resultados obtenidos revelan una rápida degradación del insecticida luego de 4 minutos de radiación.
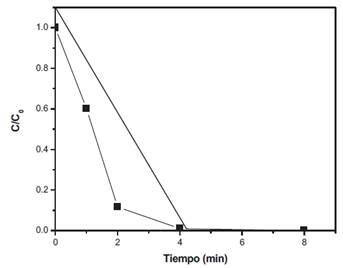
Figura 6 . Gráfico C/C0 de metomilo vs tiempo en el último experimento de tiempo para la determinación del tiempo de irradiación.
Los resultados de la determinación de la concentración de peróxido de hidrógeno, donde se consideraron las concentraciones de 3 mg/L y 10 mg/L (Tabla 4) revelan que a mayor concentración de H2O2, mayor degradación del ingrediente activo. Para este montaje experimental, la concentración de H2O2 que logro mayor degradación fue de mg/L. Es posible lograr una mayor degradación a mayores concentraciones de H2O2, sin embargo, es importante considerar el incremento de costos, así como los efectos ambientales probables.
Tabla 4 Resultados del experimento para la determinación de la concentración de peróxido de
| H2O2 | Tiempo (min) | Concentración de metomilo residual (mg/L) | Degradación |
|---|---|---|---|
| 3 ppm | 5 | 0.3 | 90.99% |
| 10 ppm | 5 | 0.06 | 98.20% |
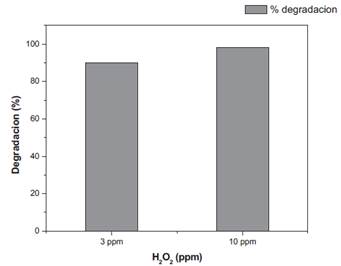
Figura 7 Comparación de la degradación de metomilo con dos diferentes concentraciones de peróxido de hidrógeno.
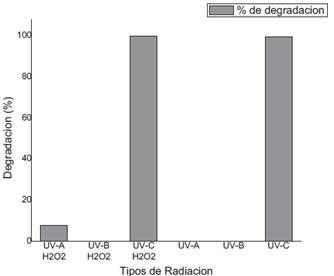
Sobre la influencia del tipo de radiación ultravioleta dentro del proceso H2O2/UV, se realizaron experimentos con tres tipos de radiación ultravioleta UV-A, UV-B y UV-C (Tabla 5). El experimento de control de fotolisis del metomilo bajo luz UV-A y UV-B (en ausencia de peróxido de hidrogeno) reveló una baja degradación debido a que el metomilo presenta un máximo de absorción de luz a 235 nm (luz UV-C). Mientras que bajo radiación UV-C si se observó una degradación del insecticida del 99.57% debido a procesos de fotolisis de la molécula. En presencia de peróxido de hidrogeno (10 mg/L) y radiación UV-A, se observó una leve degradación producida probablemente a una incipiente del H2O2, mientras que bajo UV-B no se observó mejora alguna. En condiciones de radiación con UV-C, se evidenció una rápida cinética de degradación debido al efecto de procesos altamente efectivos de fotolisis del H2O2 y de la molécula del pesticida.
Tabla 5 Resultados del sexto experimento para la determinación del tipo de irradiación.
| Radiación | Tiempo | H2 O 2 (ppm) | Metomilo (ppm) | Degradación |
|---|---|---|---|---|
| Sin UV | 0 | 0 | 10 | 0.00% |
| UV-A | 5 | 10 | 9.23 | 7.67% |
| UV-B | 5 | 10 | 10 | 0.00% |
| UV-C | 5 | 10 | 0.043 | 99.57% |
Proceso de Ozonización
Se determinó la concentración de ozono alcanzando valores de 0.07 y 0.08 mg O3/L en los primeros 30 y 40 minutos respectivamente y estabilizándose en 0.1 mg O3/L luego de 50 minutos.
Tabla 6 Concentración de ozono en diferentes tiempos.
| Tiempo (min) | Concentración (mg/L) |
| 10 | 0.07 |
| 20 | 0.07 |
| 30 | 0.07 |
| 40 | 0.08 |
| 50 | 0.1 |
Para determinar las condiciones óptimas de pH y tiempo en la ozonización para la degradación del metomilo, a través del equipo de ozonización se generó una concentración 0.07mg/L correspondiente a un flujo de 0.5 L min-1 de oxígeno. Se adicionó un experimento control, para determinar el efecto de hidrolisis sobre la degradación de metomilo en los mismos tiempos de exposición del pH 11.
La degradación de metomilo en el proceso de ozonización a pH 8, en 30 min es del 0% (Tabla 7). A pH 11 por el contrario, se observó una rápida y total degradación del contaminante luego de 10 min de tratamiento. El experimento de control a pH 11 (en ausencia de ozono) reveló que no hubo participación alguna de procesos de hidrolisis en la degradación del metomilo, demostrando que la acción generadora de radicales hidroxilos por parte del proceso de ozonización a pH alcalino fue la responsable de la desaparición del agroquímico. La degradación de metomilo a pH 11 y control del pH 11, donde el experimento control a pH 11 es la degradación de metomilo sin someter al proceso de ozonización, muestra que no se tiene ningún efecto de hidrolisis de metomilo, y que el metomilo no es inestable o fácil de ser descompuesto en esos tiempos.
Se verifico que, en pH alcalino, el proceso de ozonización del metomilo es más eficiente como se aprecia en la Tabla 7. Se muestra que en el tiempo 4 min una concentración de 6.55 mg/L de metomilo, se alcanza una degradación de 34.5%. Se obtuvo una total degradación del metomilo cuando el tiempo de ozonización se prolongó a 10 min, teniendo una concentración de 0.4 mg/L, siendo degradado el 96%. La concentración de metomilo disminuye significativamente cuando el valor de pH aumenta a 11, debido a que en este pH el ozono disuelto es descompuesto para formar radicales hidroxilos y oxida el efluente8.
Al finalizar el experimento se concluyó que la ozonización es efectiva a pH 11 y tiempo de 10 min, ya que se observa una mayor degradación considerando estas las condiciones óptimas para aplicar la degradación del metomilo, tanto en agua simulada y real.
Degradación de metomilo en Agua Simulada
Proceso foto-Fenton
Para determinar el efecto de los iones en la degradación del metomilo, se usaron las condiciones óptimas de 3.6 de pH, así como 2.5 y 10 mg/L de Fe/H2O2 y tiempo de 60 minutos, obtenidas en el experimento realizado en agua destilada, por esta razón no se realizaron repeticiones con diferentes condiciones.
Para definir la acción de los aniones en la degradación de metomilo, se realizaron experimentos con el promedio de las concentraciones encontradas en el análisis de aguas provenientes de los drenes, considerando, Fluoruro [F-]= 0.30 mg/L , Nitrato [NO -]= 5 mg/L y Carbonato [CO 2-]= 20 mg/L, obteniendo los resultados de la degradación de metomilo(Tabla 8) en presencia de iones interferentes, indicando la concentración restante de metomilo y su porcentaje de degradación, durante el tiempo de 60 minutos, expuestos a radiación UV-A. Los resultados evidenciaron una reducción de metomilo cercana al 23.14% luego de 60 min de irradiación bajo concentraciones de ion ferroso y peróxido de hidrogeno de 2.5 y 10 mg/L. Tal como lo demuestra Andreozzi et al 199915 al considerar que las especies inorgánicas disueltas de HCO - y CO 2- , aumentan la alcalinidad del agua:
Este fenómeno se debe a la sobresaturación del agua con iones carbonatos igual a 20 mg/L. Así mismo, Wang et al., 201916 determinó que el aumento del pH generó la precipitación del catalizador de hierro a hidróxido de hierro, limitando la reacción por la menor actividad, siendo este el caso que se presenta en la experimentación en agua simulada. Debido a que el agua de los drenes que se utilizó para la realización de estos experimentos contiene una concentración de aniones bicarbonato de aproximadamente 37 mg/L, se decidió realizar estos experimentos. Así mismo, algunas investigaciones17,18 reportan que, en aguas con contenidos importantes de bicarbonato (>100 mg/L), este anión reacciona con radicales OH generando un radical menos oxidante (radical bicarbonato) pero igualmente capaz de participar en reacciones de oxidación. De esta manera, pudo confirmarse que a concentraciones inferiores de 100 mg/L de bicarbonato, este participa más como un secuestrador de radicales OH. La concentración generada de radical bicarbonato no es suficiente para generar un efecto positivo en la degradación.
Por otro lado, Devi et al., 201019 evaluó la interferencia de los aniones, Na CO , NaHCO , Na2SO4, NaCl , KNO3 para determinar el comportamiento del peróxido de hidrógeno para generar radicales •OH, estableciendo que los aniones carbonato, bicarbonato y nitrato no tienden a formar complejos con el hierro, he ahí la influencia de estos aniones en la baja cinética de degradación, inclusive a mayores concentraciones , por lo que los iones CO 2, NO - y HCO - compiten por radicales hidroxilo junto con moléculas del sustrato orgánico a degradar.
Como se muestra en las siguientes reacciones, los aniones carbonato y bicarbonato actúan como secuestradores de radicales hidroxilo generando radicales carbonato con un potencial de oxidación menor15.
Tabla 8 Resultados de la degradación del metomilo en presencia de iones interferentes (carbonato (CO =), fluoruro (F-) y nitrato (NO -)).
| pH 8 | pH 11 | Control para pH 11 | |||
|---|---|---|---|---|---|
| Tiempo (min) | % Degradación | Tiempo (min) | % Degradación | Tiempo (min) | % Degradación |
| 0 | 0 | 0 | 0 | 0 | 0 |
| 5 | 0 | 2 | 0 | 2 | 0 |
| 10 | 0 | 4 | 34.5 | 4 | 0 |
| 15 | 0 | 8 | 72.2 | 8 | 0 |
| 30 | 0 | 10 | 96 | 10 | 0 |
Proceso H2O2/UV
Los resultados de la aplicación del proceso H2O2/UV-C en agua simulada (Tabla 9) muestran que al cabo de un tiempo de irradiación de 5 minutos con una concentración de peróxido de hidrógeno de 10 mg/L, la concentración de metomilo se redujo en un 98,99%. De este modo, la degradación en agua simulada ocurre a pesar de tener la presencia de los iones carbonato, nitrato y cloruro que podrían haber causado interferencia en el proceso de degradación del metomilo. Como se demostró anteriormente, el metomilo sufre principalmente reacciones de fotolisis bajo irradiación UV-C en ausencia o presencia de H2O2, de esta manera los iones podrían afectar poco su degradación.
Proceso Ozonización
El resultado de la degradación de metomilo por el proceso de ozonización (Tabla 10) con las condiciones óptimas: concentración de ozono 0.07mg/L, pH 11 y tiempo de contacto de 10 min, no muestra una degradación de metomilo en las condiciones óptimas, ya que esta agua simulada contiene aniones interferentes nitratos (NO ), carbonatos (CO -2) y cloruros (Cl-), lo cual afecta en el proceso de ozonización. La existencia de cloruros conduce a un significante retraso en la ozonización en pH ácidos (menores a 4), el cloro reacciona con el ozono en condiciones acidas como se muestra en las ecuaciones 8 y 920.
Por lo tanto, a pH ácido, los iones cloruros pueden competir eficazmente con el ozono generando especies menos oxidantes20. Por otro lado, a un pH de 7 a más, es decir a pH alcalinos, baja la concentración de protones desactivando las reacciones anteriores y reduciendo la competencia del cloro con el ozono20. Entonces podemos asegurar que, a pH alcalino, la reacción del cloro con el ozono no interfiere en el proceso de ozonización.
También se puede evidenciar la existencia de carbonatos, lo cual afecta el proceso. Los iones carbonatos o bicarbonatos a valores de pH alcalinos son conocidos por su capacidad de secuestrar radicales •OH en el proceso ozonización reduciendo su eficiencia15,20.
Degradación de metomilo en Agua Real
Proceso fotofenton
La muestra de agua obtenida en el dren del P-05, colector final, en el sector agrícola de Uraca-Corire (ARB1-Agua Real Bruta 1), no se encontró presencia de metomilo (< 0.01 mg/L, límite de detección de técnica cromatografía liquida MS/MS). Para poder realizar una determinación adecuada de metomilo en aguas reales, se dopó la muestra con una concentración inicial de 10 mg/L. La degradación de metomilo en la matriz de agua real simulado la presencia del ingrediente activo, mediante el proceso foto-Fenton, fue de 94.12 % bajo un pH de 3.6. La concentración final alcanzada es de 0.59 ± 0,13 mg/L de Metomilo residual.
Proceso H2O2/UV
Bajo irradiación UV-C y presencia de 10 mg/L de H2O2 se observó una degradación del 99.38% de metomilo luego de 5 minutos de experimento (tabla 11), evidenciado que, a pesar de las condiciones complejas de la matriz, el proceso de degradación H2O2/UV es una tecnología efectiva para la degradación del contaminante. Probablemente la presencia de especies inorgánicas u orgánicas en estas aguas reales no absorben luz a longitudes de onda cercanas al máximo de absorción del pesticida (235 nm) evitando que se genere un efecto protector que evite la fotolisis de la molécula.
Proceso Ozonización
La degradación de metomilo en agua real por el proceso de ozonización con las condiciones óptimas: concentración de ozono 0.07 mgL-1, pH modificado 11 y tiempo de contacto de 10 min alcanzo una concentración de metomilo de 6 mgL-1, teniendo un 40% de degradación en condiciones óptimas. En este tipo de agua no se alcanzó una mayor degradación por la presencia de carbonatos, que secuestra los radicales •OH reduciendo la eficiencia del proceso de ozonización. Sin embargo, conociendo el complejo del agua real la degradación del metomilo se efectúa, es decir que el tratamiento mediante el proceso de ozonización en medio alcalino puede funcionar en agua reales.
CONCLUSIONES
La tasa de degradación para agua destilada fue de 100 % para el proceso Fotofenton, 99.57 % para el proceso UV-C/H2O2 y 96 % para el proceso de ozonización. Para el agua simulada, se alcanzó una degradación máxima de 23.14 % para el proceso Fotofenton, 98.99 % para el proceso UV-C/H2O2 y 0 % para el proceso de ozonización. Así mismo, para el agua real, se logró una degradación de 94.12 % para el proceso fotofenton, 99.38 % para el proceso UV-C/H2O2 y 40 % para el proceso de ozonización. Los resultados reportados en este trabajo demuestran que los procesos avanzados de oxidación utilizados no fueron tan efectivos en la remoción de metomilo en aguas reales superficiales, principalmente, aquellos procesos en los que la generación de radicales hidroxilos fueron los más afectados por la presencia de la matriz de agua real. Dicha matriz evidenció la presencia de aniones bicarbonato (HCO -) que pueden competir por los radicales •OH fotogenerados generando un radical menos oxidante como lo es el radical carbonilo (CO3•) afectando negativamente el proceso de degradación. Es importante considerar que en el proceso UV-C/H2O2 también participó un rol importante los procesos vinculados a la fotolisis del metomilo. Por eso razón, la presencia de bicarbonato en el medio no mostró generar un efecto negativo en los procesos UV-C/H2O2. Por su parte, los procesos UV-C/H2O2 parecieron inmunes a la presencia de matriz inorgánica u orgánica en las aguas reales. Esto se debió a que el metomilo bajo radiación UV-C mostró una fuerte reacción de fotolisis. La presencia del H2O2 y su concomitante generación de radicales •OH fotogenerados tuvo un efecto menor. De esta manera, la presencia de la matriz inorgánica que probablemente absorbe luz a longitudes de onda de mayor o menor energía que el metomilo no generó un efecto protector o de pantalla que evitara la degradación del pesticida.