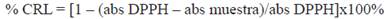INTRODUCCIÓN
En la actualidad ante la problemática de la acumulación y contaminación por plásticos y microplásticos que tardan muchos años en degradarse1,2, se están planteando alternativas ecológicas para paliar el impacto de estos productos al medio ambiente, dentro de estas propuestas destaca el empleo de biopolímeros que puedan sustituirlos3. Se está viendo por la generación de productos biodegradables y que además tengan un rol biológico, tales como las biopelículas o películas alimenticias funcionalizadas con diversos tipos de compuestos bioactivos, destacando los aceites esenciales4.
Las biopelículas constituyen una estrategia para asegurar la calidad alimentaria5, están formadas por polímeros del tipo polisacárido, influyen en los parámetros físicos y químicos, entre los que se incluyen la resistencia mecánica, elasticidad, permeabilidad de gases, humedad y transmisión de la luz. Estos parámetros se dividen en mecánicas de barrera, ópticas y estructurales6. Dentro de los polímeros más empleados en estas películas biodegradables, destaca el quitosano, polisacárido obtenido por desacetilación de la quitina de crustáceos, per se tiene capacidad antibacteriana, reduce la pérdida de agua al crear una barrera semipermeable que controla el intercambio de gases, entre otras propiedades fiscoquímicas7.
Las especies vegetales, especialmente las aromáticas, contiene una mezcla compleja de moléculas de naturaleza terapéutica, entre estas se encuentran compuestos con actividad antimicrobiana8,9. En nuestro país destaca la “muña” (Minthostachys mollis) una planta utilizada tradicionalmente como condimento, carminativo y digestivo en infusiones y tizanas, es conocida como “la menta de los andes”10. Uno de sus componentes más estudiados es su aceite esencial, rico en terpenos que le brindan propiedades antioxidantes11 y antimicrobianas12,13.
Existe evidencia del empleo de diversos tipos de aceites esenciales funcionalizados a matrices de quitosano para la obtención de películas alimenticias o biopelículas con rol biológico14, sin embargo, hasta el momento no hay estudios sobre la asociación quitosano - aceite esencial de muña, lo que motivó la presente investigación.
PARTE EXPERIMENTAL
Recolección de material biológico e identificación taxonómica
Las hojas de la especie Minthostachys mollis (muña) fue colectada en el poblado de Pomacochas, Bongará del departamento de Amazonas e identificados en el Museo de Historia Natural de la Universidad Nacional Mayor de San Marcos, siguiendo el sistema Cronquist (1988).
Obtención y caracterización química del aceite esencial
El aceite esencial de muña fue obtenido por el método de arrastre de vapor15 y caracterizado químicamente por CG-MS en la Unidad de Investigación en Productos Naturales de la UPCH. El aceite esencial fue caracterizado empleando el equipo CG-MS marca Agilent Technologies 7890 con detector de masas y columna de 60 m x 250 µms x 0.25 µm. Tiempo de corrida: 54 min; volumen de inyección: 1 µL; Split: 100 -1; gas portador: helio (1 ml/min)
Formulación y preparación de biopelículas
El quitosano de peso molecular medio se obtuvo de Sigma Aldrich, con grado de desacetilación entre 75% - 85% con respecto a la quitina proveniente de los caparazones de cangrejo.
La preparación de las soluciones se utilizaron tres concentraciones distintas de quitosano: 1%, 2% y 3% y tres concentraciones de aceite esencial de Minthostachys mollis “Muña”: 0,5%, 2% y 5%. Como medio para disolución se usó solución de ácido acético al 1% v/v. Adicionalmente se emplearon propilenglicol y glicerina como agentes plastificantes. El total de fórmulas experimentales preparadas se pueden observan en la tabla 1.
Tabla 1 Diseño de experimental de fórmulas para biopelículas de quitosano con aceite esencial de muña.
| QUIT % | AE % | PPG % | GLI % | AA 1% (csp) | |
| F1 | 3 | 5 | 2 | 5 | 100 |
| F2 | 2 | 0.5 | 2 | 5 | 100 |
| F3 | 1 | 2 | 2 | 5 | 100 |
| F4 | 1 | 0.5 | 2 | 5 | 100 |
| F5 | 3 | 0.5 | 2 | 5 | 100 |
| F6 | 3 | 2 | 2 | 5 | 100 |
| F7 | 1 | 5 | 2 | 5 | 100 |
| F8 | 2 | 5 | 2 | 5 | 100 |
| F9 | 2 | 2 | 2 | 5 | 100 |
| B1 | 1 | - | 2 | 5 | 100 |
| B2 | 2 | - | 2 | 5 | 100 |
| B3 | 3 | - | 2 | 5 | 100 |
QUIT: quitosano; AE: aceite esencial; PPG: propilenglicol; GLI: glicerina; AA: ácido acético
Una vez preparada la solución se vierten 20 mL en una placa Petri de plástico de 90 mm de diámetro y se deja secar en una estufa de aire circulante por 24 horas a 40 °C hasta la formación de una película plástica que posteriormente será sometida a evaluación de sus propiedades mecánicas, antioxidante y antimicrobiana.
Actividad antioxidante
La actividad antioxidante de las biopelículas se determinó según el método DPPH16; éste es un reactivo captador de radicales libres y reacciona con agentes con propiedades antioxidantes. Fueron evaluadas tanto para las biopelículas funcionalizadas con aceite esencial como para las biopelículas sin aceite esencial (blanco). La muestra de biopelículas fue disuelta en metanol hasta la concentración de 10 mg/mL. Interaccionan 0.8 ml de la muestra problema con 1.2 ml de DPPH (0.05 mM) por 30 minutos en oscuridad. La medida de la absorbancia del progreso de la reacción se hizo a 517 nm en un espectrofotómetro UV-visible. Todos los experimentos se llevaron a cabo por triplicado y los resultados se expresaron en porcentaje de captación de radical libre (% CRL).
Actividad antimicrobiana
La actividad antimicrobiana de las biopelículas formuladas se evaluó por el método de Kirby Bauer de difusión en agar frente a las cepas ATCC cultivadas de Escherichia coli, Staphylococcus aureus, Staphylococcus epidermidis y Aspergillus niger.
El inóculo de cada bacteria fue preparado transfiriendo la cepa pura a tubos concentrado 10 ml de caldo Mueller Hinton. La cepa de Aspergillus niger se trabajó en caldo Sabouraud dextrosa. El caldo inoculado se incubó a 37°C durante 24 horas.
Para la evaluación de zonas de inhibición se cortaron tiras de biopelículas de 1.5 cm de lado que fueron colocadas asépticamente en placas petri con agar Mueller Hinton y Sabouraud dextrosa donde previamente se habían sembrado los microorganismos. Finalmente, luego de incubación a 37 °C por 48 horas, se evaluó la zona de inhibición de crecimiento presente en las placas petri17.
Evaluación de la fuerza de tracción18
Para este ensayo se empleó un equipo de tracción en láminas, texturómetro digital AEL 200 y se aplicó el método ASTM D882. Las biopelículas fueron recortadas en tiras de 1.5 cm x 8 cm y presentar La fuerza de tensión fue medida en condiciones ambientales de 25°C, con una tasa de humedad relativa de 60%.
RESULTADOS Y DISCUSIÓN
El cromatograma de gases - masas del aceite esencial de Minthostachys mollis mostró 29 componentes terpénicos, de los cuales el mentona y pulegona se encontraron en mejor porcentaje (32 y 40% respectivamente, ver tabla 2), estos compuestos se encuentran en similares proporciones en otros ejemplares de muña y los asocian a notables actividades biológicas19.
Las biopelículas preparadas se pueden observan en la figura 1, la series F corresponde a las que llevan incorporado quitosano y aceite esencial de muña en las diferentes concentraciones de trabajo, mientras la serie B trata de los blancos de biopelículas que únicamente tenían quitosano en su composición. Cada una de estas fue sometida a los ensayos de actividad antioxidante, antimicrobiana y evaluación de propiedades mecánicas.
Tabla 2 Composición química del aceite esencial de Minthostachys mollis (“muña”).
| N° | Compuesto | tR (min) | Abundancia relativa (%) |
|---|---|---|---|
| 1 | α-Pineno | 13.38 | 0.56 |
| 2 | Sabineno | 14.63 | 0.25 |
| 3 | β-Pineno | 14.87 | 0.73 |
| 4 | β-Mirceno | 15.01 | 0.42 |
| 5 | 3-Octanol | 15.22 | 0.35 |
| 6 | p-Cimeno | 16.3 | 0.54 |
| 7 | D-Limoneno | 16.46 | 1.92 |
| 8 | cis-Ocimeno | 16.85 | 0.33 |
| 9 | γ-Terpineno | 17.36 | 1.04 |
| 10 | β-Linalool | 18.55 | 1.66 |
| 11 | Mentona | 20.56 | 32.72 |
| 12 | Isopulegona | 21.11 | 1.09 |
| 13 | trans-Dihidrocarvona | 21.79 | 1.85 |
| 14 | Pulegona | 23.05 | 40.94 |
| 15 | D-Carvona | 23.15 | 3.67 |
| 16 | Piperitona | 23.47 | 1.42 |
| 17 | Isotimol | 24.51 | 0.53 |
| 18 | Metileugenol | 25.14 | 0.39 |
| 19 | Acetato de Timol | 25.81 | 0.32 |
| 20 | Eucarvona | 25.88 | 0.74 |
| 21 | Carvacrol | 26.35 | 0.99 |
| 22 | Acetato de Geraniol | 26.58 | 0.97 |
| 23 | β-Cariofileno | 28.22 | 2.77 |
| 24 | Metilisoeugenol | 28.87 | 0.55 |
| 25 | α-Cariofileno | 29.17 | 0.4 |
| 26 | Germacreno D | 29.82 | 0.71 |
| 27 | Biciclogermacreno | 30.22 | 1.07 |
| 28 | Elemicino | 30.57 | 0.34 |
| 29 | Isoelemicino | 33.74 | 0.73 |
La actividad antioxidante de las biopelículas se evaluó por el porcentaje de captación de radical libre DPPH de acuerdo al diseño experimental visto en la tabla 1 (tanto quitosano como aceite esencial a tres concentraciones y el blanco corresponde a biopelículas sin aceite esencial), los resultados se observan en la Figura 2, la tendencia indica que la incorporación del aceite esencial de muña a las biopelículas tiene una relación directa con la actividad antioxidante, destacando la fórmula que lleva 5% de aceite esencial que presenta porcentaje de captación de radical libre DPPH mayor al 60% a diferencia de las biopelículas blanco que poseen una actividad antioxidante reducida (menor al 20 %). La actividad antioxidante de las biopelículas con solo quitosano se debe a la interacción de grupos amino en C2 e hidroxilos a lo largo de la molécula20,21. Las biopelículas funcionalizadas con aceite esencial de M. mollis (muña) aumenta la capacidad antioxidante por los compuestos terapéuticos del aceite esencial, esta observación está de acuerdo con Granados y col22.

Figura 1 Biopelículas formuladas. La serie F (F1 a F9) son las biopelículas de quitosano con aceite esencial de muña, mientras que la serie B (B1 a B3) son las biopelículas de quitosano sin aceite esencial añadido.
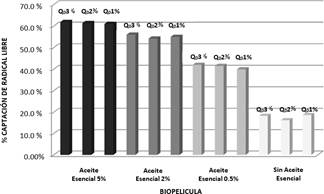
Figura 2 Actividad antioxidante de biopelículas por captación del radical libre DPPH En cuanto a la actividad antimicrobiana, según el método Kirby Bauer que evalúa diámetro de halo de inhibición en zonas de crecimiento de microorganismos frente a las muestras de biopelículas, se observan los resultados en la figura 3.
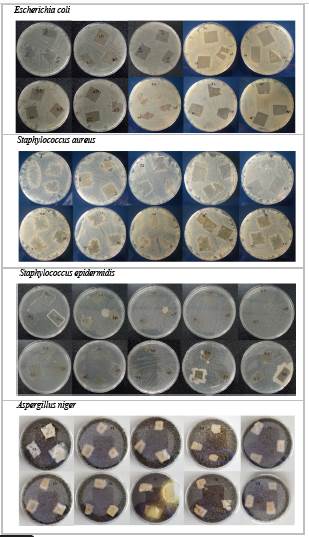
Figura 3 Actividad antimicrobiana de biopelículas frente a cepas de bacterias y fúngica De acuerdo a los resultados en ninguno de los casos se observó halos de inhibición para medición, por lo que se adoptó el criterio de inhibición en zona de aplicación, porque la muestra de biopelícula sólida difícilmente puede difundir sus componentes17,23 por medio de agar al encontrarse sólida y no en forma líquida. En las placas con cepas bacterianas de Escherichia coli, Staphylococcus aureus, Staphylococcus epidermidis se observa inhibición en zona de contacto tanto para biopelículas con aceite esencial como los blancos, mientras en las placas con cepa fúngica de Aspergillus niger se observa que debajo de la zona de aplicación solo las biopelículas con aceite esencial inhibían crecimiento, mas esto no sucedió en los blancos de biopelículas de quitosano.
Un criterio cualitativo adicional a considerar fue el índice de severidad24 que evalúa el compromiso y/o afectación de las biopelículas al estar en contacto con microorganismos; en los enfrentamientos microbianos vistos se observó que las cepas bacterianas presentaron un índice de severidad tal como 1 (1 - 24 % de afectación de biopelícula).
Recomienda Nevena Hromis y col17 se emplee el método ASTM E2149 que mediante contacto dinámico de biopelículas permite evaluar la actividad antimicrobiana cuantitativamente, esto debido a la baja tasa de difusión del activo en la matriz de quitosano.
Tabla 3 Evaluación de fuerza de tracción a biopelículas.
| Muestras | Fuerza de tracción (MPa) |
| B1 (1% Q) | 17.73 |
| B2 (2% Q) | 12.93 |
| B3 (3% Q) | 12.53 |
*F1-F9 (No evidenciaron resultados en texturómetro)
La fuerza de tracción (MPa) se determinó dividiendo la carga máxima (N) por el área de sección transversal inicial de la biopelícula (el área de la biopelícula fue 7.5 x 10-5 m2). Todas las biopelículas analizadas presentaron semejante espesor (+/- 5%) al ser sometidas a este ensayo. La incorporación de aceite esencial a la biopelícula ocasiona la disminución a la tensión, en comparación cuando la biopelícula que solo tiene quitosano (ver tabla N° 3), donde si se observaron resultados del texturómetro digital AEL 200 (figura 4) con valores de 17.73, 12.93 y 12.53 MPa para las concentraciones de quitosano de 1, 2 y 3 % respectivamente. La fuerza de tensión obtenida para los blancos es menor a lo reportado en la literatura (30-100 MPa)25, probablemente por la influencia del propilenglicol empleado en la formulación con agente emulsificante para facilitar la incorporación del aceite esencial de muña. En estudios previos se ha encontrado que la interrupción de las agregaciones de la cadena de quitosano facilita el desplazamiento de la cadena durante el estiramiento, lo que le da a la biopelícula una mayor capacidad de deformarse sin romperse26.
CONCLUSIONES
Los principales componentes del aceite esencial de muña fueron la mentona y pulegona cuyo porcentaje de abundancia determinado por CG-MS fue de 32.72 y 40.94 respectivamente, los cuáles en parte son responsables de la actividad antioxidante. Las biopelículas formuladas con aceite esencial mostraron notable captación de radicales libres, mientras que su rol antimicrobiano fue principalmente en zona de contacto. Finalmente, solo las biopelículas blanco con quitosano presentaron propiedades tensiles.