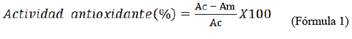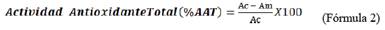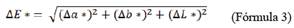INTRODUCCIÓN
Las antocianinas son pigmentos solubles en agua, por lo que son fácilmente incorporadas en sistemas alimentarios acuosos. Las investigaciones reportan que las antocianinas son estables en un rango de pH 2 - 4. Estas cualidades hacen que estos colorantes naturales sean atractivos, no sólo por su color, sino principalmente porque se ha demostrado sus beneficios para la salud como excelentes antioxidantes, además, poseen actividad anti - inflamatoria, antineoplásica, vasoprotectora, vasotónica y hepatoprotectora1.
Estos colorantes naturales se suelen usar para mejorar la aceptabilidad de ciertos productos alimentarios, haciéndolos más atractivos y evitando el uso de colorantes sintéticos cuya seguridad ha sido cuestionada. Los colorantes alimentarios sintéticos se han utilizado durante muchos años debido a su menor costo y mayor estabilidad2, pero recientemente han suscitado la preocupación del público en cuanto a su seguridad para la salud humana. Muchos estudios han aportado pruebas científicas sobre los posibles efectos adversos de los colorantes sintéticos en la salud de los niños. Uno de ellos fue el desarrollado por Hallagan y Lauro, todavía en 1991 3, quienes reportaron que países como Japón, Austria, Suecia y Noruega han prohibido los colorantes rojo No. 2 y No. 40 porque fueron relacionados con la hiperactividad de niños en edad escolar, considerándose éste un mal neuronal agudo4,5.
Mota et al, (2021)6 realizaron una revisión basada en la normativa internacional y los riesgos para la salud asociados al consumo de colorantes artificiales en países como Estados Unidos, la Unión Europea, Australia, Nueva Zelanda, Japón, Brasil, China e India, habiendo concluido que, los colorantes sintéticos pueden causar serios efectos adversos.
El mercado de los antioxidantes naturales está creciendo exponencialmente cada año debido a que muchos de estos compuestos son eficaces contra problemas cardiovasculares, cancerígenos, neurodegenerativos y oxidativos asociados al envejecimiento7,8.
La actividad antioxidante de las antocianinas es bien conocida9, por lo que son componentes bioactivos utilizados como ingredientes nutracéuticos y farmacéuticos, pero además se suelen usar como colorantes alimentarios naturales.
El género Berberidaceae presenta unas 500 especies alrededor del mundo, de las cuales casi 99 se distribuyen en Sudamérica, y cerca de 32 se encuentran en Perú y 14 son endémicas10. Se caracterizan por ser arbustos espinosos caducifolios de hoja perenne, flores amarillas (3 - 6 mm de largo), y pequeñas bayas rojas o azules cuando están maduras (5 - 15 mm)11.
Berberis boliviana y Berberis humbertiana son bayas silvestres que crecen en el Perú, especialmente en la región altoandina, entre los 3500 y 4200 m de altura. Los frutos púrpuras completamente maduros están disponibles desde febrero hasta finales de abril de cada año y contienen antocianinas y componentes fenólicos como principales constituyentes fitoquímicos. Muchas bayas silvestres comestibles se han consumido como una importante fuente de suplementos nutritivos desde la antigüedad12.
Por todas estas razones es importante dar a concocer los resultados obtenidos sobre los colorantes antociánicos extraídos de estas dos especies de Berberis, que podrían tener un alto potencial de industrialización.
PARTE EXPERIMENTAL
Material vegetal
Los frutos maduros de B. boliviana y B. humbertiana maduros, frescos (500 g) e intactos, sin grietas, cortes o manchas, fueron cosechados manualmente en el valle de Pumahuanca en Urubamba, Cusco. Los frutos se secaron a 8 - 10°C bajo sombra durante 2 meses. Las plantas fueron identificadas por Tupayachi Herrera, y se depositó un voucher en el herbario Vargas CUZ de la Universidad Nacional de San Antonio Abad del Cusco (UNSAAC).
Extracción de las antocianinas usando solventes de grado alimentario
La extracción de antocianinas suele realizarse usando solventes ácidos como metanol con HCl, etanol con HCl, así como acetona y cloroformo. Sin embargo, en nuestro estudio decidimos usar mezclas de etanol 96 acidificado a pH 3,5; etanol 96: agua (50:50) a pH 3,5; agua acidificada a pH 3,5. En todos los casos se usó ácido cítrico para conseguir la acidez.
Actividad antioxidante de los extractos antociánicos
Inhibición frente al radical libre 2,2-difenil-1-picrilhidrazilo (DPPH).
Se pesó 1,0 mg de DPPH y se disolvió con 50,0 mL de metanol, obteniendo una concentración de 0,05 mM. Se comprobó la absorbancia a 517 nm, la que debe estar entre 0,7 y 0,8. Se colocó 0,50 mL de cada concentración de los extractos antociánicos en tubos de ensayo, se adicionó 2,0 mL de la solución de DPPH, se homogenizó y se dejó por 35 minutos en la oscuridad. Luego se midió la absorbancia de las soluciones a 517 nm. La curva patrón se trazó usando como antioxidante patrón TROLOX. Para calcular la actividad antioxidante se usó la fórmula:
Decoloración del radical ABTS·+ (ácido 2,2′-azino-bis (3-etilbenzotiazolina-6-ácido sulfónico)).
Se pesó 77,6 mg de ABTS y se disolvió con 20,0 mL de agua destilada, obteniéndose una concentración de 7 mM. Luego se pesó 13,2 mg de persulfato de potasio y se disolvió con agua destilada hasta alcanzar una concentración de 2,45 mM, haciendo reaccionar ésta con la solución de ABTS en un frasco ámbar en la oscuridad durante 12 a 16 horas a T° ambiente. Esta solución fue diluida usando metanol hasta obtener una absorbancia de 0,7± 0,02 nm a 734 nm. Se colocó 100 µL de cada concentración de los extractos antociánicos en tubos
de ensayo, se adicionó 2 900 µL de solución de ABTS a cada tubo, se homogenizó y dejó reaccionar durante 35 minutos en la oscuridad, pasado este tiempo se midió la absorbancia a 734 nm. Como antioxidante de referencia se usó Trolox en un rango de concentración de 0-15 µM. Los cálculos de la actividad antioxidante total se hicieron usando la siguiente fórmula:
Obtención del extracto liofilizado
El extracto liofilizado se preparó pesando 6,0 g de frutos secos de cada una de las especies de berberis y se llevó a maceración con 100 mL de la solución de etanol 96 acidificado con ácido cítrico a pH 3,5. Luego el etanol fue evaporado en un rotavapor y se le añadió 3,0 mL de agua acidulada con ácido cítrico (pH 3,5), posteriormente esta solución fue sometida a liofilización por 24 horas.
Determinación de pH, color y actividad antioxidante de los yogures
Las muestras de yogurt a las cuales se incorporó los extractos liofilizados de B. humbertiana y
B. boliviana a las concentraciones de 80 y 100 mg / 50 g de yogurt y los yogures comerciales se analizaron en cuanto a pH, color y actividad antioxidante. El pH fue medido con un equipo Jenway 3510 pH meter (Metrix Laboratorios, Mexico City, Mexico). El color se midió con un equipo Chroma Meter CR-300 (Konica Minolta, Japón), a través del sistema de color CIE L, a*, b*, chroma. Para mostrar la diferencia de color entre los yogures coloreados con los extractos antociánicos (m = muestra) y los yogures comerciales (ref = referencia) se estableció la diferencia global de color usando la siguiente fórmula:
Para el análisis de la actividad antioxidante, se pesó 10,0 g de cada yogurt, se centrifugó a 6000 rpm por 20 minutos, obteniendo los sobrenadantes que fueron usados para determinar la actividad antioxidante por el método de DPPH.
RESULTADOS Y DISCUSIÓN
Extracción de las antocianinas usando solventes para uso alimentario
El solvente con más porcentaje de extracción fue el etanol 96 con ácido cítrico a pH 3,5 como se muestra en la Tabla 1.
Tabla 1 Porcentaje de extracción de antocianinas de B. humbertiana y B. boliviana.
| Solvente | Especie | % de extracción |
|---|---|---|
| Etanol 96 con ácido cítrico a pH 3,5 | B. humbertiana | 65,82 |
| B. boliviana | 63,33 | |
| Etanol 96/agua con ácido cítrico a pH 3,5 | B. humbertiana | 51,3 |
| B. boliviana | 52,42 | |
| Agua con ácido cítrico a pH 3,5 | B. humbertiana | 19,3 |
| B. boliviana | 24,6 |
La extracción de antocianinas puede realizarse con varios solventes debido a su carácter polar, lo que permite su solubilidad en agua, etanol o metanol. Pero más eficaz es el uso de metanol acidificado con HCl. Sin embargo, debido a la naturaleza tóxica del metanol normalmente para sistemas alimentarios se utiliza agua o etanol acidificado con HCl. Se sabe además que, las condiciones de extracción como la temperatura, la relación sólido-líquido, el tiempo, la concentración de solvente y el tipo de solvente influyen en la concentración de antocianinas extraídas, así como en su estabilidad. Asimismo, es importante considerar que, se debe elegir el método de extracción más adecuado en función de la aplicación que se le dará, y más si se quiere usar las antocianinas con fines alimentarios. En su estudio, Gorriti- Gutiérrez et al. (2009)13 establecieron que, las mejores condiciones para extraer antocianinas de las corontas de maíz morado son el uso de soluciones etanólicas, un tiempo de extracción entre 2 y 4 horas, una temperatura de 75 °C, y un pH entre 2 y 4. Un resultado muy parecido al nuestro fue obtenido por Miranda-Medina et al., (2018)14, cuyo modelo de optimización mostró que con etanol 96 % y una temperatura de 65 °C, se obtuvo la mayor concentración de antocianinas de Hibiscus sabdariffa L.
La idea de utilizar etanol de 96° en lugar de agua como solvente de extracción presente ventajas en pasos posteriores del proceso, como la concentración del extracto, es decir, una evaporación del solvente rápida y menos exigente en energía, una condición que preserva mejor la química de las antocianinas, además el etanol a diferencia del agua impide el crecimiento de microorganismos que podrían contaminar el extracto. Otro estudio desarrollado por Peluru y Abram (2021)15 evidenció que el solvente ácido más eficaz utilizado en la extracción de antocianinas de la piel del fruto de Cayratia trifolia L. fue el etanol al 96% con HCl al 1%, en comparación con la adición de ácido cítrico al 3% y ácido acético al 3%.
Actividad antioxidante de los extractos antociánicos usando los métodos de DPPH y ABTS
Tabla 2 Porcentaje de actividad antioxidante de los extractos antociánicos.
| DPPH | ABTS | |||
| Actividad antioxidante (%) | Actividad Antioxidante Total (% AAT) | |||
| Concentración (mg / mL) | B. Boliviana | B. Humbertiana | B. Boliviana | B. Humbertiana |
| 0,0313 | 16,36 | 35,07 | 11,95 | 24,70 |
| 0,0625 | 22,43 | 41,39 | 12,62 | 21,38 |
| 0,125 | 23,79 | 50,93 | 17,80 | 24,44 |
| 0,25 | 45,23 | 57,00 | 26,16 | 32,02 |
| 0,5 | 49,19 | 62,70 | 43,56 | 50,46 |
| 1,0 | 57,13 | 69,14 | 78,75 | 82,60 |
Como se aprecia en la Tabla 2, la actividad antioxidante del extracto antociánico de B. humbertiana es mayor que la de B. boliviana, tanto en el ensayo DPPH como ABTS, destacando que a mayor concentración existe mayor actividad antioxidante.
Nistor et al., (2021)16 estudiaron las antocianinas de zanahoria negra y chokeberry, logrando una extracción más eficiente con etanol y metanol que con acetona y agua, ambos extractos mostraron tener la mayor actividad antioxidante mediante el ensayo de ABTS.
Las antocianinas son el grupo más importante de flavonoides en las plantas, son pigmentos con una estructura de catión flavilio (AH+) que actúan como ácido. Esta estructura está directamente relacionada con su actividad antioxidante. La mayoría de las propiedades funcionales y la calidad sensorial de las antocianinas se explican por su reactividad química. Las estructuras y propiedades de las antocianinas dependen de diferentes factores, como el pH, la temperatura y los disolventes, que deben controlarse para llevar a cabo estudios de su actividad antioxidante17.
Obtención del extracto liofilizado de B. humbertiana y B. boliviana
Los extractos liofilizados de B. humbertiana y B. boliviana presentaron las siguientes características: Color magenta, sabor ácido, ambos muy solubles en agua y un porcentaje de extracción de 26,45% y 31,26% respectivamente.
Determinación de pH, color y actividad antioxidante de los yogures
Las antocianinas son estables a un pH bajo. El pH es muy importante para el color de las antocianinas, algunas son rojas en soluciones ácidas, violetas o púrpuras en soluciones neutras y azules en pH alcalino. La razón de esto es la presencia del catión flavilio en su estructura química, a bajo pH la molécula está protonada y forma un catión, a medida que aumenta el pH las moléculas se desprotonan, y a un pH alto la molécula forma un anión. Esta es la razón por la que la mayoría de los colorantes que contienen antocianinas sólo pueden utilizarse a valores de pH inferior a cuatro18. Como se muestra en la Figura 1, los yogures que contienen el extracto liofilizado de B. humbertiana y B. boliviana a la concentración de 80 mg presentan un pH de 4.13, en tanto que aquellos que contienen 100 mg presentan un pH de 4,16. El yogurt sin color presenta un pH de 4,18 que es característico de los yogures naturales a los que no se han incorporado ningún colorante artificial. Los yogures comerciales A y B de color y sabor a fresa tienen un pH mayor, 4,98 y 4,88 respectivamente.
Estos resultados muestran que, los extractos liofilizados de ambas especies de Berberis ejercen un efecto modulador del pH haciéndolo más ácido que la matriz sin color a la cual fueron incorporados, lo que garantiza la estabilidad de las antocianinas y del yogurt mismo.
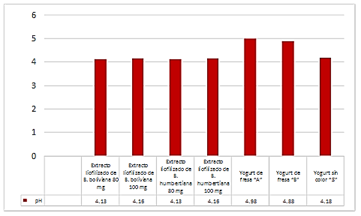
Figura 1 Valores de pH de los yogures coloreados con los extractos antociánicos y de los yogures comerciales.
Como se observa en la Figura 2, los yogures que contienen los extractos liofilizados de B. humbertiana y B. boliviana, muestran una elevada actividad antioxidante. Es importante destacar que, la muestra de yogurt usada para incorporar los extractos liofilizados de B. boliviana y B. humbertiana, mostró una baja actividad antioxidante alcanzando únicamente el 15,61% en el ensayo de DPPH, en tanto que el mismo yogurt al cual se le añadió 80 y 100 mg del extracto liofilizado de B. humbertiana alcanzó 91,45 % y 93,31% de actividad antioxidante respectivamente, en tanto que, con el extracto liofilizado de B. boliviana a las mismas concentraciones alcanzó 85,25% y 91,10% respectivamente, esto demostró que, los extractos liofilizados de ambas especies, incrementan notablemente la actividad antioxidante de la matriz de yogurt sin color. En el caso de los yogures con sabor y color a fresa comerciales, en caso del yogurt A alcanzó una actividad antioxidante de 62,33% y el yogurt B alcanzó una actividad antioxidante de 75,1%, ambos porcentajes están por debajo de los yogures con los extractos liofilizados de las especies de berberis.
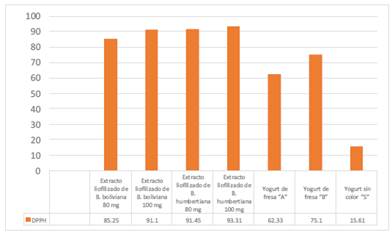
Figura 2 Porcentaje de actividad antioxidante de los yogures coloreados con los extractos liofilizados de B. humbertiana y B. boliviana y de los yogures comerciales.
En la Tabla 3, se presentan los resultados de los índices de color medidos usando el espacio de color CIEL*a*b*, en la actualidad uno de los más usados para evaluar el color de los alimentos19. El valor de L*, representa la medida de luminosidad, que va de cero para negro hasta 100 para blanco. El valor de a* será positivo cuando se tenga contenido de rojo y será negativo cuando se tenga contenido de verde. El valor de b* será positivo cuando se tenga contenido de amarillo y será negativo cuando el contenido de color sea azul.
En base a la información anterior, podemos establecer que en todos los casos (Tabla 3) se tienen colores de luminosidad más cercanos al blanco, pues todos los valores se encuentran en el rango de 70,65 a 75,32. El valor de a* en todos los casos es positivo, por lo que se deduce que todos los yogures evaluados presentan contenido de color rojo. El valor de b* en todos los casos es positivo también, lo que significa un contenido de color amarillo.
Tabla 3 Índices de color CIEL*, a* y b* de los yogures coloreados con los extractos liofilizados y de los yogures comerciales.
| N° | Muestra de yogurt | L | a* | b* |
|---|---|---|---|---|
| 1 | B. boliviana 80 mg | 71,29 | +9,16 | +2,39 |
| 2 | B. boliviana 100 mg | 70,65 | +9,66 | +2,09 |
| 3 | B. humbertiana 80 mg | 74,46 | +6,65 | +3,61 |
| 4 | B. humbertiana 100 mg | 73,10 | +7,67 | +2,98 |
| 5 | Yogurt de fresa “A” | 75,32 | +9,67 | +2,08 |
| 6 | Yogurt de fresa “B” | 73,21 | +16,13 | +2,29 |
| 7 | Yogurt sin color “S” | N. D | N. D | N. D |
Una de las propiedades más importantes que determinan la calidad de los productos alimentarios es el color. El color tiene un papel importante en la aceptación de los productos alimentarios por parte de los consumidores. Si un producto alimentario no tiene un color adecuado, su valor de mercado puede verse debilitado.
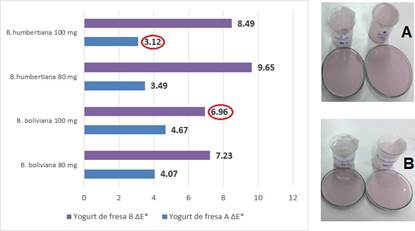
Para establecer cuál de los extractos liofilizados de las especies de Berberis y en qué concentración se asemeja más al color de los yogures comerciales de color y sabor a fresa, A y B, se estableció la diferencia global de color (∆E). La Figura 3 muestra la variación de la diferencia de color total (ΔE) de las muestras. Si ΔE es más de 10, muestra una severa destrucción del color que no puede verse a simple vista20.
En esta investigación, se establece que la muestra de yogurt que tuvo la menor diferencia de color total (ΔE) y que es menor a 10, en comparación con los yogures comerciales A y B es aquella que cumple con la tolerancia de color, que se define como la diferencia máxima de color que puede ser admitida para un producto de fabricación en comparación con un estándar que el consumidor considera ideal. En ese sentido, de acuerdo con los valores de ΔE mostrados en la Figura 3, el yogurt que contiene 100 mg de B. humbertiana en color es más parecido al yogurt comercial A (ΔE = 3,12), y el yogurt que contiene 100 mg de B. boliviana en color es más parecido al yogurt comercial B (ΔE = 6,96).
CONCLUSIONES
Los extractos etanólicos 96 acidificados a pH 3,5 con ácido cítrico y liofilizados de Berberis humbertiana y Berberis boliviana a las concentraciones de 80 mg y 100 mg / 50 g de yogurt, demostraron mantener el pH ácido logrando estabilizar las antocianinas y la matriz de yogurt, además logran una coloración muy similar a los yogures comerciales porque la diferencia global de color (∆E) es baja y presentaron mayor actividad antioxidante que los yogures comerciales.