INTRODUCCIÓN
El Perú es considerado uno de los países megadiversos del mundo, pues cuenta con más de 60 ecosistemas diferentes, en donde crecen cerca de 25000 plantas diferentes1, las cuales son utilizadas con fines decorativos, alimenticios y medicinales. Tal es el caso del Yawar Panga (Aristolochia cf. Cauliflora Ule. o Aristolochia Didyma)2, cuyo nombre proviene de dos palabras en quechua, “yawar” que significa sangre y “panga” que es hoja ancha, cuya traducción del quechua al español es hoja ancha de sangre, debido a que al cortarse sus ramas liberan un líquido rojizo, similar a la sangre.
La familia a la cual pertenece el Yawar Panga, Aristolochiaceae, cuenta con 7 géneros y 625 especies diferentes3.
En esta familia de plantas se presenta comúnmente el alcaloide denominado ácido aristolóquico, el cual posee actividad antitumoral y antimicrobiana4, pero que genera problemas renales al ser consumido5.
El Yawar Panga actualmente se usa en medicina tradicional en razón a sus propiedades eméticas. Así, en el Centro Takiwasi (Tarapoto, Perú) la utilizan para la etapa inicial de desintoxicación de sus pacientes, mediante la ingesta de la decocción acuosa de sus hojas2.
En la bibliografía no se ha publicado estudios relativos a la composición química de las hojas de Yawar Panga, ni de ninguna otra parte de la planta.
Por ello teniendo en cuenta los resultados del análisis cualitativo, decidimos estudiar los esteroles y flavonoides presentes en las hojas de Yawar panga.
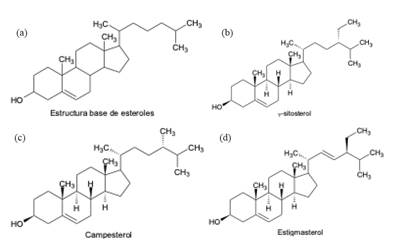
Los esteroles, Figura 1, son un tipo de metabolitos secundarios ampliamente distribuidos en las plantas, siendo el β-sitosterol, el principal esterol presente en plantas, junto con el estigmasterol y el campesterol. El γ-sitosterol es un 24β-epímero del β-sitosterol6 y se ha publicado muy poco acerca de él. Los sitosteroles se diferencian del estigmasterol solo en que la cadena lateral del sitosterol es saturada7.
Los esteroles de origen vegetal presentan varias propiedades farmacológicas. Su consumo favorece la reducción de los niveles de colesterol8. El γ-sitosterol exhibe un amplio rango de actividad citotóxica frente a células cancerosas9. El estigmasterol inhibe marcadamente los tumores en carcinogénesis en ratas y se ha verificado que posee potenciales propiedades antiinflamatorias10 .
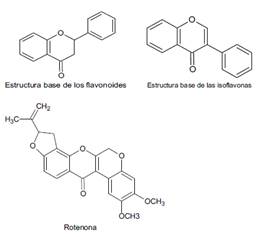
Los flavonoides, Figura 2, constituyen los compuestos de mayor distribución en las plantas, encontrándose principalmente en forma de agliconas. Durante mucho tiempo se emplearon como colorantes, y actualmente como conservantes por sus propiedades antioxidantes. Además, poseen características antiinflamatorias y antibacterianas11. Los flavonoides se clasifican en flavonas, isoflavonas, chalconas y auronas, Figura 2. Uno de los ejemplos más conocidos de isoflavonas es la rotenona, un flavonoide que se extrajo por primera vez de las raíces de las plantas de los géneros Lonchocarpus y Derris12. Desde 1985 se utilizó como pesticida e insecticida natural eficaz contra chinches y acaros13, hasta que en 2007 fue catalogado como toxina ambiental.
A continuación, se describe el estudio químico cualitativo y el análisis mediante cromatografía de gases acoplada con espectrometría de masas (CG-EM) que permitió la identificación de tres esteroles presentes en las hojas de Yawar panga, γ-sitosterol, campesterol y estigmasterol. Además, se aisló el flavonoide rotenona y su estructura fue confirmada por resonancia magnética nuclear de 1H y 13C (RMN 1H y RMN 13C), por espectrometría de masas (CG-EM) y por espectroscopía infrarroja con transformada de Fourier (FTIR).
PARTE EXPERIMENTAL
Materiales y equipos
Para las cromatografías en capa fina (CCF) se utilizaron placas de silica kieselgel 60 F254 de 0,2 mm de espesor, con base de aluminio (Riedel de Haёn). Las cromatografías en columna (CC) y la columna flash (CF) se realizaron sobre silica gel de un poro de 60 Å y un tamaño de partícula de 40-63 µm (Sigma Aldrich), así como también se utilizó sephadex LH-20 (GE Healthcare). Las placas preparativas (PP) fueron PLC Silica Gel 60 F25 de 2 mm de espesor, con base de vidrio de 20 x20 cm Merck Millipore.
Los análisis de identificación de esteroles y de la rotenona se realizaron por CG-EM SHIMADZU, GC-2010 Plus, con automuestreador AOC-6000, y detector de espectrometría de masas SHIMADZU, GCMS-QP210 Ultra.
Además, para la identificación estructural de la rotenona se obtuvieron los espectros de RMN 1H y RMN 13C, que se registraron en la plataforma de RMN del Institut de Chimie de Toulouse - Francia, con un espectrómetro Bruker Avance de 300 MHz y el espectro FTIR por un IR marca Perkin Elmer modelo Spectrum 400IR/NIR.
Material vegetal
Las hojas de Yawar Panga (Aristolochia cf. Cauliflora Ule) se recolectaron en el Jardín Botánico del Centro de Rehabilitación de Adicciones y de Investigación de Medicinas Tradicionales - Takiwasi, el 11 de febrero de 2014, bajo lluvia, por el Dr. Victor Reyna P. y fueron identificados por el Blgo. Severo Baldeon (Herbario San Marcos, Museo de Historia Natural de la Universidad Nacional Mayor de San Marcos).
La muestra vegetal se secó a 40 °C y se guardó en recipientes herméticos (febrero 2014), siendo nuevamente puestas a secar a 40 °C durante 5 días y pulverizadas en un molino doméstico previo al inicio del trabajo químico (noviembre 2018).
Análisis cualitativo
El análisis cualitativo (marcha fitoquímica) se realizó por duplicado según el procedimiento adaptado de Rondina & Coussio14.
Aislamiento de rotenona e identificación de esteroles
Extracción
Las hojas secas y pulverizadas (500 g) de Yawar Panga se extrajeron por maceración a temperatura ambiente con éter de petróleo durante periodos de 1, 2, 3 y 4 días, respectivamente, juntándose los extractos obtenidos.
El extracto líquido se concentró en rotavapor a 40°C y se obtuvo 4,54 g del extracto bruto orgánico de éter de petróleo (EBO/éter).
A continuación, el material sólido se extrajo por maceración, a temperatura ambiente, con diclorometano y, luego, con etanol, obteniéndose los extractos brutos orgánicos de diclorometano (10,82 g) y etanol (4,37 g), EBO/diclorometano y EBO/etanol, respectivamente.
Separación y purificación de esteroles mediante cromatografía de EBO/éter y EBO/ diclorometano
El extracto de EBO/éter (4,54 g) se sometió a dos CC, una tras otra, utilizando como eluyentes mezclas de éter de petróleo, acetato de etilo, cloroformo y metanol. Las fracciones obtenidas en cada CC se analizaron por cromatografía de capa fina (CCF) frente a un patrón de ergosterol, lo cual permitió agrupar aquellas que tenían un comportamiento similar al ergosterol, obteniéndose 168 mg de una muestra, que denominamos muestra E, de cristales blancos con impureza amarilla.
El extracto de EBO/diclorometano (10,82 g) se separó por columna flash (CF), utilizando como eluyentes mezclas de éter de petróleo, acetato de etilo, cloroformo y metanol. Aquellas fracciones con comportamiento similar al ergosterol en CCF, se juntaron y volvieron a separar esta vez por CC utilizando como eluyentes combinaciones de los solventes ya mencionados. Nuevamente, se juntaron las fracciones con comportamiento similar al ergosterol en CCF. Finalmente, se purificaron por placa preparativa (PP), realizando tres veces la elución con una mezcla de éter de petróleo y acetato de etilo (relación nueve a uno); se reveló con luz UV a 265 nm y se colectó la silica gel donde se observaba bandas coloreadas similares al ergosterol, la cual se extrajo con diclorometano, obteniéndose 120 mg de cristales blancos (muestra D).
Identificación de esteroles mediante CG-EM
Se analizaron las muestras D y E (ricos en esteroles). Para ello, se disolvió 1 mg/1 mL de la muestra en diclorometano. 1 µL de cada muestra se inyectó utilizando un Split de 10:1, con un flujo de 1 mL/min, con una temperatura del inyector, de la interfase y del detector, iguales a 250 °C, 220 °C y 200 °C, la temperatura de la columna varió de 240 °C hasta 265 °C a una velocidad de 10 °C/min., permaneciendo en 265 °C durante 40 min.
Purificación de rotenona a partir del EBO/etanol
El EBO/etanol (4,37 g) se sometió a partición líquido-líquido (PLL) con butanol, cloroformo y agua, obteniéndose tres fracciones, uno por cada solvente: Gbutanol (0,9 g), Gcloroformo (2,4 g), y Gagua (0,9 g). La fracción de Gcloroformo (2,4 g) se procesó mediante una columna de sephadex, con éter de petróleo, diclorometano y metanol, obteniéndose fracciones por cada solvente utilizado, las cuales al ser concentradas en rotavapor a 40 °C proporcionaron las fracciones Ge (1,2 g), Gd (0,6 g) y Gm (0,3 g). Gd (0,6 g) presentaba cristales con impurezas crema, motivo por el cual se realizó su purificación mediante CC, utilizando como eluyentes combinaciones de éter de petróleo, acetato de etilo, cloroformo y metanol. Las fraccione obtenidas se analizaron por CCF y se obtuvo 159 mg (muestra R) de un sólido-polvo de color crema con una sola mancha en CCF.
Identificación de rotenona por CG-EM y FTIR
Se disolvió 1 mg de la muestra R en 1 mL de diclorometano. 3 µL de la disolución se inyectaron con un Split de 20:1, con un flujo de 3 mL/min, con una temperatura del inyector, de la interfase y del detector, iguales a 250 °C, 220 °C y 200 °C, respectivamente, la temperatura de la columna varió de 190 °C hasta 250 °C a una velocidad de 10 °C/min., permaneciendo en 250 °C durante 5 min. Luego aumentó hasta 280 °C a una velocidad de 15 °C/min., permaneciendo en 280 °C durante 47 min. Además, obtuvimos su espectro de FTIR.
Identificación de rotenona por RMN 1 H y RMN 13 C
La muestra R (20 mg) se envió a Toulusse-Francia para la obtención de sus espectros de RMN 1H y RMN 13C.
RESULTADOS Y DISCUSIÓN
Análisis cualitativo
El análisis cualitativo mostró que las hojas del Yawar Panga (Aristolochia cf. Cauliflora Ule) contienen aminogrupos primarios y/o secundarios, grupos fenólicos, tripertenos y esteroles, catequinas, flavonoides, quinonas, antronas y antranoles. Además, se verificó la ausencia de taninos, alcaloides, leucoantocianidinas y saponinas. Como el ácido aristolóquico es considerado un alcaloide4 y las pruebas cualitativas para alcaloides resultaron negativas, descartamos la presencia del ácido aristolóquico en las hojas de Yawar Panga.
Identificación de esteroles por CG-EM
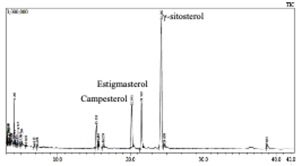
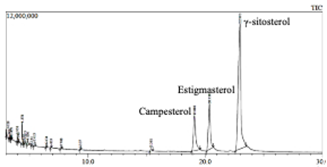
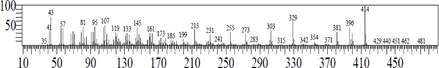
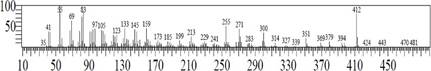
Las muestras D y E presentan los mismos (tres) esteroles: γ-sitosterol (mayoritario), estigmasterol y campesterol, Figuras 3 y 4.
La muestra E, Figura 3, presenta un total de 78,42 % de esteroles, el porcentaje restante está distribuido en compuestos identificados como impurezas y algunas como grasas que se extrajeron con el éter de petróleo.
Por su parte la muestra D, Figura 4, están conformada por 94.5% de esteroles, siendo el γ-sitosterol el mayoritario. Los demás picos observados en el cromatograma de iones totales no alcanzan el 1% de composición.
En la Tabla 1 se muestra el porcentaje de tres esteroles presentes en las muestras E y D obtenidos de las hojas del Yawar Panga: campesterol, estigmasterol y γ-sitosterol.
El equipo CG-EM proporciona los espectros de masas que corresponde a cada compuesto analizado (según su tiempo de retención) y proporciona los espectros de masas de las sustancias de referencia que están registrados en la base de espectros del equipo, resultando positiva la identificación de los tres esteroles.
Tabla 1 Metabolitos secundarios presentes en el extracto hidroalcohólico del fruto de tres variedades de Opuntia ficus-indica (L.) Miller “tuna”.
| Muestra | Compuesto | Tiempo de retención (min.) | Área (%) |
| E | Campesterol | 20,191 | 14,63 |
| Estigmasterol | 21,522 | 14,83 | |
| γ-sitosterol | 24,26 | 48,96 | |
| D | Campesterol | 19,086 | 12,69 |
| Estigmasterol | 20,358 | 16,51 | |
| γ-sitosterol | 22,97 | 65,3 |
El espectro de masas del compuesto mayoritario (figura 5) resultó similar al espectro del γ-sitosterol (registrado en la base de espectros del equipo), ambos con el pico ion molecular de 414.
Además, este espectro de masas es similar al publicado por Grovas et al. (2018)6 e identificado como γ-sitosterol.
El espectro de masas del segundo esterol (figura 6) resultó similar al espectro del estigmasterol (registrado en la base de espectros del equipo), ambos con el pico ion molecular de 412.
El espectro de masas del tercer esterol (Figura 7) resultó similar al espectro del campesterol (registrado en la base de espectros del equipo), ambos con el pico ion molecular de 400.
Identificación de rotenona por CG-EM, FTIR y RMN 1H y RMN 13C
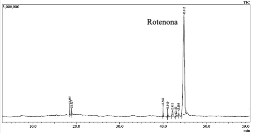
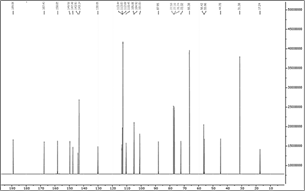
La muestra R analizada mediante CG-EM (Figura 8) proporcionó rotenona con un 93,42 % de pureza. Los demás compuestos tienen menos del 1% de presencia en la muestra R. El color crema de nuestro producto, diferente al blanco reportado anteriormente para la rotenona, podría deberse a impurezas aún presentes en la muestra R.
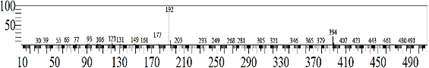
El equipo CG-EM proporcionó el espectro de masas (Figura 9), que resultó similar al espectro de la rotenona patrón (registrada en la base de espectros del equipo CG-EM), con los picos característicos a 394 (ion molecular) y 192 (pico base). Además, este espectro es similar al publicado por De Souza (2007)12 de la rotenona obtenida de las raíces de Darris urucur.
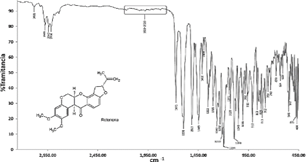
Para confirmar ello, se registró el espectro FTIR (Figura 10), que resultó similar al reportado por Othman at al. (2018)15 para una muestra patrón de rotenona.
Para complementar el análisis estructural de la rotenona aislada de las hojas de Yawar panga se registraron los espectros de RMN1H (Figura 11) y de RMN13C (Figura 12):
Ambos espectros resultaron similares con aquellos publicados por de Souza (2007)12, tal como se ilustra en la comparación de los desplazamientos químicos δH obtenidos para ambos espectros (Tabla 2 y Tabla 3, respectivamente):
Tabla 2 Desplazamientos químicos (δH en ppm) de RMN1H a 300MHz de la rotenona en CDCl3 (Figura 11), y aquellos reportados en bibliografía12.
| Número de H | Integración | Acoplamiento | δH obtenido experimentalmente | δH (De Zouza, 2007)12 |
| 1 | 3H | s | 1,76 | 1,77 |
| 2 | 1H | m | 2,96 | 2,97 |
| 3 | 1H | m | 3,3 | 3,31 |
| 4a | 3H | s | 3,76 | 3,76 |
| 4b | 3H | s | 3,8 | 3,81 |
| 4c | 1H | s | 3,83 | 3,84 |
| 5 | 1H | d | 4,17 | 4,18 |
| 6 | 1H | d | 4,6 | 4,61 |
| 7a | 1H | s | 4,92 | 4,93 |
| 7b | 1H | s | 4,92 | 4,93 |
| 8 | 1H | s | 5,06 | 5,07 |
| 9 | 1H | t | 5,23 | 5,24 |
| 10a | 1H | s | 6,44 | 6,45 |
| 10b | 1H | d | 6,49 | 6,5 |
| 11 | 1H | s | 6,76 | 6,77 |
| 12 | 1H | d | 7,83 | 7,84 |
Tabla 3 Desplazamientos químicos (δH en ppm) de RMN13C a 75MHz de la rotenona en CDCl3 (Figura 11), y aquellos reportados en bibliografía12.
| Número de C | Tipo de C | δc obtenido experimentalmente | δC (De Souza, 2007)7 |
| 1 | CH3 | 17,24 | 17,09 |
| 2 | CH2 | 31,38 | 31,24 |
| 3 | CH | 44,7 | 44,57 |
| 4 | OCH3 | 55,96 | 55,82 |
| 5 | OCH3 | 56,42 | 56,42 |
| 6 | CH2 | 66,38 | 66,24 |
| 7 | CH | 72,32 | 72,19 |
| 8 | CH | 87,95 | 87,8 |
| 9 | CH-arom. | 101,01 | 100,88 |
| 10 | C-arom. | 104,92 | 104,79 |
| 11 | CH-arom. | 105 | 104,86 |
| 12 | CH-arom. | 110,45 | 110,34 |
| 13 | CH2 | 112,68 | 112,53 |
| 14 | C -arom. | 113,07 | 112,93 |
| 15 | C -arom. | 113,44 | 113,3 |
| 16 | CH-arom. | 130,09 | 129,95 |
| 17 | C | 143,14 | 143 |
| 18 | C -arom. | 143,97 | 143,85 |
| 19 | C-arom. | 147,48 | 147,34 |
| 20 | C-arom. | 149,58 | 149,46 |
| 21 | C-arom. | 158,05 | 157,9 |
| 22 | C-arom. | 167,47 | 167,33 |
| 23 | C-arom. | 189,06 | 188,91 |
Los espectros obtenidos del compuesto aislado de las hojas de Yawar panga, y su correspondencia con los espectros publicados en la bibliografía para la rotenona, nos llevan a concluir que el compuesto aislado es la rotenona.
CONCLUSIONES
A partir de los extractos de éter de petróleo y diclorometano de las hojas de Yawar Panga, colectadas en el Jardín Botánico del Centro Takiwasi (Tarapoto, región San Martín, Amazonia peruana) se identificaron, mediante CG-EM, tres esteroles, γ-sitosterol, estigmasterol y campesterol.
Así mismo, del extracto etanólico se aisló la rotenona (con 93,4% de pureza), que fue identificada mediante CG-EM, FTIR, RMN 1H y RMN 13C
Además, en el análisis fitoquímico de las hojas de Yawar Panga se verificó la presencia de aminogrupos primarios y/o secundarios, grupos fenólicos, tripertenos y esteroles, catequinas, flavonoides, quinonas, antronas y antranoles.