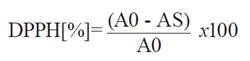INTRODUCCIÓN
Los aceites vegetales pueden proporcionar fuentes renovables de ácidos grasos de alto valor y aunque se utilizan principalmente para aplicaciones nutricionales, en las últimas décadas ha aumentado su uso en las industrias química, farmacéutica y cosmética, así como para la producción de biocombustibles, y últimamente se ha desarrollado un marcado interés por la investigación sobre aceites vegetales funcionales, es decir aquellos que pueden tener efectos beneficiosos sobre la salud de las personas, previniendo la obesidad y las enfermedades crónicas como las cardiovasculares y muchos cánceres, debido especialmente a que presentan buenos perfiles nutricionales y bioactivos antioxidantes que pueden ser usados como sustancias capaces de reducir el riesgo de estrés oxidativo y prevenir ciertas enfermedades neurodegenerativas, así como el envejecimiento. Los aceites vegetales son componentes indispensables de la dieta humana, sobre todo aquellos que son una fuente importante de ácidos grasos esenciales. Con el crecimiento de la población y el desarrollo económico, los aceites vegetales comestibles han experimentado un notable aumento en su consumo y se ha intensificado la búsqueda de nuevas fuentes de aceites funcionales debido a su importante papel en la protección de la salud y la prevención de enfermedades.
En los últimos años, han surgido algunos nuevos tipos de aceites vegetales como el aceite de maíz, el aceite de salvado de arroz y el aceite de camelia, que, en comparación con los principales aceites vegetales, como el de soja, tienen cuotas de mercado y producción relativamente pequeñas, por lo que se denominan aceites vegetales menores, sin embargo, presentan sustancias activas muy interesantes y con importantes actividades biológicas por lo que pueden ser útiles en el ámbito alimentario así como dermocosmético.
En este contexto, surgen los granos andinos como la quinua (Chenopodium quinoa) y la kiwicha (Amaranthus caudatus) cuyo alto valor nutricional está bien reconocido y que investigaciones realizadas en los últimos años han evidenciado la presencia de un aceite de alta calidad en sus semillas, con alto contenido en ácidos grasos poliinsaturados1.
El valor y la aplicación de un aceite vienen determinados en gran medida por su composición de ácidos grasos, en la naturaleza hay una rica diversidad de ácidos grasos, muchos de los cuales tienen un uso potencial en la industria. Algunas investigaciones han aportado evidencia sobre la compleja influencia del método empleado para extraer el aceite de semillas y frutos secos en la composición fisicoquímica, el valor nutricional y las propiedades sensoriales de los aceites2.
Existen diferentes métodos para obtener aceites de semillas, los más populares en los laboratorios y fábricas son las extracciones convencionales con disolventes simples (extracción sólido-líquido, extracción Soxhlet). Actualmente existen métodos más rápidos como la extracción asistida por ultrasonidos (UAE), extracción asistida por microondas (MAE), extracción acelerada con disolventes (ASE) y la extracción por fluidos supercríticos, que presentan ventajas sobre los métodos convencionales porque ahorran tiempo y reducen el uso de disolventes y pueden llevarse a cabo sin oxígeno ni luz, lo que evita la degradación de las sustancias deseadas3.
La extracción por fluidos supercríticos está considerada como una metodología ecológica, y se utiliza para hacer que los lípidos sean más funcionales. La extracción de aceites utilizando fluidos supercríticos es de gran importancia debido a la alta pureza de los compuestos finales, lo que aumenta el valor añadido de los productos finales y su precio en el mercado internacional. El fluido supercrítico suele ser el CO2 porque no es tóxico, no es inflamable, con bajo costo y condiciones críticas suaves (P ≥ 74 bar y T ≥ 31 °C) que permiten la recuperación de compuestos termolábiles4.
Por estas razones, la extracción por fluidos supercríticos tiene un enorme número de aplicaciones, y se ha utilizado como una técnica adecuada para los productos naturales y en especial para los aceites con potencial uso como alimentos funcionales.
El objetivo de este estudio fue determinar el contenido de ácidos grasos, las propiedades fisicoquímicas y la actividad antioxidante de los aceites de los granos andinos: Chenopodium quinoa Willd. y Amaranthus caudatus L., extraídos por CO2 supercrítico, con la finalidad de proporcionar una base teórica para el desarrollo e investigación de aceites funcionales derivados de los granos andinos más importantes de la región andina.
PARTE EXPERIMENTAL
Material vegetal
Las variedades de granos andinos adquiridas fueron: Chenopodium quinoa Willd., var. INIA 420 Negra Collana (quinua negra) de la comunidad de Jasana Kapallino, Huancané - Puno y Amaranthus caudatus L., var. Oscar Blanco (kiwicha) del Instituto Nacional de Innovación Agraria (INIA) Cusco.
Extracción del aceite de las semillas de los granos andinos
La extracción de los aceites se realizó en un Sistema de Extracción de Fluidos Supercríticos SFT-100 suministrado por Supercritical Fluid Technologies Inc. (Newark, DE, USA). El gas de operación fue CO2 de grado industrial con una pureza del 99,9 % suministrado por Praxair, Lima - Perú. La operación del proceso fue: 1) Llenado de la cámara de extracción con 480
- 520 g de semillas de grano deshidratado y molido con un tamaño de 522mm. 2) Cambio de las condiciones de CO2 en el tanque a condiciones supercríticas. 3) Extracción estática, el CO2 en condiciones supercríticas entró en la cámara de extracción durante 30 min. (tiempo de remojo). 4) Extracción dinámica cuando el CO2 en condiciones supercríticas se deja fluir a través del lecho fijo formado por las semillas molidas, el tiempo varía de 180 - 360 min. dependiendo de la velocidad de extracción. El CO2 con el aceite extraído se dirigió a la cámara de separación donde el gas se expandió hasta presión atmosférica. Las condiciones del proceso de extracción fueron flujo de 4.41 g/min de dióxido de carbono, la temperatura de extracción fue de 45 °C y la presión de extracción fue de 300 bar.
Determinación del contenido de ácidos grasos
El perfil y contenido de ácidos grasos de las muestras de los aceites se determinó a través de los ésteres metílicos de ácidos grasos (FAME) que se prepararon de acuerdo con el método
963.33 de la AOAC6 y que posteriormente fueron inyectados en un sistema de cromatografía de gases/espectrometría de masas (GC/MS) 6890 N Network GC (Agilent Technologies, Santa Clara, CA, EE.UU.) equipado con un detector de ionización de flama de helio y una columna capilar para aceites modelo HP-5 (50m longitud x 0.32 i.d., 1.05 µm de grosor de película), siendo arrastrados por el helio para ser separados de la fase estacionaria de la columna. La temperatura del inyector (Agilent Technologies - 7683B Series), fue de 250 ºC, la temperatura del detector fue de 270 ºC, el volumen de inyección de la muestra fue 5 μL. Para la identificación de los espectros de masa de los ácidos grasos se hizo la comparación con los espectros de masas brindados por la librería NIST y FAME y por comparación con los espectros de masas de estándares de metilésteres de ácidos grasos. El contenido de los aceites expresó como porcentaje en peso, % p/p (g de AF/100 g de muestra)
Propiedades fisicoquímicas
Las propiedades fisicoquímicas evaluadas fueron la gravedad específica5, Índice de acidez, Índice de peróxido, Índice de yodo e Índice de saponificación que fueron determinados según los métodos oficiales de la AOAC 20006.
Actividad antioxidante
El ensayo de DPPH se realizó según el procedimiento descrito por Christodouleas et al.7con ligeras modificaciones. En detalle, las muestras de aceite se mezclaron con una solución 90:10 (v/v) de 1-butanol/etanol, y la mezcla se homogenizó en un baño de ultrasonidos. A continuación, se mezclaron 1,00 mL de la muestra diluida en 1-butanol/etanol y 4,00 mL de solución de DPPH. La actividad de barrido de radicales libres contra el DPPH de las soluciones de aceite se midió utilizando un espectrofotómetro UV/VIS PG Instrument T80+ (Woodway lane, Leicestershire, Reino Unido) a 517 nm. En este experimento, se utilizó Trolox como control positivo y todos los experimentos se repitieron tres veces. La actividad de barrido de radicales DPPH se calculó en términos de porcentaje de reducción de DPPH según la siguiente ecuación:
Donde A0 representa la absorbancia de la solución blanco y As es la absorbancia de la muestra.
Se halló los valores de EC50, que determinan el 50% de inhibición de los radicales libres DPPH, para lo cual se trazó un gráfico con el porcentaje de inhibición y la concentración de los aceites. El cálculo se realizó usando la ecuación lineal.
RESULTADOS Y DISCUSIÓN
Extracción del aceite de las semillas de los granos andinos
En la Tabla 1, se muestra el porcentaje de extracción de aceite de cada uno de los granos andinos en estudio, el mayor porcentaje de extracción obtenido fue de 1,97 ± 0,00 g de aceite/100g de semillas de Amaranthus caudatus L. var. Oscar Blanco (kiwicha), en tanto que Chenopodium quinoa Willd. var. INIA 420 Negra collana presentó un porcentaje de extracción de 1,49 % ± 0,00 g de aceite/100 g de semillas. Cada determinación se realizó por triplicado.
Tabla 1 Porcentaje de rendimiento de extracción de aceites de granos andinos
| Granos andinos | Rendimiento * (g de aceite/g de muestra) |
|---|---|
| Chenopodium quinoa Willd. var. INIA | 1,49 % ± 0,00 |
| 420 Negra Collana (Quinua Negra) | |
| Amaranthus caudatus L. var. Oscar | 1,97 % ± 0,00 |
| Blanco (Kiwicha) |
*Datos por triplicado con media ± desviación estándar
Las condiciones del proceso de extracción fueron un flujo de 4,4 g/min de CO2, la temperatura de extracción fue de 45 °C y la presión de extracción fue de 4300 psi (aprox. 300 bar).
Koziol8 reportó un contenido de aceite en Chenopodium quinoa entre 1,8% y 9,5% con una media de 5 % al 7,2 %, que es superior al del maíz (3 % a 4 %), nuestro porcentaje de extracción está por debajo de este rango. En otro estudio realizado por Benito-Román et al. 9 se reportó un contenido de aceite en Chenopodium quinoa var. Collana de 4,9 ± 0,3 g aceite /g de muestra usando hexano como solvente de extracción, en tanto que para la extracción usando CO2 supercrítico considerando una temperatura de extracción de 40-60 °C, una presión de 20-40 MPa y un tamaño de partícula de 250-1000 μm, se pudo evidenciar que la extracción resultó ser más rápida cuanto más alta es la presión, en tanto que la temperatura tuvo menos influencia en la cinética de extracción, sin embargo la calidad del aceite en términos de actividad antioxidante, y contenido de tocoferoles fue mayor en el aceite extraído por fluidos supercríticos.
En el caso del aceite de Amaranthus caudatus L, Westerman et al.,10 determinaron un contenido total de aceite de 8,1 % en peso usando hexano como solvente y la extracción se realizó usando un Soxhlet durante un período de 18 h. Asimismo, reportaron diferentes porcentajes de extracción usando diferentes condiciones de extracción por fluidos supercríticos; a 45 °C y 100 bar, se obtuvo un rendimiento máximo del 2,69 %, a 35 °C y 100 bar, la tasa de extracción fue del 4,58 % y a 50 °C y 200 bar dio un máximo rendimiento del 6,57 %.
La diferencia entre los rendimientos de extracción podría explicarse por los diferentes métodos y condiciones utilizados para la extracción de los aceites, por ello es importante, establecer la necesidad de realizar la optimización del proceso de extracción con fluidos supercríticos de CO2, principalmente porque se encontró que el rendimiento de extracción varía significativamente con la temperatura y la presión. Muchos estudios, han demostrado que el uso de solventes como el hexano produce extracciones completas, en tanto que, la extracción por fluidos supercríticos representa alrededor del 92 %11. Es importante también tener en cuenta que los aceites obtenidos utilizando disolventes orgánicos presentan propiedades organolépticas insatisfactorias y aunque es un método fácil de desarrollar, está relacionado con la contaminación ambiental y con largos tiempos de extracción. La extracción por fluidos supercríticos es una técnica recomendada para extraer compuestos bioactivos de forma segura y sostenible habiendo obtenido mucha atención últimamente debido a sus grandes beneficios como su mayor selectividad y ecología12.
Contenido de ácidos grasos
En la Tabla 2, se puede apreciar que tanto el aceite de Amaranthus caudatus y de Chenopodium quinoa, presentan un alto contenido de ácido linoleico, 38,09 % y 50,99 % respectivamente. Asimismo, en ambos aceites se aprecia un alto contenido de ácido oleico 27,64 % y 28,96 % respectivamente. Ambos ácidos grasos constituyen el 65,73 % y 79,95 % del contenido de ácidos grasos insaturados en el aceite de Amaranthus caudatus y Chenopodium quinoa respectivamente, siendo el contenido de los ácidos grasos poliinsaturados el mayor en ambos casos. Estos valores son muy cercanos a los encontrados en otras investigaciones, como se discute líneas más abajo. Los tiempos de retención de los principales ésteres de metilo de ácidos grasos se muestran en las Fig. 1 y 2.
Tabla 2 Principales ácidos grasos presentes en los aceites de los granos andinos.
| N° | Nomenclatura Química | Ácido graso | % ésteres de metilo de ácidos grasos | ||
|---|---|---|---|---|---|
| Chenopodium quinoa Willd. var. INIA 420 Negra Collana (Quinua Negra) | Amaranthus caudatus L. var. Oscar Blanco (Kiwicha) | ||||
| 1 | C18:2 | Ácido linoleico (ω-6) | 50,99 | 38,09 | |
| PUFA | 50,99 | 38,09 | |||
| 2 | C18:1 | Ácido oleico (ω-9) | 28,96 | 27,64 | |
| MUFA | 28,96 | 27,64 | |||
| 3 | C16:0 | Ácido palmítico | 10,55 | 18,28 | |
| 4 | C18:0 | Ácido esteárico | -- | 4.47 | |
| SFA | 10,55 | 22,75 | |||
| Ácidos | Saturados | 10,55 | 22,75 | ||
| grasos | Insaturados | 79,95 | 65,73 | ||
PUFA, Ácidos grasos poliinsaturados; MUFA, Ácidos grasos monoinsaturados; SFA, Ácidos grasos saturados. Se reportan los ácidos grasos mayoritarios.
Estudios anteriores reportaron que el contenido de ácidos grasos insaturados en el aceite de quinua es de aproximadamente 82,7 %-85,0 % de la cantidad total de ácidos grasos, siendo los principales ácidos grasos el linoleico (más del 50 %), el oleico (más del 20 %) y el palmítico (8 %)8.
Benito-Román et al.,9 estudiaron diferentes variedades de quinua, una de ellas fue la Collana, y obtuvieron el aceite usando la extracción por fluidos supercríticos, siendo el ácido linoleico el más abundante (52 ± 3 %), seguido del ácido oleico (26 ± 1 %) y del ácido palmítico (9,4 ± 0.5 %), asimismo, el porcentaje de ácidos grasos poliinsaturados fue de 56 ± 3 %, el porcentaje de ácidos grasos monoinsaturados fue de 32 ± 2 % y el porcentaje de ácidos grasos saturados fue de 11,7 ± 0,6 %, resultados muy cercanos a los obtenidos en la presente investigación.
Paucar-Menacho et al.,13 indicaron que el aceite de Amaranthus caudatus contenía mayoritariamente los siguientes ácidos grasos: ácido linoleico en un 40,76 ± 0,01 %, ácido oleico en un 27,88 ± 0,01 %, ácido palmítico en un 17,16 ± 0,01 % y ácido esteárico en un 3,64 ± 0,01 %. Finalmente, un estudio reciente14 ha reportado en el aceite de Amaranthus caudatus la presencia del ácido linoleico en un 44,48 %, ácido oleico en un 28,82 ± 0,02 %, ácido palmítico en un 19,08 ± 0,01 % y ácido esteárico en un 4,10 ± 0,01 %, resultados muy cercanos a los obtenidos en la presente investigación. Estos resultados demuestran que tanto Chenopodium quinoa Willd. var. INIA 420 Negra collana y Amaranthus caudatus L. var. Oscar Blanco, son una fuente atractiva de ácidos grasos insaturados, que pueden ser usados en el ámbito alimentario teniendo en cuenta que con el continuo aumento de la población y el desarrollo económico la demanda de aceites de semillas de alta calidad sigue aumentando en países como China, de hecho, en las últimas décadas muchos aceites comestibles no comerciales (aceites comestibles especiales) que, aunque suelen ser más caros, presentan características nutricionales especiales por lo que se han vuelto cada vez más populares15. Asimismo, pueden ser usados en el desarrollo de formulaciones dermocosméticas, debido principalmente a que existe una demanda creciente de aceites vegetales para el tratamiento de enfermedades de la piel como la xerosis, dermatitis atópica, afecciones eczematosas y psoriasis16.
Las principales razones para su uso en la formulación de diferentes tipos de dermocosméticos son la presencia de ácidos grasos esenciales que actúan como emolientes naturales, portadores de otras sustancias activas; pero lo que realmente los hace valiosos son sus propiedades biológicas porque ofrecen numerosos ácidos grasos poliinsaturados (ácido linoleico, ácido γ-linolénico) que participan en la formación de los lípidos de la barrera cutánea17.
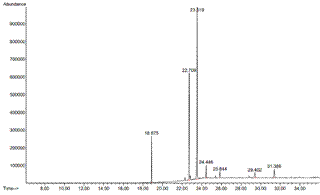
Figura 1 Cromatograma de los ésteres de metilo de los ácidos grasos del aceite de Chenopodium quinoa Willd. var. INIA 420 Negra collana extraído por fluidos supercríticos. Picos principales: 18,875 para ácido palmítico (C16:0), 22,709 para ácido oleico (C18:1), 23,519 para ácido linoleico (C18:2).
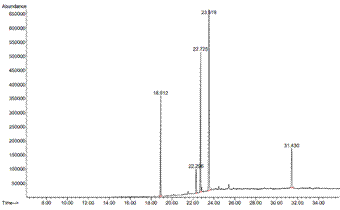
Figura 2 Cromatograma de los ésteres de metilo de los ácidos grasos del aceite de Amaranthus caudatus L. var. Oscar Blanco extraído por fluidos supercríticos. Picos principales: 18,912 para ácido palmítico (C16:0), 22,296 para ácido esteárico (C18:0), 22,725 para ácido oleico (C18:1), 23,519 para ácido linoleico (C18:2).
Propiedades fisicoquímicas de los aceites extraídos por fluidos supercríticos
Las propiedades fisicoquímicas evaluadas a ambos aceites extraídos por fluidos supercríticos se detallan en la Tabla 3.
Tabla 3. Propiedades fisicoquímicas de los aceites extraídos por fluidos supercríticos
| Propiedades fisicoquímicas* | Chenopodium quinoa Willd. var. INIA 420 Negra Collana (Quinua Negra) | Amaranthus caudatus L. var. Oscar Blanco (Kiwicha) |
| Aspecto | Líquido oleoso denso de color amarillo | Líquido oleoso de color amarillo |
| Gravedad específica (20°C) | 0,925 ± 0,01 | 0,922 ± 0,03 |
| Índice de acidez (mg KOH/g) | 0,79 ± 0,35 | 0,89 ± 0,14 |
| Índice de yodo (g de I/100g) | 159,98 ± 5,27 | 168,87 ± 13,29 |
| Índice de peróxido (mEqO2/Kg) | 4,8 ± 0,64 | 5,1 ± 0,50 |
| Índice de saponificación (mg KOH/g) | 195 ± 0,02 | 199 ± 0,02 |
*Datos por triplicado con media ± desviación estándar.
El aspecto de líquido amarillo de los aceites de quinua negra y kiwicha se asemeja mucho a otros aceites vegetales utilizados tanto en el ámbito alimentario (aceite de girasol, aceite de soja) como en el ámbito dermocosmético (aceite de avena, aceite de argán).
La gravedad específica de los aceites de quinua negra y kiwicha determinadas fueron: 0,93
± 0,01 y 0,92 ± 0,03 respectivamente. Estos valores son muy cercanos a los reportados para otros aceites de uso alimentario como el aceite de soja (0,919 - 0,925), aceite de girasol (0,918 - 0,923), aceite de oliva (0,918 - 0,923)18, y también son semejantes a los valores de aceites muy usados en el ámbito cosmético como el aceite de avena (0,914 - 0,932)19 y aceite de argán (0,906 - 0,919)20.
Los índices de acidez y peróxido son propiedades relacionadas directamente con la calidad del aceite, así, el índice de acidez determina la cantidad de ácidos grasos libres, y el índice de peróxido permite conocer el estado de oxidación y la susceptibilidad a la rancidez. Un índice de peróxido debe ser inferior a 20 meqO2/kg para evitar el enranciamiento21.
El índice de acidez hallado para el aceite de quinua negra y kiwicha fue de 0,79 ± 0,35 y 0,89
± 0,14 respectivamente. Estos valores están muy cercanos al del aceite de los frutos de Olea europaea (oliva) (0,24 - 0,78 mg/KOH), y el índice de peróxido fue de 4,8 ± 0,64 mEqO2/Kg para el aceite de quinua negra y de 5,1 ± 0,50 mEqO2/Kg para el aceite de kiwicha, ambos valores inferiores a 10 mEqO /Kg, valor que garantiza un bajo nivel de enranciamiento21.
El índice de yodo de los aceites de quinua negra y kiwicha fue de 159,98 ± 5,27 y 168,87 ± 13,29 respectivamente, estos altos valores indican el grado de insaturación de ambos aceites. El índice de saponificación hallado para el aceite de quinua negra fue de 195 ± 0,02 y para el aceite de kiwicha fue de 199 ± 0,02, en ambos casos son valores altos que indican un alto contenido de ácidos grasos poliinsaturados, como se muestra en la Tabla 2 y que son muy cercanos a los de aceites de uso alimentario como el de soja (195,56 ± 1,35) y de girasol (197,14 ± 0,56)22.
Los valores de los índices de yodo y de saponificación son indicativos de la alta calidad de estos aceites, y demuestran su potencial uso tanto en el ámbito alimentario como dermocosmético.
Actividad antioxidante
La actividad antioxidante de los aceites de quinua negra y kiwicha se determinó utilizando el método de inhibición del radical DPPH a las concentraciones de 62,5, 125, 250, 500 y 1000 µg/mL como se muestra en la Tabla 4. Los resultados mostraron que todas las concentraciones presentan actividad antioxidante, siendo la concentración de 1000 µg/mL la que presentó la mayor actividad antioxidante para ambos aceites, 57,23 ± 0,16 % para el aceite de quinua negra y 61,30 ± 0,14 % para el aceite de kiwicha.
Tabla 4. Actividad antioxidante (% Inhibición ± D.S) del aceite de Chenopodium quinoa Willd. var. INIA 420 Negra Collana (Quinua Negra) y Amaranthus caudatus L. var. Oscar Blanco (Kiwicha)
| Muestras | Concentración (µg/mL) | Inhibición (%) DPPH* |
|---|---|---|
| Chenopodium quinoa Willd. var. INIA 420 Negra Collana (Quinua Negra) | 250 | 52,46 ± 0,09 |
| 500 | 54,47 ± 0,14 | |
| y = 0.0053x + 51.792 | 1000 | 57,23 ± 0,16 |
| IC50 = 337,92 µg/mL | ||
| Amaranthus caudatus L. | 62,5 | 49,34 ± 0,16 |
| var. Oscar Blanco | 125 | 47,12 ± 0,10 |
| (Kiwicha) | 250 | 39,19 ± 0,04 |
| y = 0.016x + 43.055 | 500 | 49,34 ± 0,14 |
| 1000 | 61,30 ± 0,14 | |
| IC50 = 433,94 µg/mL |
*Datos por triplicado con media ± desviación estándar.
Por otro lado, la concentración de aceite de quinua negra que se necesita para disminuir la concentración de DPPH en un 50% (IC50) fue de 337,92 µg/mL y para el aceite de kiwicha fue de 433,94 µg/mL como se muestra en la Tabla 4.
Estos valores son superiores al de otros aceites como el de jojoba (215 ± 0,15 μg/ mL)23, aceite de semillas de uva (283,3 ± 0,9 μg/ mL)24, en tanto que es inferior a aceites como el de aguacate (6200 ± 0,4 μg/ mL), salvado de arroz (500 μg/ mL)25.
Es importante mencionar además que, en investigaciones anteriores como la desarrollada por Benito-Román et al.,9 se demostró que el aceite de Chenopodium quinoa extraído usando CO2 supercrítico mostró mayor actividad antioxidante en comparación con el extraído usando como solvente hexano.
CONCLUSIONES
En las muestras de aceite de las semillas de Amaranthus caudatus y Chenopodium quinoa se ha evidenciado un alto contenido de ácidos grasos insaturados que va de 65,73 a 79,95% respectivamente. Los ácidos grasos más abundantes fueron el ácido linoleico en 38,09 % y 50,99 % y el ácido oleico en 27,64 % y 28,96 % para Amaranthus caudatus y Chenopodium quinoa respectivamente. Las propiedades fisicoquímicas de ambos aceites son muy parecidas a las de otros aceites comúnmente utilizados y los valores de los índices de yodo y de saponificación son indicativos de su alta calidad demostarndo su potencial uso tanto en el ámbito alimentario como dermocosmético. La actividad antioxidante usando el método de DPPH demostró un EC50 de 337,92 µg/mL para el aceite de Chenopodium quinoa y de 433,94 µg/mL para el aceite de Amaranthus caudatus.
En la presente investigación se ha podido evidenciar que los aceites de quinua negra y kiwicha presentan importantes propiedades fisicoquímicas comparables a muchos de los aceites usados actualmente en alimentación y en dermocosmética. Su alto contenido en ácidos grasos insaturados los convierte en potenciales aceites funcionales que podrían ser producidos industrialmente por los mismos productores de estos fabulosos granos andinos.