INTRODUCCIÓN
Los metales pesados se consideran tóxicos para el medio ambiente, siendo uno de estos el ion cadmio, Cd(II), el cual es altamente tóxico, encontrándose en muchos casos en aguas de ríos y en el agua potable1. El Cd(II) es producido principalmente a partir de diversas actividades y fuentes, como desechos industriales, quema de carbón o petróleo, industrias de metales, baterías, fabricación de pintura y actividades de eliminación de desechos, produciendo un gran problema a la salud de las poblaciones aledañas2. Por este motivo, se han desarrollado varios métodos para eliminar los iones de metales pesados del agua, como el intercambio iónico, la ósmosis inversa, la precipitación, la cementación y la adsorción3,4.
La adsorción se considera un método eficaz, eficiente y económico empleando carbón activado (CA)5. El CA es un adsorbente ampliamente utilizado, debido a su estructura porosa, que le proporciona una gran área superficial. Sin embargo, el alto costo del CA ha llevado al desarrollo de nuevos materiales eco-amigables con características similares pero con menores costos6, como lo son los CA obtenidos a partir de diferentes desechos de biomasas, como desechos agrícolas7, cascarilla de arroz8, semillas9, cáscaras de frutas, entre otros.
Existen diversos métodos para el control y evaluación del Cd(II), como la espectrometría de masas de plasma acoplado inductivamente (ICP-MS), la espectrometría de absorción atómica de llama (FAAS) y espectroscopia de emisión atómica (AES)10. Sin embargo, estas técnicas presentan instrumentos costosos, alto costo de mantenimiento, procedimientos operativos complejos. Una forma eficaz y eficiente para la determinación de iones metálicos es la voltamperometría de onda cuadrada (VOC) con la cual se detecta concentraciones bajas en el orden de nmol.L-1; Además, según estudios previos, en los últimos años se han empleado diversos materiales eco-amigables (carbón activado proveniente de un desecho vegetal) en técnicas electroquímicas. Este uso se debe a su gran estabilidad y su bajo costo. La técnica de VOC se complementará con el proceso de adsorción para la cuantificación de iones cadmio(II) en aguas contaminadas11,12.
Por esta razón, en este artículo se preparó carbón activado a partir del desecho: cáscara de naranja (CACN) y se evaluó su proceso de remoción de Cd(II) en aguas; el cual se cuantificó mediante la técnica electroquímica de voltamperometría de onda cuadrada.
PARTE EXPERIMENTAL
Reactivos y soluciones
Todas las soluciones se prepararon con agua ultrapura (resistividad ≥18,2 MΩ.cm a 25 °C) obtenida de un sistema de purificación Milli-Q (Millipore). La sal de Cd(NO3)2.4H2O se obtuvo de Sigma-Aldrich. Se preparó una solución madre de 1,0×10-2 mol.L-1 de Cd2+ en 0,1 mol.L-1 de HCl. Se prepararon los electrólitos de 0,1 mol.L-1 de H SO , HCl, tampón acetato,
tampón Britton Robinson (TBR), tampón fosfato, KCl, NaCl, KOH, ácido acético, los cuales fueron adquiridos de Merck.
Síntesis del carbón activado a partir de la cáscara de naranja
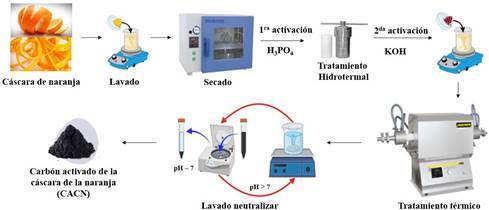
La cáscara de naranja se cortó en trozos pequeños y se enjuagaron varias veces con agua ultrapura. Los trozos se secaron en una estufa a 100 °C durante 8 h para su posterior pulverización. Luego se pesó 60 g de polvo de cáscara de naranja y se mezcló con 15 g de ácido fosfórico en 100 mL de agua ultrapura; la mezcla resultante se llevó en una autoclave de acero inoxidable para su tratamiento hidrotermal a 120 °C durante 2 h. A continuación, la muestra se lavó hasta pH 7, luego se secó a 60 °C durante 24 h. El sólido obtenido se mezcló con 5 mol.L-1 de KOH a temperatura ambiente durante 24 h, se filtró y el sólido se secó en la estufa a 60 °C durante 48 h. El proceso de carbonización se llevó a cabo en un horno tubular bajo un flujo de gas nitrógeno y a una velocidad de calentamiento de 10 °C.min-1 hasta 800 °C durante 4 h. La muestra carbonizada se enjuagó con agua ultrapura hasta pH 7 y luego se secó a 100 °C por 24 h; y finalmente se obtuvo carbón activado a partir de la cáscara de naranja (CACN)13,14,15, la secuencia del proceso de síntesis se indica en la figura 1.
Caracterización fisicoquímica del CACN
El análisis fisicoquímico del carbón activado a partir de cáscara de naranja (CACN) fue realizado utilizando un espectroscopio Raman Horiba Scientific y el FTIR Shimadzu IR prestige-21 para análisis vibracional de los grupos funcionales presentes. El análisis de la superficie BET fue realizado en un Micromeritics - Gemini VII 2390.
Evaluación de la remoción por métodos electroquímicos
El proceso de remoción se corroboró mediante las mediciones electroquímicas de voltamperometría de onda cuadrada (VOC) empleando un potenciostato-galvanostato PGSTAT204 Autolab (Eco-Chemie, Países Bajos) utilizando el software Nova. Las mediciones se realizaron en una celda electroquímica de vidrio con una configuración de tres electrodos. Se utilizó una barra de grafito como contraelectrodo, un electrodo de Ag/AgCl (3 mol.L-1 KCl) como electrodo de referencia y un electrodo de pasta de carbón como electrodo de trabajo.
La evaluación electroquímica se realizó en diferentes electrólitos de soporte como HCl, H2SO4, tampón acetato, tampón Britton Robinson, tampón fosfato, ácido acético, KCl, KOH y NaCl, y en presencia de Cd2+ 0,01 mol L-1 para la obtención del electrólito óptimo y luego se obtuvo el tiempo óptimo para la remoción del Cd2+ mediante el CACN.
RESULTADOS Y DISCUSIÓN
3.1 Caracterización fisicoquímica del CACN
El carbón activado sintetizado CACN y la cáscara de naranja se caracterizaron por espectroscopía Raman (figura 2a ). En el espectro presentado se resaltan dos bandas, la banda D presente en 1350 cm-1 que nos indica el desorden proveniente del carbón amorfo y cualquier defecto presente, lo cual demuestra que el carbón sintetizado está activado; además la banda G presente en 1600 cm-1 es generado a partir de vibraciones de enlaces carbono-carbono debido a la alta grafitización. Adicionalmente, la ausencia de la banda G' de segundo orden armónico en aproximadamente 2690 cm-1, es debido al débil grado de perfección de la red cristalina justificado por el grado de desorden que poseen los carbones porosos. El análisis FTIR se muestra en la figura 2b . En el espectro presenta las vibraciones características de los anillos aromáticos del tipo C=C correspondientes a las vibraciones en 1591 y 1461 cm-1, además se encuentra presente el enlace C-O en 989 cm-1, y los enlaces C-H en 869 cm-114,16.
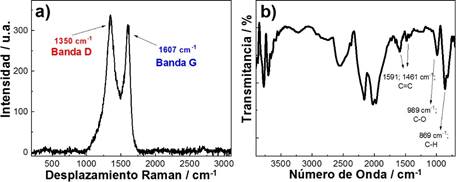
Figura 2 Análisis fisicoquímico del carbón activado por a) Espectroscopia Raman, laser 532 nm y potencia 10% y b) FTIR.
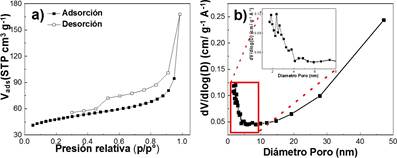
La figura 3 muestra la isoterma típica de adsorción-desorción de nitrógeno y su correspondiente distribución de tamaños de los poros presente en el carbón activado sintetizado. La isoterma obtenida es del tipo II (de acuerdo con la nomenclatura IUPAC), característica de los procesos de adsorción en sólidos porosos con presencia de mesoporos grandes o macroporos (figura 3a). El área superficial específica del carbón activado fue calculada por el método BET (Brunauer-Emmett-Teller). Los resultados arrojaron que el carbón activado presenta un área superficial específica de 154,96 m2.g-1 y una distribución de tamaño de poro de 6,70 nm y 12,39 nm calculada por el método de BJH (Barrett-Joyner-Halenda) (figura 3b) 15,16.
3.2. Evaluación electroquímica de la remoción de los iones Cd(II)
Para evaluar el proceso de remoción del Cd(II) se empleó la técnica electroquímica voltamperometría de onda cuadrada (VOC), mediante el análisis de las alturas de corriente del proceso de oxidación del cadmio (reacción 1). Primero fueron evaluados los diferentes electrólitos soportes mencionados a continuación: HCl, H2SO4, tampón acetato, tampón Britton Robinson, tampón fosfato, ácido acético, KCl, KOH y NaCl. Este análisis se realizó debido a que la presencia y naturaleza química de los electrólitos puede producir cambios en el proceso de óxido-reducción de los iones cadmio lo cual significa una mayor cantidad de iones adsorbidos en la superficie del electrodo de pasta de carbón. Los resultados se muestran en la figura 4a , en donde se identificó el pico máximo para el proceso de oxidación del cadmio a un potencial de -0,75 V. Asimismo, en la figura 4b se observa el efecto de los electrólitos, comprendidas en diferentes valores de pH, durante la detección de Cd2+. Los resultados muestran que el uso del electrólito 0,1 mol.L -1 HCl (pH ~ 1) permite obtener una mayor señal de corriente de oxidación del cadmio lo cual contribuye al aumento de la sensibilidad del sensor de pasta de carbón y al mismo tiempo nos permite inferir que el proceso de adsorción de iones sobre una superficie carbonosa se ve favorecido en medio de HCl (pH ~ 1) tomando en cuenta las consideraciones teóricas del mecanismo y proceso de detección de iones metálicos por VOC17.
The effect of graphene, aloe and starch on melting temperatures (Tm) and heat of fusion
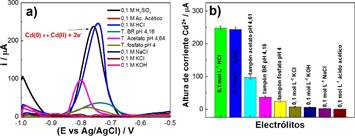
Figura 4 a) Análisis VOC de la oxidación Cd(II) en los diferentes electrólitos soportes, parámetros: frecuencia 10 Hz y amplitud 75 mV. b) Análisis de las alturas de corriente de la oxidación del Cd(II) en los diferentes electrólitos soportes.
Considerando los resultados anteriores, se procedió con el estudio de adsorción de Cd(II) en medio de HCl a diferentes intervalos de tiempo de 0, 60, 120, 180, 240, 300 y 360 minutos. Para determinar el equilibrio cinético y obtener la isoterma de adsorción, se aplicó VOC y se evaluaron las alturas de corrientes de oxidación del Cd(II) las cuales se indican en la figura 5a y 5b. Los resultados muestran que a un mayor tiempo de contacto entre el Cd(II) con el CACN, disminuye la altura de corriente de la señal de Cd; lo que indica la efectiva remoción de Cd(II). La capacidad de cantidad de Cd(II) retenido por el CACN y el porcentaje de adsorción representado por qe y %R se calcularon mediante las ecuaciones 1 y 2, respectivamente.
Dónde: C y C son la concentración inicial y final del Cd(II) en la solución (mg.L-1) antes y después de la adsorción respectivamente, m es la masa del CACN (g), y V es el volumen de la solución (L). Los resultados del proceso de remoción se indican en la figura 5c y 5d. Se determinó una capacidad de remoción de 7,52 g.g-1 y un porcentaje de remoción del 60% de Cd(II).
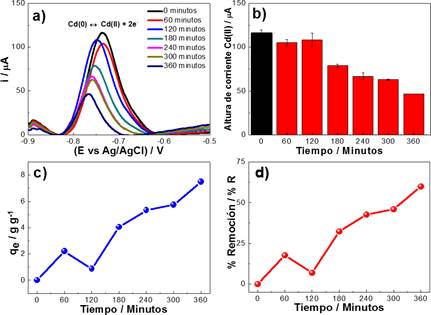
Figura 5 a) Análisis VOC de la oxidación Cd(II) en los diferentes intervalos de tiempo, parámetros: frecuencia 10 Hz y amplitud 75 mV. b) Análisis de las alturas de corriente de la oxidación del Cd(II), empleando 0,1 mol L-1 HCl. c) Evaluación de capacidad de remoción de Cd(II) y d) Porcentaje de remoción de (II).
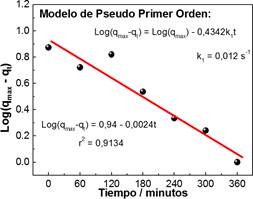
El estudio nos presenta que el proceso de adsorción del Cd(II) por el CACN, sigue un modelo de pseudo primer orden indicado por la siguiente ecuación Log(qmax - qt) = 0,94 - 0,0024t con r2 = 0,9134, donde la etapa limitante en el proceso de adsorción es la transferencia de masa del Cd(II) en la solución hacia superficie del carbón activado.
CONCLUSIONES
Se logró sintetizar carbón activado a partir de cáscara de naranja reciclada. En base a los resultados de caracterización por Raman, FTIR y BET se puede resaltar que el método de síntesis aplicado permitió la obtención de carbón activado con alta pureza y con características apropiadas para su uso como adsorbente. El estudio a partir de voltamperometría de onda cuadrada que evaluó el estado de oxidación del Cd(II) mediante la relación de alturas de corriente, permitió el estudio cinético para la remoción de Cd(II) en diferentes intervalos de tiempo con el ajuste a un modelo de pseudo primer orden. El porcentaje de remoción del CACN fue de 60% en un tiempo de 6 horas.