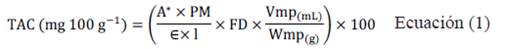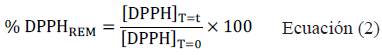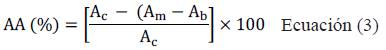INTRODUCCIÓN
La medicina tradicional basada en el uso de plantas medicinales deviene de civilizaciones antiguas y utiliza materiales vegetales como ingrediente principal en la síntesis de drogas. Así mismo, el rápido desarrollo de la obtención de fármacos farmacológicamente activos a partir de hierbas medicinales tiene un impacto tremendo en las prácticas medicinales actuales1.
Las plantas poseen metabolitos secundarios que desempeñan un papel importante en su mecanismo de defensa contra contaminantes ambientales, insectos y otras amenazas externas para la planta. Además, los metabolitos secundarios poseen propiedades farmacológicas, son antioxidantes, antibacterianos y antifúngicos, entre otras. Entre los metabolitos secundarios con potencial bioactivo se encuentran los compuestos fenólicos con propiedad medicinal significativa para el ser humano en la prevención del daño causado por los radicales libres1.
La evaluación de la actividad antioxidante, a través del uso de radicales libres estables coloreados como el 2,2-difenil-1-picrilhidracilo (DPPH), ácido 2,2-azino-bis-(3´- etilbenzotiazolina)-6-sulfónico (ABTS), o reactivos como el complejo férrico-2,4,6-tripiridil-s-triazina (TPTZ), permite jerarquizar preliminarmente las distintas especies de plantas medicinales, sus extractos o fracciones de acuerdo con su actividad antioxidante. La actividad antioxidante es directamente proporcional al contenido de compuestos fenólicos. Además, las posiciones de los grupos hidroxilo también afectan la capacidad de la actividad de eliminación de radicales libres2.
El tamizaje fitoquímico, la cuantificación del contenido de compuestos fenólicos y la actividad antioxidante son ensayos in vitro que permiten evaluar el potencial terapéutico de las plantas y brindan la posibilidad de descubrir e identificar moléculas nuevas de interés farmacológico. Asimismo, contribuye a fomentar la conservación y la protección de los ecosistemas, en especial en hábitats poco perturbados y estudiados, como los afloramientos rocosos3.
Los afloramientos rocosos son hábitats que contribuyen a la biodiversidad, ya que el área circundante posee una vegetación única. Las grandes variedades de microhábitats, la topografía inaccesible, los cambios ecológicos lentos y los bajos niveles de competencia biótica hacen que los hábitats rocosos a menudo alberguen numerosos taxones relictos3. Así mismo, son hábitats de flora medicinal nativa y endémica, las cuales crecen en los lechos de abrigos rocosos, junto a las rocas, en medio de los afloramientos o incrustados entres sus grietas. Sin embargo, los afloramientos rocosos son hábitats poco estudiados y de atención limitada3.
Es por ello, que el Gobierno Regional de Ayacucho, en el proceso de zonificación ecológica económica, lo ha identificado como unidad ecológica económica y ha recomendado ejecutar actividades de investigación y conservación4.
En ese sentido, con la finalidad de aportar al conocimiento, difusión y conservación de las especies medicinales utilizadas por la población por generaciones, en este tipo de ecosistema, se planteó el objetivo de realizar el tamizaje fitoquímico, determinar el contenido de compuestos fenólicos y evaluar el potencial antioxidante de trece plantas medicinales de los afloramientos rocosos del Bosque de Piedras de Huaraca del distrito de Vinchos en Perú.
PARTE EXPERIMENTAL
Colección de material vegetal
Las especies vegetales medicinales fueron recolectadas en los afloramientos rocosos del Bosque de Piedras de Huaraca (Figura 1A), ubicada en la comunidad de Huaraca en el centro poblado de Anchacchuasi del distrito de Vinchos, provincia de Huamanga del departamento de Ayacucho en Perú. Las coordenadas geográficas son 13°18'58.9" latitud sur, 74°26'55.8" longitud oeste y una altitud de 3627 msnm4.
Material vegetal
Trece especies vegetales medicinales (Figura 1) fueron recolectadas entre los meses de abril a mayo y fueron seleccionadas de acuerdo con la información etnobotánica proporcionada por la población aledaña al Bosque de Piedras de Huaraca (Tabla 1).
Un ejemplar de cada especie fue prensado para su respectiva identificación taxonómica, que fueron realizadas en el Museo de Historia Natural de la Universidad Nacional de Mayor de San Marcos, Herbario Huamangüensis de la Universidad Nacional de San Cristóbal de Huamanga y el Museo Botánico Herbario de la Universidad Nacional de Cajamarca en Perú. Para el tamizaje fitoquímico, la determinación del contenido de compuestos fenólicos y la actividad antioxidante, las plantas se secaron a la sombra y, luego en una estufa a 40 °C; posteriormente se pulverizaron con un molino de cuchillas y martillos y se almacenaron en envases de vidrio herméticamente cerrados hasta su análisis.

Figura 1 Fotografías de especies vegetales medicinales de los afloramientos rocosos del Bosque de Piedras de Huaraca en Perú (A) Afloramientos rocosos del Bosque de Piedras de Huaraca; (1)Baccharis uniflora Ruiz & Pav.;(2) Bartsia camporum Diels; (3) Berberis flexuosa Ruiz & Pav.; (4) Berberis lutea Ruiz & Pav.; (5) Brachyotum naudinii Triana; (6) Calceolaria engleriana Kraenzl; (7) Calceolaria rupestris Molau; (8) Gaultheria glomerata (Cav.) Sleumer; (9) Gaultheria myrsinoides Kunth; (10) Lepidoceras peruvianum Kuijt; (11) Mutisia mathewsii Hook & Arn.; (12) Passiflora trifoliata Cav. (13) Solanum nitidum Ruiz & Pav.
Tabla 1 . Información etnobotánica de trece plantas medicinales de los afloramientos rocosos del Bosque de Piedras de Huaraca en Perú
| N° | Especie | Parte usada | Uso medicinal | Modo de preparación | Forma de uso |
| 1 | Baccharis uniflora (FAM. Asteraceae) | Hoja | Reumatismo, fracturas | Emplasto | Tópica |
| 2 | Bartsia camporum (FAM. Buddlejaceae) | Hoja | Digestivo | Infusión | Oral |
| 3 | Berberis flexuosa (FAM. Berberidaceae) | Hoja | Purgante, analgésico | Infusión | Oral |
| Fruto | Alimento | Bebida | Oral | ||
| 4 | Berberis lutea | Hoja | Antibacteriano | Infusión | Oral |
| (FAM. Berberidaceae) | Fruto | Alimento | Bebida | Oral | |
| 5 | Brachyotum naudinii | Hoja | Inflamación | Decocción | Tópica |
| (FAM. Melastomataceae) | |||||
| 6 | Calceolaria engleriana | Hoja | Aromatizante | Infusión | Oral |
| (FAM. Scrophulariaceae) | Flor | Digestivo | Mate | Oral | |
| 7 | Calceolaria rupestris (FAM. Scrophulariaceae) | Hoja | Mal de aire | Infusión | Oral |
| 8 | Gaultheria glomerata | Hoja | Dolor | Infusión | Oral |
| (FAM. Ericaceae) | Fruto | Alimento | Crudo | Oral | |
| 9 | Gaultheria myrsinoides(FAM. Ericaceae) | Hoja | Dolor, somnífero | Infusión | Oral |
| 10 | Lepidoceras peruvianum (FAM. Santalaceae) | Hoja | Inflamación, dolor | Decocción | Tópica |
| 11 | Mutisia mathewsii (FAM. Asteraceae) | Hoja/ tallo | Tos, dolor | Decocción | Inhalación |
| 12 | Passiflora trifoliata | Hoja | Sedante | Infusión | Oral |
| (FAM. Passifloraceae) | Cicatrizante | Emplastos | Tópica | ||
| 13 | Solanum nitidum (FAM. Solanaceae) | Hoja/ fruto | Antiinflamatorio, cicatrizante | Cocimiento | Tópica |
Nota: FAM = familia.
Preparación de extractos
Se pesó 2 g de hojas y/o frutos y para la extracción se añadió 20 mL de cloroformo, etanol 96
%, agua y ácido clorhídrico por separado5. Ensayo fitoquímico
Tabla 2 Ensayos realizados para la identificación de metabolitos secundarios
| N° | Ensayo | E.C. | E. E. | E.A. | E.Ac. | Especificación |
| 1 | Liebermann-Burchard (triterpenos y/o esteroides) | x | x | Color verde, azul, azul, verdoso, violeta o rojo | ||
| 2 | Borntrager (quinonas) | x | Color rojo en fase acuosa | |||
| 3 | Shinoda (flavonoides) | x | Color rojo, amarillo, anaranjado | |||
| 4 | Kedde (cardiotónicos) | x | Color violeta, púrpura | |||
| 5 | Baljet (cumarinas) | x | Color púrpura | |||
| 6 | Cloruro férrico (taninos) | x | x | Color azul, verde | ||
| 7 | pH-diferencial (antocianinas) | x | Cambio de color | |||
| 8 | Espuma (saponinas) | x | Formación de espuma | |||
| 9 | Dragendorff (alcaloides) | x | Precipitado rojo a naranja | |||
| 10 | Meyer (alcaloides) | x | Precipitado de blanco a crema | |||
| 11 | Wagner (alcaloides) | x | Precipitado marrón |
Nota: E.C. Extracto clorofórmico; E.E. Extracto etanólico; E.A. Extracto acuoso; E.Ac. Extracto acidulado.
La identificación de los metabolitos secundarios (Tabla 2) de los extractos se realizó por el método de análisis cualitativo de ensayo a la gota5.
Determinación del contenido de fenoles totales y flavonoides
Preparación del extracto hidroalcohólico
Los extractos fueron obtenidos por percolación, usando como solvente etanol de 70°. El extracto fue filtrado y concentrado en un Rotavapor R-3000 a 40 °C. El extracto hidroalcohólico seco se obtuvo utilizando el Mini Spray Dryer B-290 a una temperatura de entrada de 120 °C, velocidad de flujo 2 mL/min y aspiración 100 %.
Contenido de fenoles totales
El contenido de fenoles totales (TPC) fue determinado colorimétricamente usando el reactivo de Folin-Ciocalteau (RFC)6. Se preparó una solución de 320 µg/mL del extracto en etanol de 70° por triplicado. Se midió 100 µL de cada solución y se adicionó 500 µL de RFC (1:10) y 400 µL de Na2CO3 7,5 %. Transcurrido 30 min se midió la absorbancia a 765 nm. La concentración se calculó a partir de la curva patrón de ácido gálico (y=0,0103x+0,0119) y el TPC fue expresado en miligramos equivalentes de ácido gálico por gramo de extracto seco (mg GAE/g).
Contenido de flavonoides
Para la cuantificación de flavonoides (TFC) se utilizó el método colorimétrico de tricloruro de aluminio6. Se preparó una solución de 800 µg/mL del extracto seco en etanol de 70° por triplicado. Se midió 2,0 mL de cada solución y se adicionó 0,5 mL de AlCl3 2% y se completó a volumen de 5,0 mL con etanol 50°. Después de 30 min se midió las absorbancias a 415 nm. La concentración se calculó a partir de la curva patrón de rutina (y=0,0282x+0,0047) y el TFP fue expresado en miligramos equivalentes de rutina por gramo de extracto seco (mg RUE/g).
Determinación del contenido de antocianinas
Preparación del extracto
Se pesó 15 g de fruto seco y se maceró por 24 h en 200 mL de etanol 70° acidulado con ácido cítrico a pH 3,3; el macerado se filtró y concentró en un rotavapor a 40 °C. Los extractos fueron liofilizados a -42 °C y 0,013 mbar durante 48 h.
Cuantificación de antocianinas
El contenido de antocianinas (TAC) se determinó por el método de pH-diferencial7. Se preparó una solución de extracto de 10 mg/mL en etanol 70°, a partir del cual se prepararon una solución de 1 mg/mL en buffer pH 1,0 y otra en buffer pH 4,5 por triplicado. Se midió la absorbancia a 520 nm y 720 nm, usando como blanco las soluciones buffer respectivas. Se calculó el TAC (mg/100 g), a partir de la Ecuación (1).
donde, A*: diferencia de absorbancias en las dos longitudes de onda; PM: peso molecular para cianidina-3-glicósido (449,2 g mol); FD: factor de dilución; ɛ: coeficiente de extinción molar para cianidina-3-glicósido (26900 L/mL.cm); l: longitud de paso de celda (1 cm).
Determinación del potencial antioxidante
Ensayo con el radical libre DPPH
La evaluación del potencial antioxidante se realizó monitoreando el consumo del radical libre DPPH por las muestras, a través de la disminución de las absorbancias de las soluciones a diferentes concentraciones y teniendo como control positivo al Trolox6.
Construcción de la curva de calibración de DPPH
Se preparó 250 mL de solución de DPPH en metanol a una concentración de 40 µg/mL, mantenida en refrigeración y protegida de la luz. Se obtuvieron diluciones de 1 a 35 µg/mL. La curva de calibración (y = 0,023 + 0,0079; R = 0,9997) fue construida con los valores de absorbancia leídos a 515 nm de todas las soluciones por triplicado (1 a 40 µg/mL), utilizando como blanco el metanol.
Lectura de las medidas de absorbancia de las muestras
Se prepararon soluciones de los extractos y el control positivo en etanol de 96° a una concentración de 500 µg/mL a partir de los cuales se preparó diluciones de 25 a 250 µg/ mL en metanol. Se midió 300 µL de cada dilución y se adicionó 2,7 mL de solución de DPPH (40 µg/mL). Después de 30 min se midió la absorbancia a 515 nm, calibrando el espectrofotómetro con el blanco (300 µL de agua y 2,7 mL de DPPH). A partir de la curva de calibración de DPPH se determinaron los porcentajes de DPPH remanentes (%DPPH_REM) a partir de la Ecuación (2).
donde (DPPH)T=t corresponde a la concentración de DPPH en el medio después de la reacción con el extracto y el control positivo y [DPPH]T=0 es la concentración inicial de DPPH.
La concentración eficiente, cantidad de antioxidante necesaria para disminuir la concentración inicial de DPPH en 50 % (CI50), fue determinada utilizando el software OriginPro 8, a partir de una curva exponencial (y=y_0+AeR0x) obtenida de los valores del porcentaje de DPPH remanente en función de la concentración de la muestra (µg/mL) o del control positivo.
Los porcentajes de actividad antioxidante (%AA) se calcularon a partir de la Ecuación (3):
donde Ac es la absorbancia inicial de la solución metanólica de DPPH; Am es la absorbancia de la mezcla de reacción (DPPH + muestra) y Ab es la Absorbancia del blanco.
La comparación del %AA se realizó con los valores obtenidos a la concentración 100 µg/mL.
Análisis estadístico
Los promedios del TPC, TFP, TAC y AA corresponden a la media de tres repeticiones. Previamente se realizó la prueba de normalidad de Shapiro-Wilk y la prueba de homocedasticidad de Levene. La comparación de medias se evaluó mediante el análisis de varianza y comparaciones múltiples de Tukey con un nivel de confianza de 95 %. Se calculó el Coeficiente de Correlación de Pearson para el TPC y AA. El análisis se realizó con el software IBM SPSS Statistics 23.
RESULTADOS Y DISCUSIÓN
Tamizaje fitoquímico
Los resultados del tamizaje fitoquímico de las trece especies vegetales medicinales se presentan en la Tabla 3. Se identificó la presencia de flavonoides y fenoles y/o taninos en todas las especies y drogas vegetales. De igual manera, se evidenció la presencia de triterpenos y/o esteroides (92,3 %), cumarinas (61,5 %), saponinas (61,5 %), quinonas (46,2%), antocianinas (46,2 %) y alcaloides (53,8 %). Al respecto, los metabolitos secundarios incluidos los taninos, alcaloides, saponinas, flavonoides, glucósidos y resinas contribuyen significativamente a las actividades medicinales y fisiológicas de las plantas. La composición química de las plantas está relacionada con los mecanismos de defensa de la planta y los efectos del suelo y el clima. Por ejemplo, el contenido de taninos varía según la estación climática, la humedad y la luminosidad8. Las plantas que crecen en los afloramientos rocosos se desarrollan en ecosistemas con alta radiación ultravioleta, estrés abiótico y en frío extremos; y se desarrollan mecanismos de adaptación para sobrevivir, como la producción de metabolitos secundarios. Así mismo, la altitud y latitud determinan la viabilidad de las especies vegetales y determinan su composición química8.
Tabla 3 Tamizaje fitoquímico de plantas medicinales de los afloramientos rocosos del Bosque de Piedras de Huaraca en Perú
| Nº | Especie | Parte analizada | Triterpenos y/o esteroides | Quinonas | Flavonoides | Cardiotónicos | Fenoles y/o taninos | Antocianinas | Caponinas | Alcaloides | Cumarinas |
| 1 | Baccharis uniflora | Hoja | + | - | + | - | + | - | - | - | - |
| 2 | Bartsia camporum | Hoja | + | - | + | - | + | - | - | + | - |
| 3 | Berberis flexuosa | Hoja | + | + | + | - | + | - | + | + | + |
| Fruto | + | - | + | + | + | + | + | - | + | ||
| 4 | Berberis lutea | Hoja | + | + | + | - | + | - | + | + | + |
| Fruto | + | - | + | + | + | + | + | - | + | ||
| 5 | Brachyoutum naudinii | Hoja | + | + | + | + | + | - | + | - | + |
| Fruto | - | + | + | + | + | + | + | - | + | ||
| 6 | Calceolaria engleriana | Hoja | + | - | + | - | + | - | + | - | + |
| 7 | Calceolaria rupestris | Hoja | + | + | + | - | + | - | + | - | + |
| 8 | Gaultheria glomerata | Hoja | + | - | + | + | + | - | - | - | - |
| Fruto | - | - | + | + | + | + | - | - | + | ||
| 9 | Gaultheria myrsinoides | Hoja | + | - | + | + | + | - | - | + | - |
| Fruto | - | - | + | + | + | + | - | - | + | ||
| 10 | Lepidoceras peruvianum | Hoja | + | + | + | + | + | - | + | - | + |
| Fruto | + | - | + | - | + | + | - | - | - | ||
| 11 | Mutisia mathewsii | Hoja | + | - | + | - | + | - | - | + | - |
| 12 | Passiflora trifoliata | Hoja | + | - | + | + | + | - | + | + | - |
| 13 | Solanum nitidum | Hoja | - | + | + | - | + | - | + | + | - |
Nota: (+) Positivo; (-) Negativo.
Contenido de fenoles totales, flavonoides y potencial antioxidante
En la Tabla 4, se evidencia que el extracto hidroalcohólico de las hojas de Brachyotum naudinii presentó mayor TPC, seguido por los extractos de las hojas Gaultheria glomerata y Lepidoceras peruvianum. El extracto de las hojas de Mutisia mathewsii presentó mayor TFC, seguido de los extractos de las hojas de Solanum nitidum y Baccharis uniflora, respectivamente.
Los resultados de la actividad antioxidante se evaluaron por el método DPPH a una concentración de la muestra de 100 µg/mL utilizando como control positivo al Trolox a la misma concentración. El extracto de hojas de Brachyotum naudinii presentaron mayor AA, aunque estadísticamente menor al Trolox (p < 0,05). Los extractos de hojas de Gaultheria glomerata y Lepidoceras peruvianum presentaron AA superior al 40 %. Los extractos de hojas de Calceolaria rupestris, Mutisia mathewsii, Gaultheria myrsinoides y Calceolaria engleriana presentaron actividad antioxidante entre 20 a 30 %. Las demás especies presentaron AA menor al 20 %. Además, se confirmó la relación directamente proporcional entre el TPC y la actividad antioxidante (r = 0,938).
En la Tabla 4, también se presentan los resultados de la Concentración Media Inhibitoria (CI50) de la actividad antioxidante por el método DPPH de los extractos y el control positivo (Trolox). Según este método a menor valor de CI50 mayor es la actividad antioxidante. Todos los extractos presentaron valores de CI50 estadísticamente superiores al Trolox (p < 0,05). El extracto de las hojas de Brachyotum naudinii presentó un CI50 muy significativo y promisorio, aunque estadísticamente diferente al Trolox (p < 0,05).
El TPC del extracto de hojas de Gaultheria glomerata concuerda con lo reportado con Oré9 quien determinó un TPC de 359,4 mg GAE/g y una actividad antioxidante de 48,9 %, evaluado por el método de DPPH. Los resultados tienen relación con las evidencias en el género Gaultheria, por ejemplo, Gaultheria procumbens y Gaultheria fragrantissima que son conocidas por la producción de "aceite de gaulteria" a partir de sus hojas y presentan propiedades antimicrobianas y antioxidantes10.
Otra especie de especial interés es Mutisia mathewsii, cuyo extracto hidroalcohólico de las hojas presentó mayor TFC, lo cual se contrasta con lo determinado por Condoli11, quien además reportó una elevada actividad antioxidante. Hay estudios de otras especies del género Mutisia, por ejemplo, Mutisia friesiana contiene en sus partes aéreas mutisicoumarina, metilfenona, metilcumarina, cromona, mutisifenonas y aceites esenciales; esta especie presentan actividad antifúngica y antioxidante, atribuido a su contenido de ácido caféico y quercetina12.
Respecto a Lepidoceras peruvianum, es la primera vez que se reportan estudios químicos y biológicos. Los resultados evidencian que el extracto hidroalcohólico de las hojas de Lepidoceras peruvianum presenta TPC y actividad antioxidante apreciable. Esta especie hemiparásita y endémica, habita las zonas altoandinas del distrito de Vinchos en Perú. Fue recolectada y clasificada por primera vez por Weberbauer13 en 1910 y revisada posteriormente por Kuijt en 1988. La condición de ser una especie endémica de la región de Ayacucho, ya le agrega valor en la preservación del contenido genético de esta especie, comparada a Lepidoceras chilensis que sólo habita en el país de Chile.
En el caso de las especies del género Calceolaria, diferentes estudios demostraron que los extractos de las partes aéreas de Calceolaria integrifolia y Calceolaria talcana contienen triterpenos, flavonoides verbascósido, martinósido, naftoquinonas que pueden ser usados como fumigantes, repelentes y bioinsecticidas; asimismo, son inhibidores de la colinesterasa14. El extracto hidroalcohólico de las hojas de Solanum nitidum, posee un contenido moderado de TPC y TFP, comparado con lo reportado para especies como Solanum havanense que además contiene en sus hojas la havanina, acetil etiolina y la solamarina15.
Baccharis uniflora es una especie sin estudios de bioactividad ni composición química; sin embargo, se han reportado investigaciones sobre la actividad antifúngica en especies del género Baccharis relacionados al contenido de terpenoides y flavonoides polihidroxilados y metilados16.
Tabla 4 Contenido de compuestos fenólicos y potencial antioxidante de las hojas de las plantas medicinales de los afloramientos rocosos del Bosque de Piedras de Huaraca en Perú
| N° | Especie | TPC (mg GAE/g) | TFC (mg RUE/g) | Potencial | antioxidante |
| AA (%) | CI50 (µg/mL) | ||||
| 1 | Brachyotum naudinii | 386,3 ± 9,7a | 76,3 ± 1,3c | 80,0 ± 1,1a | 42,9 ± 1,2a |
| 2 | Gaultheria glomerata | 369,5 ± 1,2b | 55,0 ± 0,2d | 49,5 ± 0,9b | 90,6 ± 0,1b |
| 3 | Lepidoceras peruvianum | 292,4 ± 2,1c | 44,0 ± 1,1f | 46,3 ± 0,9c | 106,1 ± 0,7b |
| 4 | Mutisia mathewsii | 258,4 ± 0,2d | 175,6 ± 0,7a | 36,8 ± 0,6d | 118,7 ± 0,3b |
| 5 | Gaultheria myrsinoides | 255,1 ± 0,5d | 55,2 ± 0,5d | 36,5 ± 0,2d | 120,3 ± 1,4b |
| 6 | Calceolaria rupestris | 248,5 ± 0,8d | 61,5 ± 0,1h | 29,1 ± 0,8e | 157,2 ± 4,9c |
| 7 | Calceolaria engleriana | 212,0 ± 1,2d | 55,5 ± 0,1i | 24,2 ± 0,7f | 183,1 ± 0,9d |
| 8 | Solanum nitidum | 177,0 ± 0,4e,f | 114,0 ± 0,1b | 19,5 ± 0,5g | 228,7 ± 0,3e |
| 9 | Berberis flexuosa | 163,8 ± 2,4f,g | 53,9 ± 1,1d | 16,8 ± 2,7h | 291,1 ± 4,9f |
| 10 | Berberis lutea | 162,1 ± 1,3g | 50,7 ± 1,3e | 16,7 ± 1,3h | 293,6 ± 2,7f |
| 11 | Baccharis uniflora | 155,1 ± 0,2g | 80,4 ± 0,1c | 16,6 ± 0,1h | 296,8 ± 1,1f |
| 12 | Passiflora trifoliata | 62,9 ± 0,7h | 55,7 ± 0,3d | 4,2 ± 0,4i | 767,7 ± 4,5g |
| 13 | Bartsia camporum | 28,9 ± 0,4i | 32,7 ± 0,2g | 3,7 ± 0,3i | 1356,8 ± 8,5h |
Nota: Trolox (100 µg mL-1): AA (%) = 95,5 ± 0,1h; CI50 (µg mL-1) = 36,6 ± 0,4i; Correlación de Pearson TPC-AA: r = 0,938
Tabla 5, reporta el TAC en los extractos de cinco frutos y su respectiva actividad antioxidante. El extracto de los frutos de Gaultheria glomerata reportó mayor TAC y presentó mayor actividad antioxidante, aunque estadísticamente menor al Trolox (p < 0,05). Asimismo, los extractos de Gaultheria myrsinoides y Berberis lutea presentaron actividad antioxidante mayor al 40% a la concentración de 100 µg/mL. Al respecto, se ha descrito que el fruto de Gaultheria glomerata contiene hasta diez antocianinas identificadas; además, las hojas y frutos poseen elevada de capacidad antioxidante17.
El género Berberis, presenta muchas especies distribuidas en las zonas altoandinas de nuestro país y se caracterizan por tener frutos de un color morado, debido a la presencia de antocianinas. Así, del Carpio et al.7, reportaron un contenido importante de antocianinas en frutos de Berberis boliviana. Diversos estudios de las especies del género Berberis, han reportado el uso de las hojas, corteza, frutos e inclusive las raíces. Los frutos de estas especies contienen antocianinas, ácido ascórbico, ácido clorogénico y quercetina, compuestos fenólicos y flavonoides; asimismo, poseen actividad antioxidante y antimicrobiana 7.
Tabla 5 Contenido de antocianinas y actividad antioxidante en cinco frutos de plantas medicinales de los afloramientos rocosos del Bosque de Piedras de Huaraca en Perú.
| N° | Especie | TAC (mg/100 g) | Potencial antioxidante | |
| AA (%) | CI50 (µg/mL-1) | |||
| 1 | Gaultheria glomerata | 2340,0 ± 2,26a | 47,9 ± 0,41a | 203,6 ± 0,50a |
| 2 | Gaultheria myrsinoides | 1655,2 ± 0,53b | 46,5 ± 0,21a | 220,3 ± 1,40a |
| 3 | Berberis lutea | 1535,9 ± 7,14c | 44,1 ± 0,64b | 229,8 ± 4,91c |
| 4 | Lepidocera peruvianum | 1463,6 ± 37,8d | 19,4 ± 0,51c | 761,5 ± 4,11d |
| 5 | Berberis flexuosa | 1206,8 ± 33,8e | 10,3 ± 0,44d | 864,3 ± 11,6e |