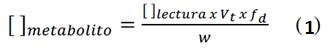INTRODUCCIÓN
El Perú es uno de los países que posee el 10% del total de la flora registrada a nivel mundial, es rico en recursos naturales, por ello que debe ser de gran interés llevar a cabo estudios sobre nuestra biodiversidad y de esta manera aprovechar los recursos e incentivar los estudios fitoquímicos de los productos naturales1. En el género Maquira hay 9 especies (M. calophylla, M.coriacea, M.costaricana, M.granatensis, M. grandifolia, M. quianensis, M. laurifolia Y M. sclerophylla), que pertenecen a la familia Moraceae. En este sentido, la especie arbórea Maquira coriacea (Karsten) C.C. Berg, es también conocida en Perú como capinuri, en Brasil le llaman capinuri o moritanga1; los usos tradicionales en la comunidades sobre esta resina es para el tratamiento de heridas internas, la impotencia sexual y la frigidez; el látex es cáustico y tóxico en altas dosis, asi mismo es usado como antiinflamatorio en luxaciones,2 hemorroides, por sus propiedades benéficas el látex es usado por los moradores de la quebrada de Maquilla, de los centros poblados de Juancito y La Pedrera en el departamento de Loreto.
En la corteza de la especie Maquira coriacea se han encontrado 14 triterpenoides y espectros de una cardenólida , k-strofantina-β (1)3, otras investigaciones reportan en la familia Moraceae del género Ficus la presencia del α y β amyrina, triterpeonoides derivados del escualeno presentes en el látex 4.
En cuanto a las investigaciones en alcaloides identificados en extractos de hojas son: la laudanosina (tipo benciltetrahidroisoquinolínico), N-Metilcoridaldina, salsolina (tipo isoquinolina), reticulina (tipo bencilisoquinoleinas), calicantidina (derivados de triptófano tipo calicantina), akuammidina (tipo corinanteina), anabasina (tipo piridina), así como también alcaloides piridínicos encontrados en la familia Moraceae5. Es por ello, el gran interés de encontrar nuevos metabolitos secundarios como los alcaloides a partir de la resina.
PARTE EXPERIMENTAL
Muestra y Recolección
El material de investigación es una resina vegetal de color crema, se recolectó 1,2 L en frascos ámbares de los centros poblados de “Juancito” y “La Pedrera” en el departamento de Loreto-Perú y el método utilizado en la recolección fue la pica de corteza.
Reactivos y equipos
Los reactivos utilizados son de uso común del laboratorio de investigación de productos naturales todos son de grado analítico y de la marca Merck, como atropina pura, ácido cítrico, fosfato de sodio, silica gel y metanol deuterado. Se utilizó el equipo de espectrofotómetro infrarrojo por transformada de Fourier (marca: Thermo, modelo: Spectronic Genesys® II ATR, software: OMNIC), espectroscopía ultravioleta- visible (marca: Thermo, modelo: Hehios Ɣ, Software: visión pro y también la marca: Shimadzu, modelo: UV-1700, software: UV-Probe), balanza analítica Sartorius Quintix 124- 1, lámpara UV (marca: UVP, UVGL-15/254/365 nm), rotavapor (marca: Buchi, modelo: R-100), espectrómetros de resonancia magnética nuclear (Marca: Bruker®, Modelo: Avant 400), espectrómetro de masas de alta resolución hibrido con analizadores cuadrupolo-tiempo (Marca: Applied biosystems).
Solubilidad, extracto y marcha fitoquímica
Se realizaron las pruebas de solubilidad con solventes de distintas polaridades como hexano, diclorometano, etanol y mezcla hidroalcohólica con la finalidad de obtener el solvente más apropiado para la identificación de los metabolitos secundarios y la extracción de los alcaloides presentes en la resina de la Maquira Coriacea. Se empleó la metodología de Lock para la marcha fitoquimica.8,9,10
Aislamiento de alcaloides
La muestra de resina (100 g), se sometió a una extracción con una mezcla hidroalcohólica por maceración en un recipiente ámbar durante cinco días, se realizaron agitaciones manuales de cinco minutos cada día; el extracto se filtró y se concentró en un rotavapor hasta casi sequedad; se obtuvo una pasta marrón y se disolvió en HCl al 2%, obteniéndose un extracto ácido, al cual, se le realizó una extracción con diclorometano para aquellos posibles alcaloides que se encuentren como base libre. La separación de fases se realizó en una pera de decantación obteniéndose una fase acuosa ácida de nombre “L”. A la fase “L” se realizó una cromatografía en columna, utilizando como fase estacionaria sílica gel y de fase móvil sistemas de hexano-diclorometano; hexano-acetato de etilo; acetato de etilo-metanol. Se obtuvieron 18 fracciones de 20 mL, a los cuales se realizó cromatografía de capa delgada (se usó cromatofolios de silica gel con sistemas de 1:1, 1:2 y 3:5 de Hexano- diclorometano y hexano-acetato de etilo), y se determinó los factores de retención (Rf). Las fracciones del 7, 9 y 10 fueron reunidas en una, ya que contenían compuestos de interés, a los alcaloides (dieron positivo a la prueba de Dragendorff, dando una coloración naranja- rojiza). Se continuaron con las purificaciones por cromatografía preparativa para finalmente recristalizar los alcaloides identificados en la cromatografía de cada delgada. 11,12,13,14
Cuantificación de los alcaloides totales
Se realizó la metodología de Shamsa con algunas modificaciones. Se pesó 1 mg de atropina pura en un matraz volumétrico de 10 mL y se enrasó con agua destilada (concentración de 100 ppm, solución estándar), se midieron con precisión alícuotas de 0,2 mL; 0,3 mL; 0,4 mL; 0,5 mL y 0,6 mL de solución estándar de atropina para transferirlas a diferentes embudos de separación. Luego, se agregaron 5 mL de tampón a base de fosfato de sodio, con un pH=4,7. Se añadieron 5 mL de solución de verde de bromocresol, se agitó y se extrajo con 1; 2; 3 y 3,5 mL de cloroformo. Los extractos se recogieron en un matraz aforado de 10 mL y luego se ajustó el volumen con cloroformo. El blanco se preparó siguiendo el mismo procedimiento, pero sin atropina. La absorbancia del complejo formado se leyó a 470 nm en el espectrofotómetro UV-VIS.15
Análisis por espectroscopía ultravioleta-visible (UV-Vis)
Los espectros UV-Visible se realizaron entre 190 a 600 nm y la muestra de alcaloide se disolvió con metanol de grado analítico de la marca Merck (1 mg/mL).
Análisis por espectroscopía infrarroja (IR)
Los espectros obtenidos de IR fueron registrados en el rango de 400 a 4000 cm-1. Se preparó una pastilla de los sólidos aislados con bromuro de potasio (KBr) con una concentración del 2%.
Análisis por resonancia magnética nuclear (RMN 1H y 13C)
Los espectros fueron obtenidos utilizando metanol deuterado operando con una frecuencia de 400 MHz para 1H y 100 MHz para 13C; del mismo modo para los experimentos 2D de RMN como HSQC y HMBC.
Análisis por espectrometría de Masas de Alta Resolución híbrido cuadrupolo-tiempo (HRMS-Q)
Se analizó la muestra mediante ionización por electrospray en modo positivo, realizándose la inyección por disolución en metanol. Los espectros de HRMS-Q se registraron en un espectrómetro con plataforma VG (FISONS) utilizando la técnica de ionización química (amoniaco como gas) o de bombardeo de átomo rápido (FAB).16
RESULTADOS Y DISCUSIÓN
Los resultados de las pruebas de solubilidad de la resina mostraron que la solubilidad fue aumentando de acuerdo con la polaridad del solvente; en hexano fue insoluble, diclorometano y etanol se observó una solubilidad media y en una mezcla hidroalcohólica se observó solubilidad de la resina.
En los ensayos de coloración y precipitación en diferentes extractos (hexano, diclorometano (DCM), etanol (EtOH), mezcla hidroalcohólica (HA) y agua) podemos obsérvalo en la Tabla 1, del cual se deduce que el mejor solvente para la maceración de la resina para la extracción de alcaloides es la mezcla hidroalcohólica.
Tabla 1 Identificación y obtención de extractos para la marcha fitoquímica.
| Metabolito | Solventes utilizados para las extracciones | ||||
| Hexano | DCM | EtOH | Mezcla HA | Acuoso | |
| Taninos | - | - | + | ++ | +++ |
| Flavonoides | - | - | +++ | ++ | ++ |
| Alcaloides | - | - | + | +++ | - |
Solubilidad muy evidente (+++), solubilidad medianamente evidente (++), solubilidad poco evidente (+) y no hubo evidencia (-).

Figura 1 Mezcla HA con los reactivos de identificación de alcaloides Reactivo: 1. Mayer, 2. Wagner, 3. Dragendorf.
La marcha fitoquímica con las reacciones de identificación para metabolitos secundarios nos indicó resultados positivos para taninos, flavonoides y alcaloides, todos los detalles están en la Tabla 2.
Tabla 2 Reacciones de identificación de metabolitos secundarios
| Metabolitos | Ensayo | Método | Notación de resultados | Color |
|---|---|---|---|---|
| Taninos | Reactivo de Gelatina | Cualitativo | +++ | pp. Blanco |
| Reactivo de FeCl3 | Cualitativo | +++ | pp. Marrón-Negro | |
| Reactivo de H2O-Br2 | Cualitativo | +++ | Formación de precipitado | |
| Reactivo Formaldehido | Cualitativo | +++ | pp. Blanco-Total | |
| Reactivo Acetato de plomo | Cualitativo | +++ | pp. Amarillo | |
| Flavonoides | Reactivo de Shinoda | Cualitativo | +++ | pp. Naranja-Rojizo |
| Reactivo de FeCl3 | Cualitativo | +++ | pp. Verdoso oscuro | |
| Reactivo de NaOH al 20% | Cualitativo | +++ | pp. Naranja | |
| Alcaloides | Reactivo de Dragendorf | Cualitativo | +++ | pp. Naranja |
| Reactivo de Wagner | Cualitativo | +++ | pp. Marrón tenue | |
| Reactivo de Mayer | Cualitativo | +++ | pp. Blanco |
pp: precipitado, muy evidente (+++), medianamente evidente (++), poco evidente (+) y no hubo evidencias de la presencia del metabolito (-).
Aislamiento de alcaloides
Se obtuvo 2 compuestos de alcaloide de los cuales solo se analizará el de fluorescencia azul como se observa en las fracciones 7, 9 y10 en la onda larga de la lampara UV de la figura 2, se siguieron las separaciones con las cromatografías de capa delgada para establecer el sistema de purificación figura 3, y finalmente se realizó la cromatografía preparativa para su purificación obteniéndose unos Rf1=0.86 y Rf2=0.97 figura 4.
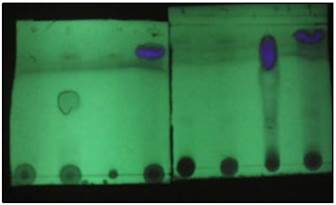
Figura 2 Cromatografía de capa delgada a las fracciones del 2, 4, 7, 6, 8, 9, 10 y 14 del extracto “L”.

Figura 3 Cromatografía de capa delgada a las fracciones 7 y 9 en búsqueda de un nuevo sistema de separación.
Espectroscopía UV-VIS
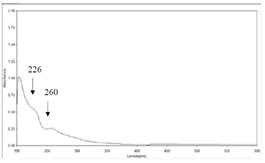
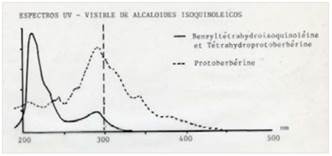
En la figura 5, se muestra el espectro UV-visible del Rf2=0.97 (fluorescencia azul) con longitudes de ondas máximo de 226 nm y mínimo 260 nm. Se realizó la comparación con el espectro UV-visible teórico de una bencilisoquinoleinas y bis-bencilisoquinoleinas (Figura 6), los cuales reportan máximos de absorción hacia 225 y 280 nm y mínimo entre 250 y 260 nm longitudes muy parecidas a las reportadas en el experimental, esto nos podría indicar la posible estructura del compuesto Rf2.
Espectroscopia infrarroja
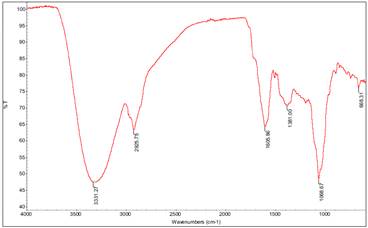
Al analizar el espectro IR (Figura 7), se observa la presencia de bandas características como presencia del grupo OH a 3331 cm-1, presencia del enlace C-O a una banda de 1068 cm-1, los demás detalles están en la Tabla 3.
Tabla 3 Bandas del espectro IR de la muestra.
| Bandas cm-1 | Grupo funcional | Observaciones |
|---|---|---|
| 3331.27 | O-H | Una banda de vibración de tensión O-H |
| 2925-2850 | C-H | Los C-H del metileno (R=CH2) |
| 1460 -1380 | C-H | Son característicos del estiramiento y la torsión de enlaces del tipo C―H de radicales metilos (-CH3) |
| 1068.61 | C-O | Esta banda del estiramiento C-O |
Resonancia magnética nuclear RMN 1H
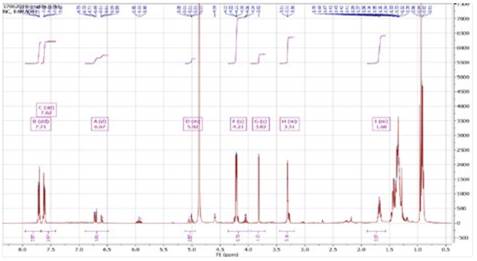
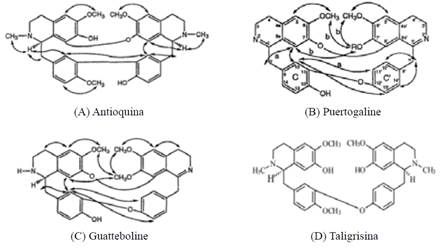
En el estudio estructural de nuestro compuesto se observó 11 señales de protones (Figura 8) que absorben en campos bajos como δ=7.71 ppm (dd, J=5.7, 3.3 Hz, 3H) y δ=7.62 ppm (dd, J=5.7, 3.3 Hz, 3H) se destaca por los dobles dobletes correspondiente a un grupo aromático y los δ=3.82 ppm (s, 1H), δ=3.31 ppm (m, 3H), estos resultados se compararon con valores teóricos (Figura 9-A, B y C)18 y simulados en MestReNova de alcaloides la taligrisina (Figura 9-D), los cuales se representan en la Tabla 4.
Tabla 4 Cuadro comparativo de datos experimentales, teóricos, y simulados en MestReNova, para 1H-RMN (400 MHz, metanol-d4).
| Datos de desplazamiento δ1H (ppm) | ||
|---|---|---|
| Experimentales del Rf2 | Valores Teóricos de Antioquina1 Puertogaline B2 Guatteboline3 | Mestre Nova Taligrisina |
| δ1H(ppm) y Multiplicidad, J (Hz) | ||
| 7.71(dd) | 7.27 (dd)1/ 6.86 (dd)2/ 6.64 (d)3 | 7.17 (dd) |
| 7.62 (dd) | 6.86 (d)1/ 6.96 (dd )2/ 6.78 (dd) 3 | 7.09 (dd) |
| 4.21 (OMe-) (s) | 3.90 (OMe-) (s)1/ 3.92 (s)2/ 3.90 (s)3 | 3.79(OMe-) (s) |
| 3.82 (OMe-) (s) | 3.82 (OMe-) (s)1/ 3.92 (s)2/ 3.90 (s)3 | 3.90 (OMe-) (s) |
| 3.31 (m) | 3.05 (m)1 /3.48 (m)2 /2.76(m)3 | 3.11(m) |
Resonancia magnética nuclear RMN 13C
En la figura 10, se observaron 23 señales que corresponde a carbonilos, grupo metoxi, señales de carbonos cuaternarios, metinos, carbono secundario de la unión de los grupos aromáticos; por otro lado, se analizaron los espectros DEPT de 135° (Figura 11) y 90° (Figura 12), las cuales nos ayudaron a determinar los tipos de carbonos (CH3, CH2, CH, C) para finalmente realizar una comparación de valores experimentales, teóricos17 y simulados en MestReNova como se muestra en la Tabla 6.
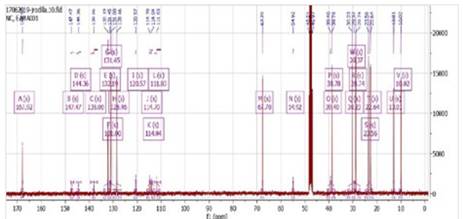
Figura 10 13C RMN (100 MHz, Metanol-d4): Se observa todas las señales de la fase positiva y negativa del compuesto correspondientes a los C, CH, CH2 y CH3.
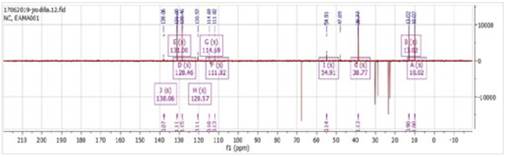
Figura 11 DEPT-135: Se observa señales en fase positiva CH, CH3 y señales en fase negativa correspondiente a los CH2
Tabla 5 Comparación entre los resultados experimentales, datos teóricos de Bis-bencilisoquinoleinas y datos simulados.
| Datos de desplazamiento δ13C(ppm) | ||||
|---|---|---|---|---|
| Datos experimentales del Rf2 | Datos teóricos | Datos simulados Taligrisina | ||
| Antioquina | Puertogaline B | Guatteboline | ||
| 147.47 | 148.2 | 157.3 | 155.6 | 146.60 |
| 145.7 | 153.5 | 147.9 | 146.52 | |
| 144.36 | 142.6 | 137.5 | 138.3 | 144.12 |
| 134.4 | 143.8 | 144.4 | 144.04 | |
| 132.19 | 130.3 | 135.7 | 135.8 | 133.88 |
| 131.45 | 137.8 | 128.3 | 122.8 | 132.48 |
| 131 | 131.2 | 127.7 | 128.4 | 131.13 |
| 128.46 | 128.0 | 121.9 | 121.7 | 128.77 |
| 111.82 | 110.7 | 115.8 | 114.7 | 112.47 |
| 120.57 | 116.8 | 121.9 | 122.2 | 121.49 |
| 54.92 | 56.3 | 56.1 | 55.7 | 56.09 |
| 67.56 | 55.8 | 56.1 | 56.0 | 56.06 |
| 38.77 | 43.6 | - | - | 42.45 |
| 38.77 | 42.3 | - | - | 42.43 |
| 39.40 | 39.8 | 44.5 | 38.5 | 39.79 |
| 39.40 | 38.0 | 50.5 | 44.8 | 39.44 |
| 23.56 | 27.4 | 27.8 | 27.3 | 25.87 |
| 22.64 | 22.4 | 26.1 | 29.7 | 25.79 |
Espectro bidimensional Heteronuclear Múltiple Bond Correlation (HSQC) y Heteronuclear Single Quantum Correlation Spectroscopy (HMBC)
Analizando el espectro de HSQC (Figura 13), se observaron los protones que se encuentran unidos directamente al núcleo de carbono, como el H de δ=7,71 ppm está unido al de 131 ppm; asimismo, el H de δ=3,82 ppm con el carbono a δ=54 ppm. Por otro lado, en el espectro HMBC (Figura 14), donde se obtuvieron señales que nos representan δ de H (ppm) que está a 2 o 3 enlaces del carbono el cual nos va confirmando los carbonos e hidrógenos asignados previamente, todos estos detalles se muestran en la Tabla 7.

Figura 13 Espectro HSQC muestra los protones que se encuentran unidos directamente al núcleo de carbono.
Tabla 6 Datos de RMN bidimensional HSQC y HMQC.
| Datos experimentales de los análisis bidimensionales | |||||
|---|---|---|---|---|---|
| HSQC | HMBC | ||||
| Asignación del carbón directamente conectado al protón δ13C (ppm) | Protón directamente conectado al carbón δ1H (ppm) | Asignación del carbón. a 2 o 3 enlaces δ13C (ppm) | δ1H(ppm) Protón está a 2 o 3 enlaces del carbono | Distancia de los protones a | |
| 131 | 7.71 | 167.92 | 7.71 | 3 enlaces | |
| 128.46 | 7.62 | 132.19 | 7.71 | 2 enlaces | |
| 54.92 | 3.82 | 167.92 | 3.82 | 3 enlaces | |
| 39.40 | 3.31 | 128.46 | 6.67 | 2 enlaces | |
| 67.56 | 4.21 | 132.19 | 3.18 | 2 enlaces | |
| 111.82 | 6.75 | - | - | - | |
Análisis instrumental espectrometría de masas de alta resolución (HRMS-Q)18
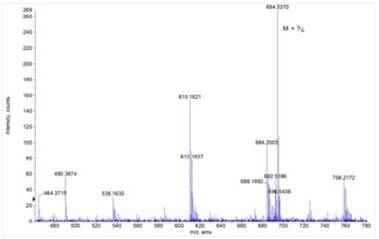
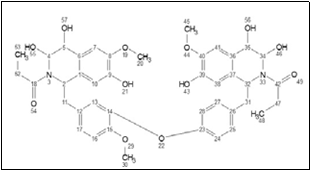
El espectro de masa (Figura 15) es de un alcaloide, cuyo pico molecular base es de m/ s=758.21 de baja intensidad y picos importantes de fragmentación de m/s=694.53 y m/ s=610.18; después de analizar y comparar con la bibliografía, la estructura propuesta para el alcaloide de Rf2 (m/s=758.21) es la coriacina, cuya estructura tipo bis-bencilisoquinoleinas según la figura 16.
Cuantificación de alcaloides totales
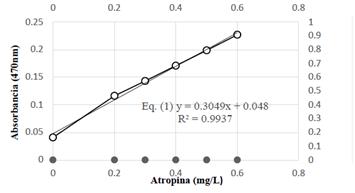
De acuerdo con el análisis espectrofotométrico con verde de bromocresol (Figura 17), se observan los valores de concentración y absorbancia del extracto hidroalcohólico. Se realizaron los cálculos correspondientes de acuerdo con la Eq. (2), obteniendo 175 mg Atropina (AT)/100 g de resina de Maquira coriacea a una absorbancia de 0,174 nm y una concentración de 0,409 (mg/L). Para los cálculos se aplica la ecuación:
[ ] metabolito: Concentración del metabolito (polifenoles, taninos, alcaloides, carbohidratos; expresado en mg/100g de estándar o g/100g de estándar)
[ ] lectura: Concentración de lectura en el equipo (mg/mL)
Vt: Volumen total (mL)
fd: Factor dilución
W: Peso inicial de muestra (g)
CONCLUSIONES
Se aisló a partir de la resina de Maquira coriacea un alcaloide aislado y elucidado su estructura química a base de espectroscopia UV, IR, RMN-1H, RMN-13C, HSQC, HMBC y HRMS-Q, como un compuesto del tipo Bis-bencilisoquinoleinas de deonimiado coriacina; además, se cuantificó, por primera vez a los alcaloides totales de la especie estudiada, dando como resultado 175 mg de Atropina (AT)/100 g de resina.