INTRODUCCIÓN
La especie Corryocactus brevistylus subsp. puquiensis conocida como “Sanqui” pertenece a la familia de las cactáceas y crece entre los 2600 a 3400 m.s.n.m1. Es una especie perenne, de forma columnar, forma parte de extensas colonias en laderas de cerros, en suelos arenosos, rocosos y pedregosos2. En el Perú, el Corryocactus brevistylus se distribuye en los departamentos de Ayacucho, Arequipa, Moquegua y Tacna3.
Según encuestas recogidas de los pobladores, consumiendo el fruto y savia del tallo se obtienen propiedades tenso-reguladoras, antidiabéticas, es usado para prevenir la gastritis, enfermedades del hígado y como reguladora del colesterol. El jugo de sanqui en altas concentraciones posee propiedades laxantes4. La cáscara del fruto es utilizada para la alopecia, caspa y seborrea; el cuero cabelludo lavado con el tallo y el fruto fortalecen las raíces del cabello y el crecimiento capilar4. Además, usan el jugo del fruto para bajar la fiebre y para el resfriado común5.
Actualmente la planta está siendo bastante difundida como un fruto exótico peruano que provee de muchos beneficios para la salud. Se han desarrollado productos a base de sanqui tales como bebidas, zumos atomizados, comestibles, aditivos alimenticios y farmaceúticos, cremas cosméticas entre otros2,6,7,8,9,10,11; en estudios previos del sanqui, se han encontrado resultados de análisis proximales, fisicoquímicos, marcha fitoquímica, de contenido de Vitamina C, ácido cítrico, minerales2,11,12,13 y se han analizado ciertas propiedades como el efecto hematoprotector14,15, actividad antioxidante16,17, sensibilidad antibacteriana frente a la Escherichia coli y Staphylococcus aureus17 y efecto cicatrizante18. Sin embargo, en la planta sólo se han realizado estudios fitoquímicos cualitativos, no se han encontrado reportes publicados respecto al contenido de los ácidos grasos y alcanos presentes en el sanqui.
La búsqueda de nuevas fuentes de grasas y aceites es un proceso continuo. De lejos, las semillas de plantas son las fuentes de aceites más prometedoras para fines nutricionales, industriales y farmacéuticos. Sin embargo, la aplicación de un aceite para un propósito particular está determinada por la composición de sus ácidos grasos y triglicéridos. Es por esta razón que la búsqueda de nuevas fuentes de aceites es tan importante19.
Los ácidos grasos son moléculas muy importantes en los organismos vivos porque juegan diferentes roles: fuente de energía, función estructural y moduladores de funciones fisiológicas20. Se ha informado que el consumo de ácidos grasos monoinsaturados y poliinsaturados proporciona beneficios para la salud en todas las etapas de la vida y contribuye a mejorar diversas afecciones de salud como la obesidad, las enfermedades cardiovasculares, la diabetes mellitus e incluso algunos tipos de cáncer20.
Los n-alcanos son hidrocarburos de cadena lineal que componen la cera de la cutícula de las plantas y participan en numerosas funciones vitales. El contenido relativo de n-alcanos impares con diferente longitud de cadena de carbonos (patrón de alcanos) varía entre especies, cultivares y partes de planta, permitiendo su uso como marcadores naturales de composición de la dieta en estudios de herbivoría21.
En este estudio se trabajó con la pulpa del sanqui, pero a la vez con sus residuos: espinas, cáscara y semillas, para poder conocer los atributos de cada uno de ellos; así aprovecharlos y darles un valor agregado. Toneladas de residuos de frutos se descartan anualmente y, en algunos casos, su eliminación resulta un gran problema. La utilización adecuada de estos productos de desecho podría conducir a importantes nuevas fuentes de aceite y alimento19.
Este es el primer trabajo de investigación que ha realizado el estudio de la incidencia de los ácidos grasos y alcanos en las espinas, cáscara, pulpa y semillas del fruto del sanqui. Donde los ácidos grasos mayoritarios fueron: los ácidos araquídico y behénico en las espinas, los ácidos linoleico y palmítico en la cáscara y pulpa, y los ácidos linoleico y oleico en las semillas. Los alcanos mayoritarios fueron: el nonacosano y hentriacontano en las espinas y cáscara, el pentacosano y tricosano en la pulpa. En las semillas no se identificaron alcanos.
PARTE EXPERIMENTAL
Reactivos
n-hexano P.A. >96% (Merck Millipore), metanol para cromatografía líquida 99.8% (Merck Millipore), ácido sulfúrico P.A. 98% (Merck Millipore), cloruro de sodio P.A. 99.5% (Merck Millipore), sílica gel 60 (0.063-0.200 mm) para cromatografía de columna (Merck Millipore), gas helio 5.0 UHP (Linde gas Perú). Estándar Component FAME Mix (SUPELCO SIGMA- ALDRICH, Lote LRAC1814). Mix de estándares de alcanos (SIGMA-ALDRICH, Lote LRAC1880). El agua tipo I utilizada fue purificada en el equipo Elga, Purelab CLASSIC UV.
Equipos
Estufa (Pol-eko aparatura, SLN 32 ECO), ultracongeladora (Binder), liofilizador (Labconco, FreeZone 2.5L), molino (Moulinex), rotavapor (Buchi R-3000, Vacuum controller V-850, Vacuum pump V-700), cromatógrafo de gases acoplado a espectrómetro de masas (Shimadzu, GCMS-QP 2010 Ultra).
Colecta de la muestra e identificación botánica
La primera colecta para identificación botánica se realizó en febrero del 2014. Se colectó el tallo y el fruto del Sanqui en el distrito de Laramate provincia de Lucanas departamento de Ayacucho, Perú. A una altura de 3411 m.s.n.m., a 19.5°C y 35%H.R. Todo el material vegetal fue identificado como se muestra en la Tabla N°1 por el la Dra. Mónica Arakaki, reconocida especialista en cactáceas y suculentas del país y por la Dra. Haydeé Montoya Terreros, Jefa del Herbario San Marcos, del Museo de Historia Natural de la Universidad Nacional Mayor de San Marcos. La colecta realizada para el presente estudio de investigación se realizó en la misma ubicación de muestreo en julio del 2019.
Secado y molienda de la planta
Se seleccionaron los frutos libres de daño físico y se lavaron, separando previamente sus espinas. Las espinas se secaron en una estufa a 45°C. Se separaron las cáscaras de la pulpa con semillas. La cáscara y pulpa con semillas fueron congeladas a -70°C en una ultracongeladora para después ser colocadas en el liofilizador, obteniéndose así las muestras de cáscara, pulpa y semillas secas. Las semillas fueron separadas manualmente de la pulpa. Las muestras de espinas, cáscaras y semillas fueron pulverizadas usando un molino casero y no fue requerido pulverizar la pulpa (sin semillas).
Obtención de los extractos
La extracción se realizó teniendo como referencia el método descrito por Collantes et al. (2011)22. Cada parte del fruto del sanqui seco y pulverizado fue macerada en n-hexano a temperatura ambiente por 24 horas, luego el extracto hexánico fue decantado y filtrado. El proceso se realizó dos veces adicionales. Los extractos orgánicos obtenidos se colectaron y concentraron con un rotavapor a 40 ºC y presión reducida, hasta la eliminación completa del solvente, obteniéndose los extractos hexánicos.
La limpieza de los extractos hexánicos se realizó teniendo como referencia el método descrito por Collantes et al. (2011)22, donde cada extracto hexánico (100mg) fue filtrado usando la fase estacionaria sílica gel para columna con 50 ml de n-hexano, la fracción obtenida fue concentrada hasta la eliminación del solvente, para luego ser sometida a transesterificación.
Transesterificación de los ácidos grasos
Con el objetivo de poder cuantificar los ácidos grasos presentes en los extractos hexánicos de las espinas, cáscara, pulpa y semillas de la especie en estudio, se realizó el proceso de transesterificación de los mismos para obtener sus correspondientes ésteres metílicos que si pueden ser analizados mediante cromatografía gaseosa. Se procedió según las Normas analíticas del Instituto Adolf Lutz23, tomando 25 mg de cada uno de los extractos hexánicos, a los que se le agregaron 3 mL de n-hexano y 15 mL de la solución de ácido sulfúrico al 2% en metanol. La mezcla fue sometida a reflujo por una hora, al enfriarse y se adicionó en una fiola que contenía una solución saturada de cloruro de sodio. La fase orgánica superior, que contenía a los ésteres metílicos formados, fue separada y concentrada.
Análisis por cromatografía gaseosa acoplada a espectrometría de masas
El análisis se llevó tomando como referencia algunos parámetros recomendados por Collantes et al. (2011) 22, usando un cromatógrafo de gases acoplado a espectrómetro de masas con las siguientes condiciones cromatográficas: Cromatógrafo de gases, Temperatura de inyección de 240 °C, Tipo Split, Razón de Split de 42.0 (43:1), Volumen de Inyección de 3µL, Modo de Control de flujo con velocidad Lineal (41.1 cm/sec), Flujo de columna de 1.28 mL/min, Gas de arrastre de helio, Flujo de purga de 3 mL/min; Programa de Temperatura de Columna de 50°C (5´) - 280°C (35´), 2°C/min, Columna Cromatográfica Restek, Rtx®-5 MS de 30 m x 0.25 mm x 0.25 μm; Detector de Masas, Temperatura de Fuente de iones de 230°C, Temperatura de Interface de 250°C, Tiempo de corte de 2 min, Tiempo de inicio MS de 2.80 min, Energía de ionización por impacto electrónico de 70eV.
Las muestras se prepararon a una concentración de 1.5mg/mL en n-hexano, se filtraron a través del filtro de jeringa (0.45 µm, Restek) antes de la inyección a la columna cromatográfica. Los análisis de cada muestra se realizaron por triplicado.
Los ácidos grasos de las muestras se identificaron como sus ésteres metílicos a través de su comparación con el tiempo de retención, masa molar, el patrón de fragmentación y las concentraciones de los compuestos del Mix de estándares de FAMEs, adicionalmente con el apoyo en la base de datos de la librería NIST 2014 incluída en el software. De igual manera se procedió para la identificación de los alcanos usando el Mix de estándares de alcanos. Para la cuantificación, se obtuvieron los contenidos relativos de los analitos utilizando el método de normalización de área corregida con factor de escala24.
RESULTADOS Y DISCUSIÓN
Rendimientos de los extractos
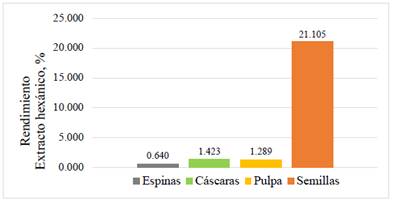
Los rendimientos de los extractos hexánicos de cada parte del fruto del sanqui se muestran en la Tabla 2 y se comparan en la Figura 1, donde se observa que la mayor cantidad de extracto hexánico obtenido es el de la semilla (21.105%), seguido por similares rendimientos de la cáscara (1.423%) y pulpa (1.289%), siendo el menor el de las espinas (0.640%). Las especies Opuntia albicarpa y O. ficus indica son cactáceas como el sanqui, las cuales presentan rendimientos de los extractos hexánicos de sus semillas del 11.83 y 6.69% respectivamente25. El mesocarpio o pulpa de las frutas generalmente contiene niveles muy bajos de material lipídico (0,1% -1,0%), mientras que en el caso de las semillas los contenidos de lípidos son elevados, oscilando en la mayoría de los casos entre el 20% y el 60%. Algunas semillas como las de litchi y longan, aguacate, durian, yaca y semillas de tamarindo tienen niveles de lípidos por debajo del 10%19.
Tabla 2 Rendimiento de los extractos hexánicos de cada parte del fruto del C. brevistylus subsp. Puquiensis
| Parte del fruto | Masa del material seco, g | Masa del extracto Hexánico, g | Rendimiento, % |
|---|---|---|---|
| Espinas | 48.7629 | 0.3123 | 0.640 |
| Cáscaras | 56.5081 | 0.8039 | 1.423 |
| Pulpa | 16.8709 | 0.2174 | 1.289 |
| Semillas | 52.1465 | 110.057 | 21.105 |
Perfil de los ácidos grasos
La identificación y cuantificación de los ácidos grasos presentes en los extractos hexánicos de las espinas, cáscara, pulpa y semillas por GCMS se muestran en la Tabla 3 y su comparación en la Figura 2, donde los componentes mayoritarios en las espinas son los ácidos araquídico (0.940%) y behénico (0.891%); en la cáscara, pulpa y en las semillas están presentes los ácidos linoleico (17,528%, 31,254%, 56,945%), palmítico (13,42%, 33,17%, 15,853%) y oleico (9,491%, 24,129%, 19,603%) respectivamente. Los ácidos grasos observados en la espina del sanqui no sobrepasan el 1%, solamente son observados 4 tipos de ácidos grasos y ellos también están presentes en las otras partes del fruto en estudio.
No hay estudios previos de ácidos grasos presentes en el sanqui. En comparación con el contenido de ácido linoleico presente en otros frutos tenemos que, en las cáscaras la cactácea Tuna (Opuntia ficus-indica) presenta de 37.0 a 52.0%20; en las pulpas se presentan desde el 0.5% para el olivo (Olea europea) al 66.7% para la Grosella (Ribes spp.)19, la cactácea Tuna (O. ficus-indica) contiene 37%26; en las semillas se presentan desde el 6.5% para el Tamarindo (Tamarindus indica, India) al 87.5% para la Japónica (Betula platyphylla )19, las cactáceas Tuna (O. ficus-indica), Pitahaya dulce (Stenocereus thurberi), Pitahaya agria (S. gummosus), Sahuaro (Carnegiea gigantea), Etcho (Pachycereus pecten-aboriginum) y Cardón (P. pringlei) contienen 65.41, 52, 50, 53, 51 y 50% respectivamente25,27. En comparación con la composición de aceites vegetales comestibles convencionales, el aceite de cactus sobrepasa el contenido de ácido linoleico de los aceites de soja (Glicyne max) (49.7%), aceites de maíz (Zea mays) (47.7%), aceites de sésamo (Sesamun indicum) (44.5%) y aceites de girasol (Helianthus annus) (49.7%)28. Por estas razones pueden incluirse en el grupo de aceites de contenido de ácido palmítico bajo y ácido linoleico alto29, un aspecto que nos permite recomendar el aceite de semilla en estudio como un posible agente nutracéutico. En el caso del contenido de ácido oleico presente en otros frutos tenemos que, en las cáscaras la cactácea Tuna (O. ficus-indica) presenta de 6.83-31.0%20; en las pulpas se presentan desde el 5.7% para el Níspero (Eriobotrya japonica) al 81.0% para el olivo (Olea europea)19, la cactácea Tuna (O. ficus-indica) contiene 10.8%26; en las semillas se presentan desde el 6.4% para la Yaca (Artocarpus integrifolia) al 76.4% para la Moringa peregrina19, las cactáceas Tuna (O. ficus-indica), Pitahaya dulce (S. thurberi), Sahuaro (Carnegiea gigantea), Pitahaya agria (S. gummosus), Etcho (Pachycereus pecten-aboriginum) y Cardón (P. pringlei) contienen 17.06, 35, 37, 36, 36 y 37% respectivamente25,27.
Tabla 3 Composición de los ácidos grasos presentes en los extractos hexánicos de las espinas, cáscara, pulpa y semillas del Corryocactus brevistylus subsp. puquiensis.
| N° | Nombre | Contenido relativo de ácidos (%) (1) | |||
|---|---|---|---|---|---|
| Espinas | Cáscara | Pulpa | Semillas | ||
| 1 | Ácido mirístico (C14:0) | Ni | 0.169 ± 0.024 | 0.267 ± 0.004 | 0.056 ± 0.004 |
| 2 | Ácido pentadecanoico (C15:0) | Ni | Ni | 0.111 ± 0.002 | Ni |
| 3 | Ácido cis-9-hexadecenoico (C16:1) (2) | Ni | Ni | 0.118 ± 0.007 | 0.187 ± 0.005 |
| 4 | Ácido palmítico (C16:0) | 0.312 ± 0.010 | 13.420 ± 0.026 | 33.170 ± 0.132 | 15.853 ± 0.064 |
| 5 | Ácido margárico (C17:0) | Ni | 0.486 ± 0.013 | 0.482 ± 0.007 | 0.046 ± 0.001 |
| 6 | Ácido linoleico (C18:2) (2) | Ni | 17.528 ± 0.120 | 31.254 ± 0.279 | 56.945 ± 0.399 |
| 7 | Ácido oleico (C18:1) (2) | Ni | 9.491 ± 0.087 | 24.129 ± 0.140 | 19.603 ± 0.216 |
| 8 | Ácido elaídico (C18:1) (2) | Ni | Ni | 0.558 ± 0.092 | 3.12 ± 0.051 |
| 9 | Ácido esteárico (C18:0) | 0.191 ± 0.005 | 1.675 ± 0.028 | 1.730 ± 0.027 | 2.607 ± 0.046 |
| 10 | Ácido cis-11-eicosenoico (C20:1) (2) | Ni | Ni | Ni | 0.184 ± 0.005 |
| 11 | Ácido araquídico (C20:0) | 0.940 ± 0.033 | 0.173 ± 0.025 | 0.202 ± 0.004 | 0.533 ± 0.029 |
| 12 | Ácido erúcico (C22:1) (2) | Ni | Ni | Ni | 0.106 ± 0.005 |
| 13 | Ácido behénico (C22:0) | 0.891 ± 0.034 | 0.215 ± 0.017 | 0.289 ± 0.010 | 0.497 ± 0.020 |
| 14 | Ácido tricosanoico (C23:0) | Ni | 0.200 ± 0.032 | 0.182 ± 0.005 | Ni |
| 15 | Ácido lignocérico (C24:0) | Ni | 0.822 ± 0.022 | 1.908 ± 0.010 | 0.076 ± 0.0024 |
| SFA | Ácidos grasos saturados | 2.333 | 17.160 | 38.341 | 19.669 |
| MUFA | Ácidos grasos monoinsaturados | - | 9.491 | 24.805 | 23.200 |
| PUFA | Ácidos grasos poliinsaturados | - | 17.528 | 31.254 | 56.945 |
| PUFA/SFA | - | 1.021 | 0.815 | 2.895 | |
| IA | Índices de aterogenicidad | - | 0.522 | 0.611 | 0.201 |
(1) Valores promedio de 3 repeticiones ± D.S. / Ni: No identificado.
(2) Corresponden a los ácidos grasos: C16:1[cis-9], C18:2[cis-9,12], C18:1[cis-9], C18:1[trans-9], C20:1[cis-11] y C22:1 cis-13].
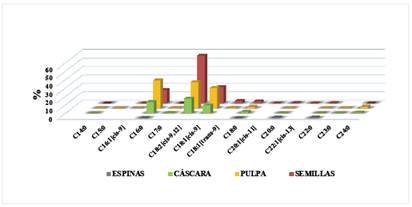
Figura 2 Comparación del porcentaje de ácidos grasos en los extractos hexánicos de las espinas, cáscara, pulpa y semillas del C. brevistylus subsp. puquiensis.
En el caso del contenido de ácido palmítico presente en otros frutos tenemos que, en las cáscaras la cactácea Tuna (O. ficus-indica) presenta de 21.5-32.1%20; en las pulpas se presentan desde el 3.4% para Grosella (Ribes spp.) al 42.5% para la uva (Vitis vinifera)19, la cactácea Tuna (O. ficus-indica) contiene 34.4%26; en las semillas se presentan desde el 4.5% para la Grosella (Ribes rubrum) al 61.9% para la Pera africana (Dacryodes edulis)19, las cactáceas Tuna (O. ficus-indica), Pitahaya dulce (S. thurberi), Pitahaya agria (S. gummosus), Sahuaro (Carnegiea gigantea), Etcho (P. pecten-aboriginum) y Cardón (P. pringlei) contienen 17.06, 6.0, 7.0, 5.5, 6.5 y 7.0% respectivamente25,27. Como podemos observar, para los casos de los frutos de las cactáceas nombradas, los ácidos grasos principales son el ácido linoleico, oleico y palmítico, como se da en nuestras muestras de cáscara, pulpa y semillas del sanqui. El contenido de ácidos grasos presentes en las espinas de otros frutos no ha sido encontrado.
De acuerdo con esta investigación, los ácidos grasos con mayor contenido en el fruto del sanqui son los ácidos linoleico, oleico y palmítico. El ácido linoleico C18:2 [cis-9, 12], un ácido graso poliinsaturado esencial ya que, junto al ácido linolénico, son precursores de la biosíntesis de los ácidos grasos poliinsaturados de cadena larga como los ácidos eicosapentaenoico (EPA) y docosahexaenoico (DHA) que son los principales constituyentes de la membrana de la célula neural y que están relacionadas con la prevención de las enfermedades cardiovasculares.30,31,32,33El ácido oleico C18:1 [cis-9] es el ácido graso monoinsaturado (MUFA) más común en dietas alimenticias que incrementan la actividad de los receptores de lipoproteínas de baja densidad (LDLRs) y disminuyen la concentración de colesterol34.
Existe una amplia evidencia científica que muestra que la modulación de la composición de las grasas en la dieta afecta las concentraciones de lípidos en la sangre, y los efectos más notables se deben por sustituir los ácidos grasos saturados con ácido oleico35. Se ha estimado que el reemplazo de ácidos grasos saturados con ácido oleico reduce el riesgo de enfermedad coronaria al 20-40% principalmente a través de la reducción del colesterol de baja densidad (LDL)36. Asimismo, han sido reportados otros efectos beneficiosos en factores de riesgo de enfermedades cardiovasculares, como factores relacionados a la trombogénesis, susceptibilidad oxidativa y sensitividad a insulina35.
El ácido oleico también ha sido usado para prevenir el cáncer, pero no existe evidencia científica suficiente para respaldar esta hipótesis. Sin embargo, esta hipótesis podría ser explicada considerando que los ácidos grasos monoinsaturados (MUFAs) son menos propensos a la peroxidación por contar con un solo enlace doble37.
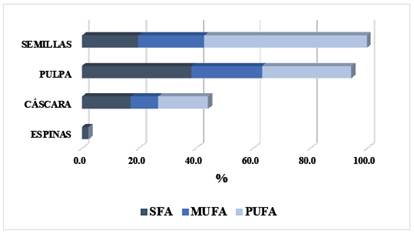
Figura 3 Comparación del porcentaje de SFA, MUFA y PUFA en los extractos hexánicos del C. brevistylus subsp. puquiensis.
El ácido palmítico (16:0) es un ácido graso saturado sintetizado de forma endógena. Aunque a menudo se considera que tiene efectos adversos sobre las enfermedades crónicas en adultos, el ácido palmítico es un componente esencial de las membranas celulares, lípidos secretores y transportadores, con funciones cruciales en la palmitoilación de proteínas y moléculas señalizadoras palmitoiladas38.
Los valores de ácidos grasos saturados (SFA), monoinsaturados (MUFA) y poliinsaturados (PUFA) de las partes del fruto del sanqui se encuentran en la Tabla 3 y su comparación en la Figura 3. Los índices PUFA/SFA determinados en este estudio son 2.895 para las semillas, 1.021 en la cáscara y 0.815 en la pulpa. PUFA/SFA es el índice más comúnmente usado para evaluar el valor nutricional de los alimentos. Los valores de este índice encontrados en las diferentes partes del sanqui analizadas son comparables con los valores que tienen alimentos como los mariscos (0.20-2.10), pescados (0.5-1.79), algas marinas verdes (0.23-0.88), algas marinas marrones (0.20-1.38).39 Los índices de aterogenicidad (IA) encontrados en este estudio son 0.201 para las semillas, 0.522 para la cáscara y 0.611 para la pulpa. El IA indica la relación entre la suma de ácidos saturados (SFAs) y la suma de ácidos insaturados (UFAs), las clases principales de SFAs, que incluyen a los ácidos C12:0, C14:0 y C16:0 con excepción del C18:0, son considerados proaterogénicos, es decir, estos ácidos favorecen la adhesión de los lípidos a las células del sistema circulatorio e inmunológico. Por otro lado, los UFAs son considerados antiaterogénicos ya que reducen los niveles de fosfolípidos, colesterol y ácidos grasos esterificados. Por lo tanto, el consumo de comida y productos con bajo IA pueden reducir los niveles de colesterol total y colesterol LDL en el plasma sanguíneo humano39. Los valores de este índice encontrados en las diferentes partes del sanqui analizadas son comparables con los valores que tienen alimentos como los mariscos (0.29-0.37), pescados (0.21-1.41), algas marinas verdes (0.04-2.90), algas marinas marrones (0.08-1.89)39.
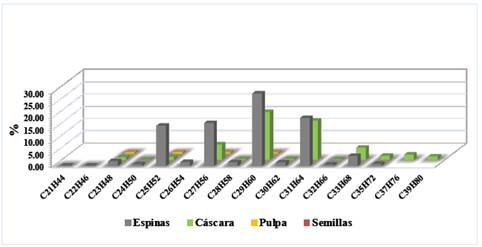
La identificación y cuantificación de los alcanos presentes en los extractos hexánicos de las espinas, cáscara, pulpa y semillas por GCMS se muestran en la Tabla 4 y su comparación en la Figura 4, donde la mayor presencia de alcanos se encontró en las espinas (29.473% de nonacosano y 19.521% de hentriacontano), seguido por la cáscara (19.402% de nonacosano y 15.982% de hentriacontano) y la pulpa (0.632% de pentacosano y 0.513% de tricosano). En las semillas no se identificaron alcanos. Los alcanos observados fueron los de cadena larga a partir de 21 carbonos hasta 35 carbonos para la espina, excepto el de 34 carbonos; para la cáscara fue observado los alcanos a partir de 23 carbonos hasta 39 carbonos excepto los de 26, 34, 36 y 38 carbonos; en la pulpa sólo fue observado 4 alcanos, de 23, 25, 27 y 29 carbonos, todos de cadena con número impar de carbonos.
Los n-alcanos son hidrocarburos de cadena lineal que componen la cera de la cutícula de las plantas y participan en numerosas funciones vitales, tales como reducir la pérdida no estomática de agua, proteger contra la radiación UV, disminuir la acción del polvo, contaminantes del aire, bacterias y hongos, y, además, cumplen un rol importante en la interacción con los insectos21. Diversos autores han mostrado que los alcanos poseen propiedades biológicas interesantes por su localización en el exterior de los órganos vegetales (cutícula)40, lo que concuerda con nuestros resultados donde el mayor contenido de alcanos se da en las espinas y cáscara.
En una investigación, mencionan que los frutos y hojas de V. mexicana sintetizan alcanos en condiciones de estrés hídrico, los cuales poseen propiedades antialimentarias ocasionando un menor consumos por insectos40. Las ceras cuticulares de las plantas están compuestas por alcanos de cadena larga (C21-C35)41, como los presentes en las espinas y cáscaras del sanqui, así como también alcoholes primarios y secundarios, ácidos grasos, aldehídos, cetonas, entre otros41.
Tabla 4 Composición de los alcanos presentes en los extractos hexánicos de las espinas, cáscara, pulpa y semillas del C. brevistylus subsp. puquiensis.
| N° | Nombre | Espinas | Cáscara | Pulpa | Semillas |
|---|---|---|---|---|---|
| 1 | Heneicosano (C21H44) | 0.185 ± 0.011 | Ni | Ni | Ni |
| 2 | Docosano (C22H46) | 0.123 ± 0.002 | Ni | Ni | Ni |
| 3 | Tricosano (C23H48) | 1.997 ± 0.049 | 0.978 ± 0.017 | 0.513 ± 0.024 | Ni |
| 4 | Tetracosano (C24H50) | 0.739 ± 0.001 | 0.050 ± 0.001 | Ni | Ni |
| 5 | Pentacosano (C25H52) | 16.389 ± 0.057 | 1.060 ± 0.017 | 0.632 ± 0.026 | Ni |
| 6 | Hexacosano (C26H54) | 1.617 ± 0.010 | Ni | Ni | Ni |
| 7 | Heptacosano (C27H56) | 17.554 ± 0.123 | 6.274 ± 0.041 | 0.465 ± 0.025 | Ni |
| 8 | Octacosano (C28H58) | 1.545 ± 0.013 | 0.214 ± 0.004 | Ni | Ni |
| 9 | Nonacosano (C29H60) | 29.473 ± 0.150 | 19.402 ± 0.026 | 0.420 ± 0.027 | Ni |
| 10 | Triacontano (C30H62) | 1.502 ± 0.023 | 0.313 ± 0.004 | Ni | Ni |
| 11 | Hentriacontano (C31H64) | 19.521 ± 0.058 | 15.982 ± 0.013 | Ni | Ni |
| 12 | Dotriacontano (C32H66) | 0.591 ± 0.009 | 0.145 ± 0.007 | Ni | Ni |
| 13 | Tritriacontano (C33H68) | 4.130 ± 0.132 | 4.927 ± 0.052 | Ni | Ni |
| 14 | Pentatriacontano (C35H72) | 0.836 ± 0.005 | 1.672 ± 0.041 | Ni | Ni |
| 15 | Heptatriacontano (C37H76) | Ni | 2.056 ± 0.075 | Ni | Ni |
| 16 | Nonatriacontano (C39H80) | Ni | 1.399 ± 0.157 | Ni | Ni |
(1) Valores promedio de 3 repeticiones ± D.S. / Ni: No identificado.
CONCLUSIONES
El presente trabajo de investigación es el primero que estudia los ácidos grasos y alcanos presentes en el fruto de la especie Corryocactus brevistylus subsp. puquiensis (sanqui). Se determinó que los ácidos grasos mayoritarios en las espinas son los ácidos araquídico (0.940%) y behénico (0.891%), en la cáscara son los ácidos linoleico (17.528%) y palmítico (13.420%), en la pulpa son los ácidos palmítico (33.170%) y linoleico (31.254%) y en la semilla son los ácidos linoleico (56.945%) y oleico (19.603%). Asimismo, se determinó que los alcanos mayoritarios en las espinas son el nonacosano (29.473%) y hentriacontano (19.521%), en la cáscara son el nonacosano (19.402%) y hentriacontano (15.982%) y en la pulpa son el pentacosano (0.632%) y tricosano (0.513%). En las semillas no se identificaron alcanos.
Los resultados demuestran que las partes del fruto como las semillas y cáscaras que pueden ser desechados como residuos en la industria, podrían ser aprovechados por su contenido de ácido linoleico y otros ácidos grasos insaturados, usándose como agentes nutraceúticos.