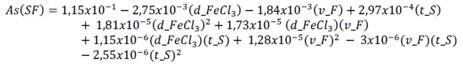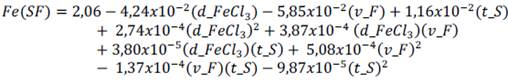INTRODUCCIÓN
A nivel mundial diversas investigaciones1 reportan que el contenido de arsénico en las diferentes fuentes de agua de los continentes del mundo, son un peligro para la salud pública, debido a los daños a la salud que se pueden generar por un consumo continuo y de largo tiempo; como son afecciones cardiovasculares, la hiperqueratosis, cáncer de piel y pulmón entre otros.
El arsénico se presenta en distintas formas inorgánicas y orgánicas y en diferentes estados de oxidación (−3, 0, +3 y +5) 2; en particular, algunas formas, trivalente (As+3) y pentavalente (As+5) son peligrosas para la salud humana. Las formas más comunes en que se encuentra el arsénico en aguas naturales es en su forma inorgánica (As+3 y As+5) 3. Las especies disueltas de arsénico dependen del pH y potencial de óxido-reducción (Eh) 4,5. En las aguas subterráneas anóxicas y aguas en condiciones reductoras, el As(III) comúnmente se hidrata existiendo principalmente como la especie H3AsO3 en un pH<9,2 y bajo condiciones más alcalinas
existirán sus aniones disociados (H AsO -, HAsO 2- y AsO 3-). La especie H AsO del As+3 sería la forma dominante que se encontraría presente en un agua natural a un pH ente 0 - 9,2. La forma dominante del arsénico en las aguas naturales superficiales suele ser el As+5 disuelto que incluye al H3AsO4 en condiciones muy ácidas (pH < 2) y sus aniones asociados (H AsO −, HAsO 2− y/o AsO 3−) en aguas menos ácidas, neutras y alcalinas6. Los valores de Eh para un agua en condiciones moderadamente oxidativa se encuentra en rangos de +141 < Eh < +202 y valores de pH entre 7,4 - 8,3 las especies se presentarían como HAsO 2-1.
Se han estudiado y propuesto una diversidad de tecnologías convencionales y no convencionales para la remoción de arsénico 2,7,8,9; en los últimos años investigaciones 9 categorizan en 04 grupos los procesos de remoción de arsénico: intercambio iónico, separación por membranas, procesos de precipitación y procesos de adsorción, los cuales generalmente incluyen la pre-oxidación para hacer posible la remoción del As+3. La investigación7 menciona que una combinación de los procesos de coagulación y filtración son los más económicos y efectivos. Adicionalmente indica que los mecanismos durante el proceso de coagulación para la remoción del arsénico son: (i) Adsorción que implica la formación de complejos superficiales entre el arsénico soluble y los sitios activos en los precipitados de hidróxido metálico, (ii) Coprecipitación con incorporación de las especies de arsénico soluble en una fase creciente de hidróxido por inclusión, oclusión o adsorción. Otros estudios10 mencionan que los tratamientos de coprecipitación y adsorción con sales de Fe+3 hidróxidos de hierro (Fe(OH)3), son los mayormente utilizados debido a sus bajos costos y alta eficiencia en la remoción del arsénico. También se menciona que la precipitación de arsénico es posible a través de la coagulación química con sales de Fe+3, como son las de cloruro férrico (FeCl ) y sulfato férrico(Fe (SO ) ) 5. En los procesos de coagulación y floculación para una máxima eficiencia de eliminación de As, el coagulante se mezcla homogéneamente en todo el medio acuoso. El coagulante metálico como por ejemplo el FeCl3 se hidroliza en agua y forma el Fe(OH)3 con carga positiva. El As se trata previamente con algún oxidante para convertirlo en As+5, es un paso necesario en la eliminación del As del agua contaminada. As+5 es un anión y es atraído por los flóculos de Fe(OH)3 cargados positivamente. En todo el proceso de coagulación y floculación, el pH, la especiación, la dosis de coagulante y la velocidad de agitación son los principales parámetros11.
Autores12 muestran en sus investigaciones que la presencia de los iones fosfato, silicato y bicarbonato reducen la eficiencia de remoción del As(III) y la presencia de bicarbonato y silicato magnifica el efecto del fosfato sobre la absorción del As(V).
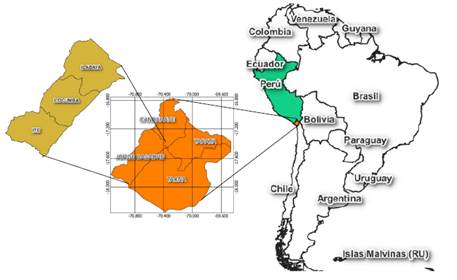
La región de Tacna ubicada en la zona extremo sur del Perú, frontera con Chile, es una de las regiones de Latinoamérica con la problemática de concentraciones de arsénico de origen natural que sobrepasan los valores máximos recomendados por la OMS (0,01 mgL-1) en varias de sus fuentes de agua. Entre las fuentes de agua antes mencionadas tenemos las del Valle de Locumba donde se reportan concentraciones entre 0,2-0,4 mgL-1 de arsénico13 (zona rural de la Región de Tacna-Perú) que se encuentra ubicado en la parte media de la cuenca hidrográfica Locumba, que abarca los ríos Curibaya, Ilabaya y Cinto14. La unión de estos tres ríos antes mencionados forma el río Locumba. La Administración Local del Agua Caplina Locumba (ALA-Caplina Locumba) que pertenece a la Autoridad Nacional del Agua (ANA-Perú); en el historial de resultados de monitores participativos de la calidad del agua superficial en la cuenca Locumba, durante las épocas de estiaje (setiembre-2015, octubre-2016, octubre-2017, noviembre-2019, octubre-2020 y mayo-2021), la estación de monitoreo 1316RLocu5 se ubicada en el río Locumba (coordenadas UTM Zona 19, 300082 Este y 8036874 Norte), muestra valores promedio de: arsénico 0,4930±0,0642 mgL-1, sulfatos 437,48±45,77 mgL-1, silicato 47,97±3,24 mgL-1, cloruros 397,20±52,65 mgL-1, hierro 0,3454±0,2317 mgL-1, pH 8,45±0,3547 y conductividad 2271,57±281,40 µScm-1. Metros más abajo de esta estación de muestreo se encuentra la bocatoma del canal de Ite, que lleva agua del río Locumba hasta el centro poblado de Ite (Provincia de Jorge Basadre, región de Tacna). El centro poblado de Ite tiene una población de 77215 habitantes, cuenta con una planta antigua de tratamiento de agua que se utiliza cloruro férrico (FeCl3) para la remoción de arsénico; la concepción de diseño de la planta no es la adecuada para alcanzar concentraciones ≤ 0,01 mgL-1 de arsénico. La planta trata una parte del agua derivada del río Locumba que llega al centro poblado de Ite; pero este tratamiento no es suficiente para hacerla apta para el consumo humano. El agua para consumo humano que utilizan los pobladores proviene de un pozo de agua subterránea, teniendo el inconveniente de un número reducido de horas de abastecimiento durante el día.
La presente investigación propone utilizar un método convencional de tratamiento (coagulación-floculación optimizado) para el agua proveniente del río Locumba, utilizando como coagulante metálico el FeCl3. Se determinaron las variables que afectan al proceso de remoción de arsénico y los valores que permitan alcanzar la remoción de arsénico a niveles menores o iguales a los límites máximos permisibles que exige la norma nacional peruana y lo recomendado por la OMS (0,01 mgL-1). Esta propuesta busca ser una alternativa de solución al problema de horas limitadas de abastecimiento de agua apta para consumo humano que tienen los pobladores del distrito de Ite.
II PARTE EXPERIMENTAL
Área de estudio
El área de estudio se encuentra localizado en el distrito de Ite. El distrito de Ite pertenece a la Provincia Jorge Basadre, que está ubicado al norte de la región de Tacna Perú (ver Figura 1). Limita por este con el distrito de Locumba, por el Oeste con el Océano Pacífico, por sur con el distrito de Sama las Yaras y por el norte con la provincia de Ilo (región de Moquegua). Se ubica a una altitud media de 174 metros sobre el nivel del mar (m s.n.m.).
Punto de toma de muestras de agua
El punto de toma de muestra de agua fue en el río Locumba que pasa por la localidad de Ite. Sus coordenadas de ubicación (Zona 19 Este 291898,3 Norte 8024172,4) a la entrada de la planta de tratamiento de agua de Ite.
Muestreo y análisis de laboratorio:
Para el muestreo en el río Locumba se utilizó el protocolo Nacional de Monitoreo de la calidad de los recursos hídricos superficiales de la ANA16. Se analizaron como parámetros de campo las coordenadas de ubicación (GPS marca Garmin Montana 680), temperatura, pH, conductividad (multiparámetro marca HANNA HI98129) y potencial de oxidación reducción (HANNA HI98120). Estas muestras fueron preservadas con HNO3 (1:1), mantenidas a una temperatura de 4 ºC y enviadas para su análisis mediante ICP-MS a un laboratorio externo acreditado S.G.S. del Perú S.A.C., el límite de detección (LD) y límite de cuantificación (LC) para el arsénico fue de 0,00003 mgL-1 y 0,00010 mgL-1 respetivamente, el hierro tuvo un LD=0,0004 mgL-1 y LC=0,0013 mgL-1.
Para la recolección de muestra de agua para las pruebas de remoción de arsénico se utilizó dos envases de polietileno de 20 litros de capacidad. Las fechas de muestreo para las pruebas de remoción de arsénico fueron realizados en el año 2019 entre los meses de agosto a octubre; realizándose varios muestreos, pero solo seleccionando los datos de dos muestreos realizados en diferentes fechas, uno para el diseño factorial fraccionado y el otro para el diseño experimental de Box-Behnken. El análisis de especiación de arsénico se realizó solo una vez en el mes de abril del año 2022.
Análisis de especiación de arsénico (As+3)
Para el análisis de especiación de As+3 se utilizó dos metodologías de análisis para la misma muestra de agua del río Locumba.
La primera metodología fue utilizando la extracción por fase sólida (EFS) a través de cartuchos descartables de especiación de arsénico17, estos cartuchos son usados para separar las especies de arsenito (As+3) del arseniato (As+5) en muestras de agua. Cada cartucho contiene 2,5 g de adsorbente selectivo. Para la preparación de la muestra se pasa de 30 a 50 mL de la muestra de agua previamente filtrada utilizando un filtro de jeringa de 0,45 µm, a través de un cartucho de especiación desechable (para muestras de agua con concentraciones mayores a 0,5 mgL-1 se debe utilizar dos cartuchos conectados en serie). El cartucho retiene al arseniato de la muestra, mientras que la especie arsenito permanece en el agua filtrada. El rango de pH recomendable para la separación de la especie arsenito es entre 4 a 9.
El procedimiento seguido en esta investigación fue tomar una muestra de agua del río Locumba e inmediatamente en el lugar de muestreo utilizando una jeringa de 50 mL conectada a un filtro de jeringa de 0,45 µm se procedió a filtrar y hacer pasar 30 ml de la muestra filtrada a través de dos cartuchos de especiación de arsénico conectados en serie (recomendado cuando la muestra contiene más de 0,5 mgL-1 de arsénico); esta muestra fue preservada con HNO (1:1) a 4ºC y enviada para su análisis mediante ICP-MS a un laboratorio externo acreditado SGS del Perú S.A.C. para el análisis de arsénico (para nuestro caso será la concentración de arsenito en la muestra de agua).
La segunda metodología para la cuantificación de As+3 fue utilizando una metodología sensible y selectiva por voltamperometría atreves de un electrodo de microhilos de oro, esto se realizó mediante el analizador portátil de AV 946 (marca Metrohm) este equipo muestra límites de detección de 0,9 µgL-1 y 0,3 µgL-1 para arsénico total (As+3 + As+5) y As+3 respectivamente. La preparación de la muestra fue tomando 15 mL de muestra filtrada a través de filtro de membrana de 0,45 µm y utilizando 3 mL de electrolito compuesto por ácido sulfámico (1 mol L-1), ácido cítrico (0,5 mol L-1) y cloruro de potasio (0,45 mol L-1), se utilizó la metodología de adición estándar utilizando una solución patrón de As+3 (c(NaAsO2) = 0,05 mol/L, Titripur@). La muestra utilizada en este análisis fue filtrada en el punto de muestreo y transportada al laboratorio a 4ºC antes de las 24 h para su análisis. Estos análisis fueron realizados en el laboratorio de nanotecnología de la Facultad de Ingeniería de la Universidad Nacional Jorge Basadre Grohmann.
Adicionalmente se tomaron dos muestras de agua del río Locumba las cuales se preservaron con HNO3 (1:1) a 4 ºC; una de ellas sin filtrar y la otra filtrada utilizando filtro de jeringa de 0,45 µm. Estas dos muestras fueron enviadas para su análisis de arsénico total y arsénico soluble a un laboratorio externo acreditado S.G.S. del Perú S.A.C.. Los parámetros registrados en campo fueron la conductividad, temperatura, pH (equipo multiparámetro marca HANNA HI98129), potencial de oxidación reducción ORP (HANNA HI98120) y las coordenadas de ubicación GPS (Garmin Montana 680).
Diseño experimental aplicado para el análisis de datos
Se aplicó ensayos preliminares para determinar las variables (factores) más influyentes en la eficiencia de remoción de arsénico total para la calidad de agua del río Locumba. Para esto se aplicó un diseño experimental factorial fraccionado 25-1, considerando como factores la dosis de cloruro férrico(X1), pH(X2), velocidad de floculación(X3), tiempo de floculación(X4) y tiempo de sedimentación(X5). Como variables respuesta (independientes) se tuvo la concentración de arsénico total residual (Y1), pH final (Y2) y la concentración de hierro total residual (Y3). Una vez identificadas las variables más significativas se procedió con la aplicación del diseño factorial de superficie respuesta de Box-Behnken; este tipo de arreglo factorial permitió determinar: las condiciones de operación para obtener la mejor eficiencia de remoción, el cálculo más eficiente de los coeficientes de primer, segundo orden del modelo matemático y reducir el número de pruebas experimentales18. Siguiendo el arreglo de Box- Behnken para tres factores significativos determinados previamente: dosis de FeCl3(X1), velocidad de floculación (X2) y el tiempo de sedimentación (X3), se utilizó 12 combinaciones de las pruebas complementado con 04 puntos centrales para la evaluación del error. Los factores, rangos de operación y variables respuesta se muestran en la tabla 1.
Tabla 1 Variables y niveles de operación para el diseño experimental de Box-Behnken.
| Variables | Niveles | |||
|---|---|---|---|---|
| -1 | 0 | 1 | ||
| Variables independientes (factores) | X1: dosis de FeCl3 (mg L-1) | 30 | 40 | 50 |
| X2: velocidad de floculación (rpm) | 20 | 40 | 60 | |
| X3: tiempo de sedimentación (minutos) | 40 | 60 | 80 | |
| Variables dependientes (respuesta) | Y1(SF)): arsénico total residual (mg L-1) sin filtración. | |||
| Y2(SF): hierro total residual (mg L-1) sin filtración. | ||||
| Y3: pH | ||||
| Parámetros que se mantuvieron constantes | ||||
| Tiempo de coagulación(min)= 1 minuto | ||||
| Velocidad de coagulación (rpm) = 200 rpm | ||||
| pH=7,0 | ||||
| Tiempo de floculación (min)= 25 | ||||
Tratamiento de las pruebas de remoción de arsénico
Las pruebas de remoción de arsénico fueron efectuadas utilizando un equipo probador de jarras (marca VELP SCIENTIFICA JLT 6), con 06 jarras cilíndricas de 1 Litro sin bafles. Se utilizó FeCl3 vendido por QUIMPAC (40% p/p, densidad: 1,40 - 1,44 g/ml) como único coagulante metálico (esta presentación del coagulante es la normalmente utilizada en las plantas de tratamiento de agua). El acondicionamiento de la muestra (agua del río Locumba), los procesos de coagulación, floculación y sedimentación se realizaron con el siguiente procedimiento: El acondicionamiento del pH de la muestra de acuerdo al pH requerido por la matriz del diseño experimental (ver tabla 4) se realizó agregando un 1 Litro de muestra de agua a cada jarra, luego utilizando un agitador magnético (marca MS-H280-Pro Lb Pro) para lograr una mezcla uniforme, se procedió a agregar H2SO4 (0,1 M), hasta alcanzar el pH requerido por la prueba. El proceso de coagulación se realizó manteniendo una velocidad de 200 rpm durante 1 minuto19 (es en este punto donde se aplica las diferentes dosis de coagulante). La condición del proceso de floculación (velocidad y tiempo) y el tiempo de sedimentación fueron establecidas de acuerdo a la matriz del diseño experimental (ver tabla Nº1 y tabla Nº4). Una vez finalizado el proceso de sedimentación se extrajo 300 mL de cada muestra, de las cuales a 100 mL fueron filtrados a través de papel filtro (Whatman Nº40)19 y otros 100 mL sin filtrar se les agrego HNO (1:1) como preservante y fueron enviados refrigerados a 4ºC para el análisis de arsénico y hierro (total y filtrado). Los 100 mL finales se utilizaron para la determinación de pH.
Análisis estadístico de los datos
Para el análisis estadístico de datos se utilizó el software Statgraphics v19 (versión de prueba), con el cual se aplicó el diseño experimental factorial fraccionado 25-1 y el diseño de superficie respuesta de Box-Behnken para diferentes condiciones de operación, obteniendo los análisis de varianza, la representación de Pareto, las gráficas de comportamiento de los factores principales y la ecuación cuadrática empírica que mejor se ajustó a los datos experimentales para las concentraciones de arsénico y hierro.
RESULTADOS Y DISCUSIÓN
Especiación de arsénico (As+3)
Los resultados encontrados se muestran en la tabla 2, junto a los resultados de Arsénico total (As-T), Arsénico Soluble (As-S) y los parámetros de campo registrados. El análisis de especiación se realizó mediante dos metodologías: la primera utilizando la extracción por fase solida (EFS) a través cartuchos descartables de especiación (CDE); los autores de esta metodología(17) determinaron una recuperación promedio del 98% de As+3 en el filtrado para concentraciones de arsénico total por debajo de 0,5 mgL-1, esto fue corroborado también en investigaciones recientes20. La segunda forma de especiación fue utilizando el método de voltamperometría con uso de electrodo de oro (VEO). Las concentraciones bajas As+3 muestran claramente de forma puntual, que la concentración de esta especie en el punto de muestreo es despreciable y el arsénico predominante es la forma As+5. Considerando el segundo método (VEO) como método más sensible para la determinación de la especie As+3, se tiene que el método primer método de especiación (CDE) utilizado, tiene una lectura cinco veces mayor a este nivel de concentración de As+3; siendo posible afirmar que su límite de cuantificación es superior a 0,005 mgL-1.
Tabla 2 Resultados de la especiación de As+3
| TºC pH | ORP (mV) | C.E. (µS cm-1) | As-T mgL-1 | As-S mgL-1 | As+3 (CDE) mgL-1 | As+3 (VEO) mgL-1 |
| 18,6 8,06 | 178 | 2428 | 0,487 | 0,48 | 0,005 | 0,001 |
ORP: Potencial de oxidación reducción, C.E.: Conductividad eléctrica, As-T: Arsénico total, As-S: Arsénico Soluble, As+3 (CDE): Concentración de As+3 utilizando cartuchos descartables de especiación, As+3 (VEO):
+3Una manera cualitativa para determinar el predominio de las especies inorgánicas de arsénico (As+3 y As+5); que es tomada en consideración por otros autores1,21; es determinando el potencial de oxidación reducción ORP (mV) y el pH de la muestra de agua; y luego ubicar estos datos en un diagrama para especies acuosas de arsénico como la mostrada en la figura
2. Este tipo de registro de datos en la presente investigación se realizó una vez cada año durante tres años, estos datos y otros parámetros registrados en campo se muestran en la Tabla 3 y se grafican en la figura 2. La ubicación de los tres puntos encerrados dentro del círculo rojo señalado en la figura 2, muestra que la forma predominante del arsénico según las características de ORP y pH del agua en el punto de muestreo se encuentra en la forma de HAsO 2-(As+5). Estos resultados concuerdan con el análisis cuantitativo realizado utilizando las dos metodologías antes señaladas; el arsénico predominante se encuentra en la forma más oxidada (As+5).
Tabla 3 Registro de parámetros evaluados en campo
| Fecha | TºC | pH | ORP (mV) | C.E.(µS cm-1) |
|---|---|---|---|---|
| 10/2020 | 18,7 | 8,30 | 180,5 | 2400 |
| 10/2020 | 17,7 | 8,34 | 147,0 | 2308 |
| 04/2020 | 18,6 | 8,06 | 178,0 | 2428 |
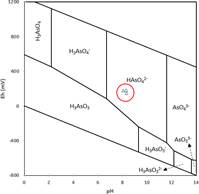
Figura 2 Diagrama Eh-pH para especies acuosas de Arsénico en un sistema As-O2-H2O a 25ºC y 1 bar total de presión22
Pruebas experimentales de remoción de arsénico
Los análisis de las muestras de agua utilizadas para las pruebas experimentales dieron como resultado concentraciones promedio de: arsénico total (As-T) = 0,5097±0,014 mgL-1, hierro (Fe) = 0,1575±0,1410 mgL-1, pH = 8,38±0,10, temperatura = 17,5±0,7 ºC y una turbiedad = 14,5±2,1 unidades nefelometrías de turbiedad (NTU). Estos resultados se encuentran en el rango del promedio registrado en los últimos años por ALA-Caplina Locumba durante los monitoreos participativos de calidad de agua en época seca (estiaje) en la estación “1316RLocu5” y también con los datos registrados en el punto Nº 9 en una publicación previa registrada por el equipo de investigación23 en la cuenca Locumba. En cuanto a la turbiedad; no se tiene registro de este parámetro en los datos de la ALA-Caplina Locumba para ser comparados.
Las variables de operación significativas seleccionadas como resultado de la aplicación de un diseño experimental factorial fraccionado 25-1 fueron: la dosis de cloruro férrico (FeCl ), pH, velocidad de floculación (v_F), y el tiempo de sedimentación(t_S). Habiéndose observado que las mayores eficiencias de remoción de arsénico se lograron a valores de pH en el rango menor de operación (pH=7), resultados que coinciden con otros autores24,3. Se consideró mantener un valor constante de pH=7 para todas las pruebas en el arreglo experimental de superficie respuesta de Box-Behnken, quedándose solamente con: la dosis de FeCl3, velocidad de floculación y tiempo de sedimentación como variables de operación. El arreglo de superficie respuesta de Box-Behnken y los resultados para cada una de las 16 condiciones de operación se muestran en la tabla 4.
Tabla 4 Parámetros de operación y valores finales de arsénico, hierro y pH, para 16 pruebas experimentales.
| Nº | Factores | Variables Respuesta | ||||
|---|---|---|---|---|---|---|
| d_FeCl3 | v_f | t_s | As(SF) | Fe(SF) | pH | |
| X1 | X2 | X3 | Y1(SF) | Y2(SF) | Y3 | |
| 1 | 30 | 20 | 60 | 0,03671 | 1,1162 | 6,88 |
| 2 | 50 | 20 | 60 | 0,01739 | 0,9037 | 6,78 |
| 3 | 30 | 60 | 60 | 0,01601 | 0,4828 | 6,89 |
| 4 | 50 | 60 | 60 | 0,01056 | 0,5795 | 6,63 |
| 5 | 30 | 40 | 40 | 0,02018 | 0,6612 | 6,84 |
| 6 | 50 | 40 | 40 | 0,01061 | 0,592 | 6,78 |
| 7 | 30 | 40 | 80 | 0,01695 | 0,4487 | 6,82 |
| 8 | 50 | 40 | 80 | 0,0083 | 0,4099 | 6,77 |
| 9 | 40 | 20 | 40 | 0,02304 | 0,902 | 6,84 |
| 10 | 40 | 60 | 40 | 0,01547 | 0,6412 | 6,78 |
| 11 | 40 | 20 | 80 | 0,02161 | 0,8755 | 6,76 |
| 12 | 40 | 60 | 80 | 0,00924 | 0,3961 | 6,72 |
| 13 | 40 | 40 | 60 | 0,01228 | 0,5618 | 6,78 |
| 14 | 40 | 40 | 60 | 0,01338 | 0,5605 | 6,76 |
| 15 | 40 | 40 | 60 | 0,01238 | 0,4847 | 6,84 |
| 16 | 40 | 40 | 60 | 0,01484 | 0,5532 | 6,86 |
Dónde: d_FeCl3 (dosis de FeCl , mgL ), v_f (velocidad de filtración, rpm), t_s (tiempo de sedimentación, minutos). As(SF) y Fe(SF) son las concentraciones (mgL-1) de arsénico y hierro en muestras que no fueron filtradas al final de cada prueba experimental (SF).
En la tabla 4 podemos observar que el resultado de las concentraciones de arsénico en 14 de un total 16 muestras que fueron analizadas al final de cada prueba sin pasar por filtración (SF), superaron el valor de 0,01 mgL-1, adicionalmente se registró que las concentraciones de hierro superaron el valor de 0,3 mgL-1 en las 16 muestras sin filtrar (SF). La normativa peruana25 establece como límite máximo permisible para el arsénico es de 0,01 mgL-1 y 0,3 mgL-1 para el hierro. La Organización Mundial de la Salud (OMS)26 establece un valor de referencia provisional de 0,01 mgL-1 para arsénico y no fija valor de referencia para el hierro. Las concentraciones determinadas de arsénico y hierro de las muestras filtradas (CF) para las 16 condiciones de operación mostradas en la tabla 4 son menores a los límites máximos permisibles que exige la normativa del Perú y del valor que establece como referencia la OMS, registrándose concentraciones de arsénico en el rango de 0,0035 a 0,0099 mgL-1 y para el hierro de 0,0163 a 0,1208 mgL-1. La investigación3 alcanzo remociones del 94% al 98% para concentraciones de As+5 de 0,5 y 1,0 mgL-1, pH=6,5, dosis de FeCl de 30 y 60 mgL-1. Encontrándose estas eficiencias de remoción cercanas a las logradas en la presente investigación para las muestras filtradas (0,99% a 0,98%, pH igual a 7 y dosis de FeCl3 entre 30 a 50 mgL-1 para una concentración inicial de arsénico de 0,5 mgL-1).
Pruebas estadísticas:
Como se observa en la Tabla 4, la concentración de As(SF) en 14 muestras y de Fe(SF) en las 16 muestras se encuentran sobre el límite máximo permitido por la legislación peruana para el arsénico y hierro. Considerando lo antes mencionado y con el fin de determinar las condiciones de operación que minimicen las concentraciones finales de As(SF) y Fe(SF) y de esta manera potencialmente asegurar concentraciones aún menores después de un proceso de filtrado final; se aplicó el diseño de superficie respuesta de Box-Behnken, generándose la tabla de análisis de varianza, diagrama de Pareto, gráfica de efectos principales, los modelos matemáticos empíricos que mejor se ajuste a los datos experimentales para As(SF) y Fe(SF) que a continuación se detallan y analizan.
Tabla 5 Análisis de Varianza para las muestras de As(SF).
| Fuente | Suma de Cuadrados | Gl | Cuadrado Medio | Razón-F | Valor-P |
|---|---|---|---|---|---|
| A:d_FeCl3 | 0,000231018 | 1 | 0,000231018 | 163,49 | 0,0010 |
| B:v_F | 0,000281675 | 1 | 0,000281675 | 199,34 | 0,0008 |
| C:t_S | 0,00002178 | 1 | 0,00002178 | 15,41 | 0,0294 |
| AA | 0,0000130863 | 1 | 0,0000130863 | 9,26 | 0,0557 |
| AB | 0,0000480942 | 1 | 0,0000480942 | 34,04 | 0,0100 |
| AC | 2,116E-7 | 1 | 2,116E-7 | 0,15 | 0,7246 |
| BB | 0,000105627 | 1 | 0,000105627 | 74,75 | 0,0033 |
| BC | 0,00000576 | 1 | 0,00000576 | 4,08 | 0,1368 |
| CC | 0,00000415141 | 1 | 0,00000415141 | 2,94 | 0,1850 |
| Falta de ajuste | 0,0000131256 | 3 | 0,00000437521 | 3,10 | 0,1891 |
| Error puro | 0,0000042392 | 3 | 0,00000141307 | ||
| Total (corr.) | 0,000728768 | 15 |
R-cuadrada = 97,6172 porciento
R-cuadrada (ajustada por g.l.) = 94,0431 porciento
Para la concentración de las muestras de As(SF)
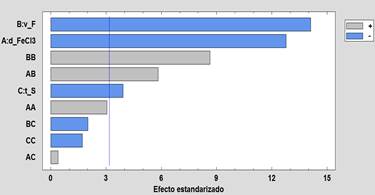
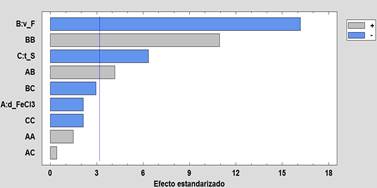
La tabla 5, muestra que los tres factores principales son significativos en el rango de exploración seleccionado, siendo el orden de significancia de mayor a menor: velocidad de floculación (v_F), dosis de FeCl3 (d_FeCl3) y el tiempo de sedimentación (t_S). También son significativos el factor cuadrático v_F y la interacción de los factores d_FeCl3 y v_F. Un importante resultado que valida el modelo cuadrático utilizado es la prueba de falta de ajuste que para este análisis no es significativo demostrando que el modelo cuadrático utilizado es adecuado; esto es también validado por el valor del R2-ajustado=94%. Los investigadores3,27al trabajar con FeCl3 para la remoción de arsénico utilizando el modelo de Box-Behnken hallaron valores de R2-ajustado de 0,92% y 0,78% respectivamente, significando que sus datos experimentales se ajustaron en menor grado al modelo cuadrático propuesto.
La ecuación empírica con sus respectivos coeficientes de regresión para el comportamiento de la concentración del arsénico As(SF) es:
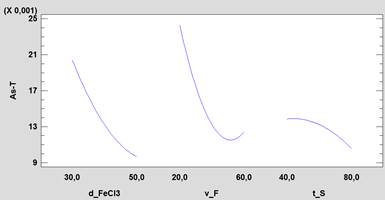
El diagrama de Pareto (figura 3) muestra que los 03 factores principales (v_F, d_FeCl3 y t_S), el factor cuadrático v_F (BB) y la interacción de factores d_FeCl3*v_F(AB) representados por barras horizontales que superan la línea horizontal de color azul; son los factores significativos. El color azul de las barras significa que a mayor valor del factor la concentración final del arsénico será menor, y el color plomo de la barra indica que a mayor valor del factor la concentración final del arsénico será mayor. El comportamiento de los efectos principales mostrados en la figura 4 complementa lo antes mencionado, claramente el aumento de la velocidad floculación (v_F) reduce la concentración de arsénico fomentando el crecimiento y aumentando la densidad del floc formado, teniendo como consecuencia la precipitación del mismo y por co-precipitación la remoción del arsénico. Pero esto tiene una velocidad límite donde una mayor velocidad provoca la rotura del floc formado aumentando nuevamente la concentración de arsénico (efecto cuadrático de la variable v_F). Para el caso de la velocidad de sedimentación (t_S) se muestra que a mayor tiempo de sedimentación favorece la reducir la concentración final de arsénico.
Para la concentración de las muestras de Fe(SF)
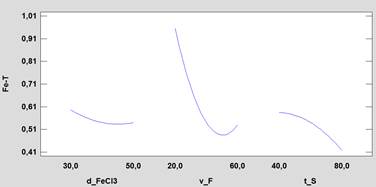
En la tabla 6 donde se muestra el análisis de varianza para el Fe(SF), se observa que los factores principales significativos son la velocidad de floculación (v_F) y el tiempo de sedimentación (t_S). Asi mismo son sifnificativos la interacción de factores de la dosis de FeCl3 (d_FeCl3) y velocidad de floculación (v_F) representados por AB, como tambien es significativo el factor cuadrático de la velocidad de flocualción (v_F) representado por BB. La falta de ajuste no es significativa indicando que el modelo cuadratico utilizado se ajusta a los datos experimentales, esto es reafirmado por el valor de un R2-ajustado de 95%.
Tabla 6 Análisis de Varianza para las muestras de As(SF).
| Fuente | Suma de Cuadrados | Gl | Cuadrado Medio | Razón-F | Valor-P |
|---|---|---|---|---|---|
| A:d_FeCl3 | 0,00626081 | 1 | 0,00626081 | 4,55 | 0,1226 |
| B:v_F | 0,360316 | 1 | 0,360316 | 261,87 | 0,0005 |
| C:t_S | 0,0554778 | 1 | 0,0554778 | 40,32 | 0,0079 |
| AA | 0,00299756 | 1 | 0,00299756 | 2,18 | 0,2364 |
| AB | 0,0239012 | 1 | 0,0239012 | 17,37 | 0,0251 |
| AC | 0,00023104 | 1 | 0,00023104 | 0,17 | 0,7095 |
| BB | 0,165039 | 1 | 0,165039 | 119,95 | 0,0016 |
| BC | 0,0119465 | 1 | 0,0119465 | 8,68 | 0,0602 |
| CC | 0,0062331 | 1 | 0,0062331 | 4,53 | 0,1232 |
| Falta de ajuste | 0,00780658 | 3 | 0,00260219 | 1,89 | 0,3069 |
| Error puro | 0,00412781 | 3 | 0,00137594 | ||
| Total (corr.) | 0,644337 | 15 |
R-cuadrada = 98,1478 porciento
R-cuadrada (ajustada por g.l.) = 95,3695 porciento
Con la finalidad de analizar el efecto de los factores, se utilizó el diagrama de Pareto que se muestra en la figura 5, donde se observa un comportamiento similar al visto en la remoción de arsénico con respecto al factor v_F(B) y su efecto cuadrático BB, indicando que el aumento en la velocidad de floculación favorece a la formación del floc de hidróxido de hierro (tamaño y densidad), fomentando su rápida sedimentación y reduciendo la concentración de hierro particulado; pero velocidades altas romperán el floc de hidróxido de hierro formado, provocando mayores concentraciones de hierro particulado (efecto cuadrático BB). Con respecto al efecto del aumento en el valor del factor tiempo de sedimentación (t_S), este contribuye a reducir la concentración de hierro. El comportamiento de los factores principales mostrados en la figura 6 complementa lo antes mencionado.
La ecuación empírica con sus respectivos coeficientes de regresión para el comportamiento de la concentración de hierro Fe(SF) es:
Condiciones de operación para la mayor remoción de las concentraciones de As(SF) y Fe(SF).
Para determinar las condiciones de operación se utilizó las ecuaciones de los modelos empíricos de regresión para el As(SF) y Fe(SF) e independientemente a cada uno se les aplico el criterio Hessiano28 o de la segunda derivada; con el fin de determinar la existencia de un mínimo local, máximo local o punto silla. Determinándose que los dos modelos empíricos encontrados muestran puntos silla, no pudiéndose determinar un único valor que pueda minimizar las concentraciones de As(SF) y Fe(SF); este comportamiento también se
muestra en una investigación27 donde se utiliza también FeCl para la remoción de arsénico,
teniendo como una variante el efecto del ácido húmico, concluyendo que no existe un único valor óptimo para la condiciones de operación que lleve a la mayor remoción de arsénico, determinando rangos de para las condiciones de operación. Los integrantes del grupo investigación tomaron como criterio seleccionar las condiciones de operación de la prueba Nº12 de la tabla 4; que muestra concentraciones finales de As(SF) y Fe(SF) de 0,00924 mgL-1 y 0,3961 mgL-1 respectivamente que fueron alcanzadas con las condiciones de operación: 40 mgL-1 de dosis de FeCl , 60 rpm como velocidad de floculación, 80 minutos de tiempo de sedimentación, pH=7 y un tiempo de floculación de 25 minutos. Esta selección fue basada en las dos únicas pruebas de As(SF) que registraron concentraciones por debajo de 0,01 mgL-1 (pruebas Nº8 y Nº12 de la tabla 4), considerando la prueba donde se tendría menor gasto de FeCl3.
CONCLUSIONES
En base a los resultados encontrados aplicando un método de tratamiento convencional para remoción de arsénico, utilizando como coagulante metálico FeCl3 se logró remover el As(CF) en todas las muestras filtradas al final de cada tratamiento, lográndose concentraciones menores e iguales al límite máximo permisible exigido por la normativa peruana (0,01 mgL-1) y recomendada por OMS. Adicionalmente también se logró concentraciones de hierro por debajo del límite máximo permisible exigido por la normatividad peruana (0,3 mgL-1) en las muestras de Fe(CF) filtradas al final del tratamiento para todas las condiciones de operación estudiadas. Esto refuerza los resultados encontrados sobre una despreciable concentración de As+3(0,001 mgL-1) y la predominancia de la especie As+5; que es la especie donde mejores resultados de remoción se tiene utilizando FeCl3 según las diversas fuentes bibliográficas consultadas.
Para el caso de las muestras que al final de cada prueba no fueron filtradas, solamente se logró remover el As(SF) por debajo del límite máximo en dos muestras (Nº8 y Nº12 de la tabla 4), la concentración de Fe(SF) en las 16 muestras mantuvo concentraciones por encima del valor máximo permisible exigido por la normatividad peruana. El análisis de superficie respuesta aplicado al As(SF) y Fe(SF) permitió determinar que los modelos cuadráticos empíricos propuestos se ajustan a los datos experimentales para el As(SF) y Fe(SF) obteniendo valores de R2-ajustado de 94% y 95% respectivamente, como también permitió reducir el número de pruebas experimentales reduciendo los costos de la investigación. No fue posible determinar una sola condición de operación que minimice las concentraciones de As(SF) y Fe(SF); debido a que los dos modelos empíricos encontrados muestran puntos silla, optando por seleccionar como las mejores condiciones de operación para la mayor remoción de As(SF) y Fe(SF): 40 mgL-1 de dosis de FeCl , 60 rpm como velocidad de floculación, 80 minutos de tiempo de sedimentación, pH=7 y un tiempo de floculación de 25 minutos; que corresponde a la prueba Nº12 de la tabla 4.
De acuerdo a los resultados encontrados en este estudio, se propone como alternativa de solución al problema de horas de abastecimiento de agua del distrito de Ite la tecnología estudiada en la presente investigación, pero es aún necesario hacer un análisis de costos por el uso adicional de ácido sulfúrico que se necesitaría para regular el pH del agua antes de la aplicación del FeCl3. Siendo potencialmente preferible el uso del ácido antes mencionado debido a los pocos kilómetros de distancia entre el distrito de Ite y la compañía minera Southern Copper Corporation quien produce este insumo químico.