INTRODUCCIÓN
En la actualidad el cáncer es una de las principales causas de muerte en el mundo. De acuerdo con el instituto nacional de enfermedades neoplásicas INEN, en el Perú la incidencia de cáncer en hombres y mujeres se ha incrementado en un 40 % en el periodo del 2020 al 2021, siendo mayor el número de casos provenientes del interior del país. Las neoplásicas más frecuentes en la población son; el cáncer de cuello uterino, cáncer de mama, cáncer de próstata, cáncer de estómago, cáncer de pulmón, cáncer colorrectal y tiroides 1.
Hoy en día, los productos naturales son una importante fuente rica en compuestos bioactivos con gran potencial terapéutico. Por ejemplo, la camptotecina y el taxol (paclitaxcel) aislados de Camptotheca acuminata y Taxus brevifolia respectivamente., siguen siendo los muy importantes en la terapia contra el cáncer desde que sus mecanismos fueron descubiertos, por ejemplo, la camptotecina es capaz de intervenir en el proceso de replicación y transcripción del ADN a través de la formación del complejo topoisomerasa-ADN provocando la muerte celular. Por otro lado, el taxol se une a los microtúbulos causando una catástrofe mitótica en las células cancerosas 2,3
Dada la gran variedad de plantas medicinales, la familia lamiaceae incluye una gran diversidad de especies con actividad farmacológica apreciable. Generalmente las especies de esta familia se caracterizan por ser arbustos de olor aromático ricos en compuestos de gran valor medicinal, esto debido a que cada especie perteneciente a esta familia posee una gran diversidad de metabolitos secundarios con buenas propiedades antibacteriales, antioxidantes, antiinflamatorias, antivirales y anticancerígenas 4. Dentro de las lamiaceae algunos metabolitos secundarios que podemos encontrar son los polifenoles; como: los ácidos fenólicos, flavonoides, estilbenos, lignanos, ligninas, cumarinas, antraquinonas y xantonas; que en el cuerpo exhiben importantes propiedades antioxidantes, antivirales, antifúngicas y anticancerígenas 5.
Los polifenoles son capaces de causar la muerte de células cancerosas a través de varios mecanismos apoptóticos 6. Los terpenoides son otro grupo de metabolitos secundarios que poseen importantes aplicaciones medicinales, los cuales se clasifican de acuerdo al número de unidades isopreno en; monoterpenos, sesquiterpenos, diterpenos, sesterpenos y triterpenos, y además son el componente principal de los aceites esenciales 7. El papel de los terpenos en la terapia contra el cáncer ha cobrado una gran importancia en los últimos años, debido a su poder antitumoral, antiproliferativo, apoptótico, antiangiogénico y antimestastásico 8,9.
Por otro lado, los aceites esenciales son mezclas complejas compuestas por sustancias orgánicas volátiles, lipídicas y de olor fuerte. Generalmente los aceites esenciales presentan en su composición terpenoides (monoterpenos, monoterpenos oxigenados, sesquiterpenos, sesquiterpenos oxigenados, diterpenos), fenilpropanoides y compuestos fenólicos 10. Los aceites esenciales son ampliamente utilizados en la industria de alimentos 11, pesticidas 12 y farmacéutica 13 y cosméticos, fragancias 14. De esta amplia gama de aplicaciones, en los últimos años se han estudiado sus actividades anticancerígenas 15. Compuestos como el mentol, mentona, carvona, piperitenona, pulegona, terpinel-4-ol, a-tujona, 1,8-cineol, b-citronelal, geraniol, linalol, alcanfor, borneol, a-pineno, b- pineno, E,E-farnesol, óxido de cariofileno, espatulanol, γ-eudesmol, germacreno D, humuleno, δ-cadineno, timol, carvacol, cinamato de metilo son algunos ejemplos de los compuestos anticancerígenos presentes en los aceites esenciales de las extraídos de diferentes especies de la familia lamiaceae16.
Entre los receptores biológicos anticancerígenos mayormente estudiados se encuentran; los inhibidores de quinasa dependientes de ciclina CDK, que son una familia de serina/treonina quinasa que actúan como proteínas reguladoras de los puntos de control durante el ciclo celular, conformado por; el crecimiento celular (G1), la replicación del ADN (S), mayor crecimiento y preparación para la fase final (Gap 2) y segregación cromosómica y división celular o mitosis (M) 17. En resumen, la proteína quinasa 2 CDK- 2 controla la fase G1/S y CDK-6 controla la fase G1 y la transcripción de la proteína retinoblastoma (Rb), ambas son responsables de regular la proliferación celular 18 . Los receptores de topoisomerasa I (topo I) y topoisomerasa II (topo II), son enzimas nucleares que catalizan la introducción de cambios topológicos en el ADN, es decir que durante la replicación y transcripción del ADN, la topo I y Topo II actúan como liberadores de tensión mediante la formación de rupturas transitorias monocatenarias y bicatenarias en la doble hélice del ADN, por lo cual las topoisomerasas son esenciales en la proliferación celular 19,20. Por otro lado existen reguladores apoptóticos encargados de mantener la homeostasis de los tejidos del cuerpo a través de la muerte celular programada, el cual es un proceso fisiológico que permite el recambio celular 21. Sin embargo los reguladores apoptóticos que se encuentran en la familia BCL-2, son las responsables de modular el umbral de respuesta a una amplia variedad de estímulos apoptóticos implicados en varios tipos de carcinomas humanos 22,23. En cambio el factor de crecimiento endotelial vascular VEGF y sus receptores VEGFR son indispensables en el proceso de regulación de la vascularización y angiogénesis 24,25. La unión VEGF/VEGFR-2 activa las vías de señalización en la angiogénesis, siendo el VEGFR-2 el principal receptor de VEGF26
.VEGFR-2 es el receptor de tirosina quinasa transmembrana que se correlaciona con la proliferación, división, motilidad, adhesión y angiogénesis celular, cuyo bloqueo inhibe la proliferación de células cancerosas 27.
Hoy en día los estudios in silico son una poderosa herramienta en la búsqueda de nuevos fármacos y elucidación de mecanismos de unión ligando-proteína. Estudios de acoplamiento molecular de los compuestos identificados en aceites esenciales han mostrado importantes aportes en cuanto a su potencial anticancerígeno. Compuestos como (E)-Z-Farnesylacetone identificado en el aceite de I. viscosa demostró potencial poder antiangiogénico con una buena afinidad en los receptores VEGFR 28,29
C. revolutum (Ruiz & Pav.) Govaerts es un especie de la familia lamiaceae comúnmente conocida como “flor de arena” encontrada en la sierra de Huánuco-Perú a 3770 m.s.n.m 30.Generalmente la flor de arena es usada para tratar problemas gastrointestinales, hepáticos y cálculos biliares. Hasta la fecha, son pocos los estudios realizados en esta esta especie, por lo que en la presente investigación se ha realizado el estudio in silico de los componentes químicos identificados en el aceite esencial de CR como posibles agentes con potencial anticancerígeno frente a seis receptores biológicos (CDK-2, CDK- 6, Topo I, Topo II, BCL-2 y VEGFR-2), los cuales cumplen funciones clave en el ciclo celular, crecimiento celular y replicación del ADN empleando cálculos de acoplamiento y dinámica molecular.
PARTE EXPERIMENTAL
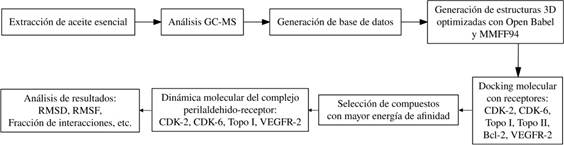
La Figura 1 resume la metodología desarrollada y en seguida se detalla en extenso cada uno de los puntos.
Extracción del aceite esencial
Las hojas secas (13 Kg) de CR se sometieron a extracción por arrastre de vapor de agua. La mezcla de aceite-agua fue separada por diferencia de densidades, se adicionó sulfato de sodio para remover la humedad, seguidamente fue almacenado en un frasco ámbar a 4°C hasta su uso.
Análisis GC-MS
El análisis de los compuestos químicos del aceite esencial de CR fue realizado en un cromatógrafo de gases (Agilent 6890N) acoplado a un espectrómetro de masas (Agilent 5975B) del laboratorio de cromatografía de la universidad San Antonio Abad del Cusco. Se inyectó 0.1 uL del aceite esencial de CR en modo Split (100:1), a una columna capilar de fenil metil silioxano (25 m x 0.25 mm i.d., 0.5 um film thickness). La temperatura del horno inicialmente fue programada a 60°C con incrementos de 5°C/ min hasta llegar a 230 °C. Se empleó helio (1ml/min) como gas de arrastre. La energía de ionización por impacto de electrones fue de 70 eV, con 38 min como tiempo de ejecución. Los componentes de CR fueron identificados a través de la comparación de los espectros de masa de cada pico con los de la biblioteca de espectros de masa proporcionados por el NIST 11 (The National Institute of Standards) a través del software MSD Chemstation B.030 (Agilnet).
Generación de base de datos
Los compuestos identificados fueron documentados en su representación SMILES empleando el repositorio PubChem. Se generaron las estructuras 3D de los compuestos empleando Open Babel 2.4.1 y luego se optimizaron las estructuras con mecánica molecular empleando el campo de fuerza MMFF94 para ser utilizadas en la siguiente etapa.
Docking molecular
En las simulaciones de docking molecular fueron considerados como ligandos los 55 compuestos de la base de datos, que se encuentra disponible en https://bit.ly/3YRLqxv. Como dianas farmacológicas en este estudio se consideraron los receptores CDK-2, CDK-6, Topo I, Topo II, Bcl-2 y VEGFR-2, con código identificador: 1DI8, 1XO2, 1T8I, 1ZXM, 2O2F y 2OH4, respectivamente, obtenidos de la base de datos de proteínas (https://www.rcsb.org/).
Los receptores fueron pretratados con Wizard de la suite Schrödinger, donde se eliminaron aguas de cristalización y otras moléculas co-cristalizadas. Para aproximar la simulación in silico a un sistema real, se editó el estado de protonación en los seis sistemas según el pH 7.4 con PropKa y se empleó el campo de fuerza OPLS para minimizar la energía del sistema. Se generó el grid box empleando cada ligando co-cristalizado como centro de una caja cúbica con 20 Å de arista. El acoplamiento molecular fue realizado con Glide de la suite Schrödinger en modo extra precisión.
Simulaciones de dinámica molecular
Se realizaron simulaciones de dinámica molecular para evaluar la estabilidad de los mejores acoplamientos encontrados en la etapa anterior. Cuatro receptores fueron seleccionados: CDK-2, CDK-6, Topo I y VEGFR-2. La dinámica molecular fue realizada con el programa Desmond. La caja de simulación consistió en una caja ortorrómbica con aristas que distan 10 Å de la parte más externa del receptor, se adicionaron moléculas de agua usando TIP3P como modelo de solvente, iones de sodio y cloro para neutralizar el sistema y se estableció una concentración salina de 0.150 M. Con el campo de fuerza OPLS3 se equilibró el sistema con los ensambles isotérmico-isocórico e isobárico- isotérmico, a temperatura 310K con el termostáto de Nosé-Hoover y una presión de 1.01325 bar con el baróstato de Martyna-Tobias-Klein, por 10 y 20 ps, respectivamente. Con este sistema equilibrado se realizó la etapa de producción de 50 ns, manteniendo constante el número de partículas, la temperatura (310K) y la presión (1.0 bar) (NPT), con la configuración predeterminada de relajación antes de la simulación. La animación de la trayectoria fue generada con 1000 frames por sistema. Se usó el módulo SID (Simulation interactions diagram) para la generación de la desviación cuadrática media (RMSD), fluctuación cuadrática media de la proteína (RMSF), diagrama de barras de la fracción de interacciones, diagrama de contactos ligando-proteína y propiedades del ligando (Ligand-RMSD, radio de giro, interacciones intramoleculares, área de superficie molecular, área de la superficie accesible al solvente y área de la superficie polar). Los cálculos con la suite Schrodinger fueron realizados en LIBIPMET de la Universidad Nacional de Ingeniería y en el Centro de Ciencias Computacionales de la Universidade Federal do Rio Grande (FURG) en Brasil.
RESULTADOS Y DISCUSIÓN
Extracción del aceite esencial
De la extracción del aceite esencial de CR, se obtuvo un líquido amarillo pálido translucido (d: 0.912 g/ml), (I.R: 1.4864), cuya composición química se detalla en la tabla N°1.
Tabla 1 Composición química del aceite esencial encontrado en CR
| N° | Tiempo de retención | Compuesto | Contenido relativo (%) |
| 1 | 4.97 | β-Tujeno | 0.89 |
| 2 | 5.15 | α-Pineno | 9.80 |
| 3 | 5.45 | Canfeno | 0.24 |
| 4 | 6.02 | Sabineno | 10.53 |
| 5 | 6.14 | β-Pineno | 18.64 |
| 6 | 6.35 | β-Mirceno | 0.50 |
| 7 | 7.01 | (+)-4-Carene | 0.36 |
| 8 | 7.20 | p-Cimeno | 0.50 |
| 9 | 7.33 | D-Limoneno | 3.77 |
| 10 | 7.40 | Eucaliptol | 0.14 |
| 11 | 7.51 | (E)- β- ocimeno | 1.14 |
| 12 | 7.78 | (Z)- β- ocimeno | 0.69 |
| 13 | 8.09 | γ-Terpineno | 1.15 |
| 14 | 8.33 | Cis- β- Terpineol | 0.16 |
| 15 | 8.88 | α- Terpinoleno | 0.25 |
| 16 | 9.17 | Linalol | 0.19 |
| 17 | 9.28 | 1-nonanal | 0.11 |
| 18 | 9.48 | 1-octen-3-il-acetato | 0.38 |
| 19 | 9.83 | Ácido octanóico, éster metílico | 0.26 |
| 20 | 10.65 | 6-octenal, 3,7-dimetil-, (R)- | 0.37 |
| 21 | 10.71 | (-)- Mentona | 0.12 |
| 22 | 10.99 | Pinocarvona | 0.06 |
| 23 | 11.38 | 4- Terpineol | 0.33 |
| 24 | 11.75 | α- Terpineol | 0.09 |
| 25 | 12.11 | Decanal | 0.07 |
| 26 | 12.62 | Ácido nonanoico, éster metílico | 0.09 |
| 27 | 12.76 | (R)- Citronelol | 0.06 |
| 28 | 13.13 | (+-)-Pulegona | 0.08 |
| 29 | 13.66 | (R)-(+)-citronelato de metilo | 0.41 |
| 30 | 14.11 | (-)- Perilaldehído | 0.05 |
| 31 | 16.19 | α-Cubebene | 4.17 |
| 32 | 16.92 | Copaeno | 2.93 |
| 33 | 17.17 | (-)-β- Borboneno | 0.50 |
| 34 | 17.31 | β- cubebene | 6.37 |
| 35 | 17.72 | Calamenene | 0.10 |
| 36 | 17.84 | α-Gurjunene | 0.45 |
| 37 | 18.16 | Cariofileno | 10.78 |
| 38 | 18.35 | β-coapeno | 0.23 |
| 39 | 18.74 | α-Selineno | 0.05 |
| 40 | 18.99 | Humuleno | 0.44 |
| 41 | 19.18 | Aloaromadendreno | 0.25 |
| 42 | 19.51 | (+)- Calarena | 0.15 |
| 43 | 19.76 | (E)-Germacreno | 10.36 |
| 44 | 19.86 | β - Selineno | 0.63 |
| 45 | 20.00 | Biciclo[4.4.0]dec-1-eno, 2- isopropil-5-metil-9-metileno- | 0.25 |
| 46 | 20.12 | 1,5,5-trimetil-6-metileno-ciclohexeno | 2.96 |
| 47 | 20.28 | α -Farneseno | 0.36 |
| 48 | 20.36 | 8-Isopropenil-1,5-dimetil- ciclodeca-1,5-dieno | 2.57 |
| 49 | 20.58 | 4-epi-cubedol | 0.8 |
| 50 | 20.75 | (+)-delta-Cadineno | 1.52 |
| 51 | 21.67 | (E)-Nerolidol | 0.07 |
| 52 | 21.91 | Palustrol | 0.06 |
| 53 | 22.14 | (-)-espatulenol | 0.27 |
| 54 | 22.29 | Óxido de cariofileno | 0.43 |
| 55 | 23.97 | γ-pachulene | 0.13 |
Docking molecular
Las energías de afinidad obtenidas son mostradas en gráficos de barras en la Figura 2, para los 10 compuestos principales. Se encontró a los compuestos (-)-perilaldehído y calamenene como los más frecuentes y con mayor afinidad en su respectivo receptor, siendo (-)-perilaldehído el mejor posicionado en cuatro receptores: CDK-2, CDK-6, Topo I VEGFR-2.
Simulaciones de dinámica molecular
Se seleccionó al perilaldehído para las simulaciones de dinámica molecular por ser el componente con mayor potencial de efecto anticancerígeno multitarget en CR, según los resultados de docking molecular. Por lo tanto, los receptores seleccionados para esta etapa fueron CDK-2, CDK-6, Topo I y VEGFR, ya que en Topo II y Bcl-2, el ligando perilaldehído no aparece en el top 10 del docking molecular. Las trayectorias de las simulaciones de dinámica molecular pueden ser visualizadas en https://www.youtube.com/playlist?list=PLRMN3GUrx4qz4zm99sms4o5sY_2kWuB-G.
Los complejos ligando-receptor CDK-2, CDK-6 y VEGFR presentaron mayor estabilidad en comparación con Topo-I, de acuerdo con los resultados de la desviación cuadrática media (RMSD) mostrada en la Figura 3.
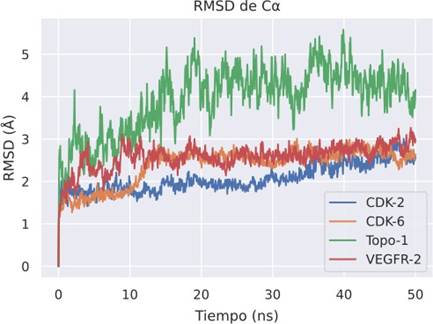
Figura 3 Desviación cuadrática media (RMSD) del C𝛼 de las simulaciones de dinámica molecular de perilaldehido con las proteínas CDK-2, CDK-6, Topo I VEGFR- 2.
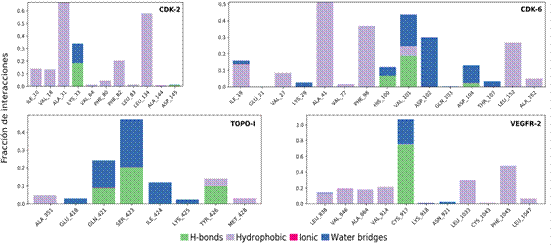
En general, los residuos presentan fluctuaciones relativamente bajas, de acuerdo con la desviación cuadrática media, en los puntos de contacto entre el ligando y el receptor, como se observa en la Figura 4 (líneas verdes verticales). Estudios relacionados con la búsqueda por cribado virtual y/o docking molecular de productos naturales con potencial actividad farmacológica muestran que valores promedio de estabilidad se encuentra por debajo de 2 y 6 Å, para RMSD y RMSF, respectivamente .Se observa en la Figura 5, que en CDK-2, CDK-6 y VEGFR-2 son predominantes las interacciones hidrofóbicas (barras moradas) y de acuerdo con el RMSD (Figura 3) y RMSF (Figura 4) podemos reconocer que estos complejos son más estables que el sistema perilaldehido-Topo I.
Este último complejo ya manifestaba una afinidad menor, como se observó en la Figura 2, sin embargo, esta energía de afinidad por encima de -5 kcal/mol, puede estar asociada con el relativo gran volumen en la cavidad del sistema proteína-doble hélice de ADN, cuando se elimina el ligando co-cristalizado en la etapa de pretratamiento.
El ligando (-)-perilaldehido por su gran afinidad con estas dianas farmacológicas en su sitio activo se perfila como el compuesto con mayor potencial anticancerígeno en el aceite esencial de CR.
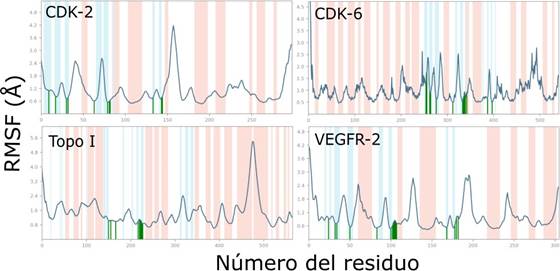
Figura 4 Fluctuación cuadrática media (RMSF) de los residuos en las simulaciones de dinámica molecular de perilaldehido con las proteínas CDK-2, CDK-6, Topo-I y VEGFR-2. Las líneas verdes indican los puntos de contacto entre el ligando y el receptor. Las regiones celestes y naranja indican estructuras beta y alfa, respectivamente.
Fracción de Interacciones
CONCLUSIONES
El aceite esencial de Clinopodium Revolutum posee propiedades medicinales promisorias contra el cáncer. En este trabajo se reportan 55 compuestos orgánicos en el aceite esencial de CR, obtenidos por GC-MS, de los cuales, (-)-perilaldehido muestra gran afinidad multitarget contra el cáncer, principalmente en las dianas farmacológicas CDK-2, CDK- 6, Topo I VEGFR-2, donde mostró alta estabilidad de acuerdo a nuestros estudios computacionales. Estos hallazgos pueden dar continuidad al diseño y optimización de fármacos contra el cáncer mediante derivados de periladehido, calamenene, entre otros.