INTRODUCCIÓN
El Perú ha sido reconocido como uno de los diecisiete países llamados megadiversos, por ser poseedores en conjunto de más del 70 % de la biodiversidad del planeta. La biodiversidad del Perú está representada por una gran variedad de ecosistemas, especies de flora y fauna, y diversidad genética, que han contribuido y contribuyen al desarrollo y la sostenibilidad mundial1. Dentro de la gran variedad de flora peruana, tenemos a los líquenes. La liquenología (estudio químico de los líquenes) como campo de estudio en el Perú ha iniciado con el doctor en botánica Augusto Weberbauer2, uno de los primeros investigadores de estas formas de vida, las cuales se pueden apreciar en su libro el Mundo Vegetal de los Andes Peruanos (1945). Sin embargo, a pesar de que varias especies de líquenes habían sido identificadas y otras utilizadas por la medicina tradicional, no fue hasta principios del siglo XX cuando la ciencia moderna se interesó por estos organismos, es por ello que estos organismos en el país aún no son tan conocidos. De acuerdo a Ramos3, solo se han reportado 924 especies de este organismo en todo el territorio, y que los estudios liquenoquímicos realizados sobre los líquenes peruanos en publicaciones científicas son muy escasos y gran parte de ellos no están identificados ni han sido estudiados.
Según su composición podemos decir que los líquenes son una asociación entre un hongo o micobionte y un simbionte fotosintético o fotobionte de cuya interacción origina un talo estable, con estructura y fisiología específicas4. Los líquenes tienen una amplia distribución geográfica, se encuentran desde los polos hasta el Ecuador; desde el nivel del mar hasta los picos más altos de las montañas y desde los sitios más húmedos como las selvas y los bosques hasta las zonas desérticas5, esto se puede deber a la gran adaptabilidad que poseen estos seres vivos, al modificar sus mecanismos fisiológicos dependiendo de las condiciones que haya en el entorno, permitiendo desarrollarse en lugares en que otros seres vivos no pueden.
A lo largo de los siglos, los líquenes se han utilizado para diversos fines, especialmente en la fabricación de colorantes, perfumes y remedios en medicinas populares6, en un principio sin conocimiento por parte de nuestros antepasados, pero debido al avance de la ciencia se descubrió que esto se debía a la presencia de los metabolitos existentes en estos organismos. Los líquenes son excepcionales en el reino vegetal, esto se debe a la alta concentración de metabolitos que pueden almacenar en su talo, se han descubierto más de 800 metabolitos secundarios de líquenes, estos se han utilizado para muchas investigaciones referentes a aplicaciones fitoquímicas y farmacéuticas7, también son las únicas plantas conservadas en herbarios que resisten largos períodos de tiempo sin sufrir invasiones bacterianas o fúngicas, producto de la actividad antimicrobiana de muchas de las sustancias liquénicas8.
Entre los metabolitos liquénicos que también se presentan en otros organismos podemos citar aminoácidos, azúcares, ácidos grasos, lactonas macrocíclicas, aromáticos monocíclicos, quinonas, cromonas, xantonas, terpenoides, esteroides y carotenoides. Entre los metabolitos hasta ahora aceptados como típicamente liquénicos se encuentran solamente dépsidos, depsidonas, depsonas, dibenzofuranos y ácidos úsnicos9.
Dentro de las investigaciones liquenoquímicas, tenemos la investigación del liquen Psiloparmelia distinta, realizado por Castro10, quien realizó el aislamiento, elucidación de las estructuras de los compuestos obtenidos, analizando sus espectros de IR, RMN-H, RMN-C, DEPT y EM; estos compuestos son: H (ácido 2-hidroxi-3-formil-4-etoxi-6- metil-benzoico), A (ácido fumarprotocetrárico). Por otro lado, Elix et al.11 a partir de los extractos de diferentes líquenes caracterizaron con el uso de técnicas clásicas analíticas y espectroscópicas aislaron e identificaron estructuras de tres nuevas depsidonas: ácido decarboxi-alectorónico [3,8-di-hidroxy-l,6-di(2'-0x0-hepta1)-11 H-dibenzo[b,e] [1,4] dioxepen-1 lone] y ácido di- 0-metilfisódico [3,8-dimetoxy-11-0x0-1-(2'-oxoheptil)-6- pentil-11H-dibenzo[b,e][1,4]dioxepin-7-ácido carboxílico] y ácido subnorstictico (1,4,10- trihydroxy -8methyl- 3,7-dioxo-1,3 -dihydro-7H -isobenzofuro- [4,5- b][1,4]benzodioxepin-11-carbaldehido). En tal sentido, la presente investigación tuvo como objetivo, aislar y elucidar metabolitos secundarios del liquen Hypotrachyna cirrhata del distrito de Churín.
PARTE EXPERIMENTAL
Materiales. - Se utilizó los materiales básicos de laboratorio (vasos, bagueta, matraces, embudos, etc.), columnas cromatográficas (Sephadex, Sílica gel), cromatofolios de Sílica gel Merck 60 (70-230 mesh) y recipientes de vidrio varios volúmenes.
Reactivos. - Se utilizaron los siguientes reactivos: metanol (MeOH), acetato de etilo (AcOEt), hexano (Hex), diclorometano (DCM), acetona (C3H6O) y etanol (EtOH), de grado analítico se adquirieron de Merck, para los espectros de RMN 1H se utilizaron solventes deuterados acetona (C3D6O) y cloroformo (CDCl3).
Equipos.- En los equipos se utilizó una balanza Analítica BOECO Germany BAS 31 de precisión 0,1 mg y capacidad 220 g, un molino Kinematica AG, maya 0.2 y fue conservado a -20 °C, el sonicador ELMA, Alemania con Frecuencia: 35 kHz; Potencia = 500 W, Tiempo = 30 min y modo = barrer, rotavapor Heidolph Hei-VAP value, la selladora al vacio Vacuubrand PC 3001 VARIOpro, una lampará UV con Luz UV 254-365 nm, el RMN 1H Espectrómetro de Bruker Avance 400 MHz y el UHPLC-PDA-MS Thermo Scientific Dionex Ultimate 3000 UHPLC sistema unido con un equipo Thermo Q exactive focus
Recolección del liquen. - Se realizó en dos oportunidades, primero para su identificación el 13 de enero del 2019, y luego para su análisis el 20 de abril del 2019, por el Dr. Olivio Nino Castro Mandujano. El lugar de colección de la especie fue en el margen izquierdo del rio Huaura a 500 m de la plaza de la Comunidad Campesina de Picoy (2258 msnm), distrito de Churín, provincia de Oyón, del departamento de Lima.
Identificación taxonómica. - Una muestra representativa se envió a la ciudad de Arequipa, al herbario del Instituto Científico Michael Owen Dillon, Herbario Sur Peruano (HSP), para su identificación taxonómica.
Secado y Molienda. - El secado se realizó en una estufa a 40°C por 3 días, después de ello se procedió a moler con un molino de casa, para luego pasarlo por una malla N° 20, obteniendo finalmente, pequeñas partículas que pesaban en total 600 gramos aproximadamente12.
Aislamiento de metabolitos
Extracción. -A partir de 150 g de liquen seco y molido, se sónico con aproximadamente 700 mL de MeOH grado analítico, a 25°C durante 30 minutos, se filtró y se reservó el filtrado, se adición 500 mL de MeOH sobre la muestra y se repitió el procedimiento unas 4 veces más. Los extractos combinados de MeOH se concentraron a sequedad con un rotavapor a 40°C (llamado Extracto EM)12
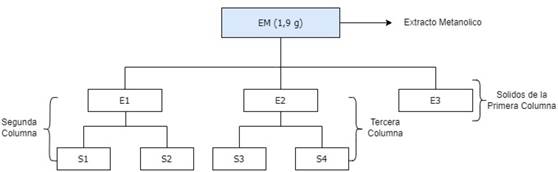
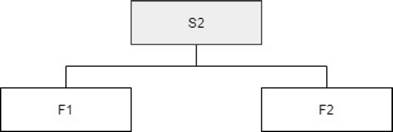
Separación y purificación. - La separación de los metabolitos secundarios, provenientes del extracto EM (1,9 g), se realizó usando las diferentes técnicas cromatográficas (CC y CCD), en varias etapas tal como lo podemos observar en la Figura 1, se empezó con la columna cromatográfica de exclusión molecular, Sephadex LH-20, con dimensiones acorde con la masa de la fracción y fase móvil de acuerdo a las necesidades, al final se obtuvo un sólido puro después de aplicar su análisis de CCD, este sólido se le llamó DB-HC-01. Luego, a partir de la subfracción S2, tal como se muestra en la Figura 2, se realizó otra CC, utilizando Sílica gel como fase estacionaria, a una proporción 1:40 (g extracto: g sílica) en medio de 400 mL de Hexano12, después de varios análisis cromatográficos se encontró un sólido puro denominado DB-HC-02.
Dónde: S2: Subfracción 2, F1: Subfracción 1 de la cuarta columna, F2: Subfracción 2 de la cuarta columna.
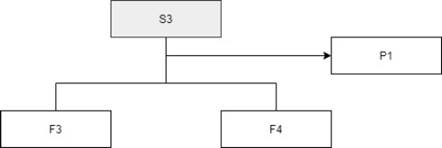
Dónde: S3: Subfracción 3, P1: Precipitado 1, F3: Subfracción 3 de la quinta columna, F4: Subfracción 4 de la quinta columna
Por otro lado, se realizó una columna de sílica gel de la subfracción S3, utilizando sílica gel como fase estacionaria, a una proporción 1:40 (g extracto: g sílica) en medio de 400 mL de DCM. Luego, se procedió a realizar una placa en fase reversa MeOH-H2O (1:1), se observó un compuesto puro, el sólido fue llamado DB-HC-03.
Los sólidos DB-HC-01, DB-HC-02 Y DB-HC-03 que se obtuvieron de las diferentes fases del proceso tuvieron que ser acondicionados previamente para ser enviados al análisis espectroscópico, para ello en un vial se pesó una pequeña parte (<50 mg) del componente separado y purificado de la muestra liquénica, se añadió 5 mL de solvente en el cual será evaluado, luego se empleó el rotavapor para secarlo durante 4 o 6 horas. Una vez seco se diluye con 2 mL del solvente deuterado, con el cual será evaluado, se coloca 0,5 mL de la sustancia preparada con ayuda de una jeringa en un tubo de RMN para ser posteriormente evaluado en el equipo.
RESULTADOS Y DISCUSION
Identificación taxonómica. - Este análisis botánico fue realizada por el Biólogo Daniel Ramos en las instalaciones del Herbario del Instituto Científico Michael Owen Dillon, “Herbario Sur Peruano” (HSP) y la clasificación taxonómica está en la tabla 1 y en la figura 4 tenemos imágenes del liquen.
Tabla 1 Clasificación taxonómica del liquen
| Reino | Fungí |
| División | Ascomycota |
| Clase | Lecanoromycetes |
| Subclase | Lecanoromycetidae |
| Orden | Lecanorales |
| Familia | Parmeliaceae |
| Género | Hypotrachyna |
| Especie | Hypotrachyna cirrhata |

Figura 4 Liquen Hypotrachyna cirrhata (Fr.) Divakar, A. Crespo, Sipman, Elix & Lumbsch. (1) Liquen en su ambiente natural, (2) Liquen seco.
Elucidación estructural de metabolitos secundarios
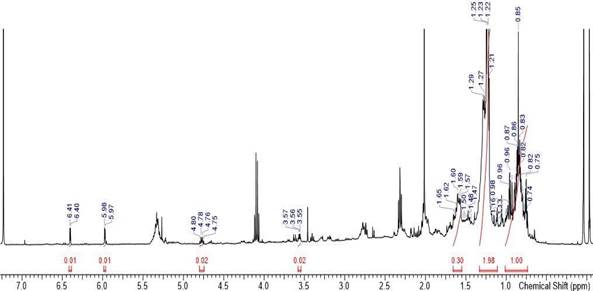
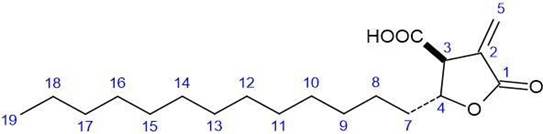
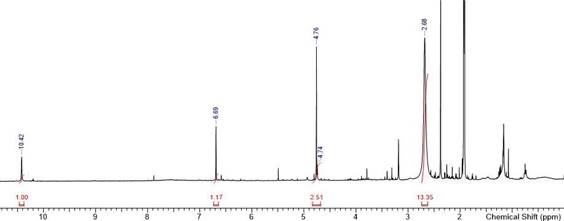
Elucidación estructural del compuesto DB-HC-01.- El compuesto DB-HC-01, es un sólido de color marrón claro, que presentaba solubilidad en cloroformo, acetona. Para el análisis por RMN 1H se disolvió en CDCl3, medido a una frecuencia de 400 MHz. en el Espectrómetro de Bruker Avance. En la Figura 5 se observa el espectro de RMN 1H del compuesto DB-HC-01, que presenta los siguientes datos: A campo alto (desplazamiento menor) se pueden identificar los protones del grupo con menor desprotección, el cual es grupo metilo (-CH3) como singulete a 0,865 ppm que se encuentra en el rango normal ya que está muy apantallado por la larga cadena de metilenos a la que se encuentra unido. La cadena de metilenos, muestra una señal de singulete a 1,231 ppm, esta señal muestra una gran intensidad debido a la cantidad de protones que representa [22H, (CH2)11 -]; el metileno unido a la cadena y al heterociclo (representado en la Figura 7 con el número 7) presenta una señal de 1,606 ppm, la cual se encuentra ligeramente desplazado de lo normal debido a que se encuentra unido a un heterociclo. De manera inversa el desplazamiento mayor se muestra a campos bajos y corresponde al que está unido heterociclo, el grupo metilideno (=CH2), con su señal mostrado por dos dobletes a 6,403 y a 5,973 ppm, siguiendo en este orden decreciente se muestra la señal de un cuadruplete a 4,772 ppm, que representa al protón unido al carbono 4 que posee mayor desprotección debido a la cercanía del oxígeno del heterociclo.
Por último, la señal del protón del carbono 3 se muestra como un quintuplete a 3.561 ppm, este desplazamiento es debido a que el protón se encuentra en un entorno que presenta una alta densidad electrónica. En la Tabla 2, se toma en cuenta los datos experimentales del 1H RMN y se comparan con los datos teóricos del Ácido Protoliquesterínico obtenidos por Huneck & Yoshimura13 y Kumar et al.14 de lo cual se observan valores muy cercanos a los obtenidos experimentalmente, con lo cual podemos afirmar que el compuesto DB-HC-01 se trataría del Ácido Protoliquesterínico, cuya estructura química lo observamos en la Figura 6.
Tabla 2 Comparación del espectro RMN 1H (400 MHz) del compuesto DB-HC-01 en CDCl3 y para el ácido protoliquesterínico.
| Desplazamiento δ (ppm) | |||
| Ácido protoliquesterínico | |||
| Compuesto DB-HC-01 | Huneck & Yoshimura, 1996 13 270 MHz, CDCl3:CD3OD = 2: 1 | Kumar et al. 2014 14 276 MHz, CDCl3 | Descripción |
| 0,865 | 0,69 | 0.89 | t, 3H, Me-19 |
| 1,231 | 1,26 | 1.3-1.2 | m, 22H,-(CH2)11- |
| 1,606 | 1,75 | 1.68 | m, 2H, 1H, -CH 2 -7 |
| 3.561 | 3,6 | - | ddd, 1H,s,6H,H-3 |
| 4,772 | 4.84 | 4.81 | q, 1H,H-4 |
| 5,973 | 6.03 | 6.03 | d, 1H,H-5 |
| 6,403 | 6.39 | 6.43 | d, 1H, H-5 |
| - | - | 11.0 | s, 1H, |
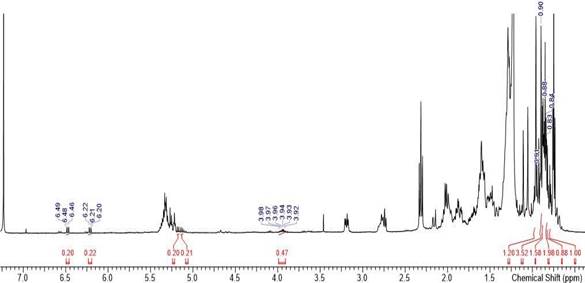
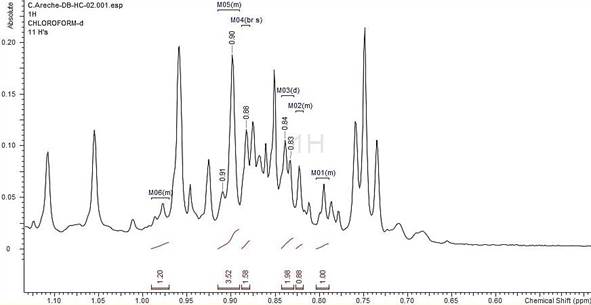
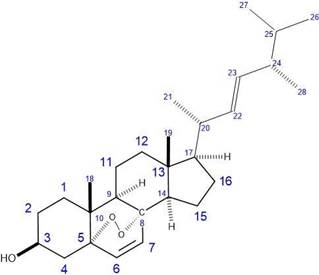
Elucidación estructural del compuesto DB-HC-02.- El compuesto DB-HC-02, es un sólido de color amarillo oscuro, que presenta solubilidad con el cloroformo. En la Figura 7 se muestra el espectro del compuesto del análisis por RMN 1H que se disolvió en CDCl3, analizando el espectro observamos que el compuesto pertenece al grupo de los esteroles, ya que presenta los siguientes datos: A desplazamiento menor (campo alto) se pueden identificar seis señales de los protones del grupo metilo (-CH3) con menor desprotección (cuatro del grupo metilo secundario y dos del grupo metilo terciario). Tal como se observa en la Figura 8, ampliación del espectro, para los grupos metilos secundarios las señales son dobletes, los cuales se muestran a 0,796; 0,836; 0,901 y 0,980 ppm, de manera similar los grupos metilo terciarios muestran señales de singuletes a 0,822 y 0,883 ppm.
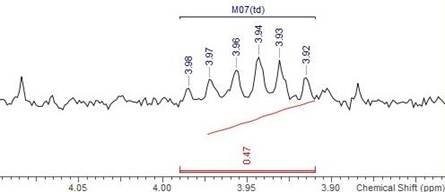
Si continuamos escalando a mayores desplazamientos, llegamos a campo intermedio, en donde se apreció una señal multiplete, de seis picos, a 3.951 ppm del hidrogeno en C-3, los seis picos son debido a los cinco hidrógenos cercanos al protón, uno de estos hidrogeno unido a un oxigeno el cual genera una menor protección al protón (Ver Figura 9). A campos bajos, es decir a mayor desplazamiento, se observan dos dobletes a 5,131 y 5,176 ppm, estas se encuentran casi juntas, debido al acoplamiento de dos hidrógenos, adicionalmente estas señales nos comprobaron la presencia de hidrógenos vinílicos del compuesto en posición trans.
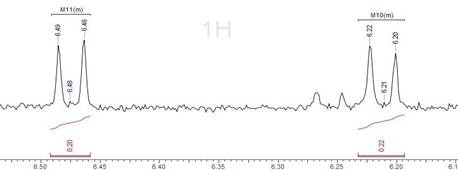
Por último, tal como se observa en la Figura 10 a campos muy bajos se muestran dos dobletes a 6,212 y 6,474 ppm, estas señales sugirieron ser de hidrógenos que forman un doble enlace, sin embargo, a diferencia de las señales precedentes estas están más desplazadas debido a que se encuentran en una posición muy cercana al radical superóxido lo cual genera un entorno que presenta una alta densidad electrónica, demostrando así la presencia de una estructura de peróxido.
En la Tabla 3, se toma en cuenta los datos experimentales del 1H RMN y se comparan con los datos teóricos del Peróxido de Ergosterol obtenidos por Huneck & Yoshimura13, Krzyczkowski et al.15 y Yang et al.16, de lo cual a través del análisis espectrométrico se observan once valores muy cercanos a los correspondientes, con lo cual podemos afirmar que el compuesto HC-DB-02 se trataría del Peróxido de Ergosterol, cuya estructura química lo observamos en la Figura 11.
Tabla 3 Comparación del espectro RMN 1H (400 MHz) del compuesto DB-HC-02 en CDCl3 y para el peróxido de ergosterol.
| Desplazamiento δ (ppm) | |||
|---|---|---|---|
| Peróxido de Ergosterol | |||
| Compuesto DB-HC-02 | Huneck & Yoshimura, 1996 1360 MHz, CDCl3:CD3OD = 2:1 | Krzyczkowski et al. 2009 15 500 MHz, CDCl3 | Yang et al. 2019 16400 MHz, CDCl3 |
| 0,796 (3H, d, H-27) | 0.82 (3H, s, 18) | 0.80 (3H, d, H-27) | |
| 0,822 (3H, s, H-18) | 0.82 (3H, d, 26) | 0.81 (3H, s, H-18) | |
| 0,836 (3H, d, H-26) | 0.83 (3H, d, 27) | 0.83 (3H, d, H-26) | |
| 0.81-1.04 (6x-Me) | |||
| 0,883 (3H, s, H-19) | 0.89 (3H, s, 19) | 0.89 (3H, s, H-19) | |
| 0,901 (3H, d, H-28) | 0.91 (3H, d, 28) | 0.90 (3H, d, H-28) | |
| 0,980 (3H, d, H-21) | 1.00 (3H, d, 21) | 1.00 (3H, d, H-21) | |
| 3,951 (1H, m, H-3) | 3.96 (1H,m,H-3) | 3.97 (1H, m, 3) | 3.94 (1H, m, H-3) |
| 5,131 (1H, dd, H-22) | 5.15-5.22 | 5.15 (1H, dd, 23) | 5.14 (1H, dd, H-22) |
| 5,176 (1H, dd, H-23) | (2H,m,H-22,H-23) | 5.22 (1H, dd, 22) | 5.22 (1H, dd, H-23) |
| 6,212 (1H, d, H-7) | 6.25 (1H, d, 6) | 6.23 (1H, d, H-7) | |
| HO 6.35 (2H,q,H-6,H-7) | |||
| 6,474 (1H, d, H-6) | 6.50 (1H, d, 7) | 6.50 (1H, d, H-6) | |
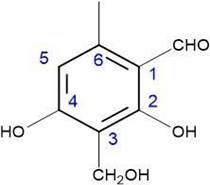
Elucidación estructural del compuesto DB-HC-03.- El compuesto DB-HC-03, es un sólido de color marrón claro, soluble en acetona, medianamente soluble en metanol y cloroformo. Para el análisis por RMN 1H se disolvió en CD₃COCD₃, medido a una frecuencia de 400 MHz. En el Espectrómetro de Bruker Avance. En la Figura 12 se observa el espectro de RMN 1H del compuesto DB-HC-3, que presento los siguientes datos: A campo alto (desplazamiento menor) se pueden identificar los protones del grupo con menor desprotección, el cual es grupo metilo unido al anillo (-CH3) como singulete a 2,680 ppm que se encuentra un poco desplazado hacia la izquierda de su rango normal, esto debido a su proximidad con el aldehído. El hidroximetil (-CH2OH) muestra una señal a 4,757 ppm, esta señal muestra un ligero desplazamiento debido los grupos alcoholes adyacentes; el protón unido al benceno presenta una señal de singulete a 6,688 ppm, la cual se encuentra dentro del rango normal. De manera inversa el desplazamiento mayor se muestra a campos bajos y corresponde al grupo aldehído, (-CHO), con su señal mostrado por un singulete a 10,420 ppm, que posee mayor desprotección debido al doble enlace con el oxígeno y debido a que el protón se encuentra en un entorno que presenta una alta densidad electrónica.
En la Tabla 4, se toma en cuenta los datos experimentales del 1H RMN, los cuales se comparan con los datos teóricos del 2-Hidroxi-4-metoxi-6-metilbenzaldehido y del 2,4- Dihidroxi-6-metilbenzaldehido tomados del Huneck & Yoshimura13 y el 2,4-dihidroxi-3- (hidroximetil)-6-metilbenzaldehido tomado de Doyon et al.17, de lo cual se observan valores teóricos cercanos a los correspondientes experimentales, con lo cual podemos afirmar que el compuesto DB-HC-3 se trataría del 2,4-dihidroxi-3-(hidroximetil)-6- metilbenzaldehido, cuya estructura química lo observamos en la Figura 13.
Tabla 4 Comparación del espectro RMN 1H (400 MHz) del compuesto HC-DB-03 en CD₃COCD₃ y para compuestos similares.
| Desplazamiento δ (ppm) | ||
|---|---|---|
| Compuesto DB-HC-03 | 2-Hidroxi-4-metoxi-6- metillbenzaldehido Huneck & Yoshimura, 1996 13 (MHz, CDCl3) | 2,4-dihidroxi-3-(hidroximetil)-6- metilbenzaldehido Doyon et al. 2019 17 400 MHz, MeOD |
| - | 12.60 (1H,s,-OH) | - |
| 10.420 (s, 1H) | 10.18 (1H,s,-CHO) | 10.07 (s, 1H) |
| 6.688 (s, 1H) | 6.24 (2H,s,H-3,H-5) | 6.26 (s, 1H) |
| 4.757 (s, 2H) | 3.79 (3H,s,OMe) | 4.68 (s, 2H) |
| 2.680 (s, 3H) | 2.45 (3H,s,-Me) | 2.50 (s, 3H) |
CONCLUSIONES
Del liquen Hypotrachyna cirrhata (Fr.) Divakar, A. Crespo, Sipman, Elix & Lumbsch, través del método espectroscópicos RMN-1H se identificó la estructura química del compuesto HC-DB-01 como Ácido Protoliquesterínico, la estructura química del compuesto HC-DB-02 aislado, corresponde al peróxido de ergosterol y finalmente el compuesto HC-DB-3 se determinó la estructura del 2,4-dihidroxi-3-(hidroximetil)-6- metilbenzaldehido.