INTRODUCCIÓN
Los recursos naturales del Perú y su biodiversidad permiten encontrar y estudiar plantas con propiedades medicinales, entre las cuales tenemos a las hierbas aromáticas como el Petroselinum crispum (Mill) Fuss “perejil” que contienen diversos compuestos fitoquímicos entre los que destacan los flavonoides (apíina, luteolina, apigenina y algunos glucósidos), aceites esenciales (apiol y miristicina)1, terpenos, sesquiterpenos y fenilpropanos, a los que se les atribuyen propiedades antibacterianas, antivirales, antitumorales, antiinflamatorias y antioxidantes2,3, cumarinas (bergapteno, imperatorina, xantotoxina, trioxaleno y angelicina)1, también contiene apreciables cantidades de vitaminas C y E, minerales como fósforo, hierro, calcio y azufre4.
En la naturaleza existe una amplia variedad de compuestos que presentan una estructura molecular caracterizada por la presencia de uno o varios anillos fenólicos. Estos compuestos podemos denominarlos polifenoles. Se originan principalmente en las plantas, que los sintetizan en gran cantidad, como producto de su metabolismo secundario. Algunos son indispensables para las funciones fisiológicas vegetales, otros participan en funciones de defensa ante situaciones de estrés y estímulos diversos (hídrico, luminoso, etc.). Los principales grupos de polifenoles son: ácidos fenólicos (derivados del ácido hidroxibenzoico o del ácido hidroxicinámico), estilbenos, lignanos, alcoholes fenólicos y flavonoides5. La biosíntesis de los polifenoles como producto del metabolismo secundario de las plantas tiene lugar a través de dos importantes rutas primarias: la ruta del ácido siquímico y la ruta de los poliacetatos6. Los antioxidantes son componentes necesarios para proteger a las células del envejecimiento causado por moléculas inestables conocidas como radicales libres7. Los antioxidantes, de acuerdo con su función, se pueden dividir en primarios y secundarios o naturales y sintéticos. Los primarios comprenden minerales tales como: selenio, cobre, hierro, zinc, manganeso, vitaminas C, E y fitoantioxidantes. Las funciones de los antioxidantes secundarios son la captura de las especies reactivas de oxígeno (ROS) y la terminación de la reacción en cadena8. Las plantas también tienen que protegerse del sol; por lo cual tienen un mejor mecanismo de defensa para evitar oxidarse y morir, debido a que son incapaces de moverse para evitar la luz solar. Así tenemos que, la mayoría de las plantas sintetizan vitaminas C y E, además de compuestos fenólicos como flavonoides, los cuales son poderosos antioxidantes9.
El perejil, perteneciente a la familia Apiaceae, ha sido objeto de diversos estudios que resaltan su importancia debido a los avances en la investigación del análisis químico. Diversos estudios han demostrado que las plantas de la familia Apiaceae son prometedoras fuentes de compuestos bioactivos naturales, los cuales podrían resultar útiles en la industria farmacéutica, alimentaria y cosmética. Esto se debe a la presencia de aceites esenciales y componentes bioactivos en los extractos crudos de estas plantas, los cuales poseen propiedades antioxidantes y antimicrobianas. Estas propiedades respaldan su uso tradicional como remedios caseros y justifican la necesidad de llevar a cabo investigaciones adicionales para desarrollar métodos industriales eficaces y ecológicos 10.
El Petroselinum crispum (Mill) Fuss “perejil” es una planta herbácea de olor penetrante. Es nativa de la región mediterránea. Ha sido introducida y cultivada en muchas partes del mundo debido a los efectos medicinales que se le atribuyen, tales como: antiséptico, estimulante, emenagogo, antiespasmódico, carminativo, estomáquico y su acción sobre la fibra uterina. La hierba fresca es ampliamente utilizada en el arte culinario. Gran parte de su uso se debe a su contenido de aceite esencial, que le brinda un aroma característico11. Se han identificado varios compuestos activos en el perejil que le confieren una amplia gama de actividad farmacológica, que incluye propiedades antioxidantes, hepatoprotectoras, protectoras del cerebro, antidiabéticas, analgésicas, espasmolíticas, inmunosupresoras y antiplaquetarias12. Sin embargo, en nuestro medio, no se tienen muchos estudios sobre la cuantificación de compuestos polifenólicos y evaluación de la actividad antioxidante del extracto hidroalcóholico de Petroselinum crispum (Mill) Fuss. Sobre esta base se decidió investigar para obtener y brindar mayor información para estudios posteriores y aplicaciones que puedan considerarlo como un recurso natural frente a productos que requieran una capacidad antioxidante para algún tratamiento dermocosmético.
Se ha trazado como objetivos evaluar la cuantificación de los compuestos polifenólicos, la actividad antioxidante del extracto hidroalcohólico del Petroselinum crispum (Mill) Fuss y de su crema dermocosmética. La cuantificación de los compuestos polifenólicos se evaluó según el método espectrofotométrico desarrollado por Folin y Ciocalteau utilizando el ácido gálico como estándar, la actividad antioxidante del extracto y de su crema dermocosmética se determinó por los métodos de DPPH• y ABTS•+.
PARTE EXPERIMENTAL
Materiales, equipos y reactivos
Materiales
Baguetas, beakers de 5 ml, 10 ml, 50 ml, 100 ml, 250 ml, probetas de 10 ml y 50 ml, cubetas de cuarzo para espectrofotómetro, embudo simple, frascos ámbar de 1 L, fiolas de 25 ml, 100 ml, matraz Erlenmeyer 250 mL, micropipetas, papel filtro Whatman Nº 42, soporte universal, gradillas, algodón, mortero y pilón, pipetas de 1 ml, 5 ml y 10 ml, puntas sueltas de (20 - 200 μl) y (100-1000 μl), tubos de ensayos, guantes de látex y papel aluminio.
Equipos
Balanza analítica electrónica modelo Ohaus® Pioneer Chaus Corporation USA, estufa modelo Barnstead Lab-Line, espectrofotómetro Thermo Scientific TM GENESYS 10S UV-Vis, refrigeradora Samsung Modelo ES21HKLMR, molino de discos, cronómetro, cocinilla eléctrica, evaporador rotatorio de marca DLAB RE100-Pro, centrífuga SMART R17, micropipetas marca ISOLAB y BOECO.
Reactivos y materias primas
Alcohol etílico 96%, agua bidestilada, agua destilada, carbonato de sodio anhydro (Na2CO3), metanol absoluto (Sigma), metanol al 70%, ácido 6-hidroxi-2,5,7,8- tetrametilcromo-2-carboxílico Trolox® (Aldrich), β, β’- azinobis-(3-etilbenzotiazolin-6- sulfónico (ABTS) (Sigma), persulfato potásico (Sigma-Aldrich), 2,2-difenil-1- picrilhidrazil (DPPH•) (Aldrich), reactivo Shinoda, tricloruro férrico (FeCl3), gelatina, reactivo de Bertrand, reactivo de Mayer, reactivo de Dragendorff, reactivo de Wagner, reactivo de Liebermann/Burchard, reactivo de Bornträger (Krauss), reactivo Baljet, reactivo Folin-Ciocalteu (Sigma- Aldrich) 0,2 N, carbonato de sodio 7,5%, ácido gálico (Sigma-Aldrich), N-Butanol, éter etílico, 1,2-diclorometano.
Metodología
Colecta y preparación de la muestra
La muestra de estudio, Petroselinum crispum (Mill) Fuss “perejil” fue colectada en diciembre del 2019 en la provincia de Huaral del departamento de Lima cuya superficie es de 64 500 km², la altitud es de 186 msnm y las coordenadas geográficas son: UTM WG S 84 E:258717.9464 N: 872854.185813. Se utilizó solo partes aéreas, se separaron las hojas del tallo y se pesaron para ser sometidas a la maceración durante 7 días en etanol 96º/agua (7:3).
Clasificación taxonómica
La clasificación del material biológico se realizó en el Museo de Historia Natural de la Universidad Nacional Mayor de San Marcos a cargo de la Dra. Joaquina Alban Castillo, siendo la especie identificada Petroselinum crispum (Mill) Fuss.
Obtención del extracto hidroalcohólico
Se pesó 1 Kg de hojas y tallos de Petroselinum crispum (Mill) Fuss “perejil” y se puso a secar en una estufa a temperatura de 42 ºC, obteniéndose un peso de 280 g de hojas secas que fueron tratadas con 1,5 L de una mezcla hidroalcohólica (7:3) realizando un proceso de maceración en un frasco de color ámbar durante siete días con agitación diaria. Posteriormente se realizó una filtración con papel Whatman Nº 42 empleando un equipo de destilación al vacío, obteniéndose un peso de 18,79 g de extracto hidroalcohólico.
Marcha fitoquímica
El análisis fitoquímico consistió en realizar un análisis cualitativo de los metabolitos secundarios presentes en el extracto, utilizando reactivos de coloración y precipitación14.
Prueba de Solubilidad
El extracto se sometió a ensayos de solubilidad con solventes de polaridad creciente, empleando éter etílico, 1,2-diclorometano, n-butanol, alcohol etílico absoluto y agua destilada.
Determinación del contenido de polifenoles totales por el método de Folin- Ciocalteu
Fundamento: Es un método espectrofotométrico que utiliza el reactivo de Folin- Ciocalteu, el cual contiene molibdato y tungstato sódico que al reaccionar con los fenoles forma el complejo fosfomolíbdico-fosfotúngstico. La transferencia de electrones a pH básico reduce los complejos fosfomolíbdico-fosfotúngstico en óxidos, visualizándose una coloración azul intensa de tungsteno (W8O23) y molibdeno (Mo8O23) que tiene un máximo de absorción a 765 nm15.
Preparación de la muestra: Se trató 0,2 g del extracto en 5 ml de metanol 70% a 70 °C. Se agitó por 10 minutos, se enfrió a temperatura ambiente y se centrifugó a 350 rpm por 10 minutos. Luego, se separó el sobrenadante en un tubo graduado. Se ajustó el volumen a 10 ml con metanol 70% frío, y se diluyó con agua hasta 100 ml15.
Procedimiento: Para la reacción de cuantificación, en un tubo de ensayo se colocó 100 µl de la dilución, 500 µl del reactivo Folin-Ciocalteu 0,2 N, se agitó y se dejó en reposo por 3 minutos, posteriormente, se agregó 400 µl de carbonato de sodio 7,5% w/v, se agitó y dejó en reposo durante una hora en oscuridad. Se realizó el mismo procedimiento para las concentraciones del estándar de ácido gálico (5-50 µg/ml). Se leyeron las absorbancias a 765 nm y el valor de polifenoles totales se expresó como equivalentes de ácido gálico/g de muestra15.
Determinación de la actividad antioxidante por el método de 2,2- difenil-1- picrilhidrazil (DPPH•)
Fundamento: El radical libre estable 2,2-difenil-1-picrilhidrazil (DPPH•) es de coloración violeta y en presencia de sustancias captadoras de radicales libres el compuesto reacciona y se decolora a amarillo pálido. La reducción del reactivo es seguida midiendo la disminución de la absorbancia espectrofotométricamente a 517 nm. El IC50 define la concentración mínima necesaria para inhibir en un 50% al DPPH• y la actividad antioxidante se expresa en TEAC (capacidad antioxidante equivalente a Trolox®)16.
Preparación de la muestra: A partir de una concentración de 12 mg/ml se realizaron diluciones de la muestra a 100, 200, 300 y 400 µg/ml, haciendo uso del solvente hidroalcohólico en proporción 7:316.
Preparación de la solución de 2,2-difenil-1-picrilhidrazil (DPPH): Se pesó 20 mg de DPPH y se disolvió en 50 ml de metanol para obtener una solución stock, posteriormente, se preparó la solución de trabajo de DPPH, midiéndose 1,7 ml de la solución stock de DPPH para llevarlo a un volumen final de 20 ml con metanol con una absorbancia final entre 0,600 - 0,700 ± 0,02 a una longitud de 517 nm16.
Procedimiento: Luego de la obtención de la solución de trabajo DPPH, se calibró el espectrofotómetro con un blanco que contiene 400 µl del solvente de la muestra problema y 800 µl de metanol. En un tubo de ensayo se colocó 400 µl de cada dilución y 800 µL de la solución de trabajo de DPPH, luego se agitó y dejó en reposo durante 30 minutos alejado de la luz. Se leyó las absorbancias a 517 nm y se realizó el mismo procedimiento para el control de DPPH en donde se reemplaza la muestra problema por su solvente y para la sustancia patrón Trolox®16.
Se calculó el porcentaje de inhibición de acuerdo a la siguiente fórmula16:
%Inhibición = (Abs. DPPH-Abs. muestra)/(Abs. DPPH)×100 Se determinó el valor TEAC según la siguiente fórmula:
TEAC= IC 50 Trolox® μg/ml/IC 50 DPPH muestra mg/ml
Determinación de la actividad antioxidante por el método de β, β’-azinobis-(3 etilbenzotiazolin-6-sulfónico) (ABTS●+)
Fundamento: El radical catiónico ABTS●+ es un cromóforo verde azulado que absorbe a una longitud de onda de 734 nm y se genera por una reacción de oxidación del β,β’- azinobis-(3-etilbenzotiazolin-6-sulfónico) (ABTS) con persulfato de potasio. En presencia de una sustancia captadora de radicales libres el compuesto reacciona y se decolora. La reducción del reactivo es seguida midiendo la disminución de la absorbancia espectrofotométricamente a 734 nm. La actividad antioxidante de la muestra se expresa en IC50 (concentración mínima necesaria para inhibir en un 50% el ABTS●+)17.
Preparación de la solución stock de β,β’-azinobis-(3-etilbenzotiazolin-6-sulfónico) (ABTS●+): Se preparó una solución stock de ABTS●+ 7 mM, y para su activación se añadió persulfato de potasio para una concentración final de 2,45 mM y se dejó reaccionar por 16 horas a temperatura ambiente y alejado de la luz. La solución stock de ABTS●+ se diluyó en agua bidestilada hasta obtener una absorbancia de 0,7 ± 0,02 a 734 nm17.
Preparación de la muestra: A partir de una concentración de 10 mg/ml se realizaron diluciones de la muestra a 25, 100 y 150 µg/ml, haciendo uso del solvente hidroalcohólico17.
Procedimiento: Luego de obtener la solución de trabajo ABTS●+, se calibró el espectrofotómetro con un blanco que contenía 20 μl del solvente de la muestra problema y 980 μl de agua bidestilada. En un tubo de ensayo se colocó 20 µl de cada dilución y 980 µl de la solución de trabajo de ABTS●+. Posteriormente se agitó y dejó en reposo durante 7 minutos alejado de la luz. Las absorbancias fueron medidas a 734 nm, realizando el mismo procedimiento para el control de ABTS●+ en donde se reemplaza la muestra problema por su solvente. Se realizó el mismo procedimiento para el estándar Trolox®. En ambos métodos, DPPH y ABTS●+, las soluciones de trabajo se prepararon y se cubrieron con papel aluminio para evitar su degradación17.
Se efectuó el cálculo del % de inhibición de acuerdo con la siguiente fórmula17:
% Inhibición = (Abs. Radical libre-Abs. muestra) / (Abs. Radical libre) × 100 Se determinó el valor TEAC según la siguiente fórmula:
TEAC = IC 50 Trolox® µg/ml / IC 50 muestra mg/ml
Formulación de la crema dermocosmética
Tabla 1 Formulación de crema dermocosmética a base del extracto hidroalcohólico de Petroselinum crispum (Mill) Fuss “perejil”.
| Crema al 1% | Crema al 2% | Crema al 4% | |||
| Fase | Componente | Nombre/INCI | % | % | % |
| A) | Agua desionizada | Water | 71.11 | 70.11 | 68.11 |
| Carbopol® Ultrez 21 polymer | Acrylates/C10-30 Alkyl Acrylate Crosspolymer | 0.14 | 0.14 | 0.14 | |
| Edeta BD | Disodium EDTA | 0.10 | 0.10 | 0.10 | |
| B) | Lanette O | Cetoestearyl alcohol | 3.20 | 3.20 | 3.20 |
| C) | MONTANOV™ 202 | Arachidyl Alcohol (and) Behenyl Alcohol (and) | 3.00 | 3.00 | 3.00 |
| Arachidyl Glucoside | |||||
| Emulgade® 1000 NI | Cetearyl Alcohol (and) | 3.10 | 3.10 | 3.10 | |
| Ceteareth-20 | |||||
| Aceite de palta | Persea gratissima oil | 1.70 | 1.70 | 1.70 | |
| Aceite de coco | Cocos nucifera (Coconut) | 1.70 | 1.70 | 1.70 | |
| Oil | |||||
| D) | Oliest IPM-R | Isopropyl myristate | 1.50 | 1.50 | 1.50 |
| Cetiol® Ultimate | Undecane (and) Tridecane | 1.50 | 1.50 | 1.50 | |
| E) | Gransil PSQ | Polymethylsilsesquioxane | 0.80 | 0.80 | 0.80 |
| XIAMETER™ PMX- | Cyclopentasiloxane (and) | 1.00 | 1.00 | 1.00 | |
| 1501 Fluid | Dimethiconol | ||||
| F) | iMoist HU 50 | Hydroxyethyl Urea | 4.50 | 4.50 | 4.50 |
| Glicerina 99.5% | Glycerin | 3.00 | 3.00 | 3.00 | |
| G) | Vitamin E Acetate | Tocopheryl Acetate | 0.50 | 0.50 | 0.50 |
| H) | Extracto de Perejil | Petrosilenum crispum leaf | 1.00 | 2.00 | 4.00 |
| hidroalcoholico 7:3 | extract | ||||
| I) | Saliguard® EHGP | Ethylhexylglycerin (and) | 1.00 | 1.00 | 1.00 |
| Phenoxyethanol | |||||
| J) | Trietanolamina 88% | Triethanolamine | 0.15 | 0.15 | 0.15 |
| K) | Rheosol AVC | Acrylamide/Sodium Acrylate Copolymer (and) Paraffinum Liquidum | 1.00 | 1.00 | 1.00 |
| (and) Trideceth-6 | |||||
| 100.00 | 100.00 | 100.00 | |||
Caracterización de la crema dermocosmética
Una vez formulada y preparada la crema antiarrugas a base del extracto hidroalcohólico de perejil al 4%, se valoraron las siguientes propiedades organolépticas: aspecto, color, olor. En cuanto a las propiedades fisicoquímicas consideradas fueron: pH, gravedad específica y viscosidad18.
También se efectuaron las pruebas de estabilidad, que nos indican la preservación de sus propiedades físicas y químicas a través del tiempo. Para ello se realizaron dos pruebas: estrés térmico y centrifugación, las cuales también se efectúan en el laboratorio cosmético SKIN CLEAN S.R.L. Durante el estrés térmico, se tomaron tres muestras del producto y se sometieron a distintas temperaturas, una muestra se llevó a la estufa a 40 ºC, la segunda muestra se refrigeró a -5 ºC y la tercera muestra se dejó a temperatura ambiente 18 - 25 º
C. Este ensayo se realizó por 30 días, verificando las muestras diariamente para observar si se produce separación de fases y/o algún cambio desfavorable en cuanto a; olor, color, pH y viscosidad19. Posteriormente, se colocaron dos muestras del producto en una centrífuga a una velocidad angular de 3000 rpm por un tiempo de 20 minutos y se observó si se llevaba a cabo la separación de fases20.
RESULTADOS Y DISCUSIÓN
Por el método de maceración hidroalcohólica se obtuvo el extracto del Petroselinum crispum (Mill) Fuss “perejil” con un rendimiento de 3,94%.
En la marcha fitoquímica se confirmó la presencia con mediana evidencia de flavonoides, compuestos fenólicos, triterpenoides, antraquinonas y lactonas. Con poca evidencia se confirmó la presencia de taninos y saponinas. Finalmente, sin ningún tipo de evidencia los alcaloides (Tabla 2.).
Tabla 2 Marcha fitoquímica del extracto hidroalcohólico del Petroselinum crispum (Mill) Fuss “perejil”.
| Metabolitos Secundarios | Reacción de identificación | Resultados en el extracto etanol/agua (7:3) de Petroselinum crispum (Mill) Fuss “perejil” | Calificación |
| Flavonoides | Shinoda | Coloración rojo intenso | ++ |
| Compuestos Fenólicos | Tricloruro Férrico (FeCl3) | Coloración azul verdoso | ++ |
| Taninos | Gelatina | Coloración ligeramente blanca | + |
| Dragendorff | - | - | |
| Bertrand | - | - | |
| Wagner | - | - | |
| Alcaloides | Mayer | - | - |
| Saponinas | Prueba de Espuma | 1 cm persistente | + |
| Triterpenoides | Liebermann - Burchard | Coloración pardo rojiza | ++ |
| Antraquinonas | Borntrager (Krauss) | Coloración rojiza | ++ |
| Lactonas | Baljet | Coloración naranja rojiza | ++ |
Leyenda: (+++) Alta evidencia, (++) Mediana evidencia, (+) Poca evidencia, (-) Negativo.
Con respecto a la prueba de solubilidad, el extracto hidroalcohólico del Petroselinum crispum (Mill) Fuss “perejil” es altamente soluble en alcohol etílico absoluto. Es medianamente soluble en agua destilada y poco soluble en en n-butanol, 1,2- diclorometano y éter etílico (Tabla 3.).
Tabla 3 Prueba de solubilidad del extracto hidroalcohólico del Petroselinum crispum (Mill) Fuss “perejil”.
| Solvente | Solubilidad |
|---|---|
| Alcohol etílico absoluto (C2H6O) (polar prótico) | +++ |
| n-butanol (C4H10O) (polar prótico) | + |
| Éter etílico (C2H5)2O (no polar) | + |
| 1,2-diclorometano (CH2Cl2) (polar prótico) | + |
| Agua destilada (H2O) (polar prótico) | ++ |
Leyenda: (+++) Alta evidencia, (++) Mediana evidencia, (+) Poca evidencia, (-) Negativo.
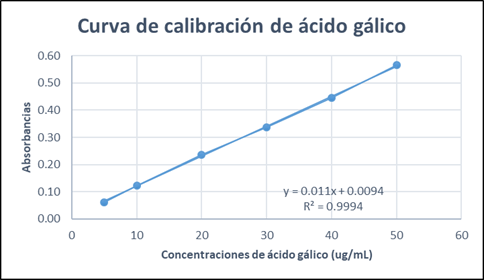
La muestra obtuvo un promedio de absorbancia de: 0,2958 y un valor de 4,33 ± 0,0162 mg EAG/g de extracto hidroalcohólico de Petroselinum crispum (Mill) Fuss. (Tabla 4, Figura 1.).
Tabla 4 Concentración de ácido gálico (µg/ml) vs. absorbancia.
| Concentración de ácido gálico (µg/ml) | Absorbancias |
| 5 | 0,0611 |
| 10 | 0,1223 |
| 20 | 0,2364 |
| 30 | 0,3371 |
| 40 | 0,4453 |
| 50 | 0,5655 |
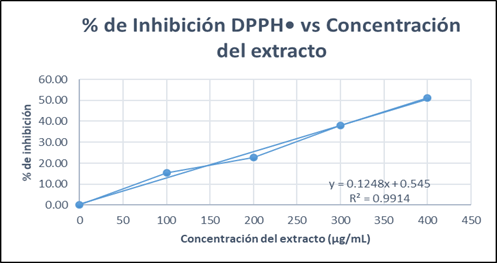
En la Tabla 5 y Figura 2 se observa una relación dependiente entre la concentración de extracto y porcentaje (%) de inhibición del radical DPPH•. A mayor aumento de concentración, la inhibición aumenta.
Las medias diferentes indican que existen diferencias significativas entre sí, usando el método de Tukey con un nivel de confianza del 95% (p ≤ 0,05).
La muestra obtuvo un IC 50 = 396,2740 ug/ml, que en comparación con el estándar de Trolox® (IC50=2,5487 ug/ml) su actividad antioxidante es baja; el estándar con una concentración menor inhibe el 50 % del radical DPPH.
Tabla 5 Concentración del extracto, absorbancia, desviación estándar y porcentaje (%) de inhibición del radical DPPH•
| Concentración del extracto (µg/ml) | Absorbancia ± DE | Inhibición (%) DPPH• | IC 50 (µg/ml) |
|---|---|---|---|
| 0 | 0,4306 ± 0,0041 | 0,00000 | 396,2740 µg/ml |
| 100 | 0,3641 ± 0,0173 | 15,4486 | |
| 200 | 0,3321 ± 0,0025 | 22,8691 | |
| 300 | 0,2663 ± 0,0062 | 38,1513 | |
| 400 | 0,2108 ± 0,0002 | 51,0413 |
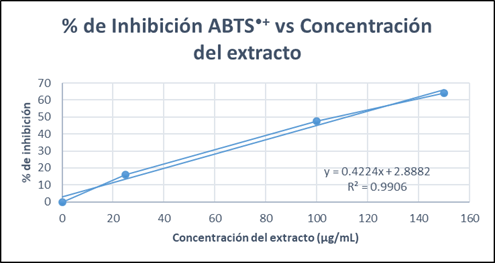
En la Tabla 6 y Figura 3 se observa una relación dependiente entre la concentración de extracto y el porcentaje (%) de inhibición del radical ABTS●+. A mayor aumento de concentración la inhibición aumenta.
Las medias diferentes indican que existen diferencias significativas entre sí, usando el método de Tukey con un nivel de confianza del 95% (p ≤ 0,05).
La muestra obtuvo un IC 50 = 111.53 ug/mL, que en comparación con el estándar de Trolox® (IC50 = 4.5549 ug/mL) su actividad antioxidante es baja, el estándar con una concentración menor inhibe 50 % del radical ABTS•+.
Tabla 6 Concentración del extracto, absorbancia, desviación estándar y porcentaje (%) de inhibición del radical ABTS●+
| Concentración del extracto (µg/ml) | Absorbancia ± DE | (%) Inhibición ABTS ●+ | IC 50 (µg/ml) |
|---|---|---|---|
| 0 | 0,7844 ± 0,0001 | 0,0000 | IC 50 = 111,53 µg/ml |
| 25 | 0,6589 ± 0,0172 | 15,9941 | |
| 100 | 0,4123 ± 0,0123 | 47,4342 |
Se realizó la preparación y caracterización de una crema dermocosmética a base de extracto hidroalcohólico de Petroselinum crispum (Mill) Fuss en concentraciones de 1%, 2% y 4%, se observó que la formulación de mayor concentración de extracto presentaba aspecto de emulsión viscosa de color ligeramente marrón suave y de olor característico, con pH 5,8 - 6,5 y una viscosidad 35,000 - 150,000 cps.
Mientras que las pruebas de estabilidad evidenciaron que las propiedades físicas y químicas se mantuvieron constantes a lo largo del tiempo y bajo las condiciones a las que se sometió. Estos resultados sugieren que la crema desarrollada tiene una buenavestabilidad, lo que la convierte en una opción prometedora para su aplicación dermocosmética.
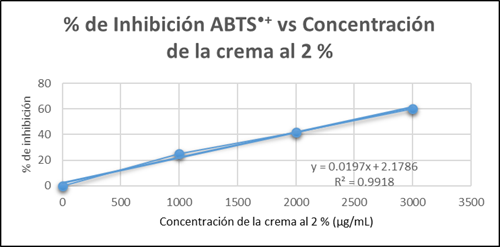
Para el método ABTS●+ se preparó una concentración de 10 mg/ml de crema y se hicieron diluciones equivalentes a las obtenidas en el extracto hidroalcohólico de Petroselinum crispum (Mill) Fuss (Tabla 7.).
Tabla 7 Concentración de la crema, absorbancia, desviación estándar y porcentaje (%) de inhibición del radical ABTS●+.
| Concentración de la crema al 2% (µg/ml) | Absorbancia ± DE | (%) Inhibición ABTS ●+ | IC 50 (µg/ml) |
|---|---|---|---|
| 0 | 0,7584 ± 0,0519 | 0,0000 | IC 50 = 2427,4822 µg/ml |
| 1000 | 0,5688 ± 0,0109 | 24,9923 | |
| 2000 | 0,4404 ± 0,0222 | 41,9344 | |
| 3000 | 0,3029 ± 0,0160 | 60,0589 |
Las medias diferentes indican que existen diferencias significativas entre sí, usando el método de Tukey con un nivel de confianza del 95% (p ≤ 0,05) (Figura 4.).
Se confirmó la actividad antioxidante en la crema dermocosmética elaborada a base del extracto hidroalcohólico del Petroselinum crispum (Mill) Fuss (perejil), la actividad se mantuvo en la crema.
Se ha demostrado en diversos materiales bibliográficos que los radicales libres tienen una estrecha relación con diversas enfermedades en el ser humano, es por ello que se dispone de sistemas destinados a neutralizar el efecto nocivo que ejercen estos compuestos, aunque al parecer, no son lo suficientemente eficientes, por lo que se recomienda ingerir compuestos con propiedades antioxidantes como las vitaminas, betacaroteno y ascorbatos, muchos de los cuales se encuentran en los vegetales, describiendo el efecto beneficioso que podrían ejercer los flavonoides21.
En el presente trabajo se utilizó el método de maceración hidroalcohólica, obteniéndose el extracto del Petroselinum crispum (Mill) Fuss “perejil” con un rendimiento de 3,94%. Asimismo, la marcha fitoquímica evidenció la presencia de flavonoides y compuestos fenólicos, así como también lactonas y triterpenoides, indicando que hay evidencia de metabolitos secundarios con función antioxidante, mientras que la prueba de solubilidad evidenció su afinidad por los solventes polares próticos frente a los no polares.
Entre los metabolitos secundarios que presenta el extracto hidroalcohólico del perejil están los flavonoides y los compuestos fenólicos que le confieren una acción antioxidante. Además, el perejil tiene diversas propiedades entre las que se mencionan: antiulcerosa22, antihepatotóxica23, hipoglucemiante24, antioxidante25 y actividad estrogénica26.
Se ha descrito que ciertos flavonoles como la rutina o la miricetina, inhiben específicamente a la xantina oxidasa, enzima que presenta afinidad por producir especies reactivas de oxígeno, fenómeno implicado en varios estados patológicos27. En la marcha fitoquímica, se evidencia la presencia de polifenoles, por lo cual, se realizó la prueba in vitro de Folin-Ciocalteau obteniéndose una absorbancia de 0,2958 y un valor de 4,33 ± 0,0162 mg EAG/g de extracto hidroalcohólico de Petroselinum crispum (Mill) Fuss. En otro estudio, se identificaron veintinueve glucósidos flavonoides en el extracto acuoso (PC) de Petroselinum crispum var. crispum y apiina, el compuesto principal, se aisló de las mismas. Se obtuvo apigenina (90% de pureza) por hidrólisis de apiina28.
Se cuantificó un alto contenido de fenoles (12,49 ± 1,70 mg EAG por gramo del extracto acuoso de perejil) por el método de Folin-Ciocalteu y flavonoides totales (15,05 ± 2,20 mg de equivalentes de quercetina por gramo de extracto acuoso de perejil) por el método de cloruro de aluminio en P. crispum. En comparación con nuestro resultado la cantidad de polifenoles totales presentes en el extracto hidroalcohólico del Petroselinum crispum (Mill) Fuss es menor con respecto a la cuantificación del extracto acuoso del Petroselinum crispum var. crispum reportados por Neide Mara29.
Con respecto a la capacidad antioxidante se midieron mediante dos métodos muy utilizados: DPPH• y ABTS•+, dando como valores TEAC-DPPH•, ABTS•+ de 6,4322 mg Trolox®/g y 40,8511 mg Trolox®/gde extracto, respectivamente. En los métodos DPPH• y ABTS•+ los valores de IC50 de 396,2740 μg/ml y 111,53 μg/ml presentaron diferencia significativa (p ≤ 0,05). Se concluyó que el extracto hidroalcohólico posee actividad antioxidante baja en comparación con el estándar Trolox®.
Mortada et al.24 evaluó la actividad antioxidante del extracto metanólico de Petroselinum crispum (Mill) Fuss por el ensayo del radical 1-difenil-2-picrilhidrazilo (DPPH•) y 2,2ʹ-azino- bis (3-etilbenzotiazolina-6-ensayo de ácido sulfónico (ABTS•+). Los resultados obtenidos fueron que la fracción de acetato de etilo derivada del extracto metanólico demostró la actividad de DPPH• (Sc50= 44,51±2,06 µg/ml) y la actividad de ABTS•+ (69,82±3,07 mg Trolox® eq./10 g extracto). En comparación con nuestro resultado el extracto metanólico posee una mayor capacidad antioxidante.
Con respecto a la actividad antioxidante de la crema de perejil al 2%, se obtuvó un TEAC
= 1,0499 mg Trolox®/g crema 2% el cual no supera al Trolox®, debido a los diferentes componentes, aditivos y excipientes presentes en su formulación; sin embargo, con los valores obtenidos se puede afirmar que la crema de perejil al 2% ejerce efecto antiarrugas. Por otro lado, se debe tomar en cuenta que el uso de distintos sustratos lipídicos tendría un impacto significativo en la actividad de diversos antioxidantes según su naturaleza hidrófila o lipófila, debido a que la distribución y las características de solubilidad afectan la actividad de los antioxidantes en un sistema heterogéneo donde se distribuyen de manera diferente entre las fases acuosa y lipídica30. Asimismo, el mecanismo de oxidación y descomposición del hidroperóxido varía con la temperatura, por lo que se pueden obtener diferentes resultados a diferentes temperaturas; y los distintos métodos utilizados para seguir la oxidación pueden dar resultados variables según los diferentes efectos de los antioxidantes en la formación de hidroperóxidos y su descomposición. Las eficiencias de antioxidantes relativas cambian significativamente de un sustrato lipídico oxidante a otro. En el mismo sustrato lipídico, la actividad relativa de los antioxidantes generalmente depende de la concentración de los antioxidantes31.
Para concluir, dado que Petroselinum crispum (Mill) Fuss “perejil” es una especie vegetal en investigación, no fue posible encontrar otros estudios sobre la actividad antioxidante de cremas a base de este vegetal, es por ello que con esta investigación se pretendió añadir la acción antioxidante del “perejil” a formas farmacéuticas tópicas, puesto que estos preparados son fácilmente utilizados por la población y al ser usados por vía tópica mejora sus beneficios para la piel, por lo cual, la concentración de antioxidantes y el vehículo son factores importantes en su efectividad32. Por otro lado, Castaño27 afirma que, en la actualidad, las cremas tópicas son una estrategia clave para prevenir las manifestaciones cutáneas, por lo que es la vía responsable del envejecimiento celular; debido a esto se buscan activos cosméticos que sean capaces de neutralizar su efecto, siendo fundamental la aplicación de activos antioxidantes que pueden minimizar los efectos del estrés oxidativo y retrasar la muerte celular que se oculta tras el proceso de envejecimiento de la piel.
CONCLUSIONES
El contenido de polifenoles totales del extracto hidroalcohólico del Petroselinum crispum (Mill) Fuss (perejil) fue de 4,33 ± 0,0162 mg EAG/g determinado por el método de Folin- Ciocalteau. La actividad antioxidante in vitro del extracto hidroalcohólico del Petroselinum crispum (Mill) Fuss (perejil) por el método DPPH• exhibió un IC50 de 396,27 µg/mL con un valor TEAC de 6,4322 mg Trolox/g y para el ABTS•+ su IC50 fue 111,53 µg/ml con un valor TEAC de 40,8511 mg Trolox/g (p < 0,05).
Se elaboraron cremas dermocosméticas con el extracto hidroalcohólico Petroselinum crispum (Mill) Fuss “perejil” en concentraciones de 1%, 2% y 4%, las cuales presentaron actividad antioxidante in vitro por el método ABTS•+ con un TEAC = 1,0499 mg Trolox®/g crema 2%. Hallándose diferencias significativas entre sí, mediante el método de Tukey con un nivel de confianza del 95% (p ≤ 0,05).