INTRODUCCIÓN
Las nanopartículas, micropartículas o partículas ultrafinas de cobre han ganado un gran interés debido a sus excelentes propiedades eléctricas 1 y antibacterianas 2,3; además el cobre tiene la ventaja de ser de bajo costo 1. Por otro lado, las partículas de plata tienen mejores propiedades antibacterianas, conductividad eléctrica y resistencia a la oxidación que el cobre 4,5, sin embargo, esta tiene un mayor costo. Una alternativa interesante son las partículas bimetálicas de cobre y plata, la forma de distribución de estos dos metales puede orientarse de diferentes maneras: core@shell, subcluster segregados, aleación intermetálica y aleación aleatoria 6,7, de estos tipos, las partículas bimetálicas core@shell Cu@Ag son las que tienen las características más interesantes 4,5,6,7,8. Al recubrir al cobre con plata se obtienen partículas core@shell con propiedades similares a la plata y de menor costo a comparación de las partículas monometálicas de plata.
Las microondas son ondas electromagnéticas con una frecuencia que oscila entre 200 MHz y 300 GHz. La frecuencia de 915 MHz (33,3 cm) se utiliza con mayor frecuencia en dispositivos industriales, mientras que la frecuencia de 2,45 GHz (12,2 cm) se utiliza en instalaciones de laboratorio de microondas. La ventaja importante del calentamiento por microondas es la rápida transferencia de energía mediante radiación en lugar de transferencia de calor o convección. Esto asegura una rápida penetración de energía en el volumen de materiales transparentes a la radiación de microondas, es decir, un calentamiento instantáneo. El tratamiento con microondas permite disminuir la duración de la reacción, aumentar los rendimientos y las selectividades, y disminuir el consumo de energía y reactivos. El uso de pulsos de energía de microondas proporciona una reducción adicional en el consumo de energía. Uno de los posibles mecanismos de acción de las microondas, ampliamente utilizado en el caso de la síntesis de nanopartículas metálicas debido a la presencia de agua, alcoholes y otros compuestos polares, en su mayoría que contienen oxígeno, en el medio de reacción, es la polarización dieléctrica. El segundo mecanismo implica corrientes de cargas libres excitadas en sólidos y que contribuyen al calentamiento debido a la pérdida óhmica; este mecanismo es característico de materiales que poseen una conductividad sustancial (metales y semiconductores) y partículas soportadas sobre soportes (semi)conductores. El tercer mecanismo que también conviene tener en cuenta es el provocado por la pérdida de corrientes de vórtice excitadas por campos magnéticos 9.
Dentro de la síntesis química de partículas de cobre y plata se tiene al método del poliol, que consiste en utilizar un solvente que tiene varios grupos hidroxilos, permitiendo disolver fácilmente al precursor metálico y alcanzar temperaturas mayores a 100°C o menores a 0°C, temperaturas que no se pueden alcanzar con el agua 1. Este método puede ser asistido mediante calentamiento por la técnica microondas obteniendo partículas metálicas en un menor tiempo a diferencia del calentamiento convencional 10. La formación de las partículas core@shell Cu@Ag ocurre mediante la deposición galvánica de la plata sobre los núcleos de cobre, ya que el potencial de reducción de la plata es mayor que el del cobre, este mecanismo explica el recubrimiento monoatómico de la plata. El crecimiento de la capa de plata se explica por los mecanismos de reducción y transmetalación, siendo la transmetalación compatible con el método del poliol. Para la formación de partículas Cu@Ag por lo general la cantidad de cobre está en exceso respecto a la cantidad de plata 11,12.
Uno de los solventes poco utilizados en la síntesis de nanopartículas de cobre (NPs Cu) y de cobre@plata (NPs Cu@Ag) por el método del poliol es la glicerina, este solvente es de bajo costo y eco-amigable con el medio ambiente. Cao y colaboradores sintetizaron NPs Cu por el método del poliol vía microondas usando como solvente la glicerina, polivinilpirrolidona (PVP) y citrato de sodio como agente dispersante 10, sin embargo, aparte de la glicerina utilizaron como principal agente reductor a la hidrazina obteniendo nanopartículas de 1 nm a 27 nm. En cambio, el grupo de Kheawhom sintetizó NPs Cu@Ag de 40 nm a 50 nm a partir de las NPsCu 13, las NPs Cu se sintetizaron de manera parecida al método anterior diferenciándose principalmente por la no utilización de citrato de sodio. Por último, Dobrovolný y colaboradores sintetizaron NPs Cu de aprox. 37 nm 14, el procedimiento fue similar a los anteriores utilizando el calentamiento convencional, no se usó ningún agente reductor adicional, pero se usó como agente dispersante al polivinilalcohol (PVA).
Hasta la fecha todavía no se ha estudiado el efecto de la irradiación microondas en la mezcla binaria de glicerina con butanol, ni el efecto del monoestearato de glicerol en síntesis química de partículas, sino los más comunes tales como PVA, PVP y citrato de sodio. En este trabajo, se plantea un método de síntesis de MPs Cu utilizando la mezcla binaria de butanol-glicerina variando las fracciones molares para encontrar la que permite producir MPs Cu con morfología homogénea y menores tamaños. Luego, se procedió a realizar el recubrimiento de los núcleos de cobre con la plata, estudiando a distintas relaciones molares de Cu:Ag para encontrar la relación que genere el recubrimiento más homogéneo a lo largo de la superficie de los núcleos de cobre.
PARTE EXPERIMENTAL
Materiales y reactivos
Acetilacetonato de cobre (C5H7O2)2Cu) (Merck), Glicerina grado técnico, monoestearato de glicerol (GMS) grado técnico, nitrato de plata (AgNO3) (J. Baker), butanol grado técnico, etanol de 96% grado técnico, billas de óxido de zirconio con silicato (65% ZrO2 y 35% SiO2) de 1,8 mm de diámetro, frasco autoclave de 250 mL (Boeco), filtros de membrana de poliéter sulfona de 0,45 𝜇m de porosidad, malla N° 14 con abertura de 14 mm. Equipo auxiliar de filtración, bomba de vacío, centrífuga y estufa de calentamiento.
Síntesis de MPs Cu
El (C5H7O2)2Cu se disolvió en glicerina con pulsos ultrasónicos (modelo GE 600, marca Ultrasonic) por 40 min sobre un baño de hielo (Figura 1.a), la suspensión obtenida se colocó en un balón y se instaló dentro de un horno microondas (modelo AMW784S, marca SAMSUNG) adaptado para síntesis química. A su vez, se disolvió el GMS en butanol en un baño maría a 70°C, éste se vertió a un embudo Schlenk que se acopló al sistema de síntesis química. A continuación, se llevó a cabo la reacción de reducción, para ello la suspensión de (C5H7O2)2Cu se le mantuvo en agitación constante a 500 rpm, se le calentó con radiación microondas por 1,5 min con reflujo constante mientras se le añadió en simultáneo la solución de GMS lentamente, obteniendo de esta manera una suspensión de MPs Cu (Figura 1.b). Esta suspensión se colocó en un frasco autoclavable con 200 g de billas de óxido de zirconio con silicato para llevar a cabo la molienda húmeda (Figura 1.c), que se realizó en un agitador vibracional automático (modelo S5, marca SANTINT) a 680 rpm por 10 min. Para separar las billas se utilizó una malla N°14. Luego, la suspensión se llevó a centrifugar a 10000 rpm por 20 min, descartando la glicerina remanente y se añadió en su lugar más butanol. Posteriormente a la suspensión de cobre en butanol se le sometió a ultrasonido por 10 min en un baño de hielo. Finalmente se filtró al vacío a través de una membrana de polietersulfona, se realizaron lavados con butanol y etanol, y por último se llevaron a una estufa a 60 °C por 4 horas, obteniendo MPs Cu secas (Figura 1.d).
Tabla 1 Datos de los reactivos en los ensayos de síntesis de MPs Cu.
| Ensayo | Cu (A) | Cu (B) | Cu (C) | Cu (D) | Cu (E) |
|---|---|---|---|---|---|
| (C5H7O2)2Cu (g) | 0,25 | 0,25 | 0,25 | 0,25 | 0,25 |
| Glicerina (mL) | 100 | 65,03 | 54,45 | 44,35 | 0 |
| GMS (g) | 0 | 1 | 1 | 1 | 1 |
| Butanol (mL) | 0 | 34,97 | 45,55 | 55,65 | 100 |
| Butanol:Glicerina | 0:01 | 3:07 | 2:03 | 1:01 | 1:00 |
En la tabla 1, se muestran los datos de los ensayos de síntesis realizados, en donde solo se variaron las cantidades de butanol y glicerina.
Síntesis de MPs Cu@Ag
Las MPs Cu@Ag se prepararon a partir de las MPs Cu disueltas en butanol (figura 1.e), según el procedimiento de síntesis del ensayo Cu (C) hasta el paso de la ultrasonicación de las MPs Cu en butanol. Por otro lado, se disolvió AgNO3 en butanol. Después se mezcló la solución de AgNO3 con la suspensión de las MPs Cu ambas en butanol acompañado de agitación constante de 650 rpm bajo oscuridad, produciéndose un cambio de color en la solución debido a la formación de las MPs Cu@Ag (Figura 1.f). Posteriormente, la suspensión de MPs Cu@Ag se ultrasónica sobre un baño de agua helada por 10 minutos, luego se filtró al vacío utilizando la membrana de poliestersulfona realizando lavados con butanol y etanol de 96 %. Finalmente, las MPs Cu@Ag se secaron en una estufa de calentamiento a 60 °C por 4 horas.
En la tabla 2, se muestran los datos de tres ensayos de síntesis variando según las relaciones molares de cobre y plata Cu:Ag 1:1, 2:1 y 3:1.
Tabla 2 Datos de los reactivos en los ensayos de síntesis de MPs Cu@Ag
| Ensayo | Cu@Ag (1:1) | Cu@Ag (2:1) | Cu@Ag (3:1) |
|---|---|---|---|
| (C5H7O2)2Cu (g) | 0,25 | 0,25 | 0,25 |
| (C5H7O2)2Cu (mol) | 0,955x10-3 | 0,955x10-3 | 0,955x10-3 |
| Butanola (mL) | 45,55 | 45,55 | 45,55 |
| AgNO3 (g) | 0,1622 | 0,0811 | 0,054 |
| AgNO3 (mol) | 0,955x10-3 | 0,477x10-3 | 0,318x10-3 |
| Butanolb (mL) | 50 | 50 | 50 |
| Cu:Ag | 1:01 | 2:01 | 3:01 |
a: Representa a la suspensión de butanol que contienen las MPs Cu. b: A la solución de butanol de nitrato de plata.
Instrumentación y caracterización de las MPs Cu y MPs Cu@Ag
La caracterización estructural de las micropartículas se realizó por Difracción de Rayos X (Modelo del difractómetro: D4 Endeavor, marca Brucker AXS), el procedimiento consistió en colocar las muestras secas en un portamuestras de polimetilmetacrilato de 5 cm de diámetro para dejar incidir los Rayos X, el barrido se llevó a cabo de 20°- 85°. La caracterización morfológica se realizó por Microscopía Electrónica de Barrido (MEB) utilizando dos equipos: Modelo Vega XMU, marca Tescan y Modelo ProX G6, marca Phenom. El tamaño promedio de las partículas se determinó a partir de las imágenes MEB utilizando los softwares Image J y Origin Pro 2018, donde el primero permitió tomar los diámetros y el segundo generar los histogramas de la distribución de tamaño de las partículas. La composición de las MPs Cu@Ag se determinó por Espectroscopia de Rayos X por Dispersión de Energía y Mapeo superficial que se midió con el equipo MEB.
RESULTADOS Y DISCUSIÓN
El efecto sinérgico de la mezcla binaria Butanol:Glicerina en la formación de MPs Cu
El método poliol utiliza un polialcohol como solvente y agente reductor para la síntesis de partículas metálicas. Este polialcohol es un alcohol con más de un grupo -OH, en este caso el poliol glicerina tiene buenas propiedades reductoras 15, sin embargo, este solvente tiene una alta viscosidad, por lo que se utilizó un solvente alternativo para disminuir la alta viscosidad de la glicerina, que no conviene porque no promueve la migración de los iones de cobre, este co-solvente es el butanol, que al ser mezclados se obtiene una mezcla binaria con viscosidad moderada y buenas propiedades reductoras 16. Adicionalmente el calentamiento vía MW para el método del poliol presenta una ventaja respecto al calentamiento por convección (convencional), el calentamiento por MW se da por una rápida transferencia de energía a través de la radiación produciendo un calentamiento instantáneo a diferencia del calentamiento por convección 9.
La eficiencia en el cual un solvente puede convertir la energía de radiación MW en calor se expresa mediante el valor de tan δ, a valores mayores de 0,5 se clasifican como de alto valor 17, la glicerina y el 1-butanol presentan valores de tan δ iguales a 0,65 y 0,57, respectivamente.
Como la glicerina tiene mayor valor de tan δ18, este se va a activar más rápidamente como agente reductor de los iones de cobre (Cu2+) reduciéndolos hasta Cu metálico (Cu0). El butanol también es un buen agente reductor, pero no tan potente como la glicerina, ya que el butanol posee en su estructura química un solo grupo -OH mientras que la glicerina posee tres grupos -OH. Sin embargo, el butanol no solo actúa como un co-solvente que mejora la viscosidad de la mezcla binaria sino también como agente conservante que disminuye la tendencia de la oxidación de las micropartículas de cobre. Asimismo, la GMS actúa como agente dispersante para las MPs Cu, inhibe la aglomeración de estas. Los iones de cobre (Cu2+) al estar disueltos con los solventes butanol-glicerina, la suspensión se torna a color azul por la formación de un complejo de cobre (II) con la glicerina 19. La reacción de reducción de los iones cobre (II) empieza cuando se inicia el calentamiento del sistema hasta alcanzar los 150 °C, temperatura en la que la glicerina reduce completamente al cobre 14, formando así MPs Cu que se caracteriza porque el color de la suspensión se torna a rojo-pardo.
Por otro lado, la formación de las MPs Cu@Ag se manifestó con el cambio de color de pardo rojizo a verde olivo. La estructura core@shell se logra como producto de la reacción redox de transmetalación de las MPs Cu con la solución de nitrato de plata, que se basa en la diferencia de los potenciales de reducción del cobre (+0.342V) y la plata (+0.799V) 20, la plata al tener mayor potencial de reducción se reduce más rápidamente que el cobre (Ag+ hasta Ag0) y lo hace específicamente sobre la superficie de los núcleos de cobre promoviendo que parte de estos núcleos se oxiden (Cu0 hasta Cu+1 y/o Cu+2).
Difracción de rayos X (DRX)
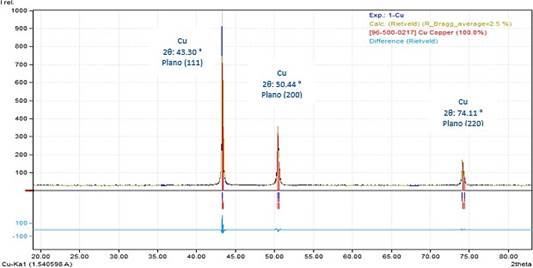
La identificación de las fases se llevó a cabo por DRX, usando la radiación del Cu- Ka1=1.5406 Å. En la Figura 2 se muestra el difractograma de las MPs Cu, los picos de difracción se localizan a 43,30°, 50,44° y 74,11°. Este difractograma se comparó con el patrón de cobre (PDF #96-950-0217) correspondiendo los picos a los planos de difracción (111), (200) y (220) respectivamente que confirman la estructura cúbica centrada en las caras del cobre. No se detectaron picos característicos de óxido de cobre (Cu2O y CuO) en los difractogramas, los resultados cuantitativos en la tabla 3 confirman que el 100% es cobre metálico, debido al poder reductor de la glicerina 13.
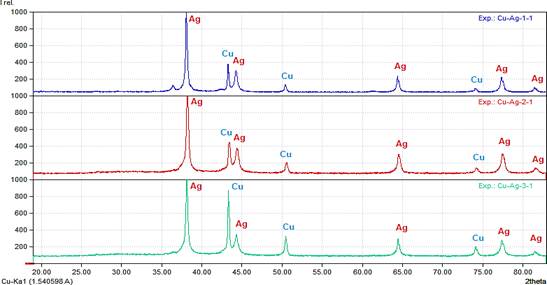
En la Figura 3 se exhibe el difractograma de MPs Cu@Ag 1:1, 2:1 y 3:1, los picos situados a 43.64°, 50.80° y 74.42° corresponden a los planos (111), (200) y (220) respectivamente, esto confirma la estructura cúbica centrada en las caras del cobre al compararlo con el patrón de cobre metálico (PDF #96-500-0217). Asimismo, los picos a 38,45°, 44,48°, 64,69°, 77,62° y 81,83° correspondientes a los planos (111), (200), (220),(311) y (222) respectivamente, confirman la estructura cúbica centrada en las caras de la plata al compararlo con el patrón de plata metálico (PDF #96-901-2955). Para Cu:Ag 1:1 se observa un pequeño pico de difracción aproximadamente a 38° que corresponde al plano (111) de la fase Cu2O 1,12,13, no obstante esto no es significativo ya que en la en la tabla 3 donde se muestra los porcentajes de las fases este no aparece, por ser un pico pequeño y al aplicar el refinamiento Rietveld se ha considerado como ruido de fondo. En los demás difractogramas no se observan picos de óxidos ni de otros elementos.
Refinamiento Rietveld y estimación del tamaño promedio del cristal
A todos los difractogramas de rayos X de las muestras se le aplicó el Refinamiento Rietveld para calcular el porcentaje de las fases presentes y estimar el tamaño de grano de cada muestra. El tamaño de grano, también conocido como tamaño de cristalito, es el tamaño promedio de los dominios cristalinos de las partículas presentes en la muestra. Una partícula está compuesta por varios granos o también llamados dominios cristalinos. A diferencia del tamaño promedio de partícula que se obtiene a partir de una imagen por MEB donde un subconjunto de partículas seleccionadas se les mide el diámetro y se calcula el tamaño promedio 21. En la Tabla 3, se indican los porcentajes en peso de las fases y los diámetros promedios estimados del tamaño de grano. Las MPs Cu (C) presentan menor tamaño de grano en comparación con las demás, confirmando las dimensiones nanométricas del tamaño de grano y la alta pureza del cobre, ya que no se detectaron presencias significativas de otras fases.
Tabla 3 Datos de porcentajes de fases y tamaño de cristal de MPs Cu y MPs Cu@Ag.
| Muestras | Fases | WExp. % | WTeo. % | Tamaño de grano (nm) |
|---|---|---|---|---|
| Cu (A) | Cu | 100 | 100 | 153,40 |
| Cu (B) | Cu | 100 | 100 | 165,78 |
| Cu (C) | Cu | 100 | 100 | 103,32 |
| Cu (D) | Cu | 100 | 100 | 133,58 |
| Cu | 37,8 | 37,1 | 32,44 | |
| Cu@Ag (1:1) | Ag | 62,2 | 62,9 | |
| Cu | 40,6 | 54,1 | 26,72 | |
| Cu@Ag (2:1) | Ag | 59,4 | 45,9 | |
| Cu | 55,6 | 63,9 | 34,49 | |
| Cu@Ag (3:1) | Ag | 44,4 | 36,1 |
WExp. %: Porcentaje en peso experimental. WTeo. %: Porcentaje en peso teórico.
La técnica de DRX es la que más se aproxima en la determinación de la composición real, ya que el DRX determina las fases presentes en toda la muestra. En la Tabla 3, se encuentran los porcentajes en peso experimental y teórico de Cu y Ag de las muestras de Cu@Ag (1:1), (2:1) y (3:1) después de la síntesis. Por lo general, el porcentaje en peso de cobre es menor y el porcentaje en peso de plata es mayor, es decir, la cantidad de cobre que se encuentra en las MPs Cu@Ag es menor a la que deberían de ser, esto se explica de la siguiente manera, cuando la plata se deposita (se reduce los iones de plata Ag (I) hasta Ag (0)) sobre el cobre, el cobre se oxida desprendiéndose de la superficie de la partícula y disminuye la cantidad de cobre final en la MPs Cu@Ag.
Se confirman las dimensiones nanométricas del tamaño de grano de las MPs Cu@Ag, así como la ausencia de impurezas. Estos cristales de Cu@Ag son más pequeños que los cristales de Cu, esto podría deberse al proceso de ultrasonido que se aplica a las MPs Cu como tratamiento previo antes de la formación de las partículas core@shell. El fenómeno de cavitación ultrasónica permitió la dispersión y micromolienda de las MPs Cu pudiendo disminuir su tamaño de las partículas obtenidas inicialmente.
Por otro lado, el análisis DRX difiere del EDX sobre todo en las especies de Si y Zr, porque el DRX analiza a toda la muestra mientras que el EDX analiza los componentes en la superficie y las capas próximas a la superficie. La baja cantidad de estas especies no es significativa en las señales de los difractogramas.
Microscopía Electrónica de Barrido (MEB)
Morfología de las MPs Cu y MPs Cu@Ag
En la imagen MEB de la MPs Cu (A) (figura 4.a) se observa que las micropartículas son amorfas y están formando grandes cúmulos, esto se da porque no se utilizó butanol y GMS, ya que el agente dispersante hubiera permitido controlar el crecimiento de las partículas 10, 14. En la imagen MEB de la MPs Cu (B) (figura 4.b), las micropartículas son amorfas formando cúmulos con una variedad de tamaño. En el caso de la MPs Cu (C) (figura 4.c) se observa que el tamaño de partículas se encuentra distribuidas de manera más uniforme, siendo su morfología más cristalina que las otras muestras. En la imagen MEB de las MPs Cu (D) (figura 4.d) se exhibe que las micropartículas son amorfas con una variedad de tamaños formando en algunos casos cúmulos o conglomerados. Por último, en el caso de la muestra Cu (E) donde se utilizó solo se utilizó butanol no se obtuvo cobre metálico, ya que este solvente no tiene el poder reductor suficiente para reducir los iones de cobre (II) hasta cobre (0).
Adicionalmente en las muestras de Cu (C) se ha encontrado microcristales de cobre de forma hexagonales (Figura 5.a) e icosaédricas (Figura 5.b), esta morfología es congruente con la estructura cúbica centrada en las caras del cobre metálico. Siendo las MPs Cu (C) las que tienen una morfología más regular que las demás.
En la Figura 6.a, 6.b y 6.c se muestran las imágenes MEB de las MPs Cu@Ag (1:1), MPs Cu@Ag (2:1) y MPs Cu@Ag (3:1), respectivamente; todas estas micropartículas core@shell tiene una morfología amorfa y se encuentran aglomeradas en varias zonas formando pequeños cúmulos.

Figura 4 Imágenes MEB de las MPs Cu según las fracciones molares de butanol:glicerina (a) 0:1, (b) 3:7, (c) 2:3 y (d) 1:1.
Tamaño de partículas
En la Figura 7.a, se muestra la selección de los diámetros de 121 micropartículas de la imagen MEB de MPs Cu (C), para la elección de partículas a las cuales se les midieron el tamaño, se utilizó la metodología utilizada por Bresch 22. Luego a partir de estos datos se generó un histograma de la distribución de diámetros (Figura 7.b) y este se realiza un análisis estadístico descriptivo donde el tamaño promedio de partícula fue de 3,52 𝜇m y la desviación estándar 0,15 𝜇m. De forma similar se realizaron para las MPs Cu (B) y MPs Cu (D). En la Tabla 4, están los resultados de la morfología, tamaño promedio de las micropartículas y la desviación estándar. La fracción molar de butanol:glicerina 2:3 (MPs Cu (C)) nos permitió generar micropartículas con una menor polidispersidad de tamaño, ya que su desviación estándar fue menor que los demás resultados.
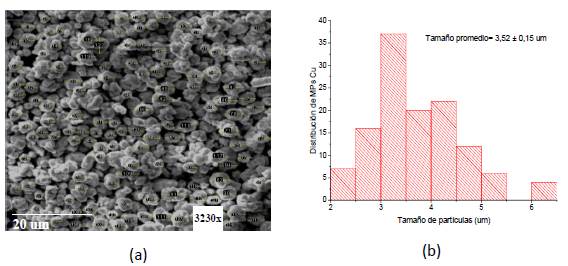
Figura 7 Análisis MEB de las MPs Cu (C): (a) Imagen MEB de MPs Cu y (b) Histograma de distribución de los diámetros de MPs Cu.
Tabla 4 Resumen de fracciones molares de la mezcla binaria, morfología, tamaño promedio y desviación estándar de las MPs Cu.
| Ensayo | Butanol: Glicerina | Morfología | Tamaño promedio (µm) | Desviación estándar (µm) |
|---|---|---|---|---|
| Cu (A) | 0:01 | Conglomerado | No se puede | - |
| determinar | ||||
| Cu (B) | 3:07 | Amorfas dispersas | 4,09 | 0,21 |
| Cu (C) | 2:03 | Hexagonales e icosaédricas | 3,52 | 0,15 |
| Cu (D) | 1:01 | Ligeramente amorfas | 3,08 | 0,33 |
| Cu (E) | 1:00 | No se puede determinar | No se puede determinar | - |
En la Figura 8.a y 8.b se realizó la determinación de diámetros promedios de MPs Cu@Ag 1:1 y la desviación estándar con el mismo método que las MPs Cu, de forma análoga se realizó para las otras MPs Cu@Ag, los resultados se observan en la tabla 5. En las tres síntesis de MPs Cu@Ag se forman conglomerados amorfos; de las cuales, las MPs Cu@Ag (1:1) son las que tuvieron menor tamaño promedio de partículas 0,33 ± 0.01 µm y menor polidispersión, a comparación de las MPs Cu@Ag 2:1 y MPs Cu@Ag 3:1.
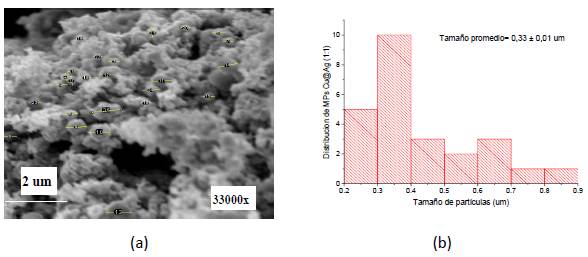
Figura 8 Análisis MEB de las MPs Cu@Ag (1:1): (a) Imagen MEB, (b) Histograma de distribución de los diámetros de MPs Cu@Ag (1:1).
Espectroscopía de rayos X de energía dispersiva (EDX)
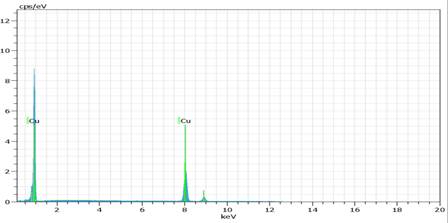
La composición elemental de las micropartículas se estudió a través de espectroscopia de rayos X de energía dispersiva (EDX). En la Figura 9 se muestra el espectro EDX de las MPs Cu (C) donde se exhiben solamente los picos de cobre, siendo 100 % el porcentaje en peso y porcentaje atómico en la superficie de las muestras. Los espectros EDX de las MPs Cu (B) y MPs Cu (D) también contienen únicamente los picos característicos del cobre.
Se estudió la composición de las MPs Cu@Ag con mapeos superficiales de las imágenes MEB. Se presentan las imágenes MEB y el mapeo superficial de las MPs Cu@Ag 1:1, 2:1 y 3:1 en las Figuras 10.a, 10.b y 10.c, respectivamente; donde la zona roja corresponde al cobre y la zona azul corresponde a la plata. El recubrimiento del cobre con plata fue más heterogéneo en MPs Cu@Ag 3:1, mientras que fue más homogéneo en MPs Cu@Ag 1:1. Estos resultados son congruentes con la composición cuantitativa de la superficie por EDX mostrada en la tabla 6, al haber una mayor cantidad de plata, esta tiene una mayor probabilidad de recubrir la superficie del cobre, confirmando así la estructura core@shell de las MPs Cu@Ag 12, 13.
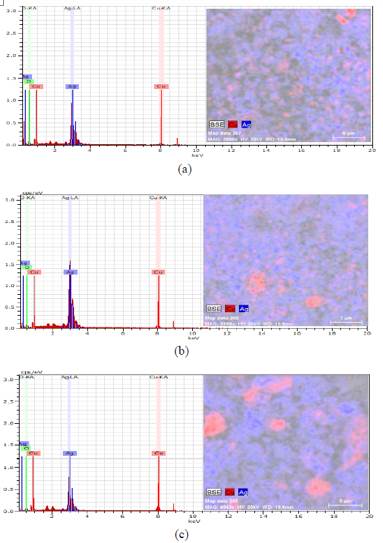
Figura 10 Espectros EDX del mapeo superficial de las MPs Cu@Ag (a) Cu:Ag 1:1, (b) Cu:Ag 2:1 y (c) Cu:Ag 3:1.
Adicionalmente en la Tabla 6, se observa la presencia de oxígeno, zirconio y silicio, esto se puede deber al proceso de molienda húmeda, ya que las billas están compuestas por ZrO2 y SiO2. El zirconio y el silicio no se observaron en los difractogramas porque el DRX analiza la composición de la muestra en general no la composición de la superficie que si realiza el EDX. Probablemente, el zirconio y el silicio se encuentran en mayor concentración cerca de la superficie de la partícula por el proceso de molienda mecánica.
Tabla 6 Composición elemental de las MPs Cu@Ag (1:1), (2:1) y (3:1) por espectroscopia EDX y mapeo superficial.
| Cu:Ag | Elementos | W % | At % |
|---|---|---|---|
| 1:01 | Ag | 74,75 | 42,38 |
| Cu | 10,68 | 10,28 | |
| O | 11,33 | 43,29 | |
| Zr | 2,01 | 1,35 | |
| Si | 1,24 | 2,7 | |
| 2:01 | Ag | 75,73 | 46,57 |
| Cu | 11,96 | 12,48 | |
| O | 8,83 | 36,62 | |
| Zr | 2,37 | 1,73 | |
| Si | 1,1 | 2,6 | |
| 3:01 | Ag | 57,48 | 32,34 |
| Cu | 26,43 | 25,25 | |
| O | 9,19 | 34,88 | |
| Zr | 4,93 | 3,28 | |
| Si | 1.97 | 4.25 |
CONCLUSIONES
En este trabajo se presenta el estudio experimental de los parámetros de síntesis para obtención de MPs Cu y MPs bimetálicas Cu@Ag mediante una mezcla butanol-glicerina. En la primera etapa, se obtuvo MPs Cu sin impurezas u otras fases por el método poliol vía microondas mediante diferentes proporciones de la mezcla butanol-glicerina, a diferencia de cuando se usó a uno de los solventes. Las mejores características fueron con el procedimiento Cu (C) cuyas fracciones molares de butanol-glicerina es de 2:3, teniendo una morfología poliédrica más regular, con un tamaño promedio de partícula de 3,52 µm y la desviación estándar de 0,15 µm. Debido a que ambos solventes son necesarios, el glicerol para favorecer la reducción del Cu y el butanol para disminuir la viscosidad. En la segunda etapa, se realizó un pretratamiento a las MPs Cu antes de la reacción de redox de transmetalación. Al inicio se realizó la molienda humedad de las MPs Cu con el procedimiento Cu(C) con billas ZrO2 y SiO2, esta es la razón por la cual aparecen presencias de zirconio, silicio y oxígeno en la superficie de las MPs Cu@Ag. Luego estas se ultrasonicaron disminuyendo más el tamaño de partícula, esto explica porque el tamaño de las MPsCu@Ag son menores a las MPs Cu. En la última etapa, se obtuvieron las MPs Cu@Ag mediante la reacción de transmetalación usando tres relaciones molares de Cu:Ag 1:1, 2:1 y 3:1, siendo estas amorfas y formando cúmulos. De aquellas las MPs Cu:Ag 1:1 presentaron un menor tamaño promedio de partículas de 0,33 µm y desviación estándar de 0,01 µm. Ya que a mayor cantidad de plata se puede cubrir más eficientemente la superficie del cobre.