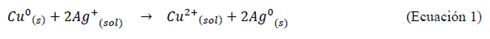INTRODUCCIÓN
Un problema ambiental actual y que se prevé a futuro es la contaminación en aguas subterráneas y superficiales por nitratos (NO -). Estas aguas son fuentes para el suministro de agua potable de consumo humano. Por ejemplo, altos niveles de nitrato en el agua de consumo humano estarían asociados con problemas de salud como: la metahemoglobinemia (síndrome del niño azul). Además, el nitrato consumido se puede reducir a nitrito (NO -), otro subproducto que reacciona con las aminas secundarias para formar sustancias cancerígenas además puede ocasionar problemas de tiroides y teratogénicos para los humanos. En los Estados Unidos, el límite máximo permitido (MCL) de nitratos en agua para consumo humano es MCL > 10 mg L-1 NO -- N1,2. En el Perú, el decreto supremo DS N° 031-2010-SA establece un límite máximo permisible (LMP) 50 mg NO - L-1.
Como uno de los diez principales contaminantes, se buscan más tecnologías para lograr su reducción a niveles seguros. En respuesta a este problema emergente en el tratamiento de aguas, se están estudiando el uso de métodos de reducción electroquímica para abordar la presencia de nitrato en los efluentes de agua. Específicamente, la reducción electroquímica de nitrato (REN) ha ganado interés significativo en la investigación durante la última década, mostrando ventajas prometedoras desde una perspectiva tanto económica como ambiental2,3,4.
La investigación en REN está creciendo rápidamente, abordando varios objetivos clave que buscan solucionarse. Estos objetivos principales incluyen la eficiencia, la selectividad y la conversión. Desde un enfoque en ingeniería, aspectos como el tiempo, la temperatura, el pH, el volumen, la reproducibilidad, la actividad del catalizador, el diseño del reactor, el tipo de celda, el número de cátodos, costo de los materiales, están adquiriendo una importancia significativa a medida que avanzan los estudios sobre la REN como una alternativa viable. De esta manera, se está llevando a la definición de las condiciones más comúnmente empleadas en la REN. Como resultado, la disponibilidad de metales y tecnologías estables para electrodos está adquiriendo cada vez más relevancia en proyectos de ciencias básicas y aplicadas a industrias Así finalmente, uno de estos objetivos que buscan ser resueltos es la necesidad de nuevos cátodos1,2,3,4.
Debido a las propiedades electrónicas características de los metales de transición, han sido ampliamente utilizados en la REN durante un largo período para el desarrollo de electrodos2. Metales como Pt, Ni, Pb, Zn, Fe, Cu, Ti, Au, Ru, Rh, Ir, Sn y GC han sido probado como materiales catódicos y anódicos5. Entre ellos, el cobre ha destacado como uno de los más relevantes para la REN. Estudios han demostrado su importante papel en la estructura electrónica de los catalizadores utilizados en la REN. Catalizadores con una energía similar entre los orbitales d ocupados de mayor energía (HOMO) y que también posean una estructura de capa abierta, son capaces de transferir electrones al orbital molecular de menor energía (LUMO) del ion NO -4,5,6.
Las nanopartículas de Cu ofrecen condiciones favorables para trabajar a temperatura ambiente y son económicamente viables en el desarrollo de materiales, aunque sufren de la propensión de oxidación, especialmente cuando se empleen nanopartículas por sus características de relación superficie-volumen7. Por otro lado, las nanopartículas de Ag presentan selectividad para la reducción de NO - a NO -, además de proporcionar una ventana de potencial más amplia y una mayor energía de adsorción para el NO *, en comparación de las caras cristalinas (211) de la Ag y (111) del Cu8.
Las nanopartículas de Cu-Ag han sido estudiadas en diversas aplicaciones, para mejorar la actividad catalítica, buscando evitar la corrosión del Cu y estudiando diversas estructuras, como metales, óxidos, entre otros. Una de las técnicas empleadas para su preparación es el desplazamiento galvánico, ya que controla la cinética del transporte de masa9,10. Las técnicas sin electricidad requieren equipos menos costosos y tienen potencial para ser utilizadas a escala industrial7,11. Además, se ha observado que los valores de conductividad mejoran, y según lo reportado, esto está relacionado con las interconexiones de Ag entre los granos de Cu9,12.
El Ag/Cu2O fue estudiado y mostró una alta eficiencia en la REN, con una eficiencia faradaica (EF) de 96,45% y una selectividad hacia la formación del amonio12. A pesar que cálculos por DFT muestran la inestabilidad de la disposición de Ag-Cu debido a la tensión interfacial, la interacción fuerte entre Ag-Cu2O mostró una firmeza en la formación de enlaces Ag-Cu2O12. En el presente trabajo, se buscó mejorar la estabilización de la configuración de Cu-Ag al controlar la temperatura durante el crecimiento y la migración de Ag a nanoescala durante el proceso de formación de las nanopartículas9.
Además, se empleó un cátodo basado en titanio, material menos costoso y más abundante que el Pt en la REN, y que además muestra propiedades fotoelectrocatalíticas13.
Por lo tanto, el objetivo es obtener una buena estabilidad y eficiencia en comparación con la literatura más reciente. Para cumplir con estas características, se propone la síntesis de nanopartículas Cu-Ag, variando las relaciones molares para encontrar el mejor material. Estas nanopartículas buscan ser más estables durante la reacción y ser reutilizables.
PARTE EXPERIMENTAL
Materiales y reactivos
Para la preparación de las nanopartículas de Cu-Ag se emplearon los siguientes reactivos: acetato de cobre (CuOAc), acetato de plata (AgOAc), polivinilpirrolidona (PVP), ácido ascórbico (AA), ácido cítrico monohidratado (Ac), etilenglicol (EG) de la marca Sigma- Aldrich. Para los cátodos, placas de Titanio (Ti) junto con propan-2-ol (isopropanol, 99,9%) de Fisher Scientific.
Para la preparación del ánodo IrO2 /Ti se emplearon, Titanio (Ti) (Sigma-Aldrich),) tricloruro de iridio (III) (IrCl3·3H2O) de Acros orgánicos (53,56%) y propan-2-ol (isopropanol, 99,9%) de Fisher Scientific.
Para el pre-acondicionamiento de los electrodos, las láminas fueron tratadas superficialmente con un papel abrasivo de tamaño de grano 200, 700 y 1000, y se pulieron con polvo de alúmina (0,3µm). Las placas de Ti fueron pretratadas con solución de ácido oxálico al 10% durante 20 minutos.
Se emplearon los siguientes reactivos para preparar la solución de trabajo H2SO4, de KNO3, Na2SO4 (Merck), HClO4, HNO3 o NaNO2 y KNO3 (99,9%) de Sigma-Aldrich. Gas nitrógeno UHP (Linde).
Síntesis en dos etapas de las nanopartículas Cu-Ag
El método se fundamenta en la reacción de sustitución galvánica (Ecuación 1)9. Para la síntesis de nanopartículas de Cu (Nps Cu), se llevaron a cabo los siguientes pasos: el precursor, acetato de Cobre (1 mmol) y PVP (9,6 mmol) disuelto en 50 mL de etilenglicol (EG) a 70°C con agitación. Posteriormente, se añadió ácido ascórbico (2,7 mmol) disuelto en 25 mL de etilenglicol. Minutos después, ácido cítrico monohidratado (1,6 mmol) disuelto en 20 mL de etilenglicol9. Todas las reacciones se llevaron a cabo bajo agitación a una temperatura controlada en 70°C y se mantuvo en burbujeo constante de gas nitrógeno para evitar la presencia de oxígeno en las soluciones. La reacción de desplazamiento ocurre de acuerdo a la Ecuación 1
Se realizó una segunda etapa para la preparación de las nano partículas del compósito Cu- Ag a partir del precursor de plata, AgOAc (0,15 mmol) disuelto en 10 mL de etilenglicol. En este método La solución de AgOAc se agregó sobre el coloide de nanopartículas de cobre mediante goteo lento. Todas las reacciones se realizaron en agitación constante, temperatura controlada de 70°C durante 4h. Se sintetizó dos tipos de compósitos, el tipo Cu-Ag N1 correspondiente a la relación Ag:Cu (1:2) y el tipo Cu-Ag N2 correspondiente a la relación molar Ag:Cu (1:6). Finalmente se realizaron el lavado de nanopartículas mediante centrifugado9,10.
Se prepararon electrodos, tipo Ag-Cu/Ti N1 y Ag-Cu/Ti N2, empleando los compósitos sintetizados como recubrimiento sobre placas de titanio, se llevó a cabo por inmersión. Primero, se preparó una solución de las nanopartículas Ag-Cu en isopropanol (1 mg/10 mL). Posteriormente, se realizó un tratamiento térmico en dos etapas, a 150 °C y a 250°C.
Síntesis nanopartículas Ag
Para la síntesis de nanopartículas de Ag (NPs Ag), se llevaron a cabo los siguientes pasos: el precursor, acetato de plata (0,6 mmol) disuelto en 30 mL de etilenglicol (EG) a 60 °C con agitación. Posteriormente, se añadió PVP (9 mmol) disuelto en 15 mL de EG durante 1 hora con agitación. Se añadió ácido ascórbico (0,4 mmol) disuelto en 15 mL de etilenglicol. Finalmente, se agregó ácido cítrico monohidratado (1,4 mmol) disuelto en 15 mL de etilenglicol9. Todas las reacciones se llevaron a cabo bajo agitación y se mantuvo en burbujeo constante de gas nitrógeno para evitar la presencia de oxígeno en las soluciones.
Espectrofotometría UV-visible (UV - vis)
La medición de la concentración de iones nitrato fue determinado empleando espectroscopía UV-vis. Esta técnica también se empleó para identificar los plasmones de las nanopartículas de Ag a 400nm aproximadamente y las nanopartículas de Cu alrededor de 600nm9. Las medidas se realizaron en el equipo Spectrophotometer Lambda 465, de PerkinElmer.
Dispersión dinámica de luz (DLS)
En la técnica de análisis por DLS, se determina el tamaño promedio del diámetro de las partículas (diámetro hidrodinámico), así como la distribución del tamaño de las partículas. El índice de polidispersidad (PDI) varía entre 0-1, siendo una medida de valor aceptable para nanopartículas, valores menores a 0.2514. Los resultados Se obtuvieron en el equipo Zetasizer Nano series ZS equipment (Malvern Instruments Ltd, UK).
Microscopía electrónica de barrido de emisión de campo (FE - SEM)
La FE-SEM se empleó para determinar el tamaño y la morfología de las nanopartículas en las películas. Se empleó un equipo de la marca JEOL, modelo JSM-7500F, con software de funcionamiento PC-SEM v 2,1,0,3, equipado con detectores de electrones secundarios, retrodispersados y análisis de composición atómica por espectroscopia por energía dispersiva (Energy dispersable spectroscopy - EDS) de la marca Thermo Scientific, modelo Ultra Dry, con software de operación NSS 2.3.
RESULTADOS Y DISCUSIÓN
Análisis por espectrometría UV-visible (UV - vis)
Las muestras de nanopartículas Cu (Cu), Ag (Ag) y Cu-Ag (N1-N2) fueron dispersadas en una suspensión coloidal y éstas se analizaron mediante espectroscopía UV-Vis. Según Dzido et al., 2015 la presencia de la resonancia plasmónica superficial (SPR) en bandas cercanas a 419nm indica la presencia de plasmones en nanopartículas de Ag. Mientras, los plasmones de las nanopartículas de Cu producen señales características alrededor de 600nm15. Un desplazamiento hacia valores mayores de longitud de onda corresponde a tamaños de nanopartículas mayores9,15.
En la Figura 1, se muestran tres curvas de absorción UV-Vis correspondientes a las muestras Cu, Ag y Cu-Ag -N2. En la Figura 1-A (línea negra), el espectro para nanopartículas de Cu presenta una señal a 625 nm, ligeramente mayor a la señal característica del plasmón de nanopartícula de Cu alrededor de 600 nm por lo que podría indicar tamaños mayores15. La muestra de Ag (línea azul) en la misma figura presenta un máximo de absorción a 422 nm, similar a la señal de 419 nm (Dzido et al. 2015), característica para plasmones de nanopartículas de Ag15.
Las señales de las nanopartículas Cu-Ag en la Figura 1-A (línea violeta) presentó dos picos a 402 y 558 nm similares a las nanopartículas de cobre (625 nm) y plata (422 nm), que podrían atribuirse a la presencia de ambas nanopartículas, debido a una interacción o aleación a nivel nanométrico9. El pico de absorción a 558, que correspondería a la señal característica de nanopartículas de Cu, comparado con la señal de nanopartículas de Cu sintetizadas a 625 nm (línea negra), presenta un desplazamiento al azul que significa tamaños menores respecto al valor referencial. Esto podría explicarse por las reacciones redox involucradas que desgastan parte de la superficie de las nanopartículas de Cu previamente sintetizadas, durante la síntesis por desplazamiento galvánico.
En la Figura 1-A los estudios de absorbancia UV-vis en la muestra Cu-Ag- N2 (línea violeta) presenta la primera señal a 402 nm, que corresponde a la señal por síntesis de nanopartículas de Ag (422 nm), con un desplazamiento hacia el azul respecto a la formación de muestra Cu-Ag- N2, que corresponde a diferencias menores en la composición o tamaños respecto a la síntesis de Nanopartículas de Ag. Entonces, durante la síntesis, las reacciones redox van actuando en la superficie y se produce el transporte de masa, disminuyendo el tamaño de la masa disponible para la formación de nanopartículas de plata asociadas a las nanopartículas de Cu9. Por lo tanto, es más adecuado que dichas muestras correspondan a un composito de Cu-Ag con tamaños de nanopartículas menores.
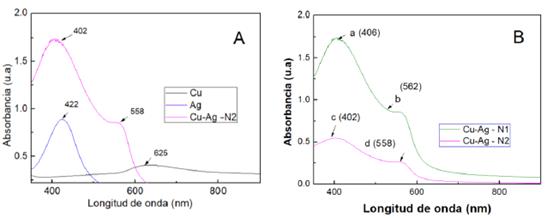
Figura. 1 (A) Espectro de absorción UV-Vis de la comparación de las nanopartículas de Cu (Cu) y las nanopartículas de Ag (Ag) con las nanopartículas de Ag-Cu. (B) Comparación de las nanopartículas de Ag-Cu (N1 y N2).
En la Figura 1-B se presentan los espectros para las nanopartículas Cu-Ag (N1 y N2), que se realizaron por el mismo tipo de síntesis, con dos relaciones molares (2:1) y (6:1) de Cu:Ag. Se presentan para compositos de Cu-Ag-N1 (línea verde) las señales a 406 y 562 nm (a y c), que presentan un ligero desplazamiento hacia el rojo respecto a las señales de 402 y 558 nm (c y d), lo que sugiere variaciones en la composición, tamaño o forma de las nanopartículas. Estas diferencias pueden influir en las propiedades ópticas y físicas de las nanopartículas para la aplicación en REN9.
Análisis por dispersión de luz dinámica (DLS)
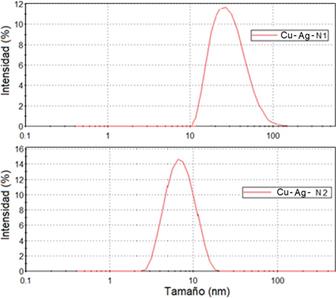
La Tabla 1 presenta resultados obtenidos para las pruebas realizadas mediante la técnica de análisis por DLS para las muestras de nanopartículas Cu-Ag (N1 y N2). Estas nanopartículas se dispersaron en EG y preparadas por el mismo método, pero con diferentes relaciones molares. Se obtuvieron valores de PDI de 0,26 y 0,24, para las muestras Cu-Ag (N1 y N2), respectivamente, que son considerados aceptables para síntesis de nanopartículas debido a que valores menores a 0,25 indican menor polidispersidad y heterogeneidad14. Esto indica, una homogeneidad de las nanopartículas preparadas que se puede observar en la Figura 2.
TABLA 1 Cuadro de los resultados por el análisis DLS.
| Muestra | Cu-Ag - N1 | Cu-Ag - N2 |
| PDI | 0,26 | 0,24 |
| Tamaño promedio (nm) | 24,31 | 7,32 |
Finalmente (Tabla 1), se muestra que se han obtenido tamaños de nanopartículas promedio de 24,31 nm y 7,32 nm para las nanopartículas Cu-Ag (N1 y N2) respectivamente. Por lo cual, el análisis reveló para la muestra Cu - Ag-N2 presenta condiciones más favorables, porque al obtener nanopartículas más pequeñas ofrece una mayor área de reacción, lo que resulta en una mayor actividad en función de la relación área-volumen, para las REN7.
Análisis por espectroscopía de dispersión de energía (EDS)
El análisis por EDS se empleó para determinar la composición atómica presente en el electrodo Cu-Ag/Ti-N2. En este electrodo, están presentes las nanopartículas Cu-Ag-N2 impregnadas en la placa de titanio. Según los valores mostrados en la Tabla 2, la relación % de Cu/Ag es 39,0/6,6 del electrodo equivalente a 59/10, lo que concuerda con la relación molar teórica de preparación que era de 6/1 para las nanopartículas. Durante el desplazamiento galvánico en la síntesis parte del Cu, se ha disuelto en la solución para depositarse plata. Además, esta presencia de oxígeno se debería a los TiOx superficiales formados durante el pretratamiento de la placa de titanio, realizado para aumentar área de superficie-contacto para la REN16.
Caracterización mediante microscopía electrónica de barrido con emisión de campo (FE - SEM)
Mediante microscopía electrónica de barrido (FE-SEM) se observan para las muestras de los electrodos de Cu-Ag/Ti-N2 antes y después de ser empleado. Cu-Ag/Ti-N2 después de ser empleado corresponde en 8 reacciones de evaluación de REN de 5 horas cada prueba, sometido a un total de 40 horas de reacción. En la Figura 3 A, correspondiente al electrodo Cu-Ag/Ti-N2 sin utilizar, se puede observar deformaciones como cavidades que corresponderían al pre-tratamiento de la placa de Titanio para formar más superficie de contacto. Sobre estás superficies estarían dispersadas las nanopartículas en el electrodo Cu-Ag-N2 preparado, que se puede observar de forma tenue en ligeras protuberancias como gránulos deformes. Estás presentan un tamaño promedio de 15.23nm, que guarda relación con el tamaño obtenido de 7,32 por DLS (Tabla 1), correspondientes a las nanopartículas Cu-Ag-N2 antes de ser impregnadas en la placa de Titanio. En la Figura 3B, se observa también las deformaciones y cavidades correspondientes al pre- tratamiento de la placa de Titanio, lo cual implica estás formaciones han resistido después de haberse sido sometido a la aplicación. Mientras sobre estas aún persisten en menor cantidad los gránulos deformes en un tamaño promedio de 17.25 nm. Probablemente una parte mínima de estás nanopartículas impregnadas han podido ser desprendidas del electrodo durante el uso.
Caracterización Electroquímica
Los análisis por voltametría se realizaron para los electrodos: placa de Titanio (Ti blanco), nanopartículas de Cu sobre Titanio (Cu/ Ti), nanopartículas de Ag sobre Titanio (Ag/Ti) y nanopartículas de Cu-Ag sobre Titanio (Cu-Ag/Ti N1-N2) en solución blanco y con presencia de nitrato. La solución sintética del blanco presenta solo electrolito de soporte 0,03 M Na2SO4, mientras con presencia de nitrato está compuesta de 100 mg L-1 de NO-N y electrolito de soporte 0,03 M Na2SO4. Todos los análisis fueron realizados con burbujeo de nitrógeno previo por 5 minutos en gas nitrógeno y se empleó con un contraelectrodo de IrOx/Ti y electrodo de referencia de Ag/AgCl (3M). El electrodo de trabajo se cicló tres veces entre -0,4 y -2,0 V a una velocidad de barrido de 50 mV s-1 antes de tomar datos experimentales estables17. Se trabajó en una celda de vidrio convencional a un volumen de celda 20 mL, área de los electrodos de 3 cm2 de área (3 x 1 cm).
En la Figura 4-A, se realizó por voltametría cíclica para los electrodos: Ti blanco (línea negra), Cu/ Ti (línea azul) y Ag/Ti (línea gris) en solución blanco en una ventana de potencial de -2 a -0 V, con velocidad de barrido de 50 m V s-1, con un contraelectrodo de IrOx/Ti y como electrodo de Referencia Ag/AgCl (3 M). Donde no se observa una señal significativa antes de -1.2 V de bandas de reacción, mientras que después hacía los valores de -2 V se ve que se incrementa la reacción de correspondería a la reacción de Reducción de Hidrógeno (HER que es una reacción de competencia17.
En la Figura 4-A los análisis por voltametría cíclica para los electrodos: Ti blanco (línea verde), Cu/ Ti (línea roja), Ag/Ti (línea celeste) y Cu-Ag /Ti-N2 (Línea violeta) en solución con presencia de nitrato en una ventana de potencial de -2 a -0 V, con velocidad de barrido de 50 m V s-1, con un contraelectrodo de IrOx/Ti y como electrodo de Referencia Ag/AgCl (3 M). En donde para los electrodos Ag/Ti (línea celeste) y Cu-Ag/Ti-N2 (Línea violeta) se observan bandas de reacción antes de -1.4 V, una señal significativa antes de -1,2 V y la otra de -1,4 V a diferencia de las muestras con solución sin presencia de nitrato. Por lo cual corresponderían a bandas de señal para reducción del nitrato así como se reportan bandas en valores menores de -1 V para esta reacción17.
En tanto, el electrodo Cu-Ag /Ti (Figura 4-A, línea roja) en presencia de nitrato presenta dos bandas muy significativas antes de -0,6 V y -1,2 V que se relaciona con la presencia de nanopartículas que son altamente reactivas para REN17. Respecto al electrodo Ti (línea verde) en presencia de nitratos presenta la menor señal para reducciones de nitratos respecto a los otros electrodos. Además, para todas las reacciones con los electrodos en presencia de nitratos después de -1,2 V se incrementa la señal para HER como las observadas en las reacciones sin nitratos. Donde se da la electrolisis de agua y se observó formación de burbujeo sobre los electros durante los experimentos.
En la Figura 4-B se comparan los electrodos Cu-Ag /Ti (N1-N2) en presencia de nitratos (Línea verde y violeta) y sin presencia de nitrato (línea azul). Se observa que hubo una mayor área de reducción para Cu-Ag/Ti - N2, respecto a Cu-Ag/Ti - N1, en las bandas entre -0,35V a -0,88 y -1,0 a -1,4 V.
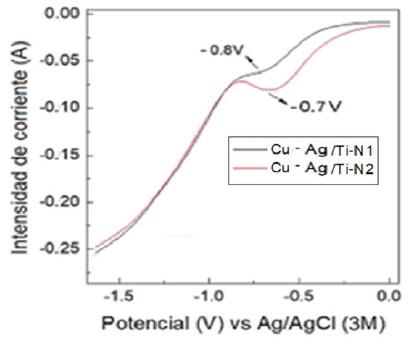
Finalmente, en la Figura 5 se analizó por el análisis voltametría lineal (LV) realizado con solución sintética de 100 mg L-1 de NO3 - electrolito de soporte 0,03 M Na2SO4, electrodo de Referencia Ag/AgCl (3 M) una velocidad de barrido de 10 m V s-1. Se presenta una mejora del electrodo de Ag-Cu/Ti N2 respecto a N1 al presentar una señal que empieza a
- 0,74 V antes que - 0,88 V, Lo cual indica menor empleo de intensidad de corriente para la REN.
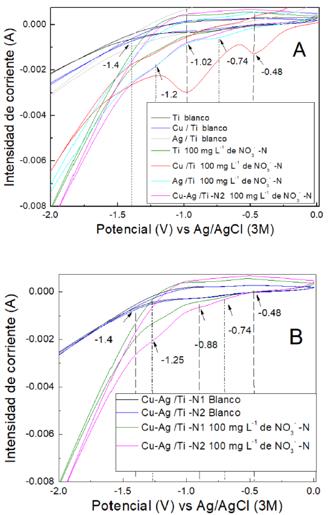
Figura. 4 Voltamograma cíclico. (A) Para la muestra de placa de Titanio (Ti), nanopartículas de Cu sobre Titanio (Cu/Ti), nanopartículas de Ag sobre Titanio (Ag/Ti) y nanopartículas impregnadas sobre Titanio (Cu-Ag /Ti-N2) en solución blanco y solución con nitrato con presencia de nitrato (línea azul) sin presencia de nitrato (línea negra). Ag-Cu/Ti - N2 en solución. (B) Comparación de las muestras Ag-Cu/Ti (N1 y N2) (línea verde y violeta) en presencia de nitrato y solución blanco (línea negra y azul), obtenidos en solución a una velocidad de barrido de 50 m V s-1.
Efecto del tiempo de cronopotenciometría.
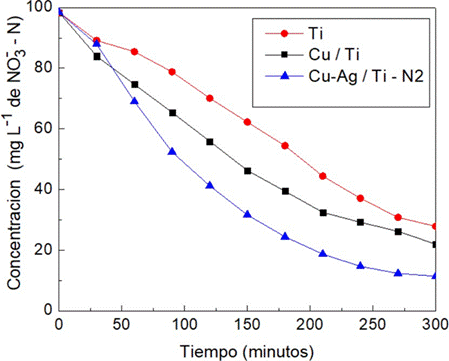
Para los estudios de reducción electroquímica por cronopotenciometría, se empleó como electrodos de trabajo: placa de Ti (Ti), Nanopartículas de Cu sobre placa de Ti (Cu/Ti) Y NPs Ag-Cu sobre placa de Ti (Ag-Cu/Ti-N2). Como contraelectrodo el ánodo preparado IrOx/Ti, electrodo de Referencia Ag/AgCl (3 M) a una densidad de corriente 20 mA cm-2. Como pretratamiento, todas las soluciones estudiadas se burbujearon con N2 gas durante 10 minutos antes. Se trabajó con solución sintética de 100 mg L-1 de NO3 --N, en un tiempo de reacción de 300 minutos. Los resultados fueron graficados en la Figura 5 mostrando una mayor reducción para el electrodo preparado Ag-Cu/Ti-N2 (línea Azul) respecto a Cu/ Ti (línea negra) y Ti (línea roja). A pesar de que las nanopartículas Cu impregnadas en la placa de titanio presentan más reactividad según las voltametrías (Figura 4-A, línea roja), donde el nano-composito Cu-Ag mejora la conductividad, a nivel de nanoescala. Entonces los cátodos: Ti, Cu/Ti y Ag-Cu/Ti presentaron una reducción de %NO --N en 71,65, 77,63 y 87,37 respectivamente.
Aplicación de los Cátodos
Se estudió la reducción electroquímica de nitrato, comparando los cátodos: placa de Titanio (Ti), nanopartículas de cobre sobre placa de Ti (Cu/Ti), nanopartículas Ag/Cu tipo N1 (1:2) sobre placa de Ti (Ag-Cu /Ti-N1) y nanopartículas Ag/Cu (1:6) sobre placa de Ti (Ag-Cu/Ti-N2). Esto correspondió a 4 experiencias en condiciones de: como ánodo preparado IrOx/Ti, distancia ánodo-cátodo de los electrodos a 1 cm de distancia, la densidad de corriente fue de 40 mA cm-2, conectados a una fuente de suministro de corriente continua con solución sintética de 100 mg L-1 de NO --N, como concentración inicial y electrolito de soporte de 0,03 M Na2SO4 por un tiempo de reacción de 210 minutos en temperatura ambiente.
Se observa en la Figura 6, donde el resultado con la concentración final en mg L-1 de NO -N fue de 77,37, 71,49, 62,92 y 52,38 para los cátodos. Siendo, su porcentaje reducido en mg L-1 de NO -N de 22,62; 28,28; 38,58 y 47,61 respectivamente.
En la Figura 6 donde la pendiente de mayor reducción de nitrato es para el Ag-Cu /Ti-N2 (línea negra), teniendo el material propuesto una ventaja sobre la aplicación respecto a los materiales Cu/Ti (línea naranja) y al blanco la placa de Ti (línea azul). Comparando los cátodos preparados de Ag-Cu /Ti (N1-N2) (línea verde y negra), se presenta una eficiencia superior el Ag-Cu /Ti-N2 que guarda relación a las caracterizaciones voltamétricas y análisis morfológicos de menor tamaño17.
Para la Comparación de materiales catódicos para la reacción evaluando con una densidad de corriente de 40 mA cm-2 se pudo observar que la HER se puede estar dando durante la formación de un burbujeo intenso y saturación de la superficie activa para la REN, la mayor reducción del nitrato en el material propuesto se llevó a cabo en la primera hora. En los siguientes minutos se saturaría la superficie a la vez que la reacción de competencia se da con intensidad, dificultando el transporte de masa sobre la superficie del electrodo.17.
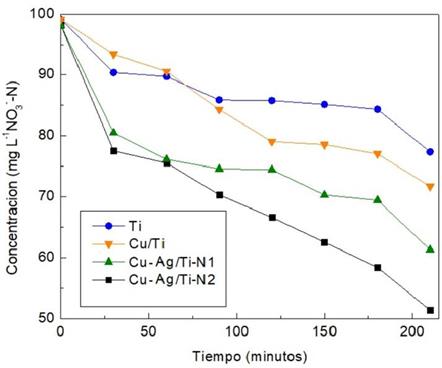
Figura 7 Reducción de nitratos empleando diferentes materiales Titanio (línea azul), cobre titanio (línea naranja), Ag-Cu/Ti-N1 (línea verde) y Ag- Cu/Ti-N2(línea negra) con densidad de corriente 40 mA cm-2 durante 210
minutos.
CONCLUSIONES
Se logró la preparación de nanopartículas por el método de desplazamiento galvánico, caracterizadas por espectroscopía UV-Vis. Los diferentes picos de señal SPR observados corresponden a nanopartículas de Ag, Cu y compositos Cu-Ag (Figura 1). Además, las nanopartículas sintetizadas recubiertas sobre un sustrato de placa de Titanio se analizaron por FE-SEM Y EDS (Figura 3 y Tabla 2). Las imágenes FE-SEM muestran una morfología amorfa y granulada de las nanopartículas. Por medio de EDS se confirmó la relación molar de Ag y Cu presente respecto a la teórica de 6 a 1.
Se emplearon electrodos fabricados a partir de las nanopartículas y compositos analizados:de placa de Titanio (Ti), nanopartículas de Cu sobre Titanio (Cu/Ti), nanopartículas de Ag sobre Titanio (Ag/Ti) y nanopartículas impregnadas sobre Titanio (Cu-Ag /Ti (N1-N2). Estos se probaron en solución control y solución con nitrato a una velocidad de 50 mV-1. (Figura 4-A). Se seleccionó el cátodo Cu-Ag /Ti-N2 por presentar mejores características en tamaño, relación molar de Cu:Ag (6:1) y respecto a las voltametrías lineales (Figura 5), con una velocidad de 10 mV-1.
En la electrolisis, se observó una mayor eficiencia del material propuesto Cu-Ag/Ti, evidenciada por la concentración final de nitrato (Figura 6). Se compararon los cátodos: placa de Titanio (Ti), nanopartículas de cobre sobre placa de Ti (Cu/Ti), nanopartículas Ag/Cu tipo N1 (1:2) sobre sobre placa de Ti (Ag-Cu /Ti-N1) y nanopartículas Ag/Cu (1:6) sobre sobre placa de Ti (Ag-Cu/Ti-N2). Los experimentos se realizaron bajo las siguientes condiciones: como ánodo preparado IrOx/Ti, distancia ánodo-cátodo de los electrodos a 1 cm de distancia, la densidad de corriente será de 40 mA cm-2 con solución sintética de 100 mg L-1 de NO --N, como concentración inicial, electrolito de soporte de 0,03M Na2SO4 a un pH inicial de 6 en un tiempo de reacción de 210 minutos a temperatura ambiente.
Los resultados para los cátodos correspondientes a la evaluación por REN (Figura 7) empleó diferentes materiales Titanio (línea azul), cobre titanio (línea naranja), Ag-Cu/Ti- N1 (línea verde) y Ag-Cu/Ti-N2(línea negra) con densidad de corriente 40 mA cm-2 durante 210 minutos, fue de porcentaje reducido en mg L-1 de NO --N de 22,62; 28,28; 38,58 y 47,61 respectivamente. El cátodo Ag-Cu/Ti-N2 demostró ser el más eficiente, con una reducción de nitrato del 47,61 %, respecto al 28,28 % Cu/Ti, resaltando así la significativa mejora del material propuesto.