INTRODUCCIÓN
Las 2-oxazolinas son sustancias heterocíclicas que pueden ser polimerizadas vía polimerización catiónica por apertura de anillo produciendo polímeros lineales. Esta polimerización puede ser iniciada por grupos electrofílicos como, por ejemplo, tosilato y triflato de metilo, 1,4-trans-dibromobuteno, iodometilestireno, entre otros1,2. Una característica muy importante de la polimerización de las 2-oxazolinas es que esta reacción transcurre de forma “viva”, esto quiere decir que estos monómeros polimerizan sin reacciones secundarias tales como las reacciones de terminación o de transferencia de cadena y en consecuencia se pueden obtener polímeros con un grado de polimerización o peso molecular previamente fijados o calculados así como también se puede definir desde el inicio la funcionalidad de estos polímeros2,3,4,5,6. La polimerización de las 2-oxazolinas por su carácter “vivo” permite elaborar diferentes arquitecturas poliméricas tales como, por ejemplo, macromonómeros, polímeros telequélicos, copolímeros en bloque e injertados, hidrogeles, entre otros4,5,6.
En particular, los macromonómeros pueden ser sintetizados, por ejemplo, vía el método del iniciador o del terminador7. En el primer método, se introduce el grupo vinilo en el polímero mediante la reacción del iniciador (que conlleva este grupo) con la primera molécula de monómero y en el segundo método, el doble enlace se introduce mediante la reacción del extremo final de la cadena propagante con la sustancia química que actúa como agente “terminador”, la cual contiene un grupo vinilo. El método del terminador tiene la ventaja, frente al método del iniciador, de que el grupo vinilo solo se introduce a la cadena polimérica al final de la polimerización y a temperatura ambiente, evitándose entonces exponer el grupo vinilo a temperaturas relativamente altas durante la polimerización y de esa forma se evita al máximo su posible polimerización prematura7. Para la aplicación de ambos métodos se debe usar una polimerización de tipo “viva” o sea donde solo existan las reacciones de iniciación y propagación.
Los macromonómeros posteriormente permiten sintetizar, por ejemplo, copolímeros de injerto e hidrogeles y posibilitan la introducción de grupos funcionalizados en forma controlada en este tipo de polímeros para formar polímeros para aplicaciones especiales tales como, por ejemplo, los hidrogeles para liberación controlada de medicamentos y fertilizantes8.
La Oficina de Administración de Alimentos y Medicamentos (FDA) de los Estados Unidos considera a la polimetiloxazolina y la polietiloxazolina como polímeros biocompatibles y por esta razón existe un gran interés de los grupos de investigación en el mundo en este tipo de polímeros para encontrar aplicaciones en el campo de los biomateriales9.
En esta oportunidad presentamos la síntesis de macromonómeros de 2-etil- y 2- metoxicarboniletil-2-oxazolina, con peso molecular controlado y funcionalizado, el segundo, con grupos ésteres.
PARTE EXPERIMENTAL
Materiales
Las sustancias usadas en esta investigacíon fueron usadas como recibidas o purificadas segun métodos descritos en la literatura10,11,12. Los monómeros 2-etil-2-oxazolina y 2- metoxicarboniletil-2-oxazolina y la N-(4-vinilbencil)-piperazina fueron sintetizados en el laboratorio mediante métodos descritos en la literatura10,11,12.
Equipos
Se usaron los equipos: Bruker, Ascend, 500 MHz (RMN), Perkin Elmer (FTIR), y Thermo Electron Corporation (UV/Vis). Los análisis espectrométricos de RMN, FTIR, UV/Vis de las sustancias de esta investigación se realizaron mediante métodos estándar de la literatura11,12,13, 14.
Métodos
Síntesis de la 2-Etil-2-oxazolina (EtOxa)
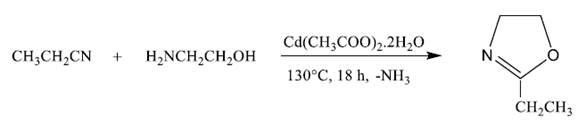
A un balón de tres bocas, equipado con un condensador, y bajo corriente de nitrógeno, se agregó 19 gramos (0,07 mol) de acetato de cadmio dihidratado (catalizador), 193,3 g de propionitrilo (3,51 moles), y se calentó la mezcla a 130 °C hasta disolución de la sal. Luego se agregó, gota a gota, 165 g de etanolamina (2,70 moles). La reacción transcurrió por un periodo de 18 horas, luego la mezcla se enfrió y se obtuvo el producto de reacción vía destilación. Se obtuvo 232 g de 2-etil-2-oxazolina (EtOxa), con un rendimiento del 87%. Posteriormente la EtOxa fue secada con hidruro de calcio y purificada mediante destilación (p. eb. 128°C). Este procedimiento de purificación se repitió tres veces. Se caracterizó la EtOxa mediante resonancia magnética nuclear10.
1H-RMN (en CDCl3) δ: 0,92 (-CH3); 2,03 (-CH2-); 3,55 (-N-CH2-); 3,97(-OCH2).
Síntesis de 2-Metoxicarboniletil-2-oxazolina (EsterOxa)
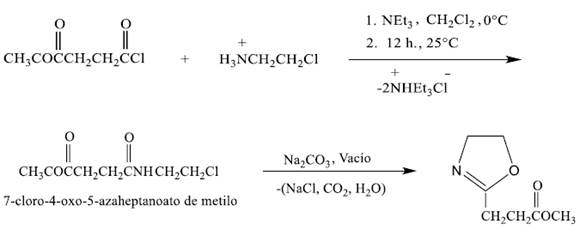
Esta síntesis se realizó en dos pasos. En la primera etapa, se sintetizó el 7-cloro-4 oxo-5- azaheptanoato de metilo y a partir de este compuesto, en la segunda etapa, se sintetizó la 2-(2-metoxicarboniletil)-2-oxazolina11.
Etapa 1.- Síntesis de 7-cloro-4 oxo-5-azaheptanoato de metilo („intermediario“): En un balón de 1000 mL fueron colocados 150 mL de diclorometano. Se enfrió el diclorometano a 0°C y se agregó, 24 gramos (0,16 mol) de cloruro de succinilo metílico y 18,6 gramos (0,16 mol) de hidrocloruro de 2-cloroetilamonio. Luego manteniendo la temperatura de 0°C, se agregó a esta mezcla 38 gramos de trietilamina (0,30 mol) en un periodo de una hora. La mezcla de reacción fue permitida a calentarse hasta temperatura ambiente y entonces fue agitada durante 14 horas. Después de este tiempo, se agregó 45 mL de agua destilada a la mezcla y la fase orgánica fue lavada tres veces con agua destilada y una vez con una solución saturada de cloruro de sodio. Luego, la fase orgánica fue secada con sulfato de magnesio, filtrada y el solvente fue removido en un evaporador rotatorio y se obtuvo finalmente 23 gramos (rendimiento 78%) de un aceite amarillo-rojizo (7-cloro-4 oxo-5-azaheptanoato de metilo).
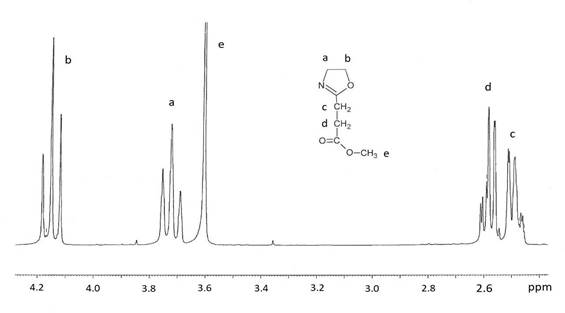
Etapa 2.- Síntesis de 2-metoxicarboniletil-2-oxazolina (EsterOxa): Se colocaron en un balón de 100 mL, 23 gramos (0,119 mol) de 7-chloro-4-oxo-5-azaheptanoato de metilo y 9.2 gramos (0,087 mol) de carbonato de sodio anhidro. A 25°C se aplicó a esta mezcla un vacío de 0,5 mmHg durante 45 minutos. Se formó finalmente un líquido transparente (EsterOxa), el cual fue posteriormente purificado y secado vía destilación fraccionada al vacío sobre hidruro de calcio. Se obtuvo 12 gramos (65% de rendimiento).1H-RMN (en DMSO) δ: 2,44 (-CH2CH2CO-); 2,58 (CH2-CO); 3,67 (CH3OCO); 3,71 (CH2-N=); 4,17 (CH2-O). 13C-RMN (en DMSO-d6) δ: 22,5 (-CH2CH2CO-); 29,6 (-CH2CH2CO); 51,4 (CH3OCO);53,8 (CH2-N=C); 66,9 (CH2-O-C); 165,9 (N=C-O); 172,3 (O-C=O).
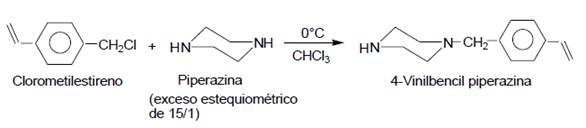
Síntesis de N-(4-vinilbencil)piperazina (agente „Terminador“)
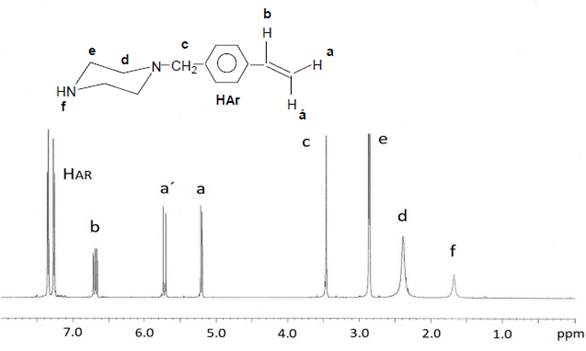
Se realizó la síntesis del compuesto denominado agente „Terminador“ según el procedimiento descrito en la literatura12. En un balón y bajo atmosfera de nitrógeno, se disolvieron 39,6 g (0,46 moles) de piperazina seca en 250 ml de cloroformo seco. Se enfrió esta mezcla a 0°C, con una mezcla de hielo y agua, y se adicionó lentamente 4,6 g (0,03 mol) de clorometilestireno y trazas (25 mg) de hidroquinona (estabilizador). Luego de 12 horas de agitación a temperatura ambiente, el hidrocloruro de piperazinio formado fue separado por filtración. La fase orgánica fue lavada 5 veces con 200 ml de agua destilada hasta neutralidad. Luego fue secada sobre sulfato de magnesio, filtrada y el solvente fue eliminado con un evaporador rotatorio y se obtuvo finalmente 5,7 gramos (95% rendimiento) de un líquido amarillo rojizo (terminador).
1H-RMN (en CDCl3) δ: 1,51 (NH); 2,40 (NCH2); 2,83 (NHCH2); 3,46 (ar-CH2); 5,20,5,70, 6,70 (CH2=CH); 7,30 (protónes aromáticos).
FTIR (KBr) cm-1: 3390, 3274 (NH), 3085-3000 (CH, alifático), 2940, 2810 (CH,alifático), 1628, 1510, 1460 (C=C).
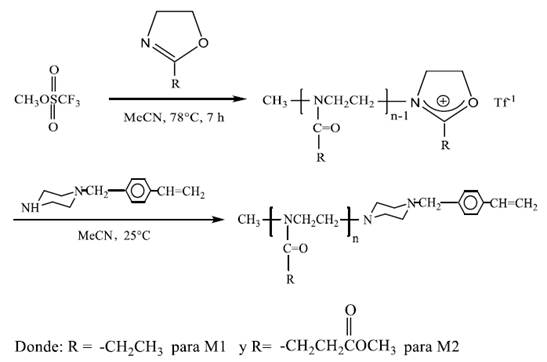
Síntesis de los macromonómeros de 2-oxazolinas.
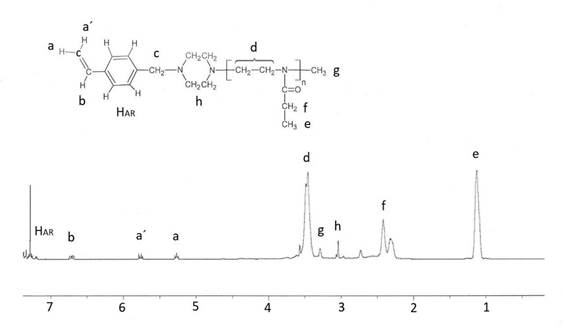
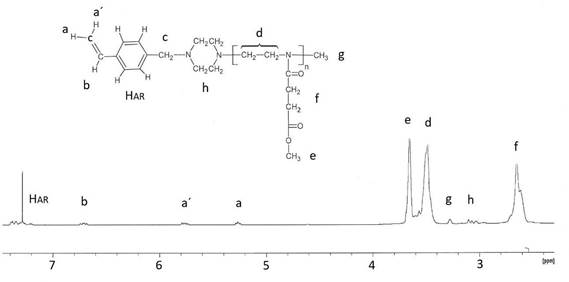
Procedimiento típico (ej. Macromonómero 2): En un balón de reacción de 100 mL, y bajo atmosfera de nitrógeno seco, se disolvieron 4,03 g (25,6 mmol) de EsterOXA en 12 ml de acetonitrilo. A esta solución se le adicionó 0,35 g (2,12 mmol) de triflato de metilo. Esta mezcla se calentó a 78°C por 7 horas bajo agitación constante. Al término de este tiempo de reacción, se enfrío la mezcla reaccionante a 25°C y para terminar la polimerización, se añadió, bajo nitrógeno, 0,94 g (4,7 mmol) del terminador N-(4-vinilbencil) piperazina) disueltos en 4 ml de acetonitrilo y se agitó la mezcla por 18 horas a temperatura ambiente. El polímero obtenido fue purificado vía tres precipitaciones en éter dietílico y luego fue secado en un evaporador rotatorio. El producto fue denominado macromonómero M2 y fue guardado en un desecador sobre sílica gel. Se obtuvo un rendimiento del 81%. Los macromonómeros fueron caracterizados estructuralmente mediante resonancia magnética nuclear de hidrógeno (1H-RMN) y FTIR. Macromonómero M1: 1H-RMN (en CDCl3) δ: 1,1 (CH3), 2,2-2,5 (-CH2-CH3); 3,08 (-CH2-N); 3,30 (-N-CH3); 3,4-3,7 (-NCH2CH2); 5,25 y 5,8 (CH2=CH); 6,65 (=CH-Ar); 7,2- 7,4 (HAR). Macromonómero M2: 1H-RMN (en CDCl3) δ: 2,54- 2,74 (-COCH2-CH2-CO); 3,07 (-CH2-N); 3,30 (-N-CH3); 3,4-3,7 (-NCH2-CH2-/-O-CH3); 5,24 y 5,78 (CH2=CH);6,65 (=CH-Ar); 7,18-7,43 (HAR).
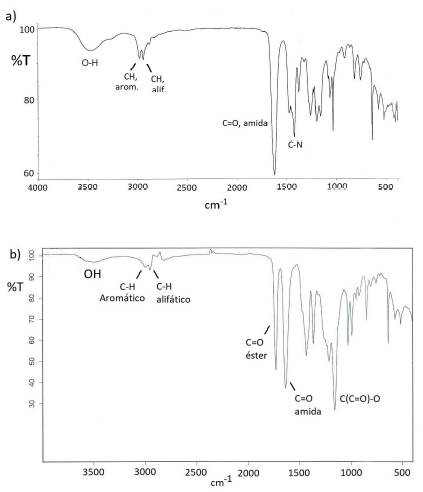
FTIR (ATR) cm-1: 1434 (C-N), 1635 (C=O, amida), 1730 (C=O, éster), 2951 (C-Halifático), 3005 (C-H, aromático), 3500 (OH) (humedad absorbida).
El espectro FTIR del M1 es similar pero no existe la señal del grupo carbonilo del éster (C=O, a 1730 cm-1.
RESULTADOS Y DISCUSION
Síntesis de la 2-Etil-2-oxazolina (EtOxa).
La síntesis de la 2-etil-2-oxazolina fue realizada mediante la reacción de la etanolamina y el acetonitrilo10 catalizada por el acetato de cadmio dihidratado a 130°C. A partir de la reacción se obtuvo 2-etil-2-oxazolina, con un rendimiento del 87%, y amoniaco como subproducto. La estructura de la EtOxa fue confirmada por 1H RMN.
Síntesis de la 2-metoxicarboniletil-2-oxazolina (EsterOxa).
Se aplicó el método descrito de Zarka y colaboradores para la síntesis de EsterOxa11. En la primera etapa, se realizó la reacción de condensación de 2-cloroetilenamina con el cloruro de succinilo metílico en presencia de la trietilamina 0°C obteniéndose el 7-cloro- 4 oxo-5-azaheptanoato de metilo (rendimiento 79%). Seguidamente este compuesto, denominado “intermediario”, fue ciclado, con vacío de 0,5 mm Hg, en presencia del carbonato de sodio anhidro para producir la deshidrolalogenación del mismo. Se obtuvo finalmente la EsterOxa con un rendimiento del 65%. La estructura química de la EsterOXA fue confirmada por 1H RMN (Fig. 1) y C13.
Síntesis de la N-(4-vinilbencil)-piperazina (agente „Terminador“)
La N-(4-vinilbencil)-piperazina (agente “Terminador”) se sintetizó mediante la reacción de condensación del clorometilestireno y la piperazina utilizando un exceso estequiométrico de 15/1 de esta última12. Esto se hizo así, con el fin de que estadísticamente solo sea atacado un grupo amino de la piperazina por el clorometilestireno y se preserve el otro grupo amino para la reacción de terminación de la polimerización de las 2-oxazolinas.
Esquema 3.- Síntesis de la N-(4-vinilbencil)-piperazina (agente „Terminador“).
El agente “terminador” fue caracterizado mediante 1H RMN, confirmándose su estructura química (Figura 2).
Síntesis de los Macromonómeros
Se realizó la síntesis de los macromonómeros mediante la polimerización catódica por apertura de anillo de la EtilOxa (Macromonómero M1) o la EsterOXA (Macromonómero M2). La polimerización se llevó a cabo a 78°C en acetonitrilo y fue iniciada por el triflato de metilo y terminada por la N-(4-vinil-bencil)-piperazina (Esquema 4). Se obtuvieron rendimientos de 84% y 91% para los macromonómeros M1 y M2, respectivamente.
Mediante el análisis cuantitativo de los espectros de 1H RMN de M1 y M2 se determinaron los grados de polimerización de estos macromonómeros (Figuras 3 y 4). Para esto, en el caso de M1 se compararon las integrales de la señal del grupo metilo (señal “e”) de la unidad química de repetición (“mero”) del macromonómero con la suma de las integrales de las señales del grupo vinilo (señales “a, a´ y b”) y se obtuvo un grado de polimerización de 14 que está en concordancia con el valor teórico de 15 (la razón molar inicial entre el monómero y el iniciador). En el caso del M2 se compararon las señales de los dos grupos metilenos (señal “f”) con las señales del grupo vinilo del macromonómero, en forma similar al caso anterior, y se obtuvo un grado de polimerización de 12 que es igual al valor teórico de 12. Estos resultados indican que los macromonómeros M1 y M2 prácticamente fueron obtenidos tal como fueron planificados y la polimerización transcurrió sin interferencias como sería esperado para la polimerización de las 2-oxazolinas.
Sumando el peso del resto del iniciador y del terminador al grado de polimerización de M1 y M2 se pudo calcular el peso molecular de 1605 y 2100 gramos/ mol para M1 y M2, respectivamente.
Esquema 4En la Tabla 1 se muestran las condiciones experimentales de síntesis de los macromonómeros y los resultados de la misma.
Tabla 1 Síntesis de los macromonómeros. Condiciones de reacción y resultados.
| MMa | MeTfb (mmol) | Monómeroc (mmol) | Termd (mmol) | Mon./MeTfe | Rf |
| M1 | 2,65 | 39,6 | 5,9 | 15 | 14 |
| M2 | 2,12 | 25,6 | 4,7 | 12 | 12 |
a) Denominación del macromonómero, b) Triflato de metilo, c) Monómero usado: EtOXA para M1 y ÉsterOxa para M2, d)N-(4-vinilbencil)-piperazina, e)Relación molar inicial de Monómero/Iniciador: (EtOxa o ÉsterOxa)/Triflato de metilo en la alimentación al reactor f)Relación molar final de Monómero/grupo vinilo en el macromonómero determinada mediante 1H-RMN, g) Rendimiento de la polimerizacionpara M1 y M2 fue de 74 y 81%, respectivamente. El rendimiento es igual a la relación entre el peso de macromonómero obtenido (luego de su triple purificación en éter dietilico) versus la suma del peso inicial de iniciador (MeTf), monómero (EtOxa (M1) o EsterOxa (M2)) y el terminador, h) En los dos experimentos: se usó 12 mL de acetonitrilo y una temperatura y tiempo de reacción de 78°C y 7 horas, respectivamente y para terminar la polimerizacion se usó 0,94 gramos (4,7 mmol) de N-(4-vinilbencil)-piperazina disueltos en 4 mL de acetonitrilo.
Estos resultados se podrían explicar de la siguiente manera: es conocido de la literatura1,2que si se usa el triflato de metilo como iniciador se obtiene una polimerización catiónica por apertura de anillo de las 2-oxazolinas de tipo “vivo” que procede en forma rápida mediante un mecanismo de tipo iónico, no ocurriendo reacciones de interferencia o reacciones secundarias (reacciones de terminación o de transferencia de cadena)2 y eso se debe a que el contraíon triflato producido por el iniciador es menos nucleofílico que el monómero, sea este EtOxa o la EsterOxa, y por consiguiente el monómero se adiciona de preferencia a la cadena polimérica reaccionando con el catión oxazolínico propagante. El número de moles de las cadenas propagantes “vivas” generadas es igual al número de moles de iniciador utilizados y una vez que se agota la cantidad de monómero adicionado las cadenas propagantes permanecen “vivas” y entonces pudieron ser terminadas cuantitativamente con la N-(4-vinilbencil)-piperazina mediante la reacción de los grupos amina de este compuesto con los cationes oxazolínicos de los extremos de las cadenas propagantes incorporándose de esta manera prácticamente al 100% los grupos vinilo al extremo de la polioxazolina.
Al momento de terminar la polimerización se agregó doble cantidad de moles de terminador con respecto a la cantidad teórica necesaria (cantidad de moles de iniciador utilizada) por dos razones. Primero, para aumentar la probabilidad de que acontezca la reacción de terminación con la N-(4-vinilbencil)-piperazina y segundo, para desprotonar el extremo de las cadenas de polioxazolina una vez que hayan reaccionado con el terminador.
Cabe mencionar que luego de tres procesos de purificación, donde se pierde una parte del polímero, se pudo conseguir rendimientos de 74 y 81% para M1 y M2, respectivamente. Se debe mencionar que los macromonómeros también se caracterizaron cualitativamente mediante la espectroscopia FTIR y UV/Vis. Mediante los espectros FTIR (Fig. 5a y 5b) se determinó la presencia de los grupos amida (1635 cm-1) para M1 y de amida y éster (1730 cm-1) para M2. Las señales de los grupos vinilo de M1 y M2, que teóricamente deberian ocurrir a 1630 y 3100 cm-1 aproximadamente13, quedaron traslapadas por las señales del carbonilo de la amida y de los C-H aromáticos y no se pudieron observar en el espectro FTIR13. En el espectro UV/Vis se observó claramente la señal de los grupos aromáticos del „terminador“ en los macromonomeros M1 y M2 aproximadamente entre 220 a 300 nm (transición π - π *)
Se probó la solubilidad de los macromonómeros en diferentes solventes tales como agua, metanol, cloroformo y tolueno. Se observó que los macromonómeros son solubles en solventes polares tales como, metanol, cloroformo y agua e insolubles en solventes no polares tales como, hexano y tolueno. Esto se debe a la hidrofilicidad global de los macromonómeros donde predomina la característica hidrofílica de la cadena polar de polietoxa o poliésteroxa sobre la propiedad hidrofóbica del anillo bencénico.
Los macromonómeros sintetizados podrían ser utilizados posteriormente para la elaboración de hidrogeles termo-conmutables y pH-Sensitivos para la liberación controlada de medicamentos. Esto se puede lograr mediante la copolimerización vía radicales libres con N-isopropilacrilamida y posterior eliminación de los grupos ésteres con una hidrólisis básica método que nuestro grupo de investigación ha aplicado en publicaciones anteriores3,4,6.
CONCLUSIONES
Es factible la síntesis de macromonómeros de 2-etil-2-oxazolina y de 2- metoxicarboniletil-2-oxazolina mediante la polimerización catiónica por apertura de anillo de estos monómeros, iniciada por el triflato de metilo y terminada por la N-(4- vinilbencil) piperazina.
La estructura química de los macromonómeros fue confirmada mediante la espectrometría de resonancia magnética nuclear de protones y la espectroscopia infrarroja. Mediante el análisis cuantitativo del espectro 1H-RMN de los macromonómeros M1 y M2 se determinó que tuvieron grados de polimerización de 14 y 12, respectivamente. Estos valores estuvieron en muy buena concordancia con los valores teóricos de 15 y 12, respectivamente. A partir de los grados de polimerización de M1 y M2 se calculó los pesos moleculares de 1605 y 2100 para M1 y M2, respectivamente