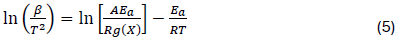INTRODUCCIÓN
En el siglo XXI, la preocupación principal de la comunidad científica es la lucha que existe contra la contaminación del aire causada por las emisiones de contaminantes generadas por varias fuentes, las cuales están relacionadas a las emisiones de compuestos perjudiciales para la salud como la generación de material carbonoso particulado (PM 2.5) mayoritariamente compuesto de hollín, estas partículas de hollín son formadas como sub-productos no deseados que, en particular, son emitidos de la combustión interna incompleta en motores junto con NOx, CO e hidrocarburos1. Las fuentes que producen altamente estos contaminantes son los vehículos, barcos, máquinas industriales, las industrias, etc. Estos contaminantes han sido relacionados con las enfermedades respiratorias, cáncer, problemas de memoria a corto plazo, disminución del coeficiente intelectual (IQ) e incluso pueden contribuir con los defectos de nacimiento2.
El impacto negativo causado por estos tipos de contaminantes ha permitido que investigadores desarrollen innovaciones con nuevos métodos sintéticos que sean más económicos y no contaminantes que puedan trabajar bajo condiciones razonables para reducir estas emisiones de hollín. Las actuales tecnologías están basadas en una combinación de filtros (filtros particulados de diesel, DPF) y materiales catalíticos3. El objetivo de estas nuevas tecnologías ayudará con la eliminación eficiente de los problemas relacionados a la emisión partícula-hollín. El atrapamiento de hollín mediante filtros (DPF) es una buena manera de disminuir la emisión de hollín de los gases de escape, sin embargo, se necesita una regeneración periódica de estos filtros para evitar que se bloqueen o se dañen. Durante la regeneración, se incrementa la temperatura del filtro ya que el hollín se oxida a altas temperaturas (alrededor de 600-700 °C) y esto requiere un ingreso de energía significativo4. Las altas temperaturas que se necesitan para la regeneración de filtros no catalizados generalmente se consiguen por inyección de diésel o por gasolina hacia el sistema de escape. Generalmente, el rango de temperatura del sistema de escape es de alrededor de 600-800 °C para gasolina y 150-500 °C para diésel. Esta estrategia conduce a un fenómeno exotérmico incontrolable, lo cual puede dañar el filtro, siendo esto una desventaja5. Recientemente, se han hecho mejoramientos significativos equipando los sistemas de escape con un convertidor catalítico. Los catalizadores de metales nobles (Pt, Pd y Rh) han sido los más usados debido a su actividad y durabilidad, sin embargo, estos metales nobles son muy caros y su uso es limitado en la reacción de oxidación catalítica del hollín4. Por lo tanto, es de gran interés el desarrollo de catalizadores efectivos y activos que puedan incrementar significativamente la velocidad de oxidación de hollín. Investigadores han reportado varios tipos de catalizadores que muestran una buena actividad catalítica para la oxidación del hollín, estos catalizadores incluyen óxidos de metales6, óxidos de metales mixtos combinados con metales nobles7, perovskita8, óxidos de metales de transición9, catalizadores modificados con tierras raras10 y metales nobles11. Los catalizadores de ceria y basados en ceria (mixtos) han adoptado ampliamente este propósito, por lo cual, investigadores han estudiado y reportado estos sistemas en varias investigaciones de oxidación del hollín3. Los catalizadores basados en ceria son considerados buenos catalizadores para la oxidación del hollín debido principalmente a su alta capacidad de almacenamiento de oxígeno y por sus propiedades rédox (disponibilidad de cambiar de Ce4+ a Ce3+)10. Sin embargo, existe una pérdida de la capacidad de almacenamiento de oxígeno de la ceria cuando está a altas temperaturas, ocasionando una pérdida de actividad por la sinterización de las partículas y el crecimiento de los granos12. Por lo tanto, es ampliamente investigado y requerido el desarrollo de catalizadores avanzados con resistencia térmica mejorada para la sinterización y una alta capacidad de almacenamiento de oxígeno. La actividad catalítica de la ceria puede mejorarse tras el dopamiento de la ceria con distintos elementos dentro de su red cristalina, es decir, se debe aprovechar la fuerte interacción que existen entre óxidos de metales distintos. Se han usado diferentes heteroátomos para dopar la ceria y así modificar sus propiedades químicas y mejorar la actividad catalítica y estabilidad térmica; entre ellos tenemos al Zr y metales de tierras raras (La y Pr) 13,14, metales de transición (Cu, Co, Mn, Cr y Fe)15,16, metales alcalinos y alcalinos térreos (K, Cs, Na, Ca, Ba y Mg)17, y metales nobles (Ag, Au, Pd, Ru y Rh)18,19, con los cuales se ha obtenido materiales con mejor rendimiento oxidativo. Liu et al.20 ha analizado el comportamiento catalítico en la combustión de hollín de diferentes sistemas de ceria dopados, ellos concluyeron que las actividades de oxidación del hollín de los catalizadores siguen el siguiente orden: metales alcalinos > metales de transición ≥ metales nobles > CeO2 dopado con Zr y tierras raras en condiciones catalíticas tanto en O2 como en NO + O2. Sin embargo, catalizadores de ceria modificados con metales alcalinos generalmente son térmicamente inestables debido a su naturaleza volátil de los metales alcalinos21, y los catalizadores de ceria modificados con metales nobles tienen un costo restringido. Por lo tanto, los metales de transición y metales de tierras raras, especialmente CexZr1-xO2, son las mejores opciones en términos de actividad, estabilidad térmica y eficiencia de costo22. Aberkane et al.3 estudiaron el efecto del pH en la estructura y propiedades de una serie de óxidos mixtos de NiO-CeO2 y relacionaron la estructura de los óxidos con la actividad catalítica en la oxidación del hollín. Sus catalizadores fueron preparados por el método de coprecipitación modificada en distintos valores de pH, la actividad catalítica de estos catalizadores fue bajo condiciones de contacto rígido y ligero. Su mejor performance catalítico fue con Ni-Ce- 8 (pH = 8) en contacto rígido (catalizador-hollín) y en atmósfera de aire/N2 (T50 = 417°C). Sellers-Anton et al.23 sintetizaron un catalizador macroporoso de orden tridimensional (3DOM) NiO-CeO2 por infiltración de Ni sucesiva para mejorar la generación del oxígeno activo por modificación con NiO y transferir este oxígeno activo desde el catalizador hacia las partículas de hollín. Su mejor performance catalítico fue con (Ni-Ce)-3DOM en presencia del 5% O2 en N2 (T50 = 530.2 °C). Reportes previos, demuestran el potencial del compuesto NiO/CeO2 para funcionar como un catalizador eficiente de oxidación del hollín a baja temperatura, sin embargo, estos métodos de preparación, son complicados y, por lo tanto, difíciles de implementar a grandes escalas. Bajo este contexto, en este trabajo, se han preparado catalizadores mixtos NiO-CeO2 a distintas proporciones molares (1, 5 y 9) mediante el método de evaporación de solvente para elegir el catalizador con mejor perfomance catalítico y poder hacer un estudio cinético no mecanístico evaluando la energía de activación (Ea) de este mediante las curvas light off.
PARTE EXPERIMENTAL
Reactivos
Para la preparación de los catalizadores mixtos de níquel (NiO) y cerio (CeO2), por el método de evaporación de solvente, se utilizaron la sal de nitrato de níquel (II) hexahidratado, Ni(NO3)2.6H2O al 99% de pureza en la marca EMSURE MERCK y sal de nitrato de cerio(III) hexahidratado, Ce(NO3)3.6H2O al 99% de pureza en la marca EMSURE MERCK y agua ultrapura MilliQ 18.2 MΩ cm at 298 K.
Síntesis de catalizadores basados en óxidos mixtos de níquel y cerio (Ni-Ce)
Para la preparación de los catalizadores de óxido mixto NiCe mediante el método de evaporación de solvente, se adicionaron distintas soluciones acuosas de las sales de níquel y cerio para obtener diferentes relaciones molares de catalizadores Ni:Ce en un volumen total de 50 mL (Tabla 1) donde cada catalizador mixto, se disolvió con agua desionizada bajo agitación constante a 80 °C durante 24 h. Luego, se secaron estos catalizadores mixtos a 50 °C durante 24 h. Finalmente, se calcinaron a 600 y 800 °C por 4 h con una rampa de calentamiento de 2 °C min-1.
Tabla 1 Masas obtenidas para la síntesis de catalizadores de óxidos mixtos Ni y Ce por el método de evaporación de solvente
| Catalizador | Cantidad molar de Ni- Ce (0.25M) en 50 mL | Masa de las sales precursoras (g) | %Ni peso (%p/p) | ||
|---|---|---|---|---|---|
| Ni | Ce | Ni(NO3)2.6H2O | Ce(NO3)3.6H2O | ||
| Ni0.5Ce9.5 | 0.000625 | 0.011875 | 0.1818 | 51.564 | 3 |
| Ni1Ce9 | 0.0025 | 0.0225 | 0.7270 | 97.699 | 7 |
| Ni9Ce1 | 0.0225 | 0.0025 | 65.432 | 10.856 | 86 |
| Ni5Ce5 | 0.0125 | 0.0125 | 36.351 | 54.278 | 40 |
Caracterización
Las caracterizaciones realizadas a los catalizadores de óxidos NiCe fueron mediante análisis de difracción de rayos X (XRD) que nos mostró la presencia de las fases cristalinas en los catalizadores mixtos de óxidos de NiCe. El equipo de difracción de rayos X utilizado fue un D2-PHASER BRUKER. La radiación utilizada fue correspondiente a la transición de CuKα (λ= 0.154184 nm) y el rango angular (2θ) utilizado fue 10° ≤ 2θ ≤ 60° a 0.050 °/s, 30 kV y 10 mA. El análisis de sorción de N2 (método BET) se utilizó para hallar las propiedades texturales de los catalizadores (área superficial, tamaño de poro, etc), el equipo utilizado fue el equipo Micromeritics GEMINI-VII serie t. Se utilizó gas N2 como gas de análisis (99% de pureza) y como refrigerante se utilizó nitrógeno líquido, este refrigerante se utilizó para la condensación del N2. Antes de analizar nuestros catalizadores mediante esta técnica, se degasificaron bajo He a 250 °C durante 2 h para eliminar componentes adsorbidos físicamente y otros gases adsorbidos en la superficie de los catalizadores. Para el cálculo del área BET, el rango de presiones p/p0 trabajados fue de 0.05 a 0.30, esto asigna a la adsorción de una monocapa. El software utilizado para medir los puntos de equilibrio fue gas micromeritics, con un total de 50 puntos en el rango: 0.09 ≤ p/p0 ≤ 0.98. El tiempo de equilibrio en cada punto fue de 5 s. Se utilizó el método de Brunnauer-Emmett-Teller (BET) para calcular el área superficial de los catalizadores. El análisis de termogravimetría (TGA) a los catalizadores se realizan con el fin de determinar las condiciones térmicas de preparación de estos, tanto másicos como mixtos. Se tomaron los catalizadores en su etapa seca para evaluar las etapas de descomposición de cada proceso y de esta manera, se determinó la temperatura óptima de calcinación de los catalizadores. El equipo utilizado fue un Perkin Elmer Simaltenous Thermal Analyzer (STA 6000). Las condiciones de análisis para estos catalizadores fueron a una rampa de calentamiento de 10 °C min-1, a una velocidad de flujo de 20 mL min-1 en aire y a un rango de temperatura de 35-800 °C. El análisis de reducción a temperatura programada con H2 (TPR-H2) fue para evaluar la reducibilidad de los catalizadores. El equipo utilizado fue un equipo TPR Chemisorb 2720 Micromeritics equipado con un detector de termoconductividad (TCD). Las condiciones de trabajo estuvieron bajo un flujo gaseoso mixto del 10% H2/N2 (25 mL min-1) y una velocidad de calentamiento de 10 °C min-1, en un rango de temperatura desde 25 °C a 800 °C. La espectroscopía Láser Raman (LRS) brinda información sobre la estructura del catalizador (defectos) tanto en el bulk como en la superficie, así como la presencia de adsorbatos e intermediarios de reacción. Esta técnica es una herramienta poderosa para el estudio de los materiales catalíticos incluyendo los procesos químicos de caracterización que ocurren en la superficie activa. Los espectros Raman fueron medidos a temperatura ambiente con un espectrómetro Horiba Scientific, con un láser de 532 nm, aplicando una potencia de 10%. La espectroscopía fotoelectrónica de rayos X (XPS) es una técnica utilizada ampliamente en la caracterización de las superficies de los materiales. Esta técnica es adecuada para probar el efecto que tiene un segundo metal agregado en un catalizador mixto en la superficie química del CeO2, la espectroscopía infrarroja por transformada de Fourier (FTIR) se utilizó para identificar los grupos funcionales presentes en la superficie de los catalizadores preparados. El equipo utilizado fue un FTIR-Alpha Fourier Transform Infrared Spectrometer-Bruker sobre 60 barridos (scan) para mejorar la relación señal-ruido en un rango de longitud de onda entre 2500 y 400 cm-1.
Actividad catalítica
Para el estudio de la actividad catalítica, se utilizó como modelo de hollín al carbón oscuro de marca Micromeritics, número de parte 004-16833-00 y número de lote D-7, ya que sus propiedades son similares a las partículas de hollín. El test catalítico se midió con un tipo de contacto específico a la mezcla catalizador-hollín (contacto directo, tight contact), este tipo de contacto consistió en moler la mezcla catalizador-hollín durante 10 min en un mortero, la mezcla de proporción catalizador:hollín fue de 1:10 (p/p), respectivamente. Las medidas catalíticas de las mezclas se realizaron por análisis termogravimétrico (TGA, Perkin Elmer Simaltenous Thermal Analyzer, STA 6000), calentando desde temperatura ambiente hasta los 850 °C, bajo un flujo de aire con 15 mL min-1 de flujo de O2 (flujo total de 50 mL min-1).
Estudio cinético
El estudio cinético de los catalizadores de óxidos mixtos NiCe frente al hollín, se llevó a cabo tras la evaluación de la rampa de calentamiento en el TGA (Perkin Elmer Simaltenous Thermal Analyzer, STA 6000), es decir, el modo rampa consistió en evaluar los análisis termogravimétricos de los catalizadores a distintas rampas constantes de calentamiento de 10, 15, 20 y 25 °C min-1 en aire con un flujo del 30% O2 como gas oxidante (50 mL min-1). El modo rampa principalmente se llevó a cabo para evaluar el rendimiento catalítico basado en la temperatura donde la mitad del hollín ha sido combustionado (T50). La conversión y velocidad de reacción se calcularon de la siguiente manera26:
Donde:
 X: Conversión de oxidación del hollín, m0: Peso inicial del hollín, mt: Peso restante del hollín en el tiempo t, La velocidad de reacción, rs, fue descrita como la pérdida de masa restante de carbono por unidad de tiempo t.
X: Conversión de oxidación del hollín, m0: Peso inicial del hollín, mt: Peso restante del hollín en el tiempo t, La velocidad de reacción, rs, fue descrita como la pérdida de masa restante de carbono por unidad de tiempo t.
La velocidad de oxidación para este tipo de reacción puede ser expresado como:
Donde:
T = Temperatura absoluta, X = Conversión de oxidación del hollín, β = Rampa de calentamiento, f(X) = Modelo de conversión, R = Constante universal de los gases, A y
Ea = Parámetros de Arrhenius, factor pre-exponencial y la energía de activación, respectivamente.
La función f(X) es la dependencia de la velocidad en la fracción del sólido que permanece invariable a medida que avanza la reacción. Por último, en base al modelo Kissinger- Akahira-Sunose (KAS), la ecuación (3) puede ser integrada y obtener la siguiente ecuación:
Este modelo de análisis generalmente asume que el modelo conversión es invariante para todas las curvas de oxidación de TGA consideradas26.
RESULTADOS Y DISCUSIÓN
Caracterización
La Figura 1 muestra los difractogramas de los catalizadores másicos y mixtos de níquel y cerio calcinados a 600 y 800 °C. El difractograma del CeO2 mostró la presencia de la fase fluorita con estructura cristalina cúbica centrada en las caras en los picos de difracción de 2θ = 28.59°, 33.13°, 47.56°, 56.43° y 59.18°, correspondientes a los planos cristalinos (111), (200), (220), (311) y (222), respectivamente1. El difractograma del NiO mostró la presencia de la fase cúbica con picos de difracción en 2θ = 37.3° y 43.36°, correspondientes a los planos cristalinos (111) y (200), respectivamente3. En el caso de los catalizadores NixCe10-x (800), solamente se detectaron menores intensidades en las líneas de difracción atribuidas al CeO2 para Ni1Ce9 (800). Además, no se detectaron los picos de difracción del NiO en el catalizador Ni1Ce9 (800), debido a que se introdujo especies de Ni a la red de la fluorita de la ceria, formando un sólido compacto27. Otra evidencia de la incorporación de los iones Ni2+ a la red del CeO2 es que el pico de los catalizadores mixtos NiCe relacionado al CeO2 presenta un ligero desplazamiento con respecto a la posición inicial del pico del CeO2 (800), 2θ = 28.52°. De la misma forma, los catalizadores calcinados a 600 °C presentan el ligero desplazamiento hacia la izquierda comparada con el pico del CeO2 (600) como se muestra en la Figura 1B. Los catalizadores mixtos Ni5Ce5 y Ni9Ce1 presentaron picos de difracción de ambas fases, esto indicó que con el incremento del contenido de NiO, a parte de los iones Ni2+ ingresados a la red de la ceria, una parte de los iones Ni2+ se cristalizaron en su superficie27. Esta introducción de iones Ni2+ sugiere que se ha formado una buena estructura sólida en Ni0.5Ce9.5 (600), insertando iones Ni2+ dentro de la red cristalina del CeO2. El incremento en el valor del parámetro de red de los catalizadores NixCe(10-x) es debido a la cristalización de parte de los iones Ni2+ en la superficie de la ceria28. Adicionalmente, la introducción de iones Ni2+ es muy ventajosa para obtener una reducción en el tamaño de cristalita determinado del pico de difracción del plano (111) por la ecuación de Debye-Scherrer. En general, el tamaño de cristalita de estas soluciones sólidas que contienen ceria son más pequeñas que el CeO2, en particular, el catalizador Ni0.5Ce9.5 (600) tiene el tamaño de cristalita más pequeño entre todos los catalizadores estudiados. Este fenómeno evita el crecimiento de la estructura de fase cúbica29 y es debido a un incremento de iones Ce3+ en la superficie, lo cual contribuye a la adsorción de especies de oxígeno y como consecuencia, promueve la actividad catalítica30.
La Figura 2A muestra las isotermas de adsorción de N2 para los catalizadores NixCe10-x calcinados a 800 °C con un comportamiento clásico de tipo II. Además, al ser isoterma de tipo II, las curvas de desorción prácticamente coinciden con la trayectoria de adsorción de las respectivas isotermas de sorción de todas las muestras, independientemente de la composición de los catalizadores31. Todas las isotermas de adsorción presentaron una inflexión a altas presiones relativas (P/P0 > 0.8), debido al llenado de vacíos de antipartículas (poros secundarios) a través de la condensación capilar de nitrógeno32. Sin embargo, se observó en la Figura 2B una diferencia significativa con los catalizadores NixCe10-x calcinados a 600 °C, estos son materiales más porosos como lo podemos apreciar en sus isotermas de sorción de N2 (Figura 2B), ya que se aprecia unas isotermas de tipo IV, donde se denota una mayor adsorción de N2 con sus ciclos de histéresis bien definidos. Por otra parte, comparando las propiedades texturales del soporte (CeO2) y los catalizadores mixtos NixCe10-x, se observó que la adición de los iones Ni2+ en la estructura del soporte CeO2 produce un bloqueo de los microporos y mesoporos, es decir, no se observó una diferencia significativa en la porosidad entre las muestras CeO2 y NixCe10-x tanto para las calcinaciones a 800 °C y a 600 °C (Tabla 2).
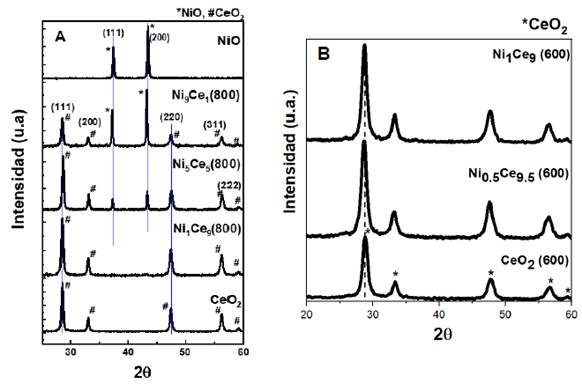
Figura 1 Difractogramas de rayos X para catalizadores mixto NixCe10-x calcinados a (A) 800 °C y (B) 600 °C
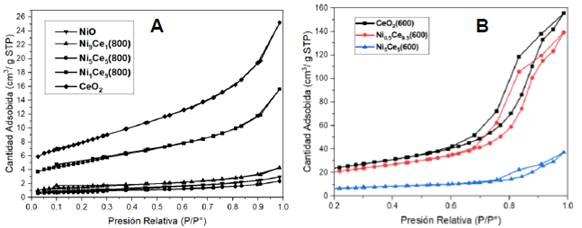
Figura 2 Isotermas de sorción de N2 de los catalizadores NixCe10-x calcinados a (A) 800 °C y a (B) a 600 °C
Este hecho denota que el área superficial de estos materiales es lo suficientemente alta para dispersar las partículas de óxido de níquel sin bloquear la entrada de los poros medidos por la adsorción de N223. Además, de acuerdo con los isotermas de sorción de N2, Ni0.5Ce9.5 (600) es el único catalizador con los mesoporos más desarrollados (11 nm, Tabla 2).
Tabla 2 Propiedades texturales de los catalizadores NixCe10-x(T), donde x: proporción molar Ni y T: temperatura de calcinación del catalizador
| Muestra | Área superficial, SBET (m2 g-1) | Diámetro promedio de poro BJH (nm) | Tamaño de cristalita (nm) |
| Ni9Ce1(800) | 5 | 2 | 20 |
| Ni5Ce5(800) | 3 | 3 | 22 |
| Ni1Ce9(800) | 18 | 3 | 18 |
| Ni5Ce5(600) | 23 | 10 | 10 |
| Ni0.5Ce9.5(600) | 74 | 11 | 9 |
| CeO2(600) | 85 | 10 | 10 |
| CeO2(800) | 28 | 3 | 21 |
Se estudió la descomposición térmica de los catalizadores NiCe en su forma de sal, es decir, el proceso de evaporación de solvente de la mezcla de sales precursoras a distintas proporciones molares en base al níquel (Sal Ni0.5Ce9.5, Sal Ni1Ce9 y Sal Ni5Ce5). Este estudio termogravimétrico se evaluó desde 25 °C hasta los 800 °C bajo un flujo de aire sintético (Figura no mostrada). En general, la evolución térmica de estas sales catalizadoras NiCe involucraron tres pasos principales de pérdida de masa durante la descomposición hasta los 600 °C. Para temperaturas mayores a los 600 °C no se observó pérdida de masa, por lo tanto, los resultados de TGA para estas sales NixCe10-x muestran que la temperatura apropiada para su calcinación es a los 600 °C debido a que a esta temperatura es lo suficientemente alto para la eliminación de agua, carbonatos y nitratos24. Adicionalmente, se evaluó una calcinación de 800 °C para estos catalizadores con la finalidad de apreciar las diferencias significativas que ocurren tanto en la superficie, en la adsorción de las moléculas de oxígeno, en el tamaño de sus parámetros de red, etc. para estas distintas temperaturas de calcinación.
La reducibilidad de un catalizador es un parámetro muy importante que está relacionado con su actividad en la reacción de oxidación del hollín. Los perfiles de TPR-H2 son mostrados en la Figura 3 para catalizadores NixCe10-x calcinados a 800 y 600 °C. En el caso del CeO2 (600), el pico de reducción de H2 fue menor (440 °C). La introducción de níquel a la red de la ceria mejoró la reducibilidad, es decir, todos los perfiles de los catalizadores de óxidos mixtos mostraron picos principales de reducción asimétricos en el rango de 200-400 °C lo cual podría proporcionar más oxígeno reticular generando una velocidad de combustión más rápida debido al mayor aumento en la cantidad de oxígeno activo disponible33, siendo el Ni0.5Ce9.5(600) el catalizador mixto con la reducibilidad más baja (205 °C), lo cual se debe a la formación de una estructura de solución sólida (combinación de los precursores de Ni y Ce que al ser fundidos a alta temperatura y luego de enfriarse forman este nuevo sólido) causada por la introducción completa del Ni dentro de la red cristalina del CeO233. Además, es importante notar que no existe señales de consumo de H2 a temperaturas mayores a 400 °C, lo cual implica que todo el proceso de reducción ocurrió hasta los 400 °C, incluyendo la reducción del CeO225.
La espectroscopía láser Raman es una técnica muy apropiada para la caracterización estructural de óxidos a base de cerio. La técnica XRD nos brinda información principalmente en relación con la posición de los cationes grandes en la red cristalina, tales como el cerio. Sin embargo, esta técnica ofrece una sensibilidad muy baja respecto a los elementos ligeros como el oxígeno34. La espectroscopía Raman nos brinda información sobre la red de aniones, por lo que la técnica de XRD no es muy sensible.
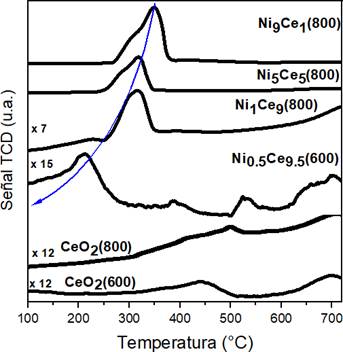
Figura 3 Perfiles de reducción a temperatura programada con H2 (TPR-H2) de catalizadores mixtos NixCe10-x calcinados a 600 y 800 °C.
En este sentido, esta técnica revela la presencia de defectos en este sistema y la disposición de los enlaces Metal-Oxígeno (M-O). La Figura 4 muestra los espectros
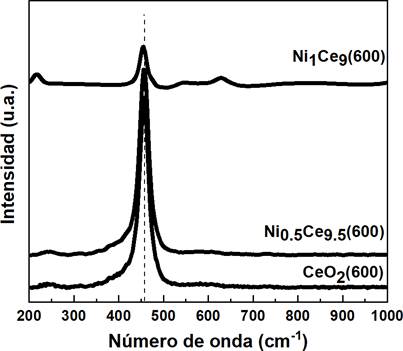
Raman de los catalizadores NixCe10-x calcinados a 600 °C. Para el CeO2, los resultados mostraron un espectro característico de una banda muy intensa alrededor de 458 cm-1, esta banda definida es atribuida al modo de vibración del enlace Ce-O activo en Raman (modo F2g) de la estructura cúbica tipo fluorita en la que cristaliza este óxido, correspondiendo a un modo de vibración simétrica de los átomos de oxígeno que rodean a los cationes de cerio34. Para los catalizadores mixtos NixCe10-x (600), se mantuvo la banda Raman con el modo de vibración F2g, lo cual confirma que estos óxidos mixtos también cristalizan en una estructura cúbica tipo fluorita. Sin embargo, se pueden observar tres efectos en esta banda F2g a medida que aumenta la cantidad de níquel en el óxido:
Una disminución en la intensidad de la banda.
Un ensanchamiento de la banda F2g.
Un ligero cambio de esta banda F2g a números de onda más bajos.
Respecto al efecto de la pérdida de intensidad de la banda F2g tras el incremento del níquel, esto es causado por el efecto de pérdida de simetría en la red del CeO2 cuando se introduce el níquel. Aquello afecta a la vibración del oxígeno con respecto a su posición de equilibrio34. Además, el ensanchamiento de los picos puede ser relacionado a las vacantes de oxígeno11. El catalizador Ni0.5Ce9.5(600) mostró relativamente un gran número de vacantes de oxígeno (Tabla 3). Por último, tras la introducción del níquel a la red del CeO2, promueve un cambio de la banda F2g hacia números de onda más bajo, lo cual es consecuencia del aumento en las distancias de enlace M-O34. Esto estaría en concordancia con los valores de parámetro de red obtenidos en el estudio por XRD.
Tabla 3 Posición del pico F2g, su ancho completo en la mitad de la máxima (FWHM) de los catalizadores calcinados a 600 °C.
| Muestra | Pico F2g (cm-1) | FWHM del pico F2g (cm-1) |
|---|---|---|
| CeO2(600) | 456.6 | 29.8 |
| Ni0.5Ce9.5(600) | 456.1 | 30.1 |
| Ni1Ce9(600) | 454.6 | 20.5 |
Los espectros FTIR de los catalizadores antes de ser calcinados se muestran en la Figura 5 muestra los espectros FTIR de los catalizadores NixCe10-x calcinados a 600 °C. Aproximadamente se observaron las mismas bandas, pero con absorbancias más débiles. Las bandas post-calcinación disminuyeron debido a la eliminación de moléculas de carbonatos, nitratos y agua de la estructura del catalizador24. Además, para los catalizadores calcinados, la presencia de bandas de baja frecuencia en 1638, 1533, 1337 y 521 cm-1 pueden ser atribuidos a las vibraciones que existen entre (M-O) y (M-O-M). Por último, la débil absorbancia e intensidades disminuidas de las bandas indican que la calcinación a 600 °C condujo a la conversión completa de la estructura del catalizador a óxidos metálicos24.
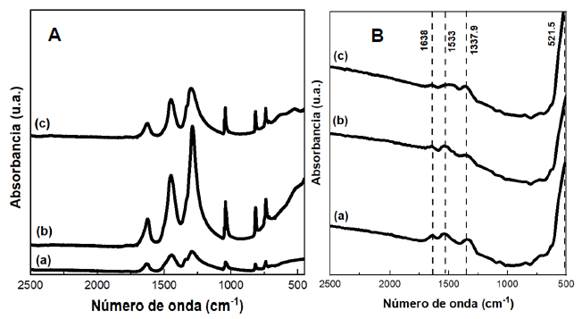
Figura 5 Espectros FTIR de los catalizadores NixCe10-x (A) antes de ser calcinados y (B) a 600 °C (a) Ni0.5Ce9.5; (b) Ni1Ce9; (c) Ni5Ce5
Actividad catalítica
Los catalizadores mixtos NixCe10-x fueron evaluados en la reacción de oxidación catalítica del hollín, además, se realizó la combustión del hollín propio (no catalizado). Las medidas de actividades catalíticas fueron hechas por el método tight contact debido a que el modo de contacto en esta reacción es muy importante porque es un factor clave en la reacción. Existen varias razones de porqué la mezcla por contacto directo es más reactiva35: (1) El catalizador tendrá más puntos de contacto con el hollín. (2) Las partículas del catalizador serán más pequeñas y mejor dispersadas. (3) El tipo de contacto controla el mecanismo que está ocurriendo. Todos los perfiles del TGA (Ni1Ce9 + C, Ni5Ce5 + C, Ni9Ce1 + C y el hollín no catalizado) fueron normalizados eliminando las respuestas debajo de los 500 °C, debido a la desorción del H2O adsorbido34. La oxidación del hollín frente a los catalizadores mixtos NixCe10-x calcinados a 800 y 600 °C sus resultados están resumidos en la Tabla 5.
Tabla 4 Temperaturas características de la oxidación del hollín en aire, bajo modo de contacto directo (tight contact) para catalizadores mixtos NixCe10-x
| Modo de contacto | Catalizador | T50* (°C) |
|---|---|---|
| No catalizado | Carbón puro (Printex-U) | 677 |
| Directo | Ni9Ce1(800) | 669 |
| (Tight) | Ni5Ce5(800) | 669 |
| Ni1Ce9(800) | 659 | |
| Ni1Ce9(600) | 547 | |
| Ni0.5Ce9.5(600) | 519 |
*Temperatura al 50% de conversión del hollín
Según la Tabla 5, la temperatura T50 calculada para la oxidación del hollín en los catalizadores estudiados siguió la tendencia de: Carbón puro > Ni9Ce1(800) ≈ Ni5Ce5(800) > Ni1Ce9(800) > Ni0.5Ce9.5(600). Estos resultados para la oxidación del hollín en base a catalizadores Ce son mejores que otras referencias encontradas, por ejemplo, Rangaswamy37. En este caso, las partículas de Ni y la temperatura de calcinación de los catalizadores presentan un gran rol en la disminución del T50 y el incremento de la actividad catalítica. Wen38 indicó que el área superficial y la estructura mesoporosa de los materiales cumplen un rol importante en el mejoramiento de contacto entre el hollín y los sitios activos del catalizador. En este trabajo de investigación, la estructura mesoporosa de nuestros catalizadores calcinados a 600 °C dieron lugar a la actividad más alta. Además, otro factor que predomina en el contacto directo es la cantidad de especies de oxígeno activo en la superficie21. Como se observó en los resultados del TPR-H2, es posible crear especies de oxígeno muy reactivos en los óxidos mixtos de cerio y níquel debido al efecto sinérgico causado por la incorporación del Ni dentro de la red del CeO235, es decir, la incorporación del Ni a la estructura del CeO2 resultó mejores resultados que los efectos individuales de cada uno de ellos. Por lo tanto, en base a los resultados, el catalizador Ni0.5Ce9.5 (600) es el catalizador mixto con mayor actividad catalítica debido a la incorporación del níquel a la red del CeO2.
Estudio cinético
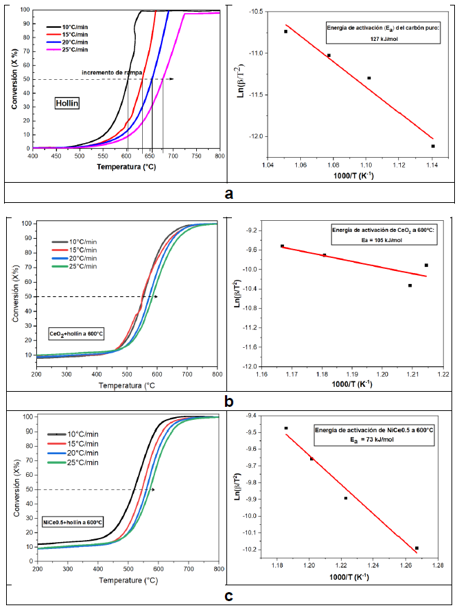
En el análisis cinético debemos tener en cuenta que, durante una reacción química, lo primero que se forma es un estado de transición, donde la energía de activación (Ea) se forma tras la diferencia de energía entre el estado de transición y el estado inicial. Cada reacción tiene su propia energía de activación, lo cual es un factor importante para determinar la velocidad de una reacción química. Si reducimos la Ea de la reacción usando un catalizador, la reacción procede más rápido, indicando que la actividad catalítica de la muestra ha mejorado efectivamente hasta cierto punto. Por otra parte, durante el proceso de reacción específica, algunos contaminantes como el CO y el NO serán absorbidos en la superficie del catalizador y luego desorbidos desde la superficie hacia el interior, generando una colisión entre contaminante y moléculas del catalizador. Esta colisión iniciará una reacción química para formar gases inofensivos tales como CO2 y N2.39 Para este trabajo de investigación, se usó diferentes rampas de calentamiento (β = 10, 15, 20 y 25 °C min-1) durante la oxidación del hollín en TGA. Se realizaron los gráficos de isoconversión para un nivel de conversión del 50% (X = 0.5) en base al método KAS para los catalizadores CeO2, Ni0.5Ce9.5 y el hollín calcinado a 600 °C . El NiO presentó un T50 = 668 °C (Figura 6) por el cual es muy similar a las muestras mixtas calcinadas a 800 °C . Sin embargo, la adición de pequeñas proporciones de níquel a la red del CeO2 disminuyó los T50. Por lo tanto, no es necesario realizar un estudio cinético al NiO. En la Tabla 5 se muestran las Ea calculadas desde la pendiente del ajuste lineal por mínimos cuadrados de Ln(β/T2) vs 1/Tx graficadas por el método KAS a un nivel de conversión del 50%.
De la Tabla 5 se observa que la Ea del hollín no catalizado es 127 kJ mol-1, lo cual, tras la presencia de un catalizador en modo de contacto directo (tight contact), influenció significativamente esta energía de activación, disminuyendo dramáticamente a 73-105 kJ mol-1. La buena interacción de las partículas de níquel incorporadas en la red de la ceria obtuvo un efecto altamente positivo en la energía de activación, reduciendo la barrera energética para la combustión del hollín. Esto se observó en el catalizador Ni0.5Ce9.5(600) que obtuvo la energía de activación más baja (73 kJ mol-1). Por lo tanto, esto comprueba que el componente Ni es un componente eficiente para activar oxígeno y formar más vacantes de oxígeno, lo cual es beneficioso para acelerar la combustión catalítica del hollín.
Tabla 5 Energía de activación calculada por el método KAS al 50% de conversión
| Catalizador | Energía de activación (kJ mol-1) al 50% de conversión |
|---|---|
| Hollín(600) | 127 |
| CeO2(600) | 105 |
| Ni0.5Ce9.5(600) | 73 |
CONCLUSIONES
Se prepararon los catalizadores de óxidos mixtos Ni0.5Ce9.5, Ni1Ce9, Ni5Ce5 y Ni9Ce1 mediante el método de evaporación de solvente a distintas temperaturas (600 °C y 800
°C).
 Los catalizadores NixCe10-x preparados a distintas cantidades de Ni mostraron diferentes propiedades fisicoquímicas al ser caracterizados rigurosamente, marcando gran influencia en sus actividades catalíticas en la combustión del hollín con aire. Además, el tamaño de los cristales del catalizador Ni0.5Ce9.5(600) disminuyeron a 9 nm, indicio de que el Ni está incorporado dentro de la red de la ceria. El estudio de la espectroscopia Raman confirmó el gran número de vacantes de oxígeno del Ni0.5Ce9.5(600) y el parámetro de red más alto (5.3922 Å). Por otra parte, la reducibilidad mejoró (205 °C) y su diámetro de poro fue el más alto (11 nm), aumentando el contacto superficial entre el hollín y el catalizador.
Los catalizadores NixCe10-x preparados a distintas cantidades de Ni mostraron diferentes propiedades fisicoquímicas al ser caracterizados rigurosamente, marcando gran influencia en sus actividades catalíticas en la combustión del hollín con aire. Además, el tamaño de los cristales del catalizador Ni0.5Ce9.5(600) disminuyeron a 9 nm, indicio de que el Ni está incorporado dentro de la red de la ceria. El estudio de la espectroscopia Raman confirmó el gran número de vacantes de oxígeno del Ni0.5Ce9.5(600) y el parámetro de red más alto (5.3922 Å). Por otra parte, la reducibilidad mejoró (205 °C) y su diámetro de poro fue el más alto (11 nm), aumentando el contacto superficial entre el hollín y el catalizador.
Se estudió la actividad catalítica de los catalizadores NixCe10-x para la combustión del hollín bajo las condiciones de contacto directo (tight contact) usando la técnica TGA. Se encontró que el catalizador Ni0.5Ce9.5(600) fue el catalizador más activo (T50 = 519 °C) comparado con los demás catalizadores NixCe10-x, obteniéndose una disminución de
157.7 °C en la combustión del hollín.
De acuerdo con el método KAS, los valores de Ea al 50% en conversión durante la combustión del hollín siguieron el siguiente orden: hollín > CeO2(600) > Ni0.5Ce9.5(600), siendo el catalizador Ni0.5Ce9.5(600) con la Ea más baja (73 kJ mol-1), catalizador mixto capaz de activar oxígeno y formar más vacantes de oxígeno, beneficioso para acelerar la combustión catalítica del hollín.