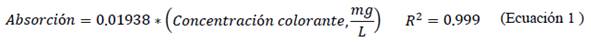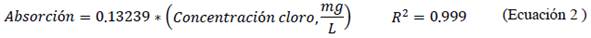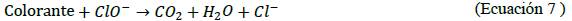INTRODUCCIÓN
La industria textil consume grandes cantidades de agua en sus operaciones de teñido y acabado1. Los efluentes de la industria textil presentan una variedad de contaminantes cuyos parámetros característicos son: color (1100-4500 unidades), demanda química de oxígeno (800-1600 mg/L), pH alcalino (9-11) y sólidos totales (6000-7000 mg/L)2. Los colorantes reactivos son los más utilizados en el teñido de sustratos textiles de celulosa, ellos generan efluentes problemáticos debido al bajo poder de agotamiento y fijación en la fibra, por consiguiente, el colorante no fijado se encuentra en altas concentraciones en los efluentes textiles.
Los procesos de oxidación avanzada (PAO’s) como las técnicas electroquímicas basadas en la electrólisis del efluente son una alternativa promisoria que se viene investigando para el reúso del efluente en los procesos textiles3. La decoloración se logra por la oxidación de la molécula del colorante, ruptura del enlace azo y posterior mineralización4. En el Perú se ha investigado la decoloración de efluentes textiles aplicando los siguientes métodos: adsorción con carbón activado5, coagulación con coagulantes naturales6, tratamiento biológico7, fotocatálisis8 y procesos de oxidación avanzada9. En la mayoría de los casos se trabajó a nivel de laboratorio y con colorantes individuales, siendo poca la experiencia con efluentes reales.
Respecto a la decoloración por el método de electro-oxidación hay experiencia con diversos colorantes 10 y reactores 11.
PARTE EXPERIMENTAL
Las pruebas se realizaron en el Laboratorio N° 21 de la Facultad de Ingeniería Química y Textil de la Universidad Nacional de Ingeniería. Se construyeron tres reactores, se ensayaron dos efluentes simulados (colorante único y tricromía) y un efluente real y se utilizó una fuente de corriente continua.
Reactores de electro-oxidación
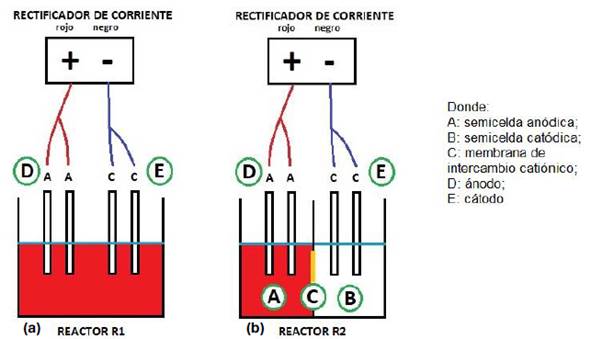
El reactor R1, tenía un compartimiento de 500 mL de volumen efectivo dentro del cual se ubicaron los electrodos, ver Figura 1.a.
El reactor R2, tenía dos compartimientos, de 400 mL de volumen efectivo cada uno. El primer compartimiento, anódico, donde se colocó la solución a tratar; y el otro, catódico, donde se colocó la solución salina a la misma concentración que la solución a tratar, separados mediante una membrana de intercambio catiónico que fue adquirida de la empresa “Membranes International Inc.”, la cual tiene un área de 36 cm2, ver Figura 1.b.
En ambos reactores los electrodos que se utilizaron fueron tipo malla: como cátodo, dos electrodos de titanio y como ánodo, dos electrodos DSA de titanio recubiertos con rutenio e iridio, estos electrodos fueron adquiridos de la empresa “Sophia's wholesale titanium,nickel,tantalum”, los cuales están recubiertos 1.1 mm por ambos lados. área total de 50 cm2.
Disposición de electrodos: Ánodo-Ánodo/membrana/Cátodo-Cátodo, distancia entre electrodos de 2 cm, intensidad de corriente 0.5 A, densidad de corriente 1 A/dm2 y un tiempo de 30 minutos.
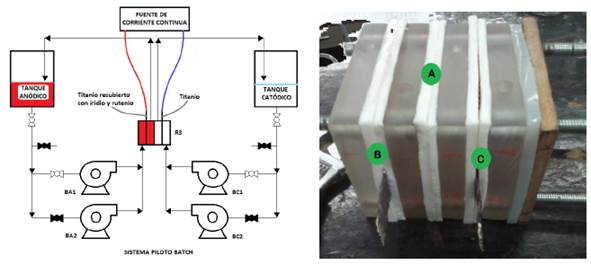
El reactor piloto R3, se basó en el diseño del reactor R2 con la mejora de capacidad aumentada en un sistema de flujo circulante. Este reactor estuvo formado de cuatro capas rectangulares de resina sólida translúcida intercaladas con capas de silicona, formando dos compartimientos mediante la membrana de intercambio catiónico. Los electrodos fueron los mismos utilizados en los reactores anteriores. El efluente a tratar se colocó en el compartimiento anódico y la solución salina en el compartimiento catódico, ver Figura 2.a. Las soluciones suministradas al reactor R3 fueron descargadas desde dos recipientes de 20 L cada uno, mediante un sistema de bombas a un caudal fijo de 78 mL/s y válvulas manuales conectadas al reactor mediante mangueras, ver Figura 2.b.
Preparación de los efluentes textiles con colorante reactivo, simulados y reales
Se prepararon dos efluentes simulados, además de contar con un efluente real. La formulación del efluente simulado de color rojo fue: 300 mg/L colorante reactivo Corafix Red ME-4B 150%, 50 g/L NaCl y la cantidad necesaria de NaOH para alcanzar valores de pH de 10 a 12.
El efluente real procedía de un proceso de teñido isotérmico a 60 °C por 60 minutos, el cual contenía 1% de cada colorante reactivo, Corafix Blue MERS 150%, Corafix Golden Yellow MERS 150% y Corafix Red ME-4B 150%, NaCl, NaOH para ajustar el pH y los siguientes auxiliares de teñido: secuestrante (Rucoquest 100-P), antiquiebre (Rucolin RSO), igualante (Rucogal EDR), buffer (Ruco control) y Ruco dye (alcaligeno).
La solución salina que se utilizó en el compartimiento catódico de los reactores R2 y R3 se elaboró con 50 g/L de NaCl.
Caracterización de los efluentes textiles con colorante reactivo, simulados y reales
El efluente simulado de color rojo se caracterizó mediante espectroscopía UV-visible12 a las concentraciones de 4, 8, 10, 20, 40, 60 y 80 mg/L, pH 4, 7 y 10, con la adición de sal (20 g/L) y auxiliares de teñido que se utilizaron en el efluente real.
Se correlacionaron los datos de concentración vs. absorbancia a la longitud 530 nm con la ecuación de la ley de Lambert-Beer.
Del mismo modo se caracterizó la solución estándar de cloro con reactivo DPD13 mediante espectroscopía UV-visible y se elaboró la curva de concentración vs. absorbancia para confirmar la ley de Lambert- Beer.
Además, se midieron el pH, conductividad, turbidez, sólidos suspendidos totales (SST) y demanda química de oxígeno (DQO) de los efluentes antes y después del proceso de decoloración.
En el caso del efluente real se obtuvieron los espectros de absorción UV-visible, se midieron el pH, conductividad, turbidez, sólidos suspendidos totales (SST) y demanda química de oxígeno (DQO), antes y después del proceso de decoloración.
Decoloración del efluente textil a nivel laboratorio
La decoloración consistió en el tratamiento del efluente simulado mediante el método de electro-oxidación en los reactores R1 y R2 y sus condiciones ya descritas. Los arreglos en los reactores R1 y R2 se muestran en la Figura 3.
Decoloración del efluente textil a nivel piloto
El efluente simulado de tricromía y el efluente real fueron tratados en el reactor R3, la distribución de los electrodos es similar a la utilizada en el reactor R2. En la Tabla 1 se muestran las condiciones de trabajo del reactor.
Tabla 1 Condiciones de las pruebas en el reactor R3
| Parámetro | Prueba 1 | Prueba 2 |
| Efluente | Simulado | Real |
| Pares de electrodos | 1 | 1 |
| Separación de electrodos, cm | 6 | 6 |
| Área de electrodo, dm2 | 0.36 | 0.36 |
| Intensidad de corriente, A | 0.5 | 1 |
| Densidad de corriente, A/dm2 | 1.39 | 2.78 |
| Membrana de intercambio | Si | Si |
| Tiempo, min | 60 | 210 |
Reúso en un proceso de teñido
El efluente real tratado en el reactor R3, se filtró y eliminó el cloro previo a ser reutilizado en teñido de algodón con 0.5% de colorante azul reactivo Corafix Blue MERS 150%, el proceso de tintura fue isotérmico a 60 °C por 60 minutos.
RESULTADOS Y DISCUSIÓN
Caracterización de efluente simulado y real
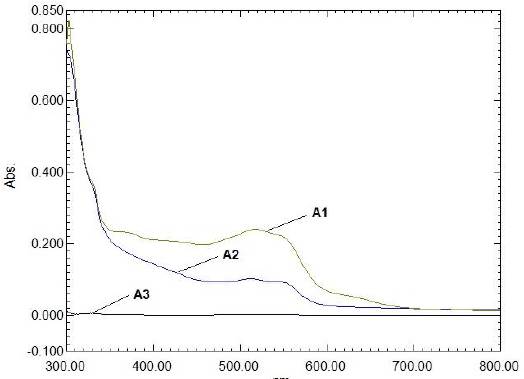
Se observa, en las Figuras 4.a y 4.b, que los espectros UV-visible del colorante reactivo
C.I. Reactive Red 195 (colorante simulado rojo) presentaron el mismo perfil en el rango de concentraciones y pH ensayados: de 4 mg/L a 80 mg/L, pH 4, 7 y 10. La adición de sal y auxiliares no modificó las longitudes de onda de los picos y valles notables, manteniendo también el mismo perfil, por lo cual se eligió la longitud de onda 530 nm para hacer el seguimiento del proceso de decoloración.
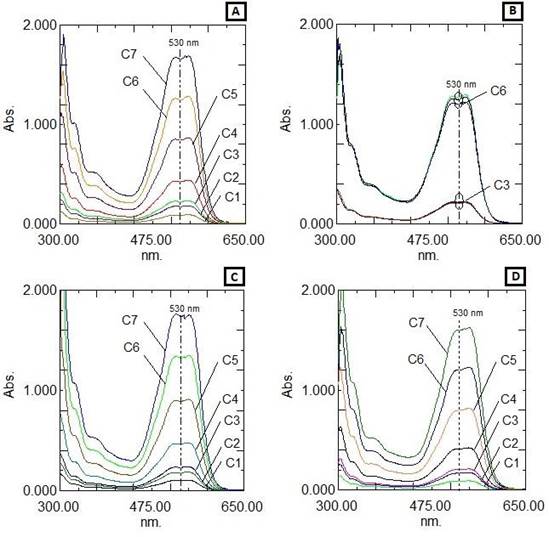
Figura 4 Espectros de absorción de efluente simulado con colorante C.I. reactive red 195. (A) variación de concentración. (B) variación de pH. (C) variación de sal. (D) adición de auxiliares. Donde: C1: 4mg/L, C2: 8mg/L, C3: 10 mg/L, C4: 20mg/L, C5: 40mg/L, C6: 60mg/L y C7: 80mg/L.
Se verificó un buen ajuste lineal al relacionar la absorbancia con la concentración (mg/L) según la ley de Lambert-Beer, del efluente con el colorante reactivo C.I. reactive red 195 (Ecuación 1) y del estándar de cloro (Ecuación 2).
En la Figura 5 se muestran los principales parámetros del efluente simulado rojo y del efluente real antes del tratamiento, así como el espectro UV-visible del efluente real diluido.
DECOLORACIÓN A NIVEL LABORATORIO
Pruebas en el reactor R1 y R2
La Tabla 3 muestra la caracterización del efluente simulado rojo antes y después del tratamiento por electro-oxidación de las pruebas. El tiempo de tratamiento fue de 30 minutos a una densidad de corriente continua de 1 A/dm2 en ambos reactores y se monitorearon las variables de pH, conductividad, ORP, DQO, y concentración de colorante, cloro y sal antes y después del tratamiento. La variación del pH y concentración del colorante durante el tiempo de tratamiento se observa en la Figura 5.
Tabla 3 Caracterización del efluente simulado rojo (C.I. reactive red 195), para 300 mg/L de efluente y 50 g/L de sal durante 30 minutos, densidad de corriente 1 A/dm2. Antes y después del tratamiento en el reactor R1 y en el reactor R2. Según los datos de concentración de colorante en la Tabla 3, se determinó que los porcentajes de decoloración para los reactores R1 y R2 fueron 16.2% y 95.9%, respectivamente; en la Figura 5 es notorio que el grado de oxidación del colorante fue mayor en el reactor R2 durante todo el proceso, lo cual también se observa en la coloración final de los efluentes tratados, ver Figura 6.
| Prueba | R1 | R2 | |||
| Inicio | Final | Inicio | Final | ||
| pH | 11.0 | 9.8 | 11.4 | 2.3 | |
| ORP (mV) | 85.4 | -254 | 80 | 1125 | |
| Sal (g/L) | 50 | 48.6 | 50 | 49.9 | |
| Concentración de colorante rojo(mg/L) | 300 | 251.6 | 300 | 12.4 | |
| DQO (mg/L) | 250 | 150 | 262 | 100 | |
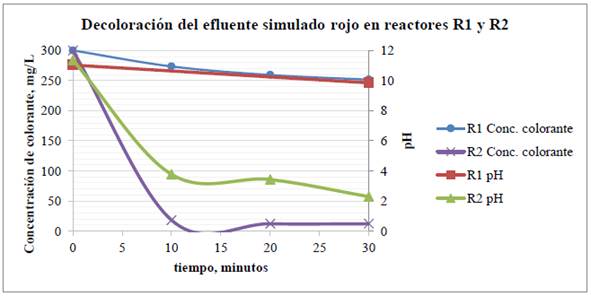
Figura 5 Pruebas en los reactores R1 y R2. Gráfica comparativa de tiempo vs. pH y Concentración de colorante C.I reactive red 195
Esto podría explicarse considerando que el reactor R2 cuenta con una separación de los compartimientos anódico y catódico, lo que evita la neutralización de los iones hidronio que se forman sobre el ánodo, ver ecuaciones 4-8, permitiendo que el pH disminuya más rápido y por consiguiente las especies cloradas predominantes (iones hipoclorito y ácido hipocloroso) puedan oxidar más eficientemente el colorante14.
Reacción de reducción (cátodo):
Reacción de oxidación (ánodo):
Reacción de neutralización
Decoloración a nivel piloto
Se utilizó el reactor piloto R3 para tratar efluente simulado y real. En la Tabla 4 se muestran las caracterizaciones del antes y después del tratamiento de electro-oxidación en el reactor R3.
Tabla 4 Caracterización del efluente simulado y efluente real con colorante C.I. reactive red 195, antes y después del tratamiento en el reactor R3
| Prueba | N°1: Efluente simulado | N°2: Efluente real | |||
| Inicio | Final | Inicio | Final | ||
| pH | 11 | 3.0 | 11.5 | 3.8 | |
| ORP (mV) | 56.4 | 1099 | -19.5 | 1045 | |
| Concentración de colorante rojo(mg/L) | 300 | 23.9 | 125.6 | 1.12 | |
| Concentración de cloro (mg/L) | 0 | 60.2 | 0 | 33.3 | |
| DQO (mg/L) | 250 | 150 | 1537.5 | 1262.5 | |
En la primera prueba se trató el efluente simulado rojo donde se obtuvo una eficiencia de decoloración del 92%, con una disminución del 40% de DQO. En la Figura 7 se muestra la variación de concentración del colorante simulado rojo y del pH vs. el tiempo de tratamiento, además del color del efluente antes y después de ser tratado.
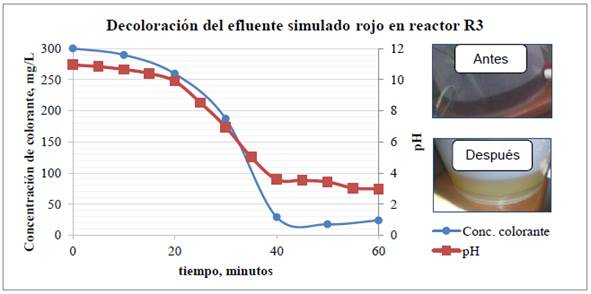
Figura 7 Reactor R3 prueba 1. Arriba: gráfica de variación de concentración decolorante y pH. Abajo: Coloración de la solución antes y después del tratamiento.
En la segunda prueba se trató el efluente real de una tricromía donde se obtuvo una eficiencia de decoloración del 99.1%. En la Figura 8 se muestra la variación de concentración del colorante rojo y del pH vs. el tiempo de tratamiento, además del color del efluente antes y después de ser tratado.
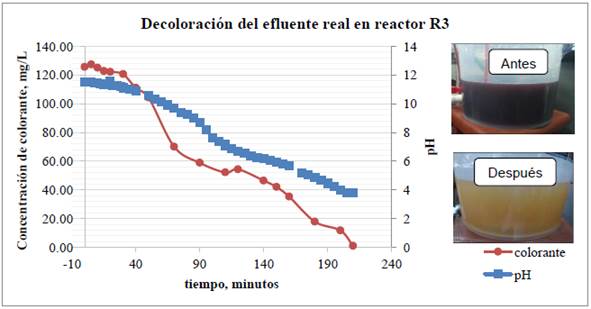
Figura 8 Reactor R3 prueba 2. Arriba: gráfica de variación de concentración de colorante y pH. Abajo: Coloración de la solución antes y después del tratamiento
Teñido con el efluente tratado
El efluente tratado de la prueba 2 del reactor R3 se acondicionó mediante filtración al vacío y eliminación del cloro remanente con bisulfito de sodio.
Se realizó el teñido de una tela de algodón con 0.5% de colorante reactivo Corafix Blue MERS 150% utilizando efluente acondicionado. Simultáneamente se hizo una tintura estándar con agua virgen utilizando el mismo porcentaje de colorante. Se midió el color de las telas utilizando un espectrofotómetro de reflectancia marca Data Color modelo SF550, el valor de la diferencia de color obtenido fue DECMC:1.06, cercano a 1.00, tolerancia máxima aceptado en la industria textil. Los colores obtenidos se muestran en la Figura 10.
CONCLUSIONES
Es posible decolorar hasta un 99.1% un efluente textil real procedente de la tintura de algodón con colorante reactivos, mediante la electro-oxidación en un reactor piloto batch de flujo circulante con cátodo de titanio y ánodo de titanio recubierto con iridio y rutenio. Es posible utilizar el efluente decolorado por electro-oxidación para un nuevo proceso de tenido y obtener resultados de color aceptables dentro de la tolerancia máxima usada en la industria textil.
A nivel laboratorio el reactor R2 (dos compartimientos) es más eficiente en la decoloración del colorante C.I. Reactive red 195 que el reactor R1 (un compartimiento), siendo la eficiencia de decoloración de 95.9% y de 16.2%, respectivamente.
Se valida que la espectrofotometría puede ser utilizada como método de seguimiento de la decoloración del colorante reactivo C.I. Reactive red 195.