INTRODUCCIÓN
Saccharomyces cerevisiae es un microorganismo ampliamente utilizado en investigación y en procesos biotecnológicos gracias a que presenta ventajas como rápido crecimiento, fácil cultivo y manipulación genética, y un simple pero eficiente sistema de secreción de proteínas1,2,3. Esta última característica es muy importante para su aplicación a nivel industrial y de investigación porque facilita la etapa de purificación de proteínas. Por esta razón se han desarrollado numerosas investigaciones buscando optimizar el rendimiento de secreción proteica4,5. Para lograr que una proteína sintetizada en la célula sea secretada, es necesaria la presencia de una secuencia de péptido señal (PS), cuya secuencia codificante puede estar incluida en el plásmido de expresión. Varios investigadores han demostrado que la eficacia de secreción de una proteína depende en parte de la secuencia del PS, la que puede optimizarse originando los llamados PS sintéticos5,6. Importantemente, el efecto de un PS sobre la secreción de una proteína debe, necesariamente, ser determinado experimentalmente.
Este estudio tuvo como finalidad determinar los niveles de secreción que pueden alcanzarse al usar dos tipos de PS. El primero es un PS nativo, PS-alfa, derivado de la proteína usada por S. cerevisiae como un factor de apareamiento durante la reproducción sexual. El segundo PS es denotado como “sintético” (PS-sintético) ya que es una secuencia optimizada diseñada a partir de las proteínas Yps1/Yap3/TA57, las cuales son secretadas eficientemente en la levadura5. Para determinar los niveles de secreción con los dos tipos de PS, se empleó a la enzima glutatión S-transferasa (GST), que cataliza la conjugación de glutatión a compuestos xenobióticos para promover la desintoxicación. GST es frecuentemente como una etiqueta que permite la eficiente purificación y detección de las respectivas proteínas de fusión7. Por esta razón, se han desarrollado múltiples anticuerpos monoclonales que permiten su detección mediante Western blots (inmunoblots, transferencia de proteínas), el método aplicado en este estudio8. Los ensayos aplicados demostraron que, aunque se presentan diferentes versiones intracelulares de GST, con diferentes tamaños, solo la forma madura y procesada (libre del respectivo péptido señal) puede ser detectada en la fracción extracelular.
PARTE EXPERIMENTAL
Materiales y cepas de levadura
Los plásmidos que permitieron la producción de las proteínas analizadas están listados en la tabla 19. El plásmido original, denotado pJN1, así como la cepa correspondiente (un mutante que es deficiente en la enzima triosa fosfato isomerasa, tfiNEG) fueron gentilmente proveídos por el laboratorio del Dr. Jens Nielsen10. La cepa tfiNEG no puede proliferar en medio conteniendo glucosa ya que la deficiencia enzimática causa la acumulación de metilgioxal, un compuesto citotóxico. El plásmido pJN1 incluye como marcador de selección al gen que codifica para la triosa fosfato isomerasa y por tanto, permite el crecimiento de los transformantes que lo incluyen en medio conteniendo glucosa.
Tabla 1 Plásmidos pJN1 modificados para este estudio9
| Nombre | Descripción | Uso |
| pAlfa | Incluye la secuencia codificante para el PS-alfa | Control negativo de secreción |
| pSint | Incluye la secuencia codificante para el PS-sintético | Control negativo de secreción |
| pAlfaGST | Incluye la secuencia codificante para GST fusionada al PS-Alfa | Secreción de GST bajo la dirección del PS-alfa |
| pSintGST | Incluye la secuencia codificante para GST PS-sintético | Secreción de GST bajo la dirección del PS-sintético |
Preparación de las muestras para los ensayos de los niveles de secreción de GST en los transformantes de levadura
Los transformantes tfiNEG que incluían los plásmidos de secreción fueron inoculados en
20 ml de caldo YPD (extracto de levadura 1%, peptona 2%, glucosa 2%) a una absorbancia inicial (600 nm) de 0.05. Los cultivos fueron incubados a 30 °C en agitación a 2000 RPM por 30 horas y según se indica en la figura 1, se colectaron las muestras M1 (medio + células), M2 (sólo células) y M3 (sólo sobrenadante). Además de la cepa tfiNEG Se usaron como controles a los transformantes de una cepa con genotipo W30311, que producían GST solo intracelularmente (plásmido pEGH)12.
En todos los casos se usó 250 µl de cada suspensión celular para la preparación de las muestras a analizar13. Para el caso de las muestras M2 (sedimento celular), después de su obtención se lavaron dos veces y luego se re-suspendieron con agua, para obtener un volumen final de 250 µl. A cada muestra se le agregó ácido tricloroacético (TCA) hasta alcanzar una concentración de 15%, se agitó y guardó a -20 °C por un día14. Pasado este tiempo, se centrifugó a 13500 RPM por 15 min, se desechó el sobrenadante, se hicieron tres lavados con etanol, dejando en cada lavado los tubos en la congeladora por 10 min antes de centrifugar. Después de eliminar el sobrenadante se dejó secar el sedimento a temperatura ambiente.
En caso de las muestras M1 y M2 que incluyen células y para asegurar su ruptura, los sedimentos fueron re-suspendidos en 40 µl de una solución conteniendo 1% SDS y 0.1N NaOH, y se agregó 15 µl del buffer de muestra concentrado (4X). Para la preparación de
20 ml de esta solución se mezclaron 8.0 ml de 1M Tris-HCl pH 6.8, 1.6 g de SDS, 8.0 ml de glicerol, 4.0 ml de β-mercaptoetanol, y 40 mg de azul de bromofenol). Las muestras M3 recibieron directamente 55 µl del buffer de muestra. Finalmente, todas las muestras fueron tratadas a 96 °C por 5 min. Para las separaciones electroforéticas (SDS-PAGE) se siguió un procedimiento similar al descrito por el Dr. Armando Yarlequé y colegas15,16.
Separación electroforética y detección de GST mediante Western blot
Se cargaron las muestras preparadas en un gel discontinuo de poliacrilamida-SDS para realizar la electroforesis (15x10 cm, gel de concentración 6%, gel de separación 12%). La electroforesis se llevó a cabo a voltaje constante (55V) por 10 horas. Las proteínas así separadas fueron transferidas a una membrana de nitrocelulosa usando un sistema líquido (buffer TGS conteniendo 20% etanol) a voltaje constante (20V, 12 horas). Para la preparación de 1 litro del buffer TGS, se requiere 14.4 g de glicina, 3.0 g de Tris base, y
0.5 g de SDS. Para comprobar si las transferencias de las proteínas fueron óptimas, las membranas de nitrocelulosa fueron sometidas a tinción de manera reversible con el kit “Memcode” (Thermo Scientific Pierce). Posteriormente, las membranas fueron bloqueadas por 30 min con una suspensión de leche en polvo descremada al 5% en buffer TBS-T 1X (20 mM Tris base, 0.8% NaCl, 0.1% (v/v)Tween 20, pH 7.6), luego se lavó brevemente con TBS-T 1X. La detección se realizó usando un anticuerpo monoclonal de ratón anti-GST (Novagen) diluido 1:5000 y un anticuerpo secundario de cabra conjugado a peroxidasa (1:1000), que reconoce inmunoglobulinas G (IgG) de ratón (ThermoFisher Pierce). Las soluciones de anticuerpos fueron preparadas en la suspensión de leche en polvo descremada al 5% en TBS-T 1X. Ambos tratamientos se realizaron a temperatura ambiente por una hora. Para la detección, se usó un kit de quimioluminiscencia (Pierce) y autoradiografía con 15 minutos de exposición. El revelado de los films de rayos X se realizó manualmente.
RESULTADOS Y DISCUSIÓN
La cepa tfiNEG fue usada para determinar las respectivas eficiencias de secreción, siendo transformada con los plásmidos pAlfa, pSint, pAlfaGST y pSintGST (tabla 1). Primero, se evaluaron los niveles de expresión y secreción logrados con el plásmido pSintGST, como se observa en la figura 2. De izquierda a derecha, los carriles 1 y 2 contienen las proteínas intracelulares y extracelulares, respectivamente, de un control con confirmada robusta expresión de GST basado en la cepa de genotipo W30311. Los carriles 3 y 4 contienen las proteínas totales (intracelulares y extracelulares) y sólo las proteínas intracelulares, respectivamente, del transformante tfiNEG que incluye el plásmido pSintGST. Se puede observar que el carril 3 muestra ligeramente mayor contenido de GST que el carril 4, como era de esperar ya que incluye la suma de proteínas totales. Finalmente, el carril 5 contiene sólo proteína extracelular.
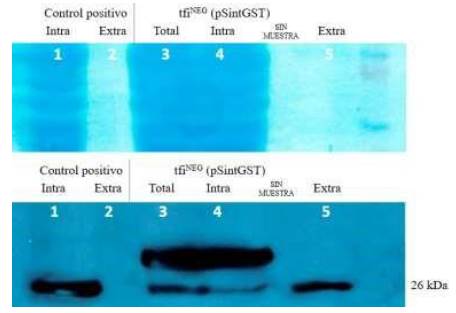
Figura 2 Análisis de los niveles de producción y secreción de GST usando el plásmido pSintGST en la cepa tfiNEG. El panel superior muestra a las proteínas teñidas en la membrana de nitrocelulosa, antes de proceder al tratamiento con los anticuerpos. El carril en el extremo derecho incluyó al marcador de tamaño de proteínas (Novex Sharp Pre-Stained Protein Standards, Invitrogen). El panel inferior muestra un resultado representativo del ensayo de Western blot con el anticuerpo anti-GST. El control positivo corresponde a una cepa que produce exclusivamente la forma intracelular de GST y por tanto, la fracción extracelular (línea 2) no presenta a ninguna banda. Asimismo, se puede verificar la presencia de versiones de mayor tamaño de GST solo en las fracciones total e intracelular (líneas 3 y 4). La línea 5 presenta solo una banda de 26 kDa que corresponde a la forma escindida de GST, sin el péptido señal sintético.
De la misma forma se evaluó la secreción utilizando el plásmido pAlfaGST en tfiNEG. En la figura 3, de izquierda a derecha, los carriles 1 y 2 contienen las proteínas intracelulares y extracelulares del control positivo (W303), respectivamente. La disposición de las muestras y su presentación es similar a la aplicada a los ensayos mostrados en la figura 2. En ambos casos, se pudo demostrar que en las fracciones totales e intracelulares se evidenciaban varias bandas que eran reconocidas por el anticuerpo anti-GST, incluyendo a la del tamaño esperado de 26 kDa. Como era esperado, además, por las características de los péptidos señal, se encontraron bandas de mayor tamaño correspondiente al precursor PS-alfa-GST (figura 3 carriles 3 y 4) que a los encontrados para el precursor PS-sintético-GST (figura 2 carriles 3 y 4). Sin embargo, en ambos casos, la proteína encontrada en la fracción extracelular correspondía casi exclusivamente a la proteína de 26 kDa, con el tamaño esperado después de la escisión del respectivo péptido señal.
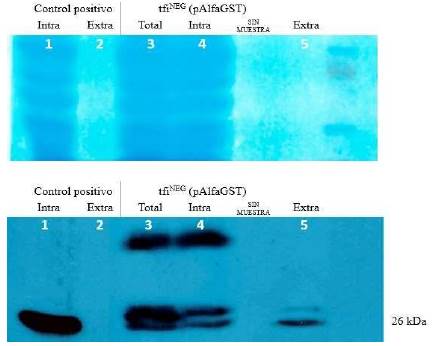
Figura 3 Análisis de los niveles de producción y secreción de GST usando el plásmido pAlfaGST en la cepa tfiNEG. El panel superior muestra a las proteínas teñidas en la membrana de nitrocelulosa, antes de proceder al tratamiento con los anticuerpos. El carril en el extremo derecho incluyó al marcador de tamaño de proteínas (Novex Sharp Pre-Stained Protein Standards, Invitrogen). El panel inferior muestra un resultado representativo del ensayo de Western blot con el anticuerpo anti-GST. El control positivo corresponde a una cepa que produce exclusivamente la forma intracelular de GST y por tanto, la fracción extracelular (línea 2) no presenta a ninguna banda. Asimismo, se puede verificar la presencia de versiones de mayor tamaño de GST solo en las fracciones total e intracelular (líneas 3 y 4). La línea 5 presenta solo una banda de 26 kDa que corresponde a la forma escindida de GST, sin el péptido señal alfa.
Para poder hacer una comparación de los resultados entre los diferentes transformantes, se corrieron las muestras correspondientes a los transformantes que incluyen los plásmidos pAlfaGST, pSintGST y pAlfa/pSint (controles negativos), en un mismo gel. En los paneles A y B de la figura 4, de izquierda a derecha, los carriles 1 y 2 contienen las proteínas intracelulares y extracelulares del control positivo (W303), respectivamente. Se observa claramente la banda esperada sólo en el carril 1, debido a que, para este control, se espera un contenido netamente intracelular. Los carriles 3 y 4 contienen las proteínas totales (intracelulares y extracelulares) y sólo las proteínas intracelulares, respectivamente, del transformante que incluye el plásmido pSintGST. El carril 5 contiene las proteínas intracelulares del transformante con pAlfaGST, y el carril 6 contiene las proteínas totales del transformante con el plásmido vacío pSint que, como era de esperarse, no evidencia expresión de GST.
En los paneles C y D de la figura 4 de izquierda a derecha, los carriles 1 y 2 contienen las proteínas intracelulares y extracelulares del control positivo (W303), respectivamente. Los carriles 3 y 4 contienen las proteínas totales (intracelulares y extracelulares) y sólo las proteínas intracelulares del transformante con pAlfaGST, respectivamente. El carril 5 contiene las proteínas intracelulares del transformante con pSintGST. Finalmente, el carril 6 contiene las proteínas totales del transformante con pAlfa que no evidencia expresión de GST. Estos resultados confirman los diferentes tamaños de las proteínas de fusión (PS-alfa-GST y PS-sintético-GST), además de la especificidad del anticuerpo anti- GST usado, evidenciado por la ausencia de bandas en los controles.
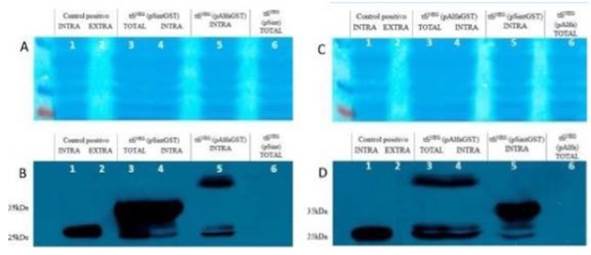
Figura 4 Resultados de los ensayos de Western Blot para el análisis de los niveles de producción y secreción de GST usando los plásmidos pAlfaGST y pSintGST en la cepa tfiNEG. El marcador de tamaño de proteínas empleado fue PageRuler Plus Prestained Protein Ladder (Fermentas). A. y C. Tinción de las proteínas transferidas en la membrana de nitrocelulosa. B. y D. Resultados representativos de los ensayos de Western blot con el anticuerpo Anti-GST.
CONCLUSIONES
Los ensayos de electroforesis y Western blot realizados demostraron que es posible lograr la secreción de la proteína glutatión S-transferasa (GST) usando tanto el péptido señal derivado del factor de apareamiento alfa (PS-alfa) como el péptido señal denotado como “sintético” (PS-sintético, derivado de las secuencias Yps1/Yap3/TA57). Ambos péptidos señal mostraron similares eficiencias de secreción.
Asimismo, los ensayos mostraron que la presencia de los PS-alfa y PS-sintético generan proteínas precursoras GST de diferentes tamaños durante su tráfico a través de la vía secretora, pero solo la forma procesada del tamaño esperado es la que logra ser secretada.