Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Scientia Agropecuaria
versión impresa ISSN 2077-9917
Scientia Agropecuaria vol.5 no.4 Trujillo 2014
http://dx.doi.org/10.17268/sci.agropecu.2014.04.04
ARTÍCULOS ORIGINALES
Influencia de la proporción agua de mar y bicarbonato en la producción de biomasa de Spirulina sp. con iluminación de diodo emisor de luz
Proportional influence of sea water and bicarbonate on the production of Spirulina sp. biomass with light-emitting diode lighting
Víctor Vasquez-Villalobos1,2*, Danny Vergaray1, Sandibel Suarez1, John Valladares1, Augusto Zamora1, Katia Gaspar1, Xiomara Escurra1
1 Universidad Privada Antenor Orrego - Escuela de Ingeniería en Industrias Alimentarias. Av. América Sur 3145 Monserrate. Trujillo, Perú.
2 Universidad Nacional de Trujillo - Facultad de Ciencias Agropecuarias - Departamento de Ciencias Agroindustriales. Av. Juan Pablo II s/n – Ciudad Universitaria. Trujillo, Perú.
Resumen
Se estudió la influencia de las variables proporción agua de mar (%) y concentración de bicarbonato en la producción de biomasa de Spirulina sp., utilizándose un Diseño Compuesto Central Rotacional (DCCR) para evaluar las regiones óptimas de producción de biomasa (ϕ), fase de adaptación (λ) velocidad específica de crecimiento (µ) y tiempo de generación (G), empleándose en cada ensayo el modelo matemático de Gompertz. Se obtuvo el mayor valor de biomasa (ϕ) log N/N0: 0,928 a las 168,8 horas en un medio de cultivo con pH de 8,8±0,1; a temperatura de 25ºC; con salinidad de 1,2% y 1,6 g/L de bicarbonato. El menor valor de ϕ fue de 0,45±0,01; obtenido coincidentemente en las repeticiones del punto central, utilizando una salinidad de 0,7% y 3,0g/L de bicarbonato en un medio con pH de 9,1±0,4 a 25ºC; lo que demuestra la importancia de la salinidad aportada por volumen de agua de mar en relación al bicarbonato, en la producción de biomasa de Spirulina. La iluminación fue de 2,7±1,2 klx, proporcionada por un Diodo Emisor de Luz Blanca (DELB) por 12 horas continuas y con una inyección de 0,86±0,09 L/s de aire por fotobiorreactor de 200 mL de capacidad. Solamente los valores de ϕ se ajustaron adecuadamente a la Superficie de Respuesta con un R2 de 0,99 para un modelo matemático cuadrático y p < 0,05, con un error absoluto medio de 2,4%.
Palabras clave: Spirulina sp., agua de mar, Diodo Emisor de Luz Blanca, bicarbonato, modelo de Gompertz.
Abstract
The study focused on the influence of the variables seawater proportion (%) and bicarbonate concentration on Spirulina sp. biomass production, using a Central Composite Rotational Design (CCRD) to evaluate the optimal regions of biomass production (ϕ), adaptation phase (λ), specific growth rate (µ) and generation time (G), using for each treatment the Gompertz mathematical model. The highest values of biomass (ϕ) log N/N0: 0.93 were obtained at 168.8 hours; in a culture medium with pH 8.8±0.1; at a temperature of 25°C; with salinity of 1.2% and 1.6 gL of bicarbonate. The lowest value of ϕ was 0.45±0.01; coincidentally obtained in repetitions of the central point, using a salinity of 0.7% and 3.0g/L of bicarbonate; in a medium with pH 9.1±0.4 to 25°C; which shows the importance of salinity provided by the volume of seawater relative to bicarbonate, in the production of Spirulina biomass. The lighting was 2.7±1.2 klx, provided by a White Light-Emitting Diode (WLED) during 12 continuous hours and an air injection of 0.86±0.09 L/s by a photo bioreactor with a 200 mL capacity. Only the values of ϕ, adjusted properly to the Response Surface with an R2 of 0.99 for a quadratic mathematical model and p < 0.05 with a 2.4% average absolute error.
Keywords: Spirulina sp., sea water, White Light-Emitting Diode, bicarbonate, Gompertz model.
1. Introducción
La Arthrospira (Spirulina) platensis es una cianobacteria filamentosa, multicelular que puede colonizar ambientes, que para otros microorganismos no son adecuados. Habita en cuerpos de agua alcalinos y algunos entornos marinos (Vonshak, 1997). La Spirulina es conocida por ser rica en proteína altamente digestible, posee productos de gran importancia como las ficobiliproteínas (ficocianina y aloficocianina), aminoácidos esenciales, minerales, vitaminas, (carotenoides, β-caroteno, provitamina A, B12 y otras vitaminas del grupo B) y ácidos grasos poliinsaturados (PUFAs: polyunsaturated fatty acids) (Belay, 2002).
Específicamente, es una de las pocas fuentes de ácido γ-linolénico, conocido por disminuir la acción de los triglicéridos en el suero y lipoproteínas de baja densidad, poseen efecto antiinflamatorio y acción inmuno regulatorias del potencial aterogénico que favorece la biosíntesis de la prostaglandina macrófaga serie-1 (Dawczynski et al., 2011; Fan y Chapkin, 1998, Kay y Barton, 1991; Ono y Cuello, 2004). Pequeñas cantidades de suplemento de Spirulina ayudan al sistema inmune de los componentes humoral y celular (Qureshi y Ali, 1996; Qureshi et al., 1996).
Por esta razón la Spirulina es muy estudiada y su producción comercial se enfoca en la alimentación humana, animal y productos farmacéuticos. La Spirulina crece naturalmente en condiciones alcalinas con alta salinidad y es obtenida comercialmente en medios líquidos con energía lumínica, aire y suplementación mineral (Mahajan y Kamat, 1995).
Asimismo requiere relativamente de valores altos de pH entre 9,5 y 9,8 (Belkin y Boussiba, 1971), lo que inhibe eficazmente la contaminación de la mayoría de cultivos algales. En el cultivo de Spirulina se ha usado agua con alto nivel de carbonatos con altos valores de pH, provenientes de ríos a efectos de reducir los costos de producción (Vieira et al., 2004). Históricamente personas que vivían cerca al lago Chad en África y los Aztecas al lago Texcoco en Méjico, han utilizado S. platensis extraídas de estas aguas como alimento, después de haberlas secado (Singh, 1998; Estrada et al., 2001).
Madkour et al. (2012) reportan el empleo de bicarbonato (NaHCO3) en una concentración de 16,8 g/L como fuente de carbono en el medio Zarrouk, manteniendo la misma proporción en un medio de costo reducido aplicando bicarbonato grado comercial. La Spirulina ha ganado considerable atención como fuente de nutracéuticos (Belay et al., 1993). Entre los cuales, los pigmentos como la ficocianina, presenta interés comercial debido a sus aplicaciones y procedimientos de extracción relativamente fácil. Pigmentos a partir de microalgas que actualmente gozan de alta demanda son las ficobiliproteínas, β-caroteno y luteína. β-caroteno producidos a partir de microalgas tiene un costo de 1000 US$/kg, comparado con 500 US$/kg para su equivalente sintético, siendo el β-caroteno preferido en el mercado de la salud debido a su mezcla de isómeros cis y trans, con propiedades anticancerígenas; mientras que el isómero cis, raramente se expresa en un producto sintético (Downham y Collins, 2000). Las ficobiliproteínas son únicas no sólo debido a su presencia exclusiva en cianobacterias, sino también debido a su amplia gama de aplicaciones comerciales (Moreno et al., 1995). Debido a sus propiedades espectroscópicas distintivas y a su naturaleza no tóxica, han encontrado aplicaciones adicionales en investigaciones biomédicas, alimentos, medicamentos e industria cosmética; reemplazando los pigmentos sintéticos tóxicos (Cohen, 1986; Glazer, 1994). Estudios in vitro e in vivo en ratas y ratones han demostrado que la Spirulina proporciona cierta actividad antioxidante (Deng y Chow, 2010). La ficocianina contribuye casi 30% de la biomasa (Garnier y Thomas, 1993). Sin embargo, las condiciones de cultivo, determinan el contenido real de estos pigmentos en la célula (Márquez-Rocha et al., 1995). Producción de Spirulina con costes reducidos, es necesaria cuando se considera el cultivo a gran escala para fines industriales. El costo de los nutrientes, es considerado el segundo principal factor que influye en el costo de producción de biomasa de Spirulina después de la mano de obra (Vonshak, 1997). Medio de Zarrouk ha servido con éxito como medio estándar (ME) para el cultivo de Spirulina durante muchos años (Zarrouk, 1966). En consecuencia, muchos medios han sido desarrollados utilizando agua de mar (Faucher et al., 1979), aguas servidas (Saxena et al., 1982) y efluentes industriales (Tanticharoen et al., 1993). La Spirulina se cultiva mayormente utilizando medios químicamente definidos (Belay y Ota, 1994). Una parte significativa de los costos de producción es atribuida por estos productos químicos. Por lo que la alternativa del uso de medios de bajo costos como agua de mar, contribuye a hacerla más competitiva para la producción de productos de valor agregado. El desarrollo de los cultivos de Spirulina en agua de mar, es inevitable para propagar cultivos al aire libre de esta cianobacteria en muchas zonas áridas tropicales, donde las condiciones climáticas son favorables, pero el agua dulce es escasa (Materassi et al., 1984). Se han reportado pocos trabajos de investigación sobre el uso de agua de mar como un medio alternativo, después de un pretratamiento (Faucher et al., 1979) o suplementación con un bajo nivel de nutrientes específicos en condiciones de laboratorio (Materassi et al., 1984) o en piletas al aire libre (Tredici et al., 1986; Wu et al., 1993). Sin embargo, varios aspectos fisiológicos relacionados con la aclimatación, tolerancia al stress, producción de pigmentos y crecimiento en agua de mar, ha sido considerado desconocido (Materassi et al., 1984). Por lo que el uso de un medio conveniente con agua de mar, es un pre-requisito esencial para el desarrollo de sistemas de producción en masa. En este sentido Lemma et al. (2010) evaluaron la idoneidad de tres distintas composiciones de los medios de cultivo con agua de mar, en el crecimiento y producción de pigmentos a partir de A. platensis. De acuerdo a lo sostenido por Blanken et al. (2013) el uso de la luz solar es libre y abundante. Sin embargo la desventaja es que incluye ciclos de día y noche, así como cambios por las condiciones estacionales.
Estas fluctuaciones en la irradiación pueden prevenirse mediante la aplicación de iluminación artificial, la cual no sólo podría aumentar la productividad, sino también los costos asociados en el cultivo de microalgas. Este aumento de coste es reconocido, pero faltaba aún una evaluación cuantitativa detallada. Los investigadores mencionados, evaluaron teóricamente los costos y el balance de energía, relacionados al cultivo de microalgas empleando luz artificial.
Calcularon que la aplicación de la luz artificial aumenta los costos de producción por 25,3 $/kilogramo de peso seco de biomasa. A partir de estos cálculos, se determinó que de 4% a 6% de la energía de alimentación eléctrica está fijado como energía química en la biomasa de microalgas. Pérdida de energía y el incremento del costo de producción pueden ser aceptables en la producción de productos de alto valor, pero en general debe evitarse. Programas de cultivo de microalgas por lo tanto, deben centrarse en el empleo de la luz del sol. En este sentido el requerimiento de luz es uno de los más importantes parámetros a abordar; la cual debe ser proveída con adecuada intensidad, duración y longitud de onda. Intensidad excesiva puede conducir a fotooxidación e inhibición, mientras que bajos niveles de luz limitan su crecimiento. La restricción de saturación de luz puede ser superada mediante cualquiera de los dos enfoques: incrementar la eficiencia fotosintética por ingeniería genética, dirigida a cambiar el tamaño de antena clorofílica; o incrementar la tolerancia al flujo, adaptando el espectro fotónico, junto con su intensidad y características temporales (Carvalho et al., 2011). Los diodos emisores de luz (LED: Light Emitting Diodes) son semiconductores, que al conectarse los electrones se recombinan dentro del dispositivo, liberando energía en forma de fotones, produciendo una intensidad bastante alta 14,7-55,5 W/m2, comparada con los principales tipos de emisores de luz artificial (bulbos incandescentes, lámparas halógenas, lámparas fluorescentes, lámparas fluorescentes Gro-Lux), con la más baja energía en la región de 400-500 nm de longitud de onda de 0,04% a 0,08%; la más alta energía de emisión en la región de 600 a 700 nm de 87,6% a 98,3%, con una muy baja interconversión de energía en calor (por debajo de 10%). Hay que precisar que la luz visible tiene una longitud de onda de 400 a 750 nm (Carvalho et al., 2011). Se han empleado LED con diferentes longitudes de onda de luz e intensidades de iluminación para explorar los efectos de la fuente de luz en cultivos fotoautotróficos de cultivo de Spirulina platensis. De los resultados experimentales, se ha encontrado que los LED rojos exhiben la mayor tasa de crecimiento específico de 0,40 (días-1) bajo la condición de 3000 μmolm-2s-1. LED azules han mostrado la menor eficiencia en la conversión de fotones a biomasa, probablemente debido a la ausencia de bandas de absorción de la clorofila en las longitudes de onda de este última. Al comparar la eficiencia económica de energía de biomasa, la utilización de LED rojos han proporcionado el rendimiento más efectivo para los cultivos fotoautotróficos (Wang et al., 2007). Dentro de este panorama, en la presente investigación se evaluó la proporción agua de mar y bicarbonato en la producción de biomasa de Spirulina sp. empleando iluminación LED.
2. Materiales y métodos
Materiales y equipos
Medio de cultivo: K2HPO4 (0,07 g/L), FeSO4 (0,005 g/L), NaNO3 (0,1 g/L), KNO3 (0,1 g/L), NaHCO3 en las concentraciones de 1 a 5 g/L, agua de mar para una salinidad en los rangos de 0,1 a 1,3%; la cual se obtuvo de la playa del Distrito de Salaverry, Provincia de Trujillo, Región la Libertad (8º1321,26" S, 78º5854,17"O) a una profundidad de aproximadamente 0,30 m con una densidad de 1,0248 g/mL determinada con picnómetro (Simax Czechoslovakia 50 cm3) a una temperatura de 20ºC y con una salinidad estimada de 35 g/kg (3,5%). Tramitancia a 460nm de 97,4% y conductividad eléctrica de 47,9 mS/cm a 20ºC. Cepa de Spirulina sp. adquirida de la Universidad Alas Peruanas Filial Arequipa, mantenida en ME Zarrouk. Once (11) fotobiorreactores de vidrio de 300 mL de capacidad, con 200 mL de medio de cultivo como máxima capacidad de operación. Compresor de aire automático de 1,5 HP presión máxima 116 psi con tanque de almacenamiento de 6 L, fotómetro AEMC Instruments Modelo CA813, luminaria LED Philips de 10W-57mA 220-240V/50-60 Hz de color blanco que suministraron a los biorreactores 2,7±1,2 klx, interruptor horario para el control del tiempo de iluminación, microscopio óptico 40X Leica mod CME, cámara Neubauer, balanza analítica Ohaus Explorer Pro Modelo EP214c, autoclave eléctrica vertical Industrias Hospitalarias S.A.C. 220V-2500W, pH metro Mettler Toledo con electrodo inlab 43, Software Statistica 7,0 y Excel 2010.
Metodología
Para la determinación de la influencia de la concentración de agua de mar y bicarbonato (dos variables) en la producción de biomasa de Spirulina sp. con iluminación de diodos emisores de luz (LED) se utilizó un Diseño Compuesto Central Rotacional (DCCR) con dos (2) niveles 22 + 2*2 puntos axiales + 3 puntos centrales, obteniéndose nueve (9) tratamientos experimentales y tres (3) repeticiones, para delimitar la Superficie de Respuesta. La optimización de las variables que intervienen en el análisis de la cinética de crecimiento de la Spirulina sp., se determinaron utilizando el modelo de matemático de Gompertz. Para la aplicación del DCCR se empleó un valor α= 2n/4= 22/4=1,4142. En la Tabla 1 se detallan los valores.
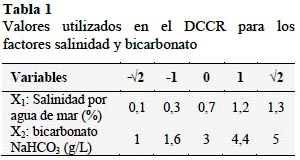
Para la formulación del medio de cultivo se tuvo en cuenta lo reportado por Ayala et al. (1985) de acuerdo: NaHCO3: 3,0 g/L, K2HPO4: 0,07 g/L, FeSO4: 0,005 g/L, salitre constituido por: NaNO3: 0,1 g/L, KNO3: 0,1 g/L, sal cruda de mar: 9,1 g/L (0,91%). Variándose los valores de bicarbonato de sodio (NaHCO3) de 1 a 5 g/L y reemplazando la sal cruda de mar, por dosificación agua de mar para obtener una salinidad en el medio de 0,1% a 1,3%. El resto de reactivos K2HPO4, FeSO4, NaNO3, KNO3, se mantuvieron constantes en sus concentraciones; los que se adicionaron como un patrón en una cantidad de 10 mL a todos los fotobiorreactores, asimismo se adicionó un mismo volumen de inoculo (10 mL con un promedio de 31427±1,38x104 células/mL), completándose con agua de mar y agua potable previamente purificada con ozono hasta completar 200 mL de capacidad de operación. Con los valores determinados en la Tabla 1, se elaboró la matriz para el desarrollo de los once (11) ensayos, donde las variables respuesta fueron los parámetros cinéticos de crecimiento: biomasa ϕ: log N/N0 (donde N es número de células en el biorreactor a un tiempo determinado y N0 es número de células al inicio del experimento), fase de adaptación (λ: horas), velocidad específica de crecimiento (µmax: horas-1) y tiempo de generación (G: horas). La cuantificación de las células de Spirulina se realizó empleando cámara Neubauer (1/10 mm deep, brigth line-Boeco, Germany) cuyos datos se introdujeron al modelo matemático de Gompertz (YA= ϕ*exp(-exp(b-c*TA)), donde YA es el log (N/N0) y TA es el tiempo en horas. Las constantes (ϕ), (b), (c) se determinaron con el empleo del software Statistica 7.0; los que permitieron calcular los valores de λ=(b-1)/c; µmax= ϕ.c; G=ln(2)/µmax. Los cultivos se mantuvieron agitados en los fotobiorreactores por dosificación de aire proveniente de la compresora (caudal promedio: 0,86±0,09 L/s), la cual fue distribuida a cada uno por mangueras de la misma longitud (0,60 m) desde el recipiente distribuidor de aire, en el cual asimismo se burbujeo el aire a través de una solución de NaCl al 5% para evitar la contaminación del cultivo. Cada fotobiorreactor conto con un ducto de salida del aire (Figura 1).
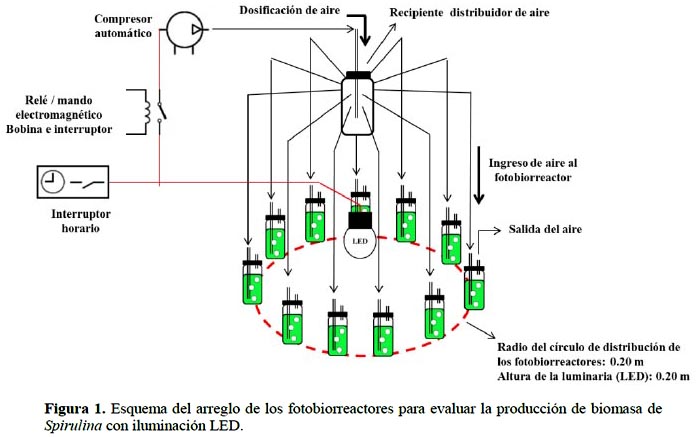
La iluminación fue proporcionada por una luminaria LED con un valor de 2,7±1,2 klx medida en la boca del fotobiorreactor y 7,2±0,1 klx medida en el punto central del círculo, la cual fue de 12 horas intercalada con 12 horas de oscuridad, controlada con un interruptor horario, extensivo al mando electromecánico del compresor por acción de una bobina, la que mantuvo la operación del compresor durante las horas de iluminación, evitando su recalentamiento. Asimismo el compresor actuó independientemente de manera automática manteniendo el caudal de aire.
3. Resultados y discusión
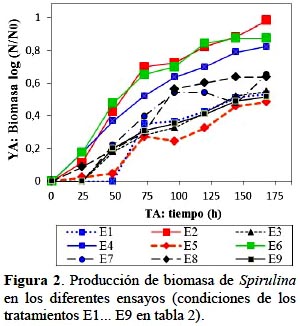
En la Figura 2 se observa la producción de biomasa de Spirulina sometida a los diferentes ensayos. Se denota que con en los ensayos E2, E4, E6 se obtienen mayores valores de biomasa (log N/N0) a las168,8 horas, los que fueron 0,928; 0,840; 0,879 respectivamente (84723, 34592, 37842 células/mL), cuyos medios de cultivo tuvieron la porcentajes más elevados de salinidad entre 1,2% y 1,3%. La presencia de bicarbonato para estos tratamientos estuvo entre los rangos de 1,6 a 4,4 g/L. Los valores más bajos de producción de biomasa se dieron con las repeticiones E9, E10, E11; coincidentemente en el punto central. Çelekli y Yavuzatmaca (2009) estudiaron el efecto de la variación de nitrato (2,0; 2,5; 3,0 g/L de NaNO3) y sal (0,5; 1,5; 2,0 g/L de NaCl) en el medio Schlösser (Schlösser, 1982) en la producción de Spirulina platensis. Observaron una alta producción de biomasa (3,495 mg/L) y clorofila (29,92 mg/L) (p < 0,001) a concentraciones de 2,5 y 1,5 g/L de NaNO3 y NaCl respectivamente.
Utilizaron para predecir la biomasa los modelos modificados de Richards, Schnute, Logístico y de Gompertz (con valores de r2 > 0,96 y suma del cuadrado de los residuos RSS ≥ 0,003), habiendo determinado que, los modelos se ajustaron bien a los datos del experimento; decidiéndose por utilizar el modelo Logístico Modificado con respecto al modelo de Gompertz, por su valor bajo de RSS y valor en la prueba F.
Sin embargo consideran que, esto no es determinante. Al respecto Zwietering et al. (1990) en el modelamiento de crecimiento de bacterias, así como Bozkurt y Erkmen (2001) en el modelamiento de crecimiento de la enterobacteria Yersina enterocolitica en queso; encontraron que el modelo de Gompertz mostró mejor ajuste que el modelo Logístico. Asimismo Vásquez-Villalobos et al. (2013) reportaron en Spirulina mejor desempeño con el modelo corregido de Gompertz, comparados con los modelos Logístico y con el de Redes Neuronales Artificiales (RNA). Mano-Pappu et al. (2013) utilizaron regresión lineal múltiple (RLM) y RNA para predecir el crecimiento de Spirulina en cultivos al aire libre a partir de la concentración de biomasa, concentración de nitrato, pH, concentración de oxígeno disuelto en el líquido, intensidad de luz y días de cultivo, medido una vez al día. Para este caso el modelo de RNA mostró un error ligeramente más pequeño que el de RLM.
Por otro lado Çelekli y Yavuzatmaca (2009) reportan para la Spirulina platensis valores de 1,29 a 17,45 g/L de valor asintótico de la biomasa, el cual es muy importante para propósitos de biotecnología, con tasa de crecimiento (µ) de 0,004 a 0,034 h-1 y un tiempo lag (λ) de 0,012 a 5,85 h. En la presente investigación se utilizó el modelo modificado de Gompertz en el cual el valor asintótico (ϕ) se estimó como recuento de células, cuyo valor fue calculado como logaritmo del número de células a un tiempo determinado referido al número de células iniciales [log (N/N0)], obteniendo siempre al inicio un valor de cero, lo que sirve para comparar adecuadamente los diferentes ensayos. La tasa de crecimiento o velocidad específica (µ) varió de 0,011 a 0,037 h-1 y el tiempo de adaptación (λ) vario desde 7,1 a 48,3 h.
Çelekli y Yavuzatmaca (2009) sostienen que esto es consecuencia que las especies tienen diferentes respuestas a diferentes condiciones medioambientales. Ellos aportaron en el medio Schlösser 13,61 g/L de NaHCO3 y 4,03 g/L de Na2CO3. En la presente investigación llevada a cabo empleando agua de mar, se incorporó directamente cantidades bajas de NaNO3 (0,1 g/L) y KNO3 (0,1 g/L) comparado con las utilizadas por Çelekli y Yavuzatmaca (2009). La dosificación de NaHCO3 llego hasta valores de 5,0 g/L, valor inferior a los utilizados por los investigadores mencionados. De acuerdo a Watson (1988) el agua de mar posee un pH entre 7,5 a 8,5, sus principales componentes del agua de mar son 1,898% de Cl-, 0,2649% de SO4-, 0,014% de HCO3-, 1,0556% de Na-, 0,1272% de Mg++, 0,038% de K+ y 0,0523% de otros elementos que aportan a la salinidad total de 3,45%. Observándose que el Cl- y el Na- son los componentes más importantes; el aporte de bicarbonato es muy bajo. El contenido de fósforo es de 0,07 ppm, nitrógeno 0,5 ppm, asimismo el agua de mar posee una serie de elementos traza como el litio, iodo, etc. Leema et al. (2010) evaluaron las perspectivas de utilizar agua de mar pretratada para el cultivo de Arthrospira (Spirulina) platensis en condiciones de laboratorio, utilizando un medio control y tres medios con agua de mar de acuerdo a: (1) control: ME Zarrouk (agua dulce); (2) medio SW1 con agua de mar sin diluir; (3) medio SW2 con 2 partes de agua de mar: 1 parte de agua fresca, v/v; (4) medio SW3 con 1 parte de agua de mar: 2 partes de agua fresca. El rendimiento relativo de estos medios fueron investigados con respecto a su producción de biomasa, producción de pigmentos (ficocianina, luteína y β-caroteno) y composición química. A. platensis cultivada en medio SW2 (salinidad estimada de 2,33%) tuvo una producción de biomasa (2,99±0,145 g/L) comparable a la del medio de control (3,114±0,085 g/L); mayor tasa de crecimiento específico (0,255 d-1) y menor tiempo de doblaje de masa (2,72 días). El contenido de ficocianina de las células cultivadas en los medios de cultivo con agua de mar SW3 (salinidad estimada de 1,17%) fue más cercana a la de control. El contenido de luteína de A. platensis en las células cultivadas en medios del agua de mar SW2, fue mayor que el de control. Los tres medios basados en agua de mar con menos productos químicos que el control (ME Zarrouk), tuvieron un crecimiento de A. platensis tan bueno como el medio control. Esto confirma que una salinidad elevada proveniente de un mayor volumen de agua de mar en el medio, promueve la producción de biomasa. Según los mismos investigadores (Leema et al., 2010) las células cultivadas en medios del agua de mar tuvieron una composición bioquímica ligeramente modificada con respecto al medio control, con alto contenido de carbohidratos y bajo contenido proteico. Yilmatz et al. (2010) investigaron los efectos de diferentes tasas de salinidad (1,0%; 2,0%; 3,0%) en la composición de grasa y ácidos grasos de Spirulina platensis, los resultados mostraron que los valores de lípidos incrementaron con la salinidad.
Con 3,0% de salinidad el nivel de lípidos fue el más alto de 9,4%. Por otro lado Madkour et al. (2012) dentro de una concepción de producción con rentabilidad a gran escala, propusieron un medio para Spirulina platensis, reemplazando todos los nutrientes que normalmente se utiliza en el laboratorio y que constituye el ME Zarrouk, por productos químicos y fertilizantes comerciales de bajo costo y disponibles localmente. El medio comercial utilizado contenía superfosfato simple (SPS) [Ca(H2PO4)2.H2O]: 1,25 g/L, solución comercial de bicarbonato de sodio [NaHCO3]: 16,8 g/L, cloruro de potasio grado agrícola (MOP): 0,898 g/L y sal cruda de mar: 1 g/L (0,1%). Como fuente de nitrógeno utilizaron indistintamente nitrato de amonio [NH4NO3], entre 0,118 a 0,471 g/L o úrea [CO(NH2)2] entre 0,088 a 0,353 g/L. La S. platensis cultivada en estos medios se comparó con la cultivada con ME. Los resultados revelaron que S. platensis, puede utilizar nitrato de amonio más eficientemente con una producción máxima de biomasa a una concentración de 0,353 g/L. Incrementos adicionales limitan el crecimiento. La máxima producción de biomasa, clorofila y la proteína fue de 0,813±0,018 mg/L, 0,0685±0,0024 µg/L y 52,62%, respectivamente; comparado con el ME que fue de 0,840±0,008 mg/L, 0,0701±0,0089 µg/L y 52,95%, respectivamente. Los resultados indicaron que el medio comercial puede utilizarse provechosamente para producción en masa a gran escala rica en proteína de Spirulina y rendimiento de producción similar al obtenido con ME. Al respecto el medio tuvo aporte de fosfato, nitrógeno y una concentración de sal cruda de mar de 0,1% (1 g/L), valor inferior al utilizado en la presente investigación que utilizó concentraciones de sal de 1,2% a 1,3%, que es donde se obtuvieron los mayores valores de biomasa. Los cultivos de Spirulina se desarrollaron a una temperatura constante de 25 ºC y a valores de pH alcalino entre 8,8±0,1 a 9,1±0,4 (Tabla 2). Ogbonda et al. (2007) reportan que la combinación de 30ºC y pH 9,0 permiten obtener la mayor producción de biomasa de Spirulina sp. Como es de observar el pH se encuentra dentro de lo deseado, pero la temperatura es relativamente baja con respecto a lo deseado, lo que va influir en crecimiento. El valor de la iluminación promedio proveniente de un Diodo Emisor de Luz Blanca DELB fue de 2,7 klx y un promedio de flujo de aire de 0,86±0,09 L/s en cada fotobiorreactor. Los valores menores de tiempo de adaptación (λ) se dieron con el E4 y E6 (4,6 y 7,1 h respectivamente), con altos valores de salinidad (1,2% y 1,3% respectivamente) y elevados valores de bicarbonato dentro del planeamiento del presente experimento (4,4 y 3,0 g/L respectivamente).
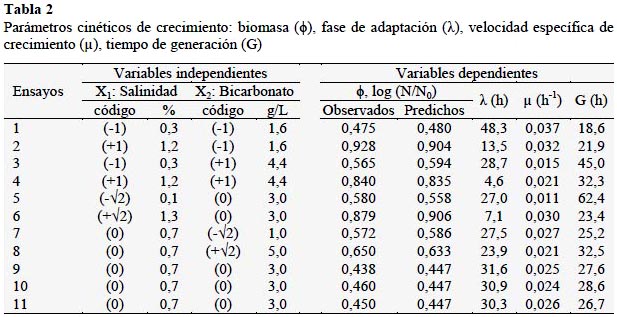
El mayor tiempo de adaptación se dio en el E1 con un bajo valor de salinidad (48,3 h) y valor de bicarbonato (1,6 g/L). Asimismo este tratamiento proporcionó la mayor velocidad específica de crecimiento (µ) de 0,037 h-1. Los ensayos E2, E4, E6 denotan también un valor elevado de velocidad específica de crecimiento de 0,032; 0,021; 0,030 h-1 respectivamente. Los coeficientes de correlación de ajuste al modelo de Gompertz de los ocho (8) ensayos de E1 a E8 fueron adecuados con valores entre de 0,97 a 0,99 y en el punto central las tres repeticiones (E9, E10, E11) entre 0,89 a 0,96. De acuerdo a las investigaciones de Leema et al. (2010) la presencia de agua de mar favorece la adaptación de la Spirulina con una mayor producción de biomasa, efecto que podría estar ligado al tipo de iluminación que en este caso ha sido con luz LED.
Los valores de población máxima de biomasa (ϕ) de los 11 ensayos fueron ajustados adecuadamente con un coeficiente de determinación (R2) de 0,99; alto valor de significancia estadística (p = 0,0028 < 0,05) y un bajo error absoluto medio (%) de 2,4 (Tabla 3), lo que permitió establecer el siguiente modelo matemático cuadrático:
ϕ
= 0,810535 - 0,601226(S%) + 0,791674(S%)2 - 0,181394(B) + 0,040649(B)2 - 0,072543(S%)(B)Donde ϕ es la población máxima de Spirulina, S% la salinidad (%) y B la concentración de bicarbonato (g/L).
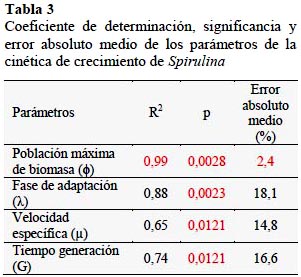
El ajuste de la Superficie de Respuesta para la fase de adaptación (λ) velocidad específica de crecimiento (µ) y tiempo de generación (G), mediante el coeficiente de determinación (R2) mostraron valores menores a 0,88 y errores absolutos medios elevados y mayores a 14,8%, a pesar de su significancia estadística menor a 0,05.
El gráfico de contornos de la Superficie de Respuesta para el valor máximo de la biomasa (ϕ) se muestra en la Figura 3, observándose que elevados valores de salinidad promueven una mayor producción de biomasa de Spirulina, donde la concentración de bicarbonato es baja. Trabajos futuros deben dilucidar el punto de inflexión de la salinidad obtenida por suplementación con agua de mar. En este sentido según las investigaciones de Leema et al. (2010) un cultivo de Spirulina realizado enteramente con agua de mar, no promueve la máxima producción de biomasa. Pero si existe una coincidencia con la concepción de Materassi et al. (1984), que el desarrollo de los cultivos de Spirulina en agua de mar, es inevitable para propagar cultivos al aire libre en muchas zonas áridas tropicales; donde las condiciones climáticas son favorables pero el agua dulce es escasa, como lo es nuestro caso en la costa del Perú.
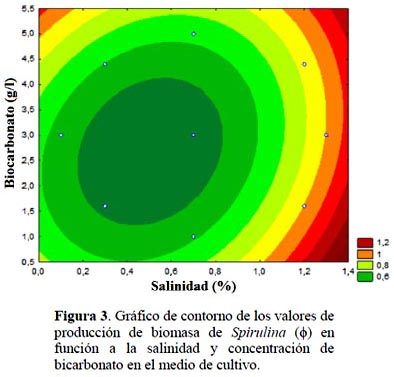
De acuerdo al gráfico de contorno, se realizó una experiencia por triplicado fuera de la frontera del dominio, utilizando un valor de salinidad de 1,35% mayor que el experimental y un concentración de bicarbonato de 0,8 g/L, menor que el utilizado en el desarrollo de los experimentos. Se obtuvo un valor promedio de biomasa (ϕ) log (N/N0) de: 0,902±0,037, λ=13,1 h, µ=0,013 h-1. El desarrollo de su cinética de crecimiento modelado con Gompertz se observa en la Figura 4 con un coeficiente de ajuste (R) de 0,98. Comparando el valor de biomasa con el ensayo E2 en donde se obtuvo el mayor valor de biomasa (ϕ) de 0,928, λ=13,5 h, µ=0,032 h-1 (Tabla 2), la diferencia en la producción de biomasa (ϕ) fue de 3%.
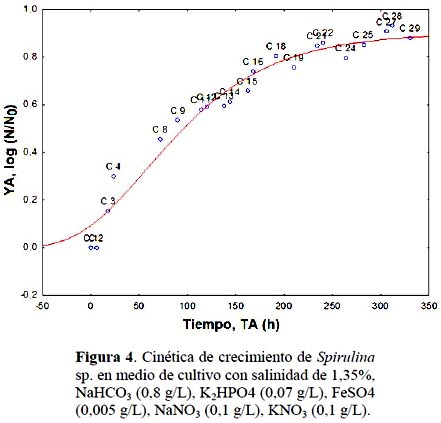
Habiéndose utilizado como se ha mencionado 1,3% de salinidad y doble concentración de bicarbonato (1,6 g/L), lo denota la importancia de la salinidad en el medio de cultivo aportada por el agua de mar, permitiendo disminuir la concentración de bicarbonato.
4. Conclusiones
Se obtuvieron los mayores valores de biomasa (ϕ: log N/N0) de Spirulina sp. a las168,8 horas, de 0,928; 0,840; 0,879 en medios de cultivo con las proporciones más elevadas de salinidad entre 1,2% y 1,3% aportadas por el agua de mar y valores de bicarbonato de 1,6; 4,4 y 3,0 g/L respectivamente. Con una iluminación promedio proveniente de un diodo de emisor de luz blanca DELB de 2,7±1,2 klx y un promedio de flujo de aire de 0,86±0,09 L/s para cada fotobiorreactor, con valores de pH entre 8,8±0,1 a 8,9±0,2 a 25ºC.
Los valores más bajos de biomasa de la Spirulina sp. de 0,45±0,01se obtuvieron en los medios de cultivos con 0,7% de salinidad y 3,0 g/L de bicarbonato con pH de 9,1±0,4; coincidentemente en las repeticiones del punto central.
Los valores de población máxima de biomasa (ϕ: log N/N0) de los nueve (9) ensayos fueron ajustados adecuadamente a la Superficie de Respuesta con un R2 de 0,99; con un bajo nivel de dispersión entre los valores observados y predichos, alto valor de significancia estadística (p = 0,0028 < 0,05) y un bajo error absoluto medio de 2,4% para un modelo matemático cuadrático.
4. Referencias bibliográficas
Ayala, F.; Díaz, M. E.; Bravo, R. 1985. Microalgae in saltwater media. Arch. Hydrobiol. Beih. Ergeb. Limnol. 20: 53-61. [ Links ]
Belay, A.; Ota, Y.; Miyakawa, K.; Shimamatsu, H. 1993. Current knowledge on potential health benefits of Spirulina. J. Appl. Phycol. 5: 235-241. [ Links ]
Belay, A.; Ota, Y.; 1994. Production of high quality Spirulina at earthrise farms. In: Phang, S.M., Borowitzka, M.A., Whitton, B. (Eds.), Algal Biotechnology in the Asia-Pacific region. University of Malaya, Kuala Lumpur. [ Links ]
Belay, A.M. 2002. The potential application of Spirulina (Arthrospira) as a nutritional and therapeutic supplement in health management. The Journal of the American Nutraceutical Association 5: 27-49. [ Links ]
Belkin, S.; Boussiba, S. 1971. Resistance of Spirulina platensis (Cyanophyta) to high pH values. Plant Cell Physiology 32: 953-958. [ Links ]
Blanken, W.; Cuaresma, C.; Wijffels, R.H.; Janssena, M. 2013. Cultivation of microalgae on artificial light comes at a cost. Algal Research 2: 333-340. [ Links ]
Bozkurt, H.; Erkmen, O. 2001. Predictive modeling of Yersina enterocolitica in Turkish Feta cheese during storage. J. Food Eng. 47: 81-87. [ Links ]
Carvalho, A.O.; Silva, S.O.; Baptista, J.M. 2011. Light requirements in microalgal photobioreactors: an overview of biophotonic aspects. Appl Microbiol. Biotechnol. 89:1275-1288. [ Links ]
Çelekli. A.; Yavuzatmaca, M. 2009. Predictive modeling of biomass production by Spirulina platensis as function of nitrate and NaCl concentrations. Bioresource Technology 100: 1847-1851. [ Links ]
Cohen, Z. 1986. Products from microalgae. In: Richmond, A. (Ed.), CRC Handbook of Microalgal Mass Culture. CRC Press, Boca Raton, Florida. [ Links ]
Dawczynski, C.; Hackermeier, U.; Viehweger, M.; Stange, R.; Springer, M.; Jahreis, G. 2011. Incorporation of n−3 PUFA and γ-linolenic acid in blood lipids and red blood cell lipids together with their influence on disease activity in patients with chronic inflammatory arthritis - a randomized controlled human intervention trial. Lipids in Health and Disease 10: 1-12. [ Links ]
Deng, R.; Chow, T.J. 2010. Hypolipidemic, antioxidant, and antiinflammatory activities of microalgae Spirulina. Cardiovascular Therapeutics 28: e33-e45. [ Links ]
Downham, A.; Collins, P. 2000. Coloring our foods in the last and next millennium. Int. J. Food Sci. Technol. 35: 5-22. [ Links ]
Estrada, J.E.; Bescós, P.; Villar del Fresno, A.M. 2001. Antioxidant activity of different fractions of Spirulina platensis protean extract. Il Farmaco 56: 497-500. [ Links ]
Fan, Y.Y.; Chapkin, R.S. 1998. Importance of dietary γ-linolenic acid in human health and nutrition. The Journal of Nutrition 128: 1411-1414. [ Links ]
Faucher, O.; Coupal, B.; Leduy, A.; 1979. Utilization of seawater-urea as a culture medium for Spirulina maxima. Can. J. Microbiol. 25: 752-759. [ Links ]
Garnier, F.; Thomas, J.C. 1993. Light regulation of phycobiliproteins in Spirulina maxima. In: Doumenge, F., Durand-Chastel, H., Toulemont, A. (eds.) Spirulina Algae of Life. Spirulina Algae de Vie. Monaco Musee Oceanographique NS. 12: 41-48. [ Links ]
Glazer, A.N. 1994. Phycobiliproteins – a family of valuable widely used fluorophores. J. Appl. Phycol. 6: 105-112. [ Links ]
Kay, R.A.; Barton, L.L. 1991. Microalgae as food and supplement, Crit. Rev. Food Sci. 30: 555-573. [ Links ]
Leema, J.T.; Kirubagaran, R.; Vinithkumar, N.V.; Dheenan, P.S.; Karthikayulu, S. 2010. High value pigment production from Arthrospira (Spirulina) platensis cultured in seawater. Bioresource Technology 101: 9221-9227. [ Links ]
Madkour, F.F.; Kamil, A.E.; Nasr, H.S. 2012. Production and nutritive value of Spirulina platensis in reduced cost media. Egyptian Journal of Aquatic Research 38: 51-57. [ Links ]
Mahajan, G.; Kamat, M. 1995. γ-Linolenic acid production from Spirulina platensis. Applied Microbiology and Biotechnology 43: 466-469. [ Links ]
Mano-Pappu, S.J.; Vijayakumar, K.G., Ramamurthy, V. 2013. Artificial neural network model for predicting production of Spirulina platensis in outdoor culture. Bioresource Technology 130: 224-230. [ Links ]
Márquez-Rocha, F.J.; Sasaki, k.; Nishio, N.; Nagai, S. 1995. Inhibitory effect of oxygen accumulation on the growth of Spirulina platensis. Biotechnol. Lett. 17: 225-238. [ Links ]
Materassi, R.; Tredici, M.; Balloni, W. 1984. Spirulina culture in seawater. Appl. Microbiol. Biotechnol. 19: 384-486. [ Links ]
Moreno, J.; Rodriguez, H.; Vargas, M.A.; Rivas, J.; Guerrero, M.G. 1995. Nitrogenfixing cyanobacteria as source of phycobiliprotein pigments. Composition and growth performance of ten filamentous heterocystous strains. J. Appl. Phycol. 7: 17-23. [ Links ]
Ogbonda, K.H.; Aminigo, R.E.; Abu, G.O. 2007. Influence of temperature and pH on biomass production and protein biosynthesis in a putative Spirulina sp. Bioresource Technology 98: 2207-2211. [ Links ]
Ono, E.; Cuello, J.L. 2004. Design parameters of solar concentrating systems for CO2 mitigating algal photobioreactors. Energy 29: 1651-1657. [ Links ]
Qureshi, M.; Ali, R. 1996. Spirulina platensis exposure enhances macrophage phagocytic function in cats, Immunopharmacol. Immunotoxicol 18: 457-463. [ Links ]
Qureshi, M.; Garlich, J.; Kidd, M. 1996. Dietary Spirulina platensis enhances humoral and cell-mediated immune functions in chickens. Immunopharmacol. Immunotoxicol 18: 465-476. [ Links ]
Saxena, P.N.; Ahmad, M.R.; Shyam, K.; Amla, D.V. 1982. Cultivation of Spirulina in sewage for poultry feed. Experientia 39: 1077-1083. [ Links ]
Schlösser, U.G. 1982. Sammlung von Algenkulturen. Ber. Deutsch Bot. Ges. 95: 18-276. [ Links ]
Singh, B.D., 1998. Biotechnology. Kalyani Publishers, New Delhi. 498-510. [ Links ]
Tanticharoen, M.; Bunnag, B.; Vonshak, A. 1993. Cultivation of Spirulina using secondary treated starch wastewater. Australasian Biotechnology 3: 223-226. [ Links ]
Tredici, M.; Papuzzo, T.; Tomaselli, L. 1986. Outdoor mass culture of Spirulina maxima in sea-water. Appl. Microbiol. Biotechnol. 24: 47-50. [ Links ]
Vasquez-Villalobos, V.; Artega, P.; Chanamé, K.; Esquivel, A. 2013. Modelamiento matemático y por redes neuronales artificiales del crecimiento de Spirulina sp. en fotobiorreactor con fuente de luz fluorescente e iluminación en estado sólido. Scientia Agropecuaria 4: 199-209. [ Links ]
Vieira, J.A.; Colla, L.M.; Duarte, P.F. 2004. Improving Spirulina platensis biomass yield using a fed-batch process. Bioresource Technology 92: 237-241. [ Links ]
Vonshak, A. 1997. Spirulina platensis (Arthrospira): Physiology, Cell Biology and Biotechnology. Taylor and Francis, London. [ Links ]
Watson, L. 1988. The properties of seawater. Jones & Bartlett, LLC. 7-126. [ Links ]
Wang, C.Y.; Fu, C.C.; Liu, Y.C. 2007. Effects of using light-emitting diodes on the cultivation of Spirulina platensis. Biochem Eng J. 37:21-25. [ Links ]
Wu, B.; Tseng, C.K.; Xiang, W. 1993. Large scale cultivation of Spirulina in seawater based culture medium. Bot. Mar. 36: 99-102. [ Links ]
Yilmaz, H. K.; Yas, D.; Yilmaz, H.; Özoğul, Y. 2010. The effects of different salinity rates on fat and fatty acid composition of spirulina platensis. Journal of Fisheries Sciences 4(3): 282-286. [ Links ]
Zarrouk, C. 1966, Contribution a letude dune cyanobacterie: influence de divers facteurs physiques et chimiques sur la croissance et la photosynthese de Spirulina maxima (Setchell et Gardner) Geitler. PhD thesis, University of Paris, France. [ Links ]
Zwietering, M.H.; Jongenburger, I.; Rombouts, F.M.; Vant Riet, K. 1990. Modeling of bacterial growth curve. Appl. Environ. Microbiol. 56: 1875-1881. [ Links ]
* Autor para correspondencia
E-mail: vvasquezv@upao.edu.pe (V. Vásquez-Villalobos).
Recibido 22 septiembre 2014.
Aceptado 03 diciembre 2014.














