Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Scientia Agropecuaria
versión impresa ISSN 2077-9917
Scientia Agropecuaria vol.6 no.1 Trujillo 2015
http://dx.doi.org/10.17268/sci.agropecu.2015.01.07
ARTÍCULOS DE REVISIÓN
Galactooligossacarídeos: produção, benefícios à saúde, aplicação em alimentos e perspectivas
Galactooligosaccharides: production, health benefits, application to foods and perspectives
Galactooligosacáridos: producción, beneficios para la salud, aplicación en alimentos y perspectivas
Ana Elizabeth Cavalcante Fai1,2, *; Gláucia Maria Pastore1
1 Departamento de Ciência de Alimentos, Faculdade de Engenharia de Alimentos, Universidade Estadual de Campinas, Campinas/SP, Brasil.
2 Departamento de Tecnologia de Alimentos, Escola de Nutrição, Universidade Federal do Estado do Rio de Janeiro, RJ, Brasil.
Resumo
Sintetizados a partir da transgalactosilação da lactose, os galactooligossacarídeos são carboidratos não digeríveis, sendo classificados como ingredientes prebióticos de alto valor agregado. Estudos recentes atribuem a estes oligossacarídeos uma série de potenciais benefícios à saúde e de prevenção de doenças. Esta revisão envolve os aspectos de produção destes compostos e aborda as suas propriedades físico-químicas, relacionando-as com aplicação na indústria de alimentos. Buscou-se apresentar, ainda, alguns dos efeitos fisiológicos e as perspectivas vislumbradas para estes açúcares não convencionais a partir do panorama atual.
Palavras-chave: Alimento funcional; fibras da dieta; β-galactosilase; reação de transgalactosilação; oligossacarídeos transgalactosilados; ingredientes bioativos.
Resumen
Sintetizados a partir de la transgalactosilación de la lactosa, los galactooligosacáridos son carbohidratos no digeribles, siendo clasificados como ingredientes prebióticos de alto valor añadido. Estudios recientes atribuyen a estos oligosacáridos una serie de potenciales beneficios para la salud y prevención de enfermedades. Esta revisión aborda aspectos de la producción de estos compuestos y sus propiedades físicas y químicas, relacionándolos con su aplicación en la industria alimentaria. Más aún, se presentan los efectos fisiológicos y las perspectivas previstas para estos azúcares no convencionales desde la situación actual.
Palabras clave: Alimentos funcionales; fibra dietaria; β-galactosidasa; reacción de transgalactosilación; oligosacáridos transgalactosilados; ingredientes bioactivos.
Abstract
Synthesized from lactose transgalactosylation, galactooligosaccharides are non-digestible carbohydrates classified as prebiotic ingredients of high added value. Recently studies associate potential health benefits and disease prevention properties to these oligosaccharides. This review involves production aspects and physicochemical properties of these compounds, correlated to their physiological effects and application in food industry. It was also presented some of the physiological effect and the perspectives for these non-conventional sugars from current viewpoint.
Keywords: Functional food; dietary fibers; β-galactosilase; transgalactosylation reaction; transgalacto-oligosaccharides; bioactive ingredient.
1. Introdução
A correlação entre alimentos e saúde é indubitável e atualmente os alimentos funcionais constituem uma importante área de pesquisa em todo o mundo (Turgeon e Rioux, 2011; Granato et al., 2010). Um alimento pode ser considerado funcional se for satisfatoriamente demonstrado que este apresenta um efeito benéfico em uma ou mais funções fisiológicas alvo, além do valor nutricional inerente à sua composição química, relevante para melhorar, manter e reforçar a saúde (Blundell, 2010).
Nesta perspectiva, os alimentos funcionais, especialmente os oligossacarídeos, com efeito prebiótico são conceitos novos e estimulantes (Rastall, 2013; Delgado et al., 2010; Roberfroid, 2002). Oligossacarídeos são açúcares encontrados como componentes naturais em alimentos como frutas, vegetais, leite e mel, podendo ser sintetizados enzimaticamente via biotecnógica (Jovanovic-Malinovska et al., 2015; Dwivedi et al., 2014; García-Cayuela et al., 2014). Muitos destes oligossacarídeos apresentam efeito prebiótico, proporcionando efeito positivo na composição da microbiota intestinal, sendo resistentes às ações das enzimas salivares e intestinais (Rastall e Gibson, 2015; Whelan, 2014; Vitetta et al., 2014).
Entre os prebióticos, destacam-se os galactooligossacarídeos (GOS) os quais são produzidos a partir de soluções com altas concentrações de lactose por ativividade de transgalactosilação, pela β-galactosidase, previamente extraída de diversas fontes, sendo a microbiana a mais usual (Fai et al., 2014; Intanon et al., 2014; Michelon et al., 2014; Park e Oh, 2010).
Convém mencionar que outro tipo de oligossacarídeo não transgalactosilado e não digerível também pode ser formado a partir da lactose por síntese química: a lactulose é um dissacarídeo composto por uma molécula de galactose e outra de frutose, unidas por ligação do tipo β-1,4 e resulta de um processo álcali de isomerização da lactose, na qual a galactose é isomerizada a um resíduo de frutose (Ait-Aissa e Aider, 2014). Os α-galactooligossacarídeos, por sua vez, são obtidos naturalmente da soja, incluindo a rafinose, estaquiose, melibiose e verbascose, os quais consistem em resíduos de galactose ligados a moléculas de sacarose por ligações do tipo α-1,6 e tampouco são digeríveis, devido à ausência de α-galactosidase entre as enzimas digestivas, sendo fermentados pela microflora gastrointestinal (Tungland e Meyer, 2002). Esta revisão visa abordar somente os GOS obtidos via trasgalactosilação por ação da β-galactosidase.
Os GOS são caracterizados como ingredientes seguros para o consumo ou GRAS (Generally Recognized as Safe), uma vez que são componentes do leite humano e tradicionalmente de iogurtes, sendo ainda produzidos no intestino por micro-organismos produtores de β-galactosidase a partir da lactose ingerida. São naturalmente encontrados na soja e não apresentam toxicidade, somente diarréia é relatada como efeito adverso quando este açúcar não convencional é consumido em excesso (Rodriguez-Colinas et al., 2014; Otieno, 2010).
Neste contexto, esta revisão bibliográfica contempla os aspectos relacionados à produção microbiana de GOS e os benefícios à saúde creditados aos mesmos. Aponta-se ainda algumas aplicações dos GOS na indústria de alimentos e quais são as perspectivas de mercado para estes ingredientes funcionais nos próximos anos.
2. Produção
Os GOS são formados a partir de substratos ricos em lactose via transgalactosilação, e para tanto podem-se utilizar células viáveis a partir da fermentação de substratos ricos em lactose, bem como fazer uso de β-galactosidase extraída previamente, sendo uma das formas interessantes de processo a imobilização do biocatalizador (Bicas et al., 2010; Panesar et al., 2010).
A reação de transgalactosilação, e a consequente formação de GOS, foi obser-vada no início dos anos 50 (Wallenfels, 1951). Goslin et al. (2010); Torres et al. (2010) e Mahoney (1998) descreveram minuciosamente as características e cinética desta reação. Nesta revisão serão enfatizados alguns dos aspectos mais importantes abordados na literatura especializada, visando colaborar para o entendimento da produção de GOS através de diversos processos biotecnológicos.
A conversão da lactose em GOS por ação da enzima β-galactosidase é uma reação cineticamente controlada e responde a um modelo de competição entre a reação de transgalactosilação e hidrólise. O mecanismo bioquímico de síntese de GOS é complexo e pode ser resumido da seguinte forma: o primeiro passo é a formação de um complexo enzima-galactosil e a simul-tânea liberação da glicose. Em uma segunda etapa o complexo enzima-galactosil é transferido para um aceptor que contenha um grupo hidroxil. Em uma solução com baixa concentração de lactose, água, ao invés de outros açúcares é mais competitiva para ser o aceptor deste complexo, sendo liberada, neste caso, a galactose.
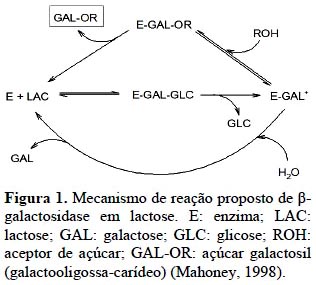
Por outro lado, se a concentração de lactose no sistema for alta, as moléculas de lactose e demais mono, di e oligossacarídeos, têm mais chances de atuarem como aceptores do complexo enzima-galactosil, formando, assim, os GOS (Michelon et al., 2014; Torres et al., 2010).
Não se elucidou, todavia, se a interação no sítio ativo da enzima é diferente de quando o aceptor é água ou é um sacarídeo. Contudo, sabe-se que β-galactosidases oriundas de fontes distintas, diferem quanto a seletividade à água e à moléculas de açúcar e que mesmo em concentrações iguais de lactose inicial, resultam em rendimentos de GOS, estruturas e tipos de ligações glicosídicas diferentes (Goslin et al., 2010; Otieno et al., 2010). Para β-galactosidase tem sido estabelecido que as reações hidrolítica, sintética e de trans-ferência são catalisadas pela mesma enzima (Becerra et al., 2001; Huber et al., 1976; Wallenfels e Malhotra, 1961).
A relação entre a concentração inicial de lactose e a quantidade de GOS formada em um sistema, é constatada, na maioria dos estudos, como diretamente proporcional, pois esta elevaria a quantidade de sacarídeos no meio e diminuiria a disponibilidade de água (Goslin et al., 2010). Contudo, é interessante ressalvar que alguns estudos de otimização da síntese de GOS observaram que a lactose não foi uma variável significativa na faixa de estudo analisada (Chen et al., 2002; Rustom et al., 1998). Goslin et al. (2010) sugerem que estes resultados podem apontar deficiências no modelo proposto e atualmente aceito para a reação de transgalactosilação. A formação de GOS a partir da lactose é influenciada por outros fatores como a fonte e concentração de enzima, pH, temperatura, tipo de processo, entre outros (Frenzel et al., 2015; Intanon et al., 2014). Os monossacarídeos glicose e, principalmente, galactose são reconhe-cidos como inibidores da reação de transgalactosilação.
A inibição da galactose parece ser resultado de uma competição com a lactose pelo sítio ativo da β-galactosidase, uma vez que esta enzima pode formar o complexo enzima-galactosil.
O mecanismo de inibição pela glicose é mais complexo e, dependendo da fonte da enzima, pode ser competitivo ou não competitivo (Park e Oh, 2010; Goslin et al., 2010).
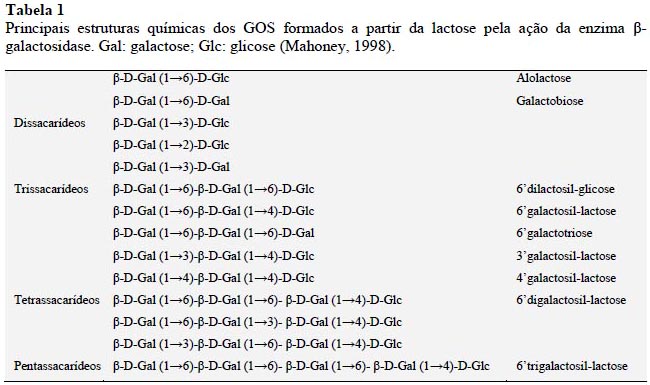
Quimicamente os GOS são formados por moléculas de galactose ligadas à glicose, sendo formados de tri a decassacarídeos com 2 a 9 unidades de galactose, respectivamente (Li et al., 2008). Embora relatado que possam ser formados produtos transgalactosilados decassacarídeos, não é usual serem produzidos GOS com cadeias tão extensas (Mussatto e Mancilha, 2007). De acordo com Mahoney (1998), a baixa efetividade da β-galactosidase em produzir GOS de maior peso molecular é explicada pela competitividade da reação de transga-lactosilação com a de hidrólise.
Entende-se assim, que o tempo de reação é um parâmetro crítico e tem direta influência na quantidade máxima e rendimento de GOS, uma vez que estes oligossacarídeos são simultâneamente sintetizados e degradados pela ação da β-galactosidase. Este autor afirma ainda, que a transgalactosilação será menos efetiva quanto maior o peso molecular do oligossacarideo aceptor, o que explicaria a maior formação de di, tri e tetrassacarideos em comparação com oligômeros maiores. A Tabela 1 apresenta as principais estruturas dos GOS.
Em termos de estrutura química, os GOS podem diferir em relação à seguintes características: composição, regioquímica, ligação glicosídica e grau de polimerização (Figura 2).
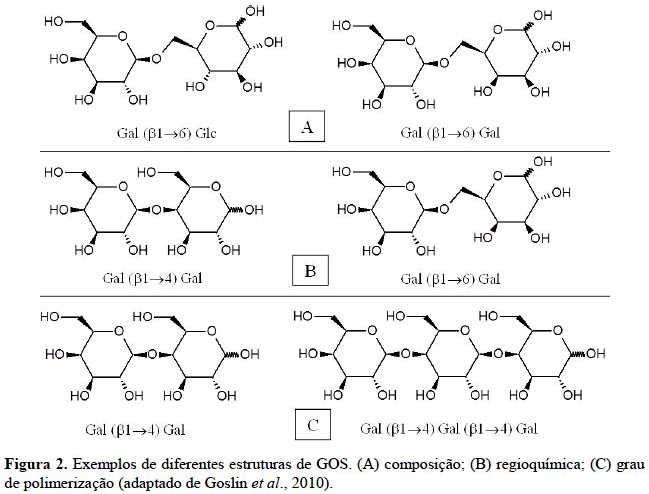
Estas propriedades são dependentes do mecanismo do biocatalisador utilizado e das demais condições reacionais do processo (Frenzel et al., 2015; Goslin et al., 2010).
É comum encontrar dissacarídeos transgalactosilados, consistindo em galactose e glicose com ligações β-glicosídicas diferentes da lactose ou com duas unidades de galactose (Park e Oh, 2010; Sako et al., 1999).
É válido ressaltar que todos os tipos de GOS, incluindo os dissacarídeos transgalactosilados, são considerados oligossacarídeos não digeríveis e apresentam propriedades fisiológicas similares, apesar de algumas particularidades e especificidades em relação a alguns probióticos terem sido relatadas (Cardelle-Cobas et al., 2011).
Um ponto interessante é abordado por Rastall (2004), o qual sugere que a biotecnologia de produção de GOS seja aperfeiçoada sintetizando estes oligossacarídeos a partir de β-galactosidases dos próprios microorganismos probióticos, partindo do princípio de que o prebiótico formado seria um substrato com uma especificidade e biodisponbilidade maior para este grupo microbiano.
Considerando que tanto a estrutura do oligossacarídeo, como a espécie probiótica, são fatores importantes e sinérgicos para o equilíbrio da microbiota intestinal, tem-se investigado a produção de oligossacarídeos alvo a partir de culturas probióticas. Como resultado, geram-se simbióticos de alta eficiência baseados no binômio micro-organismo-substrato ideal (Fai et al., 2014; García-Cayuela et al., 2014; Goulas et al., 2007).
2.1. β-galactosidase
A enzima β-galactosidase (β-D-galacto-sideo-galactohidrolase, E.C.3.2.1.23) é usualmente chamada de lactase uma vez que esta catalisa a hidrólise da lactose em seus açúcares constituintes (Park e Oh, 2010). Ressalta-se que todas as enzimas denominadas genericamente como lactases são β-galactosidases, mas o inverso não é verdadeiro. Determinadas β-galactosidases, incluindo algumas de células vegetais e de órgãos de mamíferos, que não as do intestino, têm baixa ou até mesmo nenhuma atividade de hidrólise da lactose uma vez que a função catalítica das mesmas é a quebra de outros grupos galactosil, tais como glicolipídios, glicoproteínas e mucopolissacarídeos (Mahoney, 2003).
Apesar de ocorrer em plantas como amêndoas, damascos, pêssegos, pêras, entre outros, (Mahoney, 2003; Dwevedi e Kayastha, 2009) a fonte preferida de β-galactosidase para aplicações biotecnoló-gicas é a microbiana, incluindo fungos (Fai et al., 2014; Santos et al., 2009), leveduras (Fai et al., 2014; Petrova e Kujumdzieva, 2010) e bactérias (Goslin et al., 2009); as condições ótimas do processo variam de acordo com o micro-organismo em que esta foi extraída (Frenzel et al., 2015; Rodriguez-Colinas et al., 2014).
Esta enzima apresenta uma importância comercial relevante, uma vez que, além da propriedade de produzir GOS, ao catalisar a hidrólise da lactose, sana problemas associados com a eliminação do soro, cristalização deste dissacarídeo em alimen-tos congelados e o consumo de leite e derivados por indivíduos com intolerância à lactose (Marín-Navarro et al., 2014; Dwevedi e Kayastha, 2009; Grosová et al., 2008).
2.2. Produção enzimática de GOS: enzima solúvel ou imobilizada
Existem basicamente duas formas de utilização de β-galactosidase, seja para hidrólise da lactose ou síntese de GOS: na forma solúvel (livre) e imobilizada, normalmente operando em processos de batelada e contínuo, respectivamente (Haider e Husain, 2009).
A opção de imobilização é principalmente induzida pela facilidade de controle da reação e possibilidade de reutilização do sistema, além de aumentar a estabilidade do biocatalizador em questão e permitir o escalonamento industrial (Carvalho et al., 2006; Neri et al., 2009).
Verifica-se na literatura um grande número de publicações visando a produção de GOS e hidrólise da lactose, contemplando diferentes matrizes e técnicas, tais como: cross-linking (Zhang et al., 2006), adsorção (Gaur et al., 2006), ligação covalente (Fai et al., 2014; Marín-Navarro et al., 2014), ligação iônica (Pessela et al., 2003), encapsulamento (Wu et al., 2010), ultrafiltração (Ebrahimi et al., 2010), e, até mesmo, a combinação entre esses métodos (Ansari e Husain, 2010; Haider e Husain, 2009).
Panesar et al. (2010) revisaram de forma abrangente este assunto e ressaltam o atual interesse e importância em se encontrar um método adequado para a imobilização de β-galactosidase, extraída previamente ou em células microbianas. Ressalta-se aqui que a escolha de um sistema enzimático adequado depende tanto das propriedades do biocatalizador quanto da finalidade de uso do mesmo. Por exemplo, β-galactosidases extraídas de leveduras são geralmente utilizadas na hidrólise de leite e soro doce, enquanto as de fungos são mais adequadas para aplicação em soro ácido. Comparada com β-galactosidases sintetiza-das por leveduras as de fungo são mais termoestáveis, por outro lado, são mais sensíveis frente aos inibidores do produto final, principalmente a galactose (Grosová et al., 2008).
Gaur et al. (2006) compararam três técnicas distintas de imobilização de β-galactosidase de Aspergillus oryzae: por adsorção em celite, por ligação covalente em quitosana e por formação de agregados com ligações cruzadas. Os autores concluíram que a formação de ligação covalente da enzima em quitosana foi mais apropriada para a síntese de oligossacarídeos, enquanto a adsorção e formação de agregados foram mais adequadas para a hidrólise de lactose.
Uma técnica para produção de não-monossacarídeos e galactooligossacarídeos de alta pureza, a partir de lactose, foi desenvolvida utilizando β-galactosidase de Penicillium expansum imobilizada em alginato de cálcio juntamente com células de Saccharomyces cerevisiae ou Kluyveromyces lactis neste suporte. Neste caso, o GOS sintetizado, a partir da enzima imobilizada, ficava disponível para fermentação pelas leveduras, as quais consumiam a glicose e galactose remanes-cente, resultando em aumento de pureza do GOS produzido em até 97,5% (Li et al., 2008).
Becerra et al. (2001) desenvolveram um sistema de biocatálise a partir de células de Kluyveromyces lactis imobilizada em alginato de cálcio e constataram que a atividade de β-galactosidase por unidade de biomassa celular foi maior com células imobilizadas do que com células livres, no mesmo meio de cultura. Estas células imobilizadas foram capazes de hidrolisar, sem produção simultânea de etanol, aproximadamente 99,5% de lactose a 30 ºC em 30 h.
2.3. Utilização de células para a produção de GOS
Assim como a maioria dos compostos provenientes de processos biotecnológicos, os GOS podem ser sintetizados de diversas maneiras, sendo a fermentação uma opção interessante. Neste caso, a síntese destes oligossacarídeos é levada a cabo utilizando diretamente micro-organismos (sem extra-ção prévia da β-galactosidase) que produzam esta enzima por fermentação de substratos com alta concentração de lactose (Goslin et al., 2010; Kim et al., 2001).
A fermentação apresenta como vantagens, em relação à utilização de enzimas isoladas em processos biotecnológicos, o fato de não necessitar das etapas de isolamento e purificação da enzima, as quais podem ser onerosas, fastidiosas e demandar muito tempo (Goslin et al., 2010; Goulas et al., 2007).
Além do mais, o uso de células viáveis neste tipo de processo pode contribuir com interessantes funções metabólicas adicionais, como o consumo dos monossacarídeos glicose e galactose provenientes da reação de transgalactosilação e hidrólise. Estes monômeros não apresentam efeito prebiótico, aumentam o aporte calórico deste ingrediente e sua remoção resultam em GOS com mair teor de pureza (Park e Oh, 2010; Goulas et al., 2007).
Em contrapartida, há a necessidade de se manter o processo em condições estéreis para que não haja contaminação no sistema e o produto de interesse seja efetivamente acumulado (Goslin et al., 2010; Lee et al., 2004).
Contudo, existem poucos estudos na literatura nos quais estes oligosscarídeos transgalactosilados tenham sido produzidos por fermentação. Pichia kluyveri e Pseudozyma tsukubaensis foram testadas quanto à capacidade de produção de GOS utilizando células viáveis e apresentaram rendimento máximo de 14,01 e 15,71% de GOS, respectivamente, a partir de 400 g/L de lactose em pH 7,0 a 30 °C/24 h (Fai et al., 2014).
Onishi et al. (1995) produziram GOS por fermentação da lactose a partir de culturas de Bacillus circulans, Rhizobium meliloti, Rhodotorula minuta, Sirobasidium magnum, Sterigmatomyces elviae, entre outros, e obtiveram 57; 42; 67; 63 e 74 g/L de GOS total sintetizado, respectivamente, partindo de uma concentração inicial de lactose de 300g/L à 30 °C/16 h.
Roy et al. (2002) otimizaram a síntese de GOS fermentado por Bifidobacterium infantis, a partir da lactose, utilizando metodologia de superfície de resposta e alcançaram um máximo de 43% de rendimento de GOS em relação a concentração inicial de lactose de 400 g/L. Onishi e Tanaka (1998) desenvolveram um método de reciclo celular de Sterigmatomyces elviae no qual a cultura se manteve viável e estável por 6 ciclos, alcançando um alto rendimento de GOS, em torno de 60%, a partir de uma concentração inicial de lactose de 360 g/L.
2.4. Utilização de células permeabili-zadas
Em alguns micro-organismos a β-galactosidase é uma enzima intracelular, o que resulta em algumas limitações na sua aplicação. Para a obtenção de extratos livres destas células faz-se necessário a ruptura das mesmas, o que pode levar à inativação enzimática. A permeabilização celular é apontada como um método alternativo neste caso; esta técnica modifica a estrutura da membrana do micro-organismo, diminuindo o conteúdo de fosfolipídios e facilitando assim, a entrada e saída de solutos, tais como a lactose e seus produtos reacionais, ou seja, aumenta a permeabilidade da célula. Outro aspecto interessante é que as enzimas intracelulares, das células permeabilizadas, podem ser consideradas "naturalmente" imobilizadas (Manera et al., 2010; Park e Oh, 2010). Kaur et al. (2009) estudaram as variáveis que afetam o processo de hidrólise da lactose com células permea-bilizadas de Kluyveromyces marxianus, utilizando brometo de cetiltrimetil amônio como agente permeabilizante, e alcança-ram um máximo de 90,5% de hidrólise após 90 minutos à 40 °C. Manera et al. (2010) utilizaram uma estratégia sequencial de planejamentos para produção de GOS a partir de células de Kluyveromyces marxianus permeabilizadas com isopropanol. Nas condições otimizadas, com uma concentração de lactose de 50% (p/v), os autores constataram rendimento e produtividade de 16,5% e 27,6 g/L.h, respectivamente. Onishi et al. (1996) investigaram a produção de GOS empregando células de Sirobasidium magnum, permeabilizadas com tolueno, obtendo rendimento de 37% a partir de uma solução de lactose de 360 g/L em 42 h à 50 °C.
3. Efeitos benéficos à saúde
A característica prebiótica dos GOS é amplamente estudada e corroborada na literatura sob diversas condições experi-mentais in vitro e in vivo (Ooi e Liong, 2010; Veereman-Wauters, 2005; Tzortzis et al., 2005). O critério para se definir um prebiótico são: resistência à digestão no intestino delgado, hidrólise e fermentação pelas bactérias desejáveis no cólon e estimulação seletiva do crescimento desta mesma microflora, ou efeito bifidogênico (Chong, 2014; Péris e Gimeno, 2008; Barreteau et al., 2006).
O mecanismo de atuação fisiológica dos prebióticos ocorre da seguinte maneira: assim como as demais fibras da dieta, são resistentes à digestão na parte superior do trato intestinal, sendo subsequentemente fermentados no cólon (Michelon et al., 2014; Rastall, 2013; Tungland e Meyer, 2002). Exercem, então, um efeito de aumento de volume, como consequência do aumento da biomassa microbiana resultante de sua fermentação, promo-vendo, ainda, um aumento na frequência de evacuações, efeitos estes que confir-mam a sua classificação no conceito atual de fibras da dieta (Vitetta et al., 2014; Kaur e Gupta, 2002; Roberfroid, 2002).
Os benefícios da ingestão de galacto-oligossacarídeos são o aumento da população de bifidobactérias no cólon e por efeito antagônico, supressão da atividade de bactérias putrefativas reduzindo a formação de metabólitos tóxicos (Montilla et al., 2015; Neri et al, 2009).
A mudança da microflora intestinal é apontada como responsável pela diminuição de produtos putrefativos nas fezes, por diminuir o conteúdo de colesterol no sangue e reduzir a incidência de câncer colorretal (Bruno-Barcena e Azcarate-Peril, 2015; Chong et al., 2014; Vitetta et al., 2014). Também demonstram benefí-cios derivados da sua atividade antiadesiva, visto que inibem infecções por patógenos entéricos impedindo a adesão destes micro-organismos às células epiteliais gastrointestinais (Rastall e Gibson, 2015; Giese et al., 2011). É relatado, ainda, efeito protetor contra infecções no trato urogenital (Sousa et al., 2011; Mussatto e Mansilha, 2007).
Vários relatos sugerem também que os GOS, dentre outros carboidratos não digeríveis, estimulam e aumentam a absorção de cálcio e minerais no intestino. Este efeito consiste na produção de ácidos graxos de cadeia curta, resultante da fermentação no intestino grosso, uma vez que eles estimulam a proliferação de células do epitélio do intestino e reduzem o pH luminal (Rastall, 2013; Santos et al., 2011; Scholz-Ahrens et al., 2007).
4. Propriedades e aplicação na indústria
Os GOS disponíveis comercialmente são compostos por vários tipos de misturas de oligossacarídeos transgalactosilados mes-clados à lactose, glicose e galactose resultantes do processo de síntese e hidrólise (Li et al., 2008). De forma geral, os oligossacarídeos são solúveis em água, levemente doces e equivalem de 30 a 60% à doçura da sacarose. O grau de doçura é dependente da estrutura química e da massa molar dos oligossacarídeos, bem como da concentração de mono e dissacarídeos presentes na mistura. Quanto maior a peso molecular, menor a doçura (Playne e Crittenden, 2009; Mussatto e Mancilha, 2007).
Os GOS podem ser usados largamente na produção de doces, massas, pães e geléias, haja vista que são termo e quimicamente estáveis em uma ampla faixa de pH; Resistem a 160 °C por 10 min em pH neutro ou a 120 °C por igual tempo em pH 3 e em pH 2 chegam a resistir até a 100 °C por 10 min. Nesta condição adversa a degradação da sacarose ulrapassaria 50% (Martins e Burkert, 2009; Sako et al., 1999). Uma vez que os GOS estão presentes no leite humano algumas empresas têm utilizado estes oligossacarídeos como aditivos em formulações infantis no intuito de mimetizar o efeito bifidogênico comprovado no leite materno aos demais produtos para esta faixa etária (Bruno-Barcena e Azcarate-Peril, 2015; Schwab e Ganzle, 2011).
Ao contrário do amido e dos monossacarídeos, os oligossacarídeos não são fermentados pela microflora bucal para formar ácidos e poliglucanas, sendo então utilizados como açúcares de baixa cario-genicidade em confeitos, gomas de mascar, iogurtes e bebidas (Mussatto e Mancilha, 2007). Como tampouco são digeríveis pelas enzimas digestivas, são açúcares de baixo valor calórico e podem ser aplicados em alimentos para diabéticos, podendo ainda ser utilizados em conjunto com edulcorantes artificiais, como aspartame e fenilalanina, mascarando o sabor indesejável produzido por alguns destes adoçantes (Michelon et al., 2014; Playne e Crittenden, 2009). Dentre muitos produtos nos quais é possível a adição de GOS, o pão é um alimento extremamente apropriado, pois durante a fermentação e o cozimento os GOS não são degradados e ainda favorecem o sabor e textura do mesmo. Produtos lácteos fermentados são outros bons exemplos e estes já estão comercialmente disponíveis. Alimentos infantis e especiais para idosos e imunodeficientes são também adequados para a aplicação de GOS, pois estes indivíduos são mais suscetíveis a alterações no equilíbrio intestinal (Montilla et al., 2015; Sako et al., 1999).
Geralmente, os GOS são comercializados como xaropes transparentes ou em pó e se apresentam como misturas com diversos graus de polimerização junto à lactose, glicose e galactose residuais, porém, informações detalhadas sobre o processo de fabricação destes oligossacarídeos são escassas. Ainda que utilizem enzimas de fontes microbianas distintas (Aspergillus oryzae, Cryptococcus laurentii, B. circulans, Bifidobacterium bifidum, entre outros) o que é relatado acerca do fluxograma de processamento de GOS por estas indústrias, é semelhante (Tzortzis e Vulevic, 2009). A concentração inicial de lactose varia entre 20 a 40% (w/v) a qual é incubada com a enzima em reator de batelada ou contínuo até o ponto ótimo de conversão de lactose em GOS ser alcançado. A solução é então descolorida, desmineralizada e submetida a uma etapa de separação dos monossacarídeos para purificação do produto. A solução resultante é concentrada usualmente até 67-75% de sólidos totais. Parte destes processos e outros para a produção de GOS estão protegidos por patentes de invenção (Playne e Crittenden, 2009).
Apesar de apresentarem interessantes características físico-químicas, não há dúvidas de que o principal interesse do uso dos oligossacarídeos prebióticos como ingredientes nos alimentos se deve às suas propriedades fisiológicas. Assim, à medida que os diversos efeitos benéficos dos GOS são cientificamente esclarecidos e deslocados para diante, uma maior demanda por estes produtos é evidenciada (Roberfroid, 2007; Nakakuki, 2002).
5. Perspectivas e avanços futuros
As recentes comprovações científicas estreitando a relação entre dieta e saúde, aliada à maior expectativa de vida e a valorização do consumidor por alimentos saudáveis trouxeram um novo desafio para a indústria de alimentos: o de se adaptar à era da nutrição otimizada.
Consoantes aos aspectos acima mencionados há uma ampla variedade de aplicações para os GOS como ingredientes a serem exploradas na indústria de alimentos, permitindo agregar benefícios nutrícionais e sensoriais a alimentos já existentes e novos produtos.
A receita estimada do mercado global de alimentos funcionais para o ano de 2013 foi de aproximadamente US$ 175,00 bilhões de dólares. Com uma taxa de crescimento médio anual de 15% do mercado mundial de alimentos funcionais, a previsão é de que em 2015 os alimentos funcionais movimentem US$ 230,00 bilhões de dólares (Business Wire, 2014).
A projeção do segmento para ingredientes prebióticos, elaborada nos Estados Unidos, indica que este mercado está crescendo a uma taxa anual média de 5,2% de 2013 a 2019. O mercado foi avaliado em US$ 11,16 bilhões de dólares em 2012, devendo alcançar US$ 15,90 bilhões em 2019 (Transparency Market Research, 2014).
Alimentos, saúde e biotecnologia já se apresentam no presente e assim persistirão, como um trinômio indissociável e essen-cial para que a indústria atenda as exigências de uma sociedade que busca por uma alimentação mais saudável e novos modos de vida.
6. Considerações finais
As forças condutoras que promovem a constante pesquisa por processos eficientes para a produção de ingredientes bioativos incluem as exigências de uma sociedade que entende o papel primordial da alimentação na manutenção da saúde e prevenção de doenças. Os efeitos fisiológicos dos GOS, e demais oligossacarídeos, certamente continuarão a ser elucidados em ensaios in vitro e in vivo nos próximos anos. A combinação desta acepção, aliada ao crescente número de estudos visando a otimização da síntese de GOS, estimula também o setor industrial a aplicar recursos para a produção destes compostos. Assim, estima-se que haja um aumento expressivo da aplicação destes ingredientes bioativos, em alimentos de consumo usual e em produtos específicos, em um futuro próximo.
7. Referências bibliográficas
Ait-Aissa, A.; Aider, M. 2014. Lactulose: production and use in functional food, medical and pharmaceutical applications. Practical and critical review. International Journal of Food Science and Technology 49: 1245-1253.
Ansari, S.A.; Husain, Q. 2010. Lactose hydrolysis by β-galactosidase immobilized on concanavalin A-cellulose in batch and continuous mode. Journal of Molecular Catalysis B: Enzymatic 63: 68-74.
Barreteau, H.; Delattre, C.; Michaud, P. 2006. Production of oligosaccharides as promising new food additive generation.Food Technology and Biotechnology 44(3): 323-333.
Becerra, M.; Baroli, B.; Fadda, A.M.; Mendez, J.B.; Gonzalez Siso, M I. 2001. Lactose bioconversion by calcium-alginate immobilization of Kluyveromyces lactis cells. Enzyme and Microbial Technology 29: 506-512.
Bicas, J.L.; Silva, J.C.; Dionísio, A.P.; Pastore, G. M. 2010. Biotechnological production of bioflavors and functional sugars. Ciência e Tecnologiade Alimentos 30(1): 7-18.
Business Wire. 2014. Research and Markets: Global Functional Food and Nutraceuticals Market 2013-2018 - Analysis of the $175 Billion Industry, publicado on-line em14 de abril de 2014. Disponível em: http://www.businesswire.com/news/home/20140414005944/en/Research-Markets-Global-Functional-Food-Nutraceuticals-Market#.VHvS-THF9qU.
Blundell, J. 2010. Making claims: functional foods for managing appetite and weight. Nature Reviews Endocrinology 6: 53-56.
Bruno-Barcena, J.M.; Azcarate-Peril, M.A. 2015. Galacto-oligosaccharides and colorectal cancer: feeding our intestinal probiome. Journal of Functional Foods 12: 92-108.
Carvalho, W.; Canilha, L.; Silva, S.S. 2006. Uso de biocatalisadores imobilizados: uma alternativa para a condução de bioprocessos. Revista Analytica 23: 60-70.
Cardelle-Cobas, A.; Corzo, N.; Olano, A.; Peláez, C.; Requena, T.; Ávila, M. 2011. Galactooligosaccharides derived from lactose and lactulose: Influence of structure on Lactobacillus, Streptococcus and Bifidobacterium growth. International Journal of Food Microbiology 149: 81-87.
Chen, C.S.; Hsu, C.K.; Chiang, B.H. 2002. Optimization of the enzymic process for manufacturing low-lactose milk containing oligosaccharides. Process Biochemistry 38: 801-808.
Chong, E.S.L. 2014. A potential role of probiotics in colorectal cancer prevention: review of possible mechanisms of action. World Journal of Microbiology and Biotechnology 30: 351–374.
Delgado, G.T.C.; Tamashiro, W.M.S.C.; Pastore, G.M. 2010. Immunomodulatory effects of fructans. Food Research International 43: 1231-1236.
Dwevedi, A.; Kayastha, A.M. 2009. Optimal immobilization of β-galactosidase from Pea (PsBGAL) onto Sephadex and chitosan beads using response surface methodology and its applications. Bioresource Technology 100: 2667-2675.
Dwivedi, S.; Sahrawat, K.; Puppala, N.; Ortiz, R. 2014. Plant prebiotics and human health: Biotechnology to breed prebiotic-rich nutritious food crops. Electronic Journal of Biotechnology 17: 238–245.
Ebrahimi, M.; Placido, L.; Engel, L.; Ashaghi, K.S.; Czermak, P A. 2010. novel ceramic membrane reactor system for the continuous enzymatic synthesis of oligosaccharides. Desalination 250: 1105-1108.
Fai, A.E.C.; Silva, J.B.; Andrade, C.J.; Bution, M.L.; Pastore, G.M. 2014. Production of prebiotic galactooligosaccharides from lactose by Pseudozyma tsukubaensis and Pichia kluyveri. Biocatalysis and Agricultural Biotechnology 03: 343-350.
Fai, A.E.C.; Stamford, T.C.M.; Stamford, T.L.M. ; Kawaguti, H.Y.; Thomazelli, I.; Pastore, G. M. 2014. Synthesis of galactooligosaccharides from lactose by β- galactosidase immobilized on glutaraldehyde-treated chitosan. In: Campana Filho, S.C.; Beppu, M.M.; Fiamingo, A. (Editores.). Advances in Chitin Science XIV (1aed), editora IQSC, São Carlos.
Frenzel, M.; Zerge, K.; Clawin-Radecker, I.; Lorenzen, P.C. 2015. Comparison of the galactooligosaccharide forming activity ofdifferent b-galactosidases. LWT - Food Science and Technology 60: 1068-1071.
García-Cayuela,T.; Díez-Municio, M.; Herrero, M. 2014. Selective fermentation of potential prebiotic lactose-derived oligosaccharides by probiotic bacteria, International Dairy Journal 38: 11-15.
Gaur, R.; Pant, H.; Jain, R.; Khare, S.K. 2006. Galacto-oligosaccharide synthesis by immobilized Aspergillus oryzae β-galactosidase. Food Chemistry 97: 426-430.
Giese, E.C.; Hirosi, T.; Silva, M.L.C.; Silva, R.; Barbosa, A.M. 2011. Produção, propriedades e aplicações de oligossacarídeos. Semina: Ciências Agrárias 32(2): 683-700.
Goslin, A.; Stevens, G.; Barber, A.R.; Kentish, S.E.; Gras, S.L. 2010. Recent advances refining galactooligo-saccharide production from lactose. Food Chemistry 121 (2): 307-318.
Gosling, A.; Alftrén, J.; Stevens, G.W.; Barber, A.R.; Kentish, S.E.; Gras, S.L. 2009. Facile pretreatment of Bacillus circulans β-Galactosidase increases the yield of galactosyl oligosaccharides in milk and lactose reaction systems. Journal of Agricultural and Food Chemistry 59(7): 3366-3372.
Goulas, A.; Tzortzis, G.; Gibson, G.R. 2007. Development of a process for the production and purification of α- and β-galactooligosaccharides from Bifidobacterium bifidum NCIMB 41171. International Dairy Journal 17: 648-656.
Granato, D.; Branco, G.F.; Nazzaro, F.; Cruz, A.G.; Faria, J.A.F. 2010. Functional foods and nondairy probiotic food development: trends, concepts, and products. Comprehensive Reviews in Food Science and Food Safety 9: 292-302.
Grosová, Z.; Rosenberg, M.; Rebros, M. 2008. Perspectives and applications of immobilized β-galactosidase in food industry – a review. Czech. Journal Food Sciences 26 (1): 1-14.
Haider, T.; Husain, Q. 2009. Hydrolysis of milk/whey lactose by β-galactosidase: a comparative study of stirred batch process and packed bed reactor prepared with calcium alginate entrapped enzyme. Chemical Engineering and Processing 48: 576-580.
Huber, R.E.; Kurz, G.; Wallenfels, K.A. 1976. Quantitation of the factors which affect the hydrolase and transgalactosylase activities of β-galactosidase (E. coli) on lactose. Biochemistry 15(9): 1994–2001.
Intanon, M.; Arreola, S.L.; Pham, N.H.; Kneifel, W.; Haltrich, D.; Nguyen, T.H. 2014. Nature and biosynthesis of galacto-oligosaccharides related to oligosaccharides in human breast milk. FEMS Microbiology Letters 353: 89-97.
Jovanovic-Malinovska, R.; Kuzmanova, S.; Winkelhausen, E. 2015. Application of ultrasound for enhanced extraction of prebiotic oligosaccharides from selected fruits and vegetables. Ultrasonics Sonochemistry 22: 446-453.
Kaur, G.; Panesar, P.S.; Bera, M.B.; Kumar, H. 2009. Hydrolysis of whey lactose using CTAB-permeabilized yeast cells. Bioprocess and Biosystems Engineering 32: 63-67.
Kaur, N.; Gupta, A.K. 2002. Applications of inulin and oligofructose in health and nutrition. Journal of Biosciences 27: 703-714.
Kim, J.H.; Lee, D.H.; Lee, J.S. 2001. Production of Galactooligosaccharide by β-Galactosidase from Kluyveromyces maxianus var lactis OE-20. Biotechnology and Bioprocess Engineering 6: 337-340.
Lee, Y.J.; Kim, C.S.; Oh, D.K. 2004. Lactulose production by β-galactosidase in permeabilized cells of Kluyveromyces lactis. Applied Microbiology and Biotechnology 64: 787-793.
Li, Z.; Xiao, M.; Lu, L.; Li, Y. 2008. Production of non-monosaccharide and high-purity galactooligosaccha-rides by immobilized enzyme catalysis and fermentation with immobilized yeast cells. Process Biochemistry 43: 896-899.
Mahoney, R. R. 1998. Galactosyl-oligosaccharide forma-tion during lactose hydrolysis: a review. Food Chemistry 63: 147-154.
Mahoney, R.R. 2003. β-Galactosidase In: Whitaker, J.R.; Voragen, A.G.J.; Wong, D.W.S. (Eds). Handbook of Food Enzymology, Edit. Marcel Dekker, Inc, NY.
Manera, A. P.; Costa, F. A. A.; Rodrigues, M. I.; Kalil, S. J.; Maugeri Filho, F. 2010. Galacto-oligosaccharides Production using permeabilized cells of Kluyveromyces marxianus. International Journal of Food Engineering 6(6): 1556-3758.
Marín-Navarro, N.; Talens-Perales, D.; Oude-Vrielink, A.; Cañada, F.J.; Polaina, J. 2014. Immobilization of thermostable b-galactosidase on epoxy support and its use for lactose hydrolysis and galactooligosaccharides biosynthesis. World Journal of Microbiology and Biotechnology 30: 989-998.
Martins, A; R, Burkert, C.A.V. 2009. Revisão galacto-oligossacarídeos (GOS) e seus efeitos prebióticos e bifidogênicos. Brazilian Journal of Food Technology 12(3): 230-240.
Michelon, M.; Manera, A.P.; Carvalho, A.L.; Filho, F.M. 2014. Concentration and purification of galacto-oligosaccharides using nanofiltration membranes. International Journal of Food Science and Technology 49: 1953-1961.
Montilla, A.; Megías-Pérez, R.; Olano, A.; Villamiel, M. 2015. Presence of galactooligosaccharides and furosine in special dairy products designed for elderly people. Food Chemistry 172: 481-485.
Mussatto, S.I.; Mancilha, I.M. 2007. Non-digestible oligosaccharides: a review. Carbohydrate Polymers, 68(3): 587-597.
Nakakuki, T. 2002. Present status and future of functional oligosaccharide development in Japan. Pure and Applied Chemistry 74(7): 1245–1251.
Neri, D.F.M.; Balcão, V.M.; Costa, R.S.; Rocha, I.C.A.P.; Ferreira, E.M.F.C.; Torres, D.P.M.; Rodrigues, L.R.M.; Carvalho Júnior, L.B.; Teixeira, J.A. 2009. Galacto-oligosaccharides production during lactose hydrolysis by free Aspergillus oryzae β-galactosidase and immobilized on magnetic polysiloxane-polyvinyl alcohol. Food Chemistry 115: 92-99.
Onishi, N., Yamashiro, A., Yokozeki, K. 1995. Production of galactooligosaccharide from lactose by Sterigmatomyces elviae CBS8119. Applied and Environmental Microbiology 61: 4022-4025.
Onishi, N.; Kira, I.; Yokozeki, K. 1996. Galacto-oligosaccharide production from lactose by Sirobasidium magnum CBS6803.Letters in Applied Microbiology 23: 253-256.
Onishi, N.; Tanaka, T. 1998. Galacto-oligosaccharide production using a recycling cell culture of Sterigmatomyces elviae CBS8119. Letters in Applied Microbiology 26: 136-139.
Ooi, L.G.; Liong, M.T. 2010. Cholesterol-lowering effects of probiotics and prebiotics: a review of in vivo and in vitro findings. International Journal of Molecular Sciences 11: 2499-2522.
Otieno, D.O. 2010. Synthesis of β-galactooligosaccharides from lactose using microbial β-galactosidases. Comprehensive Reviews in Food Science and Food Safety 9: 471-482.
Panesar, S.; Kumari, S.; Panesar, R. 2010. Potential applications of immobilized β-galactosidase in food processing industries. Enzyme Research 2010: 473137, 16p. doi:10.4061/2010/473137.
Park, A.R, Oh, D.K. 2010. Galacto-oligosaccharide production using microbial β-galactosidase: current state and perspectives. Applied Microbiology and Biotechnology 85: 1279-1286.
Péris, P.G.; Gimeno, C.V. 2007. Evolución en el conocimiento de la fibra. Nutrición Hospitalaria 22 (2): 20-25.
Pessela, B.C.C.; Fernádez-Lafuente, R.; Fuentes, M.; Vián, L.; García, J.L.; Carrascosa, A.V.; Mateo, C.; Guisánb, J.M. 2003. Reversible immobilization of a thermophilic β-galactosidase via ionic adsorption on PEI-coated Sepabeads. Enzyme and Microbial Technology 32: 369-374.
Petrova, V.Y.; Kujumdzieva, A.V. 2010. Thermotolerant yeast strains producers of galactooligosaccharides. Biotechnology & Biotechnological Equipment 24(1): 1612-1619.
Playne, M.J.; Crittenden, R.G. 2009. Galacto-oligosaccharides and other products derived from lactose. In: Lactose, Water, Salts and Minor Constituents. Editora: Springer, Nova York.
Rastall, R. A. 2004. Bacteria in the gut: Friends and foes and how to alter the balance. Journal of Nutrition 134(8): 2022S–2026.
Rastall, R. A. 2013. Gluco and galacto-oligosaccharides in food: update on health effects and relevance in healthy nutrition. Current Opinion in Clinical Nutrition & Metabolic Care: 16(6): 675-678.
Rastall, R. A.; Gibson G.R. 2015. Recent developments in prebiotics to selectively impact beneficial microbes and promote intestinal health. Current Opinion in Biotechnology 32: 42-46.
Roberfroid, M. 2007. Prebiotics: The Concept Revisited. Journal of Nutrition 137: 830-837.
Roberfroid, M.B. 2002. Functional food concept and its application to prebiotics. Digestive and Liver Disease 34(2): 105-110.
Rodriguez-Colinas, B.; Fernandez-Arrojo, L.; Ballesteros, A.O.; Plou, F.J. 2014. Galactooligosaccharides formation during enzymatic hydrolysis of lactose: Towards a prebiotic-enriched milk, Food Chemistry 145: 388–394.
Roy, D.; Daoudi, L.; Azaola, A. 2002. Optimization of galacto-oligosaccharide production by Bifidobacterium infantis RW-8120 using response surface methodology. Journal of Industrial Microbiology & Biotechnology 29: 281-285.
Rustom, I.Y.S; Foda, M.I.; López Leiva, M.H. 1998. Formation of oligosaccharides from whey UF-permeate by enzymatic hydrolysis: analysis of factors. Food chemistry 62(2): 141-147.
Sako, T.; Matsumoto, K.; Tanaka, R. 1999. Recent progress on research and applications of non-digestible galacto-oligosaccharides. International Dairy Journal 9: 69-80.
Santos, E.F.; Tsuboi, K.H.; Araújo, M.R.; Andreollo, N.A.; Miyasaka, C.K. 2011. Influência da dieta com galactooligossacarídeos sobre a absorção de cálcio em ratos normais e gastrectomizados. Revista do Colégio Brasileiro de Cirurgiões 38(3): 186-191.
Santos, R.; Simiqueli, A.P.R.; Pastore, G.M. 2009. Produção de galactooligossacarídeo por Scopulariopis sp. Ciência e Tecnologia de Alimentos 29(3): 682-689.
Scholz-Ahrens, K.E.; Ade, P.; Marten, B.; Weber, P.; Timm, W.; Açil, Y.; Gluer, C.C.; Schrezenmeir, J. 2007. Prebiotics, probiotics, and synbiotics affect mineral absorption, bone mineral content, and bone structure. Journal of Nutrition 137: 838S-46S.
Schwab, C.; Ganzle, M. 2011. Lactic acid bacteria fermentation of human milk oligosaccharide components, human milkoligosaccharides and galactooligosaccharides. FEMS Microbiology Letters 315: 141-148.
Sousa, V.M.C.; Santos, E.F.; Sgarbieri, V.C. 2011. The importance of prebiotics in functional foods and clinical practice. Food and Nutrition Sciences 2: 133-144.
Torres, D.P.M.; Gonçalves, M.P.F.; Teixeira, J.A.; Rodrigues, L.R. 2010. Galacto-oligosaccharides: production, properties, applications, and significance as prebiotics. Comprehensive Reviews in Food Science and Food Safety 9: 438-454.
Transparency Market Research. 2014. Prebiotics Market Will Flourish in the Forthcoming Years, publicado on-line em 25 de novembro de 2014. Disponível em: http://www.transparencymarketresearch.com/article/prebiotics.htm.
Tungland, B. C.; Meyer, D. 2002. Nondigestibleoligo- and polysaccharides (dietary fiber): their physiology and role in human health and food. Comprehensive Reviews in Food Science and Food Safety 1(3): 90-109.
Turgeon, S.L.; Rioux, L.E. 2011. Food matrix impact on macronutrients nutritional properties. Food Hydrocolloids 25: 1915-1924.
Tzortzis, G.; Goulas, A.K.; Gee, J.M.; Gibson, G.R. 2005. A novel galactooligosaccharide mixture increases the bifidobacterial population numbers in a continuous in vitro fermentation system and in the proximal colonic contents of pigs in vivo. J. of Nutrition 135: 726-1731.
Tzortzis G., Vulevic J. 2009. Galacto-oligosaccharide prebiotics. Em: Prebiotics and probiotics science and technology. Nova York: Springer.
Veereman-Wauters, 2005. G. Application of prebiotics in infant foods. British Journal of Nutrition 93: 57-60.
Vitetta, L.; Briskey, D.; Alford, H.; Hall, S.; Coulson, S. 2014. Probiotics, prebiotics and the gastrointestinal tract in health and disease. Inflammopharmacol 22: 135–154.
Wallenfels, K.; Malhotra, O. P. 1961. Galactosidases. Advances in Carbohydrate Chemistry 16: 239-298.
Wallenfels, K. 1951. Enzymatische synthese von oligosa-cchariden aus disacchariden. Naturwissenschaften 38 (13): 306-307.
Whelan, K. 2014. Prebiotics and gastrointestinal health. In Advanced Nutrition and Dietetics in Gastroenterology (Ed. M. Lomer). John Wiley & Sons, Ltd., Oxford.
Wu, Z.; Dong, M.; Lu, M.; Li, Z. 2010. Encapsulation of β-galactosidase from Aspergillus oryzae based on "fish-in-net" approach with molecular imprinting technique. J. of Molecular Catalysis B: Enzymatic 63: 75-80.
Zhang, J.; Zeng, J.; Zhang, Y.; Wang, Y.; Wang, Y. 2006. Immobilization of ß-galactosidase on tamarind gum and chitosan composite microspheres. Journal of Bioactive and Compatible Polymers 21: 415-432.
* Autor para correspondencia
E-mail: bethfai@yahoo.com.br (A.E.C. Fai).
Recibido 05 diciembre 2014
Aceptado 25 enero 2015.














