Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Scientia Agropecuaria
versión impresa ISSN 2077-9917
Scientia Agropecuaria vol.6 no.2 Trujillo abr./jun. 2015
http://dx.doi.org/10.17268/sci.agropecu.2015.02.01
ARTÍCULOS ORIGINALES
Inhibición del bronceado en cáscara de chirimoya ‘Fino de Jete’ por aplicación de 6-bencilaminopurina
Inhibition of browning in cherimoya ‘Fino de Jete’ peel by application of 6-bencylaminopurine
Aaran A. Morales P.1; Omar Franco-Mora2,*; Álvaro Castañeda-Vildózola2; Edgar Jesús Morales-Rosales2
1 Programa doctoral en Ciencias Agropecuarias y Recursos Naturales. Universidad Autónoma del Estado de México, Campus Universitario El Cerrillo Piedras Blancas. C. P. 50000, Toluca, Estado de México. Tel. y Fax (722) 296 55 18.
2 Laboratorio de horticultura, Facultad de Ciencias Agrícolas, Centro de Investigación y Estudios Avanzados en Fitomejoramiento, Universidad Autónoma del Estado de México, Campus Universitario El Cerrillo Piedras Blancas. C. P. 50000, Toluca, Estado de México. Tel. y Fax (722) 296 55 18.
Resumen
La chirimoya (Annona cherimola Mill.) es climatérica, su vida poscosecha se acorta por el bronceado de cáscara y ablandamiento del fruto. El objetivo de esta investigación fue evaluar el efecto poscosecha de la aplicación de 6-bencilaminopurina (BAP) en chirimoya ‘Fino de Jete’. Los frutos se seleccionaron aleatoriamente de la parte media y basal de la copa de seis árboles y se les aplicó 1,0 mM o 0 mM BAP. Los frutos permanecieron en el árbol 8 y 15 días después de la aplicación; después de la cosecha se transportaron por 1,5 h y se almacenaron en refrigeración (TR) (6 °C) o temperatura ambiente (TA) (16 ± 2 °C). A partir de 1 y hasta 15 días después de cosecha (DDC), cada tercer día se analizó pérdida de peso, color L*, a* y b*, firmeza y deformación de fruto. Después de 15 días de almacenamiento a TA, 1 mM BAP aplicado en cualquier fecha redujo el oscurecimiento poscosecha de la cáscara, conservando el color L* más de 35% en relación al control (ρ ≤ 0,05).
Palabras clave: almacenamiento, color, hormona vegetal, oscurecimiento de cáscara.
Abstract
The cherimoya (Annona cherimola Mill.) fruit is climacteric and has a very short postharvest life; the symptoms of senescence include peel browning and fruit softening. The objective of this research was to evaluate the effect of application of 6-benzylaminopurine (BAP) in the postharvest life of cherimoya fruit ‘Fino de Jete’. Fruits were randomly selected from the middle and basal part of six trees. BAP was applied at 1.0 mM or 0 mM in every of two dates, that is 8 or 15 days before harvest (DAC). After harvest, fruits were transported for 1.5 h and stored in two different temperatures, refrigerated (TR) (6 °C) or room temperature (TA) (16 ± 2 °C). Every third day, from 1 to 15 day after harvest (DDC), they were analyzed in relation to weight loss, color L*, a* and b*, and fruit firmness and deformation. In TA, the fruits treated with 1 mM BAP in both, 8 or 15 DAC retained peel color L* over 35% (ρ ≤ 0.05) in relation to control.
Keywords: storage, color, plant hormone, peel darkening.
1. Introducción
La chirimoya es una fruta rica en hidratos de carbono, vitaminas A y C, niacina, riboflavina, ácido fólico, potasio y fósforo (Leboeuf et al., 1982). Además, provee metabolitos secundarios benéficos para la salud humana, como los fenólicos simples y flavonoides (Pinto et al., 2005). A pesar de su potencial e importancia nutricional, existe poca información sobre los índices de madurez y el manejo poscosecha, en este último periodo se presentan altos porcentajes de pérdida económica. Después del corte, la chirimoya se ablanda muy rápidamente, lo cual limita su movimiento a mercados distantes. Por ejemplo, en chirimoya ‘Fino de Jete’ se observó un ablandamiento de 300 Newtons (N) a 21 y 4 N, durante su almacenamiento a 7 y 15 días a temperatura ambiente (Morales et al., 2014).
Se ha propuesto que el color de la cáscara de chirimoya es un índice de cosecha, ya que cambia de verde oscuro a verde amarillento (González et al., 2010); una vez cortada, la chirimoya presenta rápido bronceado en la cáscara (Prieto et al., 2007), lo cual demerita la calidad y la apariencia del fruto para el consumidor. El bronceado de la cáscara es un proceso catalizado principalmente por la polifenol oxidasa (PPO) (Amiot et al., 1996; Bray et al., 2000) y además, durante la senescencia del tejido vegetal hay pérdida de clorofila y reducción de proteínas, así como aumento en el estrés oxidativo, generando especies reactivas de oxígeno (Prochazkova et al., 2001). El proceso de senescencia en vegetales y frutos es modulado por las fitohormonas i.e. etileno, citocininas, giberelinas, auxinas y ácido abscicico. En ese sentido, se ha observado que la 6-bencilaminopurina (BAP), una citocinina, reduce la senescencia vegetal en hojas de tabaco transgénico (Nicotiana tabacum) (Wingler et al., 1998); además, limita la degradación de pigmentos y proteínas fotosintéticas, y mantiene el equilibrio hídrico de tejidos en trigo harinero (Triticum aestivum L.) (Costa et al., 2005; Zavaleta-Mancera et al., 2007). La aplicación poscosecha de BAP en brócoli (Brassica oleracea) evitó su oscurecimiento oxidativo (Costa et al., 2005), disminuyó la tasa de respiración (Rushing, 1990), y retrasó el amarillamiento de la flor (Zhu et al., 2004; Zaicovski et al., 2008). Por otro lado, en plátano (Musa paradisiaca) una dosis de 1 mM BAP mantuvo el contenido de clorofila y redujo la tasa de deshidratación en la cáscara durante la maduración (Aghofack-Nguemezi y Manka´abiengwa, 2012).
Debido a que no hay información acerca de aplicación exógena de citocininas a frutos del género Annona, específicamente a chirimoya, el objetivo del presente estudio fue conservar la calidad y alargar la vida poscosecha de chirimoya ‘Fino de Jete’ a través de la aplicación de 1,0 mM de BAP 8 y 15 días antes de la cosecha.
2. Materiales y Métodos
Aplicación de 6-Bencilaminopurina
Los frutos de chirimoya ‘Fino de Jete’ se obtuvieron como se indica en Morales et al. (2014). La aplicación de la solución de 6-bencilaminopurina (Sigma Aldrich) en agua destilada, a dosis de 1 o 0 mM, se realizó 8 y 15 días antes de la cosecha (madurez fisiológica) con un pincel directamente a la fruta, esto, para evitar contaminación a otras chirimoyas del mismo árbol o árboles aledaños. Las frutas fueron etiquetadas y permanecieron en el árbol 8 y 15 días (d) antes de ser cosechados; en un mismo árbol se tuvieron la misma cantidad de frutas de los cuatro tratamientos. Una vez cosechada, la fruta se empacó y transportó al laboratorio de Horticultura de la Universidad Autónoma del Estado de México.
Evaluación poscosecha
Una vez en el laboratorio, se formaron dos lotes de frutas para cada dosis y fecha de aplicación de BAP; cada uno de dichos lotes se almacenó ya sea en refrigeración (TR) (6 °C) o a temperatura ambiente (TA) (16 ± 2 °C). Posteriormente, cada tercer día, a partir del día 1 después de cosecha (DDC) hasta 15 DDC se evaluó la cinética de peso, color de la cáscara, firmeza y deformación de la cáscara (Morales et al. 2014). Para esta investigación, debido a que los factores L* y a* presentaron resultados de mayor interés comercial, se omite la presentación de los factores b*, croma y matiz (hue).
Diseño experimental y análisis estadístico
El diseño experimental fue completamente al azar con tres factores, dosis de BAP (con dos niveles, 0 y 1 mM), fecha de aplicación (con dos niveles, 8 y 15 días antes de la cosecha) y temperatura de almacenamiento (con dos niveles, TA y TR). Para cada tratamiento se tuvieron nueve repeticiones, un fruto por repetición; para firmeza y deformación del fruto y color de la cáscara se realizaron dos mediciones por repetición. Los resultados se analizaron con análisis de varianza y las medias se compararon, cuando fue necesario, con la prueba de Tukey (ρ ≤ 0,05), usando el paquete estadístico IBM SPSS Inc. v.19.
3. Resultados y discusión
En todas las variables evaluadas se observó un efecto significativo de la temperatura de almacenamiento. Esto se explica debido a que las temperaturas de refrigeración generalmente disminuyen diversas actividades metabólicas de los frutos i.e. respiración, transpiración, etc. (Valero y Serrano, 2010). En tal sentido, en esta investigación los resultados se muestran en diferentes gráficas para cada una de las dos temperaturas de almacenamiento y se profundiza en la discusión relativa al efecto de la citocinina sobre la chirimoya.
Pérdida de peso
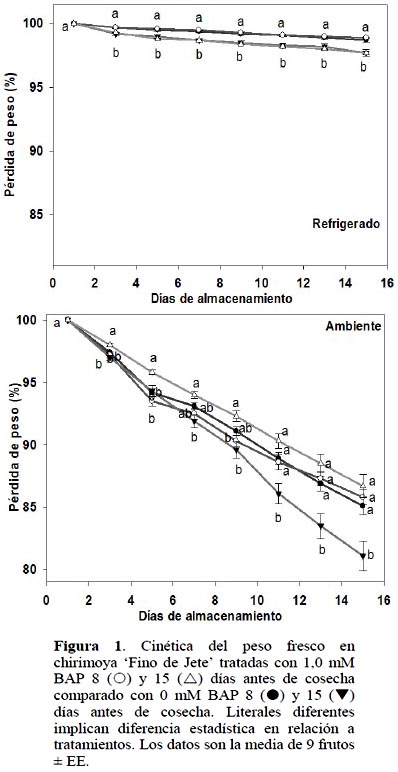
En los frutos almacenados a TR, la aplicación de 1,0 mM BAP tanto a 8 como a 15 DAC no manifestó diferencia significativa (ρ ≤ 0,05) en relación a frutos control. Sin embargo, se observó que el periodo que transcurrió entre la aplicación de BAP y la cosecha del fruto afectó (ρ ≤ 0,05) la cinética del peso fresco. Los frutos con mayor tiempo en el árbol, i.e. aplicación de 1 y 0 mM BAP a 15 DAC, perdieron 2% más peso que las chirimoyas tratadas a 8 DAC. Se sabe que la pérdida de peso de los frutos es debido principalmente al proceso de transpiración (Díaz-Pérez et al., 2007); esto indica que aquellas chirimoyas tratadas 8 DAC transpiraron menos que las tratadas a 15 DAC.
Por otro lado, en las chirimoyas almacenadas a TA y tratadas con 1,0 mM BAP 15 DAC se presentaron diferencias significativas (ρ ≤ 0,05) desde 3 DDC y hasta el final del almacenamiento con relación a su control.
Al final del almacenamiento, 1,0 mM BAP 15 DAC redujo 5,6% la tasa de deshidratación (Figura 1). Según Lim et al. (2007), la aplicación foliar de BAP prolongó el almacenamiento poscosecha en algunos forrajes de gramíneas y aumentó la tolerancia al estrés hídrico. Los resultados del presente estudio indican que en los frutos almacenados a TA, la aplicación de BAP 1,0 mM a 15 DAC, posiblemente genera que esta citocinina intervenga en los procesos fisiológicos de respiración, transpiración y ajustes osmóticos, factores responsables de la pérdida poscosecha de agua de frutos de chirimoya (Goñi et al., 2008).
Color de cáscara (L* y a*)
De manera similar a lo observado en la cinética de peso, los frutos refrigerados presentaron, desde la cosecha y hasta 7 DDC, diferencias (ρ ≤ 0,05) por efecto de la fecha de aplicación de BAP. Aquellos frutos tratados 8 DAC promediaron 41 unidades L*, mientras que los tratados 15 DAC promediaron 39 unidades L*. Sin embargo, el efecto de la fecha de aplicación no se observó en el lote almacenado a TA, donde el promedio fue 40 unidades L* (Figura 2).
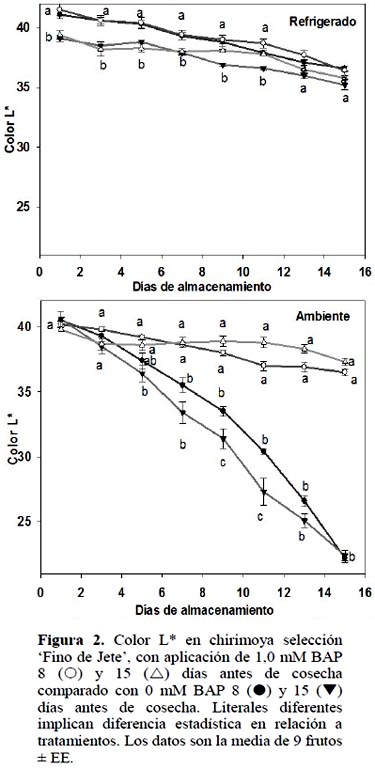
En los frutos refrigerados, sólo a los 9 y 11 DDC, la aplicación 15 DAC de 1 mM BAP inhibió el bronceado del fruto lo cual no se observó con la aplicación 8 DAC. Debido a que al final del tiempo almacenado no hubo diferencia respecto al control, los resultados no son satisfactorios para proponer la aplicación BAP cuando las chirimoyas se almacenarán en refrigeración.
Por otro lado, al final de 15 d de almacenamiento, en los frutos tratados con 1,0 mM BAP, tanto a 8 como 15 DAC, se redujo (ρ ≤ 0,05) 36 y 38% del oscurecimiento de la cáscara en relación al respectivo control. La reducción en el valor de L* implica pérdida de luminosidad de la clorofila, y este idea es confirmada por el cambio de valores negativos a positivos en el factor a* del color de los frutos control al almacenarse en las condiciones indicadas (Figura 3).
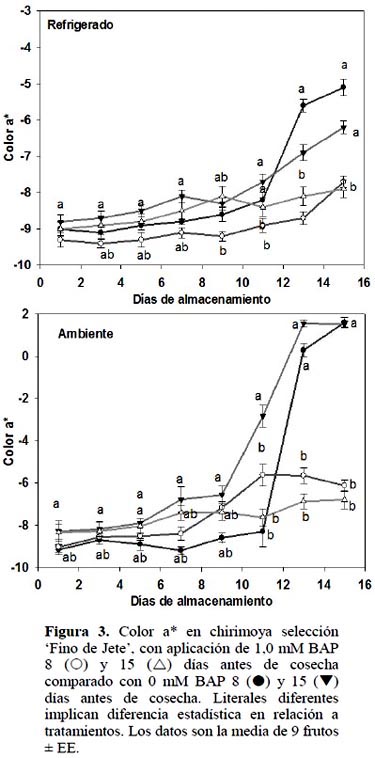
Esto ha sido confirmado por Gwanpua et al. (2014) quienes encontraron una relación de 0,93 entre el contenido de clorofila y el factor a* del color en manzanas ʻJonagoldʼ, indicando que a valores negativos de a*, mayor contenido de clorofila.
Previamente, Hörtensteiner (1999) reportó que BAP previene o retrasa la degradación de clorofila, esto debido al decremento del nivel de las enzimas clorofilasa, Mg-dequelatasa y peroxidasa en plantas superiores.
Profundizando en esta explicación, se ha determinado que BAP reduce la expresión de genes relacionados a la degradación de la clorofila (Gómez-Lobato et al., 2012), retrasando la disrupción de los cloroplastos y por ende el amarillamiento de hojas en diversas especies (Ben-Yaakov et al., 2006).
En este sentido, los datos del presente documento indican claramente que BAP mantuvo el color verde de la chirimoya cuando se almacenó a temperatura ambiente (Figura 4), pero no al almacenarse en refrigeración. Es decir, es posible recomendar la aplicación de BAP cuando el fruto se comercializará en mercados locales, en donde generalmente la exposición de la fruta es a temperatura ambiente.

Al comparar el color de la cáscara de frutos almacenados en las dos temperatu-ras, se observó que en refrigeración no existió efecto de BAP para mantener el color verde, lo cual sugiere que la temperatura de refrigeración evita la rápida degradación de la clorofila. Esto apoyado por el hecho de que en esta temperatura de almacenamiento, los valores a* de la cáscara de los distintos frutos fueron siempre negativos durante 15 DDC. De manera similar, Massolo et al. (2014) observó que 1 mM BAP no evitó la pérdida de color verde en calabacita (Cucurbita maxima) almacenada en refrigeración. En este sentido es importante verificar la cadena poscosecha que seguirá el fruto para recomendar la aplicación de BAP en chirimoya.
Firmeza y deformación del fruto
En ambas condiciones de almacenamiento, la aplicación de BAP no generó diferencia significativa (p ≤ 0,05) ni para la firmeza del fruto ni para la deformación del mismo (Figuras 5 y 6).
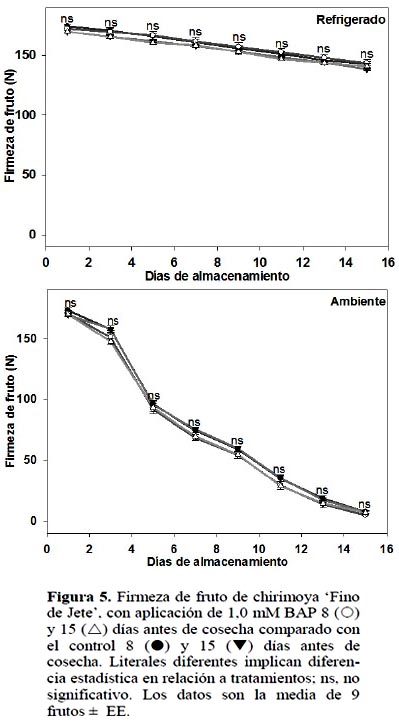
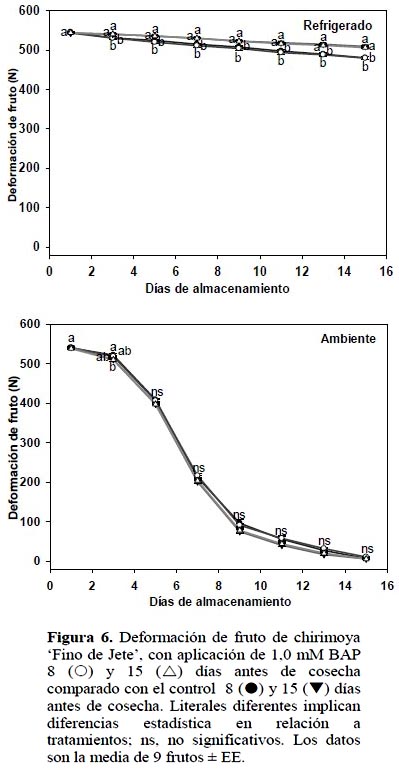
La firmeza está relacionada con la pérdida de agua, a menor deshidratación los frutos permanecen más turgentes (Jiménez et al., 2005) y por consecuencia presentan más firmeza. En este experimento, como ya se indicó, pese a que 1,0 mM BAP aplicado 15 DAC inhibió la deshidratación en frutos almacenados a temperatura ambiente, la firmeza y deformación del fruto no fueron afectadas.
En el almacenamiento refrigerado se presentó efecto por fecha de aplicación de BAP, es decir fecha de corte. En aquellas chirimoyas tratadas 8 DAC, la tasa de pérdida de firmeza fue mayor (4,8%) que las tratadas a 15 DAC (Figura 6). En los frutos almacenados a temperatura ambiente no hubo diferencia estadística. El ablanda-miento de los frutos es consecuencia, entre otros factores, de la hidrólisis de los polipéctidos presentes en la lámina media y pared celular responsables de la firmeza en los frutos (Seymour y Gross, 1996). Para ambas determinaciones de firmeza, se observa el lógico ablandamiento mayor de los frutos almacenados a temperatura ambiente, en relación a aquellos almacenados a temperatura de refrigeración, lo cual ha sido reportado por diferentes autores (Shen et al., 2009).
4. Conclusiones
La aplicación de 1 mM de 6-bencil-aminopurina, tanto 8 o 15 días antes de cosecha, redujo el oscurecimiento poscosecha de la cáscara de chirimoya durante su almacenamiento a temperatura ambiente. Esto se manifiesta por valores estables en los factor L* y a* de color de la cáscara al aplicar 1 mM de 6-bencilaminopurina; mientras que los frutos control perdieron valor en L* y pasaron de negativos a positivos en a*. Sin embargo, cuando el fruto se almacenó en refrigeración, no se observó este efecto benéfico. El oscurecimiento de la cáscara de chirimoya en poscosecha, provoca apariencia avejentada del fruto, poco apetecible para el consumidor y por consecuencia fuera de punto de venta; la 6-bencilaminopurina provee al fruto buena apariencia en color y turgencia, porque además disminuyó la tasa de deshidratación en 5,6%. Es posible sugerir la aplicación 6-bencilaminopurina para mejorar la cadena poscosecha de la chirimoya y posiblemente de otras anonáceas.
Agradecimientos
Esta investigación fue financiada parcialmente por la Universidad Autónoma del Estado de México (proyecto 2678/2008). Se agradece el apoyo de la Fundación Salvador Sánchez Colin-CICTAMEX, especialmente al Ing. Pedro Mijares Oviedo, por permitir trabajar en sus instalaciones. Aaran Aquilino Morales Pérez fue becario de CONACYT.
5. Referencias bibliográficas
Aghofack-Nguemezi, J.; Manka´abiengwa, J. 2012. Effects of exogenously applied benzylaminopurine and kinetin on the ripening of banana (Musa acuminate Colla var. William) fruits. American Journal of Plant Physiology 7: 154-163. [ Links ]
Amiot, M.J.; Richard-Forget, F.; Goupy, P. 1996. Polyphenol, oxidation and colour: progress in the chemistry of enzymatic and no enzymatic derived products. Herba Polonica 42: 237-247. [ Links ]
Ben-Yaakov, E.; Harpaz-Saad, S.; Galili, D.; Eyal, Y.; Goldschmidt, E.E. 2006. The relationship between chlorophyllase activity and chlorophyll degradation during the course of leaf senescence in various plant species. Israel Journal of Plant Sciences 54: 129-135.
Bray, E.A.; Bailey-Serres, J.; Weretilnyk, E. 2000. Responses to abiotic stresses. In W. Gruissem, B. Buchannan, R. Jones, eds, Biochemistry and Molecular Biology of Plants. American Society of Plant Physiologists, Rockville, USA. p. 1158-1249. [ Links ]
Costa, M.L.; Civello, P.M.; Chávez, A.R.; Martínez, G.A. 2005. Effect of ethephon and 6 benzylaminopurine on chlorophyll degrading enzymes and a peroxidase linked chlorophyll bleaching during postharvest senescence of broccoli (Brassica oleracea L.) at 20 °C. Postharvest Biology and Technology 35: 191-199. [ Links ]
Díaz-Pérez, J.; Muy-Rangel, M.; Mascorro, A. 2007. Fruit size and stage of ripeness affect postharvest water loss in bell pepper fruit (Capsicum annuum L.). Journal of the Science of Food Agriculture 87: 68-73. [ Links ]
Gómez-Lobato, M. E.; Civello, P. M.; Martínez, G. A. 2012. Effects of ethylene, cytokinin and physical treatments on BoPaO gene expression of harvested broccoli. Journal of the Science of Food and Agriculture 92: 151-158. [ Links ]
Goñi, O.; Escribano, M. I.; Merodio, C. 2008. Gelatinization and retrogradation of native starch from cherimoya fruit during ripening, using differential scanning calorimetry. LWT- Food Science and Technology 41: 303-310. [ Links ]
González, M.; Peinado, S.; Pinillos, V.; Hueso, J. J.; Alonso, F. 2010. Fenología de la maduración del fruto en chirimoyo (Annona cherimola Mill.). Determinación de un índice de recolección. Fundación Cajamar. Almeria, España. 27 p. [ Links ]
Gwanpua, S. G.; Vicent, V.; Verlinden, B. E.; Hertog, M. L. A. T. M.; Nicolai, B. M. 2014. Managing biological variation in skin backround colour along the postharvest chain of ʻJonagoldʼ apples. Postharvest Biology and Technology 93: 61-71. [ Links ]
Hörtensteiner, S. 1999. Chlorophyll breakdown in higher plants and algae. Cellular and Molecular Life Sciences 56: 330-347. [ Links ]
Jiménez, J. B.; Orea, J. M.; Montero, C.; González-Ureña, A.; Navas, E.; Slowing, K.; Gómez-Serranillos, M. P.; Carretero E.; de Martinis, D. 2005. Resveratrol treatment controls microbial flora, prolongs shelf life, and preserves nutritional quality of fruit. Journal of Agricultural and Food Chemistry 53: 1526-1530. [ Links ]
Leboeuf, M., Cavé, A.; Bhaaumik, P. K.; Mukherjee, B.; Mukherjee, R. 1982. The phytochemistry of the Annonaceae. Phytochemistry 21: 2783-2813. [ Links ]
Lim, P. O.; Kim, H. J.; Ham, H. G. 2007. Leaf senescence. Annual Review of Plant Biology 58: 115-136. [ Links ]
Massolo, J. F.; Lemoine, M. L.; Chaves, A. R.; Concellón, A.; Vicente, A. R. 2014. Benzyl-aminopurine (BAP) treatments delay cell wall degradation and softening, improving quality maintenance of refrigerated summer squash. Postharvest Biology and Technology 93: 122-129. [ Links ]
Morales, P. A. A.; Franco-Mora, O.; Castañeda-Vildolzola, A.; Morales-Rosales, E. J. 2014. El efecto antisenescente del resveratrol reduce la tasa de ablandamiento poscosecha de chirimoya. Scientia Agricola 5: 35-44. [ Links ]
Pinto, A. C.; Cordeiro, M. C.; De Andrade, S. R.; Ferreira, F. R.; Filgueiras, H. A.; Alves, R. E., Kinpara, D. I. 2005. Annona Species. University of Southampton, Southampton, USA. pp. 33-43. [ Links ]
Prieto, H.; Utz, D.; Castro, A.; Aguirre, C.; González-Agüero, M.; Valdes, H.; Cifuentes, N.; Defilippi, B. G.; Zamora, P.; Zuñiga, G., Campos-Vargas, R. 2007. Browning in Annona cherimola fruit: role of polyphenol oxidase and characterization of a coding sequence of the enzyme. Journal of Agricultural and Food Chemistry 55: 9208-9218. [ Links ]
Prochazkova, D.; Sairam, R. K.; Srivastava, G. C.; Singh, D. V. 2001. Oxidative stress and antioxidant activity as the basis of senescence in maize leaves. Plant Science 161: 765-771. [ Links ]
Rushing, J. 1990. Cytokinins affect respiration, ethylene production, and chlorophyll retention of packaged broccoli florets. HortScience 25: 88-90. [ Links ]
Seymour, G. B.; Gross, K. C. 1996. Cell wall disassembly and fruit softening. Postharvest News and Information 7: 45-52. [ Links ]
Shen, W. B.; Li, C. R.; Chen, J. Y.; Xie, J. H.; Lu, W. J. 2009. Expansin gene expression in cherimoya fruit is correlated with flesh firmness during fruit ripening and softening. Journal of Horticultural Science and Biotechnology 84: 333-339. [ Links ]
Valero, D.; Serrano M. 2010. Postharvest Biology and Technology, CRC. USA. 288 p. [ Links ]
Wingler, A.; Schaewen, A.; Leegood, R. C.; Lea, P. J.; Quick, W. P. 1998. Regulation of leaf senescence by cytokinin, sugar, and light. Effects on NADH–depend hydroxypyruvate reductase. Journal of Plant Physiology 116: 329-335. [ Links ]
Zaicovski, C. B.; Zimmerman, T.; Nora, L.; Nora, F. R.; Silva, J. A.; Rombaldi, C. V. 2008. Water stress increases cytokinin biosynthesis and delays postharvest yellowing of broccoli florets. Postharvest Biology and Technology 49: 436-439. [ Links ]
Zavaleta-Mancera, H.; López-Delgado, H.; Loza-Tavera, H.; Mora-Herrera, M.; Trevilla-García, C.; Vargas-Suárez, M.; Ougham, H. 2007. Cytokinin promotes catalase and ascorbate peroxidase activities and preserves the chloroplast integrity during dark–senescence. Journal of Plant Physiology 164: 1572-1582. [ Links ]
Zhu, L. H.; Van de Pappel, A.; Li, X. Y.; Welander, M. 2004. Changes of leaf water potential and endogenous cytokinins in young apple trees treated with or without paclobutrazol under drought conditions. Scientia Horticulturae 99: 133-141. [ Links ]
* Autor para correspondência
E-mail: ofrancom@uamex.mx (O. Franco-Mora).
Recibido 20 abril 2015
Aceptado 28 mayo 2015.














