Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Scientia Agropecuaria
versão impressa ISSN 2077-9917
Scientia Agropecuaria vol.6 no.3 Trujillo jul. 2015
http://dx.doi.org/10.17268/sci.agropecu.2015.03.02
ARTÍCULOS ORIGINALES
Estabilidad oxidativa y estimación de la vida útil del aceite de sacha inchi (Plukenetia volubilis L.)
Oxidative stability and estimate of the shelf life of sacha inchi (Plukenetia volubilis L.) oil
Gilbert Rodríguez 1,*; Eudes Villanueva1; Patricia Glorio2; Mery Baquerizo3
1 Universidad Nacional Del Santa, Urb. Bellamar s/n, Chimbote, Perú. E-mail:giropape@yahoo.com
2 Universidad Nacional Agraria La Molina, Av. La Molina, Lima, Perú.
3 Universidad Nacional Del Centro, Av. Mariscal Castilla, Huancayo Perú.
Resumen
El aceite de sacha inchi es rico en ácidos grasos poli-insaturados que podrían oxidarse, limitando su vida útil. El método Rancimat, es oficial, para evaluaciones aceleradas de estabilidad oxidativa en aceites. A nivel industrial se usan técnicas convencionales basadas en indicadores fisicoquímicos, no existiendo estudios de correlación entre ellas y Rancimat. Este trabajo tiene por objetivo correlacionar el índice de estabilidad oxidativa (OSI) en aceite de sacha inchi obtenido mediante Rancimat a temperaturas de 80º, 90º, 100º y 110 ºC bajo un flujo de aire de 15 L/h, con los valores de indicadores fisicoquímicos tales como Índice de peróxido, p-anisidina, totox y densidad. Asimismo estimar mediante extrapolación matemática, la vida útil del aceite de sacha inchi a temperaturas usuales de almacenamiento. Se encontró valores OSI de: 0,493 ± 0,01 h a 110 ºC, 1,590 ± 0,06 h a 100 ºC, 4,645 ± 0,1 h a 90 ºC y 20,512 ± 0,02 h a 80 ºC. Se ha establecido alta correlación entre valores de OSI vs índices fisicoquímicos de calidad (0,9322 < r < 0,9965). La energía de activación encontrada fue de 137,90 kJ/mol, lo que explica la alta estabilidad oxidativa para el aceite, estimándose una vida útil de 3,29, 1,79 y 0,79 años a 20, 25 y 30 °C respectivamente.
Palabras clave: aceite de sacha inchi, índice de estabilidad oxidativa, método Rancimat.
Abstract
Sacha inchi oil is rich in polyunsaturated fatty acids that may rust, limiting their shel flife. The Rancimat method is official, for evaluations of oxidative stability accelerated in oils. Industrially conventional techniques based on physical and chemical indicators are used; there are no studies of correlation between them and Rancimat. This work has for objective correlate the oxidative stability index (OSI) Sacha inchi oil obtained by Rancimat at temperatures of 80°, 90°, 100° and 110 °C under an air flow of 15 L/h, with the values of physic-chemical indicators such as Index peroxide, p-anisidine, totox and density. Also estimated by mathematical extrapolation, the shelf life of sacha inchi oil to usual storage temperatures. OSI values were: 0.493 ± 0.01 h at 110 ºC, 1.590 ± 0.06 h at 100 ºC, 4.645 ± 0.1 h at 90 ºC and 20.512 ± 0.02 h at 80 ºC. High correlation has been established between values of OSI vs physicochemical quality indices (0.9322 < r < 0.9965). The activation energy was found 137.90 kJ/mol, which explains the high oxidative stability for the oil, estimating a lifetime of 3.29, 1.79 and 0.79 years at 20, 25 and 30 °C respectively.
Keywords: Sacha Inchi oil, oxidative stability index, Rancimat method.
1. Introducción
Originaria de la selva peruana, el sacha inchi (Plukenetia volubilis L.), también conocido como ''maní Inca'' o ''maní silvestre'', crece a altitudes entre 200 y 1500 msnm, son plantas oleaginosas de la familia Euphorbiaceae (Follegatti-Romero et al., 2009). La semilla de sacha inchi tiene más contenido de aceite que la soja y algodón, pero comparable al de girasol y maní (Hamaker et al., 1992). Las semillas contienen en promedio 48% de aceite y 27% de proteínas ricos en treonina y triptófano (Guillén et al., 2003).Sus variedades presentan un elevado rendimiento de aceite, Plukenetia volubilis 35,4% y Plukenetia huayllabambana 44,1% (Chirinos et al., 2015); los métodos de extracción que presenta esta semilla son prensado en frío (Navas, 2010), extracción con solvente por el método Soxhlet y resonancia magnética nuclear (NMR) (Longjian et al., 2014). El aceite de sacha inchi tiene alto contenido de ácidos grasos poliinsaturados (PUFAs), principalmente el ácido alfa linolenico (ALA, C18:3, omega-3) y el ácido linoleico (LA, C18:2, omega-6), encontrándose en aproximada-mente 47–51% y 34–37%, respectivamente (Fanali et al., 2011; Guillén et al., 2003); estos ácidos grasos esenciales ofrecen importantes beneficios para la salud y la nutrición, como la protección contra enfermedades cardiovasculares (Guillén et al., 2003); en la prevención de la artritis, cáncer, enfermedades coronarias, diabetes, entre otros (Gogus y Smith, 2010; Hanssen et all., 2011).
El aceite de sacha inchi tiene gran potencial de aplicación en la industria alimentaria y farmacéutica (Chirinos et al., 2013), ello se ve reflejado en el incremento de las áreas de sembrío de esta semilla y exportación del aceite; sin embargo, el alto contenido de ácidos grasos poliinsaturados del aceite es un factor que podría atentar contra su estabilidad oxidativa; Frankel (1998) argumenta que la auto oxidación de los aceites genera pérdida del valor nutricional y forma una serie de compuestos indeseables, siendo la principal causa de deterioro y su velocidad de reacción determina la estabilidad oxidativa y vida útil de estos productos. La determinación de la estabilidad oxidativa de los aceites se realiza por métodos estáticos tales como el índice de peróxidos, p-anisidina, dienos y trienos conjugados o métodos dinámicos que están estandarizados como el Índice de Estabilidad Oxidativa (OSI) por Rancimat (AOCS, Cd 12b-92), en la actualidad existen estudios que determinan la oxidación de aceite de sacha inchi bajo índices fisicoquímicos y oxidación acelerada por calorimetría diferencial de barrido no existiendo estudios en Rancimat (Chirinos et al., 2015). El método Rancimat se realiza bajo condiciones aceleradas de almacenamiento a altas temperaturas, es ampliamente utilizado por ser confiable, reproducible, no demanda consumo de reactivos y las medidas pueden ser monitoreadas automáticamente a través del tiempo (Frankel, 2005; Lutterodt et al., 2010; Gharby Said et al., 2011; Krichene et al., 2010; García-Moreno et al., 2013; De Leonardis y Macciola, 2012). El tiempo de estabilidad oxidativa determinado por el método Rancimat a temperaturas elevadas para un aceite en particular, se puede extrapolar a temperaturas bajas como las empleadas en almacenamiento; el tiempo hallado vendría a ser teóricamente la "vida útil" a temperatura de almacenamiento; el método de extrapolación incorpora la cinética de reacción y se basa en la ecuación de Arrhenius (Metrohm, 2009); Swinbourne (1985), citado por Navas y Carrasquero-Duran (2012), utilizaron el método de Van`tHoff para calcular el orden de reacción de la auto-oxidación del aceite refinado de soya en presencia de extracto de posingué; basado en estos principios, Navas (2010) ha estimado por extrapolación la vida útil de aceites vegetales como el de girasol (1,68 años), sésamo (0,50 años) y uva (0,22 años), sin embargo indica que no es muy adecuado para predecir la estabilidad de los aceites vírgenes durante el almacenamiento a temperatura ambiente. Papaseit y Cabré (1988) han establecido alta correlación entre la calidad organoléptica y los valores de estabilidad oxidativa Rancimat e indican que los valores fisicoquímicos de calidad contribuyen poco al conocimiento de la estabilidad de los aceites a la oxidación. Rauen et al. (1992) encontraron alta correlación entre las curvas de oxidación Rancimat con los índices de calidad del aceite de soya.
El presente trabajo tuvo como objetivos determinar el índice de estabilidad oxidativa (OSI) del aceite de sacha inchi por método Rancimat a temperaturas de 80, 90, 100 y 110 °C y flujo de aire de 15 L/h; además, determinar la evolución de los índices fisicoquímicos de calidad tales como el índice de peróxido, p-anisidina, totox y densidad, luego establecer el nivel de correlación entre ellas; posteriormente, utilizando los valores del OSI estimar la energía de activación y la vida útil del aceite de sacha inchi mediante el método de extrapolación a temperaturas usuales de almacenamiento.
2. Material y métodos
2.1 Materiales
Las semillas de sacha inchi se cosecharon en la Región San Martin, provincia de Lamas, Perú (06°25′00″S de altitud y 76°32′00″W de latitud); el aceite fue extraído por prensado en frio (Prensa SEW-EURODRIVE modelo FA57/G, Alemania) con una velocidad de tornillo de 40 rpm y temperatura máxima de 40 °C, las semillas tuvieron una humedad de 9,12 ± 0,03 %. Las características del aceite fueron las siguientes: densidad 0,9291± 0,01 g/ml, índice de peróxidos 0,80 ± 0,02 meq O2/ Kg e índice de acidez 0,24± 0,1%. El aceite se mantuvo durante 45 días en un frasco obscuro bajo atmosfera de nitrógeno en un refrigerador (BOSCH, modelo KAN58A, Corea del Sur) a temperatura de (4,00 ± 0,5°C) en las instalaciones del Instituto de Investigación Tecnológica Agroindustrial de la Univer-sidad Nacional del Santa..
2.2 Composición de ácidos grasos
La composición de ácidos grasos del aceite de sacha inchi se determinaron al aceite fresco en almacenamiento y al aceite sometido en Rancimat a temperatura 110 °C por 50 minutos. Los esteres metílicos de ácidos grasos fueron preparados de acuerdo al método FAMES, AOAC 991.39. Brevemente, 0,025 g de aceite se hizo reaccionar con 1,5 ml de NaOH 0,5 N a temperatura de 80-90 °C por 5 minutos, posteriormente se enfrió a temperatura de 30-40 °C agregándose 2,0 ml de trifluoruro de boro calentándose a 100°C por 30 minutos, nuevamente se enfrío añadiéndose 1 ml de iso-octano y 5 ml de solución saturada de NaCl, todo bajo agitación y cubierto constantemente con Nitrógeno. La identificación de los componentes se determinó en el croma-tógrafo de gases (Shimadzu, modelo GC-2010, Japón), equipado con un detector de ionización de llama (FID) y un muestreador automático Shimadzu AOC-20Si. Una columna capilar de sílice SP Rt™ - 2560 (100 m x 0,25 mm con 0,25 µm film) se utilizó helio como gas portador a una velocidad de flujo de 30 ml/min y presión de 261,5 kPa. El Volumen de inyección fue de 1µl.
2.3 Estabilidad oxidativa en Rancimat
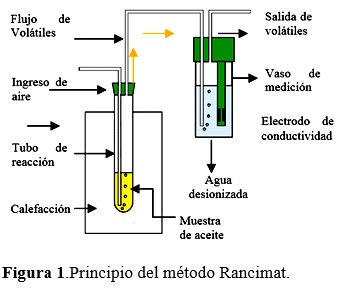
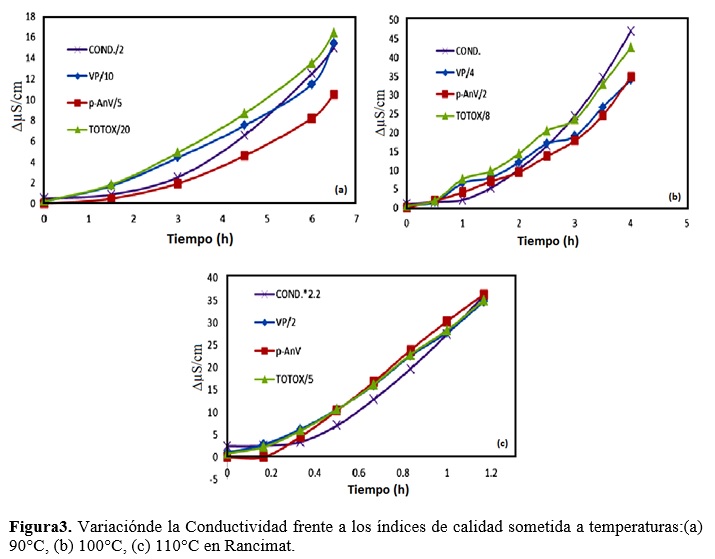
La estabilidad oxidativa se determinó en el equipo Rancimat (Metrohm, modelo 743, Switzerland), incluido en los estándares internacionales AOCS Cd 12b-92. Un flujo de aire de 15 L/h filtrado y seco se burbujeo en una muestra de 5,0 ± 0,1 g de aceite contenida en un tubo de reacción posteriormente fijada en un bloque de calefacción a temperaturas de 80, 90, 100 y 110°C. El aire efluente que contienen los ácidos orgánicos volátiles de la muestra se recogen en un recipiente de policarbonato con 60 ml de agua destilada, la conductividad (µS/cm) del agua se registró continuamente (Fig. 01). El índice de estabilidad oxidativa (OSI) fue determinado en horas.
2.4 Vida Útil
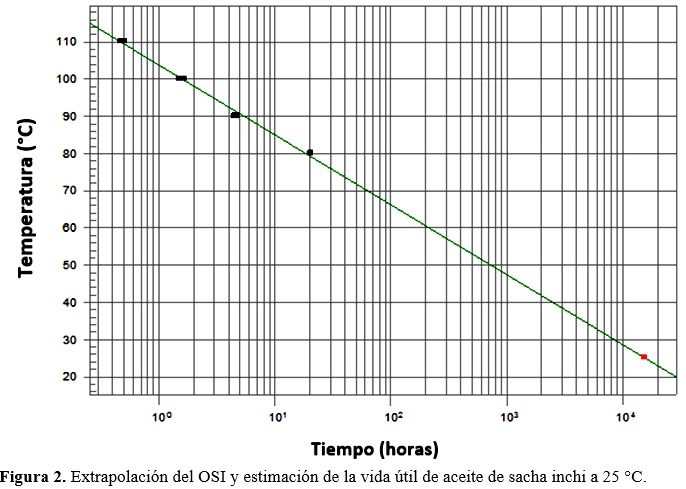
Se estimó la vida útil mediante el método de extrapolación a temperaturas usuales de almacenamiento (20, 25 y 30 °C), estableciendo una relación matemática entre los valores de OSI y la temperatura (80, 90, 100 y 110°C), utilizados en el equipo Rancimat, tal como lo han señalado para aceites vegetales, Nakataniet et al. (2001) y Méndez et al. (1996).
Log (OSI) = A + BT
2.5 Índices de Calidad
El valor de peróxido (PV) se calculó conforme al método AOAC Cd 8-53.El valor de p-anisidina (p-AnV) según el método AOCS Cd 18-90 en espectro-fotómetro Jasco (modelo V-670); El valor de oxidación total (totox) fue calculado de acuerdo a Shahidi y Wanasundara (2002) como: totox= (2×PV) + p-AnV. La densidad se determinó en un densímetro digital automático Rudolph Research Analytical DOM 2911, EE.UU.
2.6 Energía de activación (Ea )
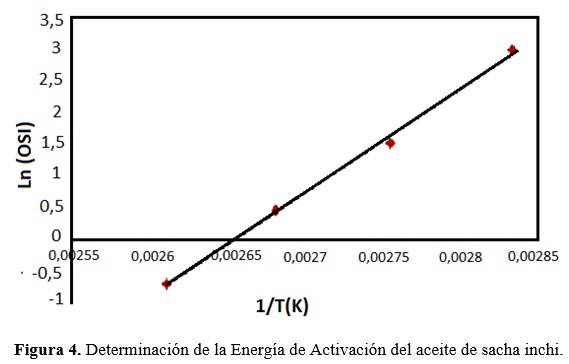
Se determinó a partir de la pendiente de la recta que resulta de representar el logaritmo natural de los valores de OSI contra el inverso de la temperatura absoluta. Según las consideraciones de Blaine (1992) y García-Ochoa et al. (1989).
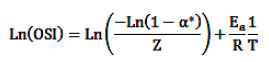
Donde α* representa el grado de transformación de moléculas insaturadas para el tiempo de inducción, R representa la constante universal de los gases (8,314 KJ/mol) y Z es el factor pre-exponencial de la ecuación de Arrhenius.
3. Resultados y discusión
Composición de ácidos grasos del aceite de sacha inchi
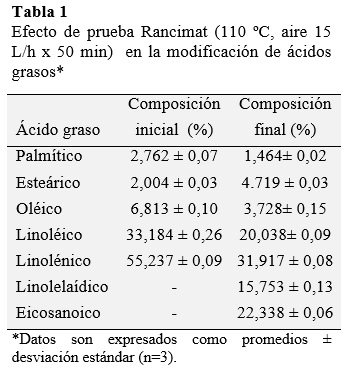
La composición en ácidos grasos del aceite de sacha inchi se resume en la Tabla 1. El aceite fresco está constituido de 6,813% ácidos grasos mono-insaturados y un 88,421% por ácidos grasos poliinsaturados, también se encontró 4,766% de ácidos grasos saturados; los resultados son concordantes con los reportados por Gutiérrez et al. (2011), Hamaker et al. (1992), Pascual et al. (2000), y Follegatti-Romero (2009).
El aceite de sacha inchi sometido a Rancimat (110 ºC, 15 L/h de aire por 50 minutos) evidencia el decaimiento de ácidos grasos mono-insaturados desde 6,813% a 3,728% y poliinsaturados desde 88,421% a 51,995%, con el consiguiente aumento de ácidos grasos saturados (Tabla 1). Según De Leonardis y Macciola (2012), la degradación de los PUFAs se relaciona con un aumento de los ácidos grasos saturados.
También se observa la generación del ácido graso transomega-6linole-laídico (15,75%) que es un isómero geométrico del ácido linoleico, esto se debe a que los hidrógenos alilicos en doble enlace cis están más expuestos y accesibles para la abstracción en ácidos grasos cis que en sus isómeros trans, por lo tanto, los ácidos grasos cis oxidan más fácilmente que sus contra-partes trans (Sargis y Subbaiah, 2003); de igual manera se observa la generación de ácido eicosanoico.
Índice de estabilidad oxidativa en Rancimat
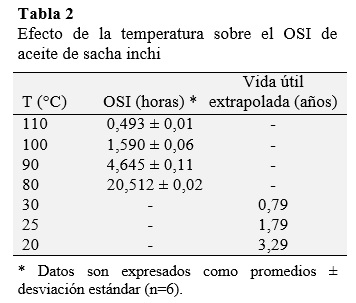
Los valores OSI de aceite de sacha inchi a diferentes temperaturas son presentados en la Tabla 2. El método de las tangentes fue utilizado para el cálculo de OSI. La oxidación del aceite se lleva a cabo en dos pasos principales: Período de inducción con la formación de hidroperóxidos conjugados (que contiene dobles enlaces trans conjugadas) y el período de oxidación final donde hidroperóxidos se dividen en compuestos orgánicos aromáticos de cadena corta (principalmente aldehídos, cetonas, alcoholes, y ácidos grasos de cadena corta), que causan la rancidez (Sherwin, 1978).
La temperatura ejerció un efecto importante sobre los valores de OSI, en el aceite evaluado, con un de 3,406, lo cual era de esperarse ya que es conocido que la velocidad de las reacciones químicas tiende a duplicarse por cada 10 °C de aumento de la temperatura a la cual ellas ocurren (Navas, 2010). Por lo tanto, los valores más altos de OSI se obtuvieron a medida que la temperatura decrece en orden de: 110, 100, 90 y 80 °C (Tabla 2).
El nivel de ácidos grasos insaturados presentes en los aceites juega un papel determinante en su estabilidad oxidativa, altos grados de insaturaciones están asociados con un menor OSI. Sin embargo, el más bajo OSI no siempre corresponde con el más alto PUFA, lo que sugiere que otros factores, por ejemplo, el contenido de polifenoles y otros antioxidantes de origen natural en el aceite también contribuyen a la estabilidad oxidativa (Lutterodt, 2011).
El sacha inchi contiene una importante cantidad de tocoferoles (78,6 – 137,0 mg/100g de semilla), primando el γ-tocoferol (56,8 – 81,4 mg/100g) y δ-tocoferol (29,2 – 47,6 mg/100g), en menores cantidades el β-tocoferol (0,67 – 0,95 mg/100g) y α-tocoferol (1,13 – 1,27 mg/100g) (Chirinos et al., 2013), estos antioxidantes posiblemente migren al aceite; así, Follegatti – Romero et al. (2009) reportaron que el aceite de sacha inchi contenía 1,14 y 1,25 g/kg de γ-tocoferol y δ-tocoferol respectivamente, los cuales le confieren mayor estabilidad oxidativa ya que la actividad antioxidante de los tocoferoles en lípidos está en orden γ > δ > β > α (Schmidt y Pokorný, 2005).
Estimación de la vida útil del aceite de sacha inchi
La vida útil estimada a 20, 25 y 30 °C fue de 3,29, 1,79 y 0,79 años (Tabla 2), mediante el método de extrapolación (Fig. 2), esta estabilidad supera a otros aceites vegetales cuya vida útil fue estimada como el de girasol (1,68 años), sésamo (0,50 años) y uva (0,22 años), a la misma temperatura(Navas, 2010). También supera al aceite de oliva que se encuentra entre 1,14 y 1,63 años obtenido mediante un modelo de regresión combinado en almacenamiento a 50 ° y altas temperaturas en Rancimat a 100-130 °C (Farhoosh, 2013). Debido a que la velocidad de oxidación es exponencialmente proporcional a la temperatura, la vida útil de un lípido disminuye logarítmicamente con el aumento de la temperatura (Frankel, 1998).
Índices fisicoquímicos de calidad
Los índices fisicoquímicos de calidad se determinaron a las muestras reaccionadas en rancimat, para ello se enfrió rápida-mente con agua helada manteniéndose en todo momento bajo atmosfera de nitrógeno con la finalidad de detener la reacción de oxidación.
Las temperaturas (90, 100 y 110 °C) ejercieron un efecto importante sobre el valor de peróxidos (PV), el incremento de temperatura refleja mayor producción de hidroperóxidos. El PV del aceite al inicio fue de 2 meq / kg que está dentro del límite permitido para aceites vírgenes y prensados en frío (PV ≤ 15 meq / kg) (Codex Alimentarius, 2001), sin embargo el PV en el tiempo de estabilidad oxidativa a 90 ºC, 100 ºC y 110 ºC, se incrementaron a 74,97 meq / kg; 32,00 meq / kg y 21,32 meq / kg respectivamente (Fig. 3), estos valores son mayores al límite permitido para el aceite comestible, debido a que el método rancimat tiende a acelerar la velocidad de formación de hidroperóxidos, los que posteriormente derivaran en compuestos volátiles.
La prueba de p-anV mide compuestos oxidativos secundarios que reaccionan con la p-anisidina reactiva. El aceite antes de someterse a Rancimat tuvo un Índice de anisidina cercana a cero; a medida que se sometió a prueba Rancimat, se incrementó levemente este indicador, mostrándose incrementos sustanciales después del tiempo de estabilidad oxidativa; para 90 °C en 6 h el p-AnV es de 40,86; a 100 °C en 2 h es 18,8; y finalmente, a 110 °C en 1 h es de 30,31 (Fig. 3). Generalmente, cuando los compuestos de oxidación secundaria (p-AnV) comienzan a surgir, normalmente se detecta una disminución progresiva en compuestos de oxidación primaria (PV) (Martin, 2012). En los resultados muestran aumento tanto de peróxidos como de p-AnV hasta después de los tiempos de inducción, lo que una vez más hace suponer que la aceleración de la oxidación en rancimat está produciendo de forma inmediata compuestos primarios y secundarios. El valor TOTOX es un buen indicador del deterioro de los aceites que relaciona el PV y el valor p-AnV para determinar el grado total de oxidación del aceite debido a la oxidación tanto primaria y secundaria (Shahidi y Wanasundara, 2002). Los resultados mostraron la misma tendencia creciente comparada con los otros indicadores; lo que nos indicaría que los compuestos primarios y secundarios de oxidación se están generando simultánea-mente (Fig. 3).
La densidad inicial que presentó el sacha inchi fue de 0,9291 ± 0,01 g/ml que concuerda con el valor 0,929 g/ml reportado por Gutiérrez et al. (2011) y 0,921 g/ml presentado por Juarez et al. (2015), ligeramente superior a los valores mostrados por Pascual et al. (2000) y Hurtado (2013) (0,918 g/ml y 0,919 g/ml) respectivamente; de esta forma se encuentra dentro de los rangos de densidad para aceites vegetales como el aceite de oliva (0,918 g/ml), maní (0,915 g/ml) y girasol (0,919 g/ml) (Codex Alimentarius, 2001). Bajo la prueba Rancimat, la densidad en el tiempo se vio afectada por todas las temperaturas reportándose un incremento sucesivo para cada una de ellas, lográndose densidades de hasta 0,931 g/ml; esto puede ser explicado por las recombinaciones de radicales alquilo primario que son las que generan los dímeros y polímeros que también dan cuenta del aumento de la viscosidad.
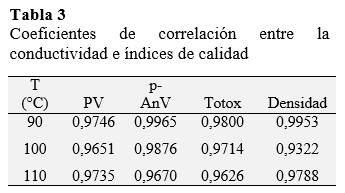
Los coeficientes de correlación (r) obtenidos entre el método rancimat y los diferentes índices de calidad fueron altos en todos los casos, como puede observarse en la Tabla 3. El intervalo se situó entre 0,9322 < r < 0,9965. El valor de peróxidos incrementa linealmente hasta el 80-90% del periodo de inducción (Mancebo, 2007).
Energía de Activación
El valor dela es de interés en la caracterización de los aceites debido a que es indicadora de la demora del proceso de oxidación inicial, debido a la escisión de la unión que tiene lugar para formar productos de oxidación primarios (Farhoosh et al., 2008). Se ha sugerido que la es influida por el grado de poliinsaturación de aceites, la parece ser menor para aceites con altos niveles de ácidos grasos poliinsaturados (Adhvaryu et al., 2000).
Considerándose por tanto al aceite de sacha inchi más estable frente a la oxidación acelerada, aun con sus altos niveles de ácidos grasos poliinsaturados, por lo que la barrera energética es mucho mayor para que las colisiones entre moléculas de oxígeno y las de los ácidos grasos poliinsaturados desencadenan la reacción de autooxidación.
4. Conclusiones
Los resultados de este estudio demostraron que índice de estabilidad oxidativa (OSI) realizado a temperaturas elevadas de reacción mediante el método Rancimat, guardan una alta correlación con los índices fisicoquímicos de calidad (0,9322 < r < 0,9965) en el proceso de oxidación acelerada del aceite de sacha inchi; permitiendo estimar con el método Rancimat la vida útil del aceite a temperaturas usuales de almacenamiento de 20 °C, 25 °C y 30 °C en 3,29, 1,79, 0,79 años respectivamente. Además este método también permite determinar su comportamiento termodinámico mediante el cálculo de la energía de activación, siendo 137,90 kJ/mol, el cual es superior a la de otros aceites vegetales poliinsaturados, esto puede ser debido a la presencia de compuestos con actividad antioxidante que se encuentran en el aceite de sacha inchi, elevando de esta manera su resistencia a la oxidación e incrementando su vida útil.
5. Referencias bibliográficas
Adhvaryu, A.; Erhan, S.; Liu, Z.; Perez, J. 2000. Oxidation kinetic studies of oils derived from unmodified and genetically modified vegetables using pressurized differential scanning calorimetry and nuclear magnetic resonance spectroscopy. Thermochemica Acta 364: 87–97. [ Links ]
Blaine, S.; Savage, P. 1992. Reaction Pathways in Lubricant Degradation, 3, Reaction Model for n-Hexadecane autoxidation. Engineering Chemical Research 31, 69–75. [ Links ]
Chirinos, R.; Zuloeta, G.; Pedreschi, R.; Mignolet, E.; Larondelle, Y.; Campos, D. 2013. Sacha inchi (Plukenetia volubilis): a seed source of polyunsaturated fatty acids, tocopherols, phytosterols, phenolic compounds and antioxidant capacity. Food Chemistry 141: 1732–1739. [ Links ]
Chirinos,R.; Pedreschi, R.; Domínguez, G.; Campos, D. 2015. Comparison of the physico-chemical and phytochemical characteristics of the oil of two Plukenetia species. Food Chemistry 173: 1203–1206. [ Links ]
Chirinos, R.; Pedreschi, R.; Cedano, I; Campos, D. 2015. Antioxidants from Mashua (Tropaeolum tuberosum) Control Lipid Oxidation in Sacha Inchi (Plukenetia volubilis L.) Oil and Raw Ground Pork Meat. Journal of Food Processing and Preservation (in press). [ Links ]
Codex Alimentarius. 2001. Fats, oils and related products (2nded.). Rome, Italy: FAO/WHO Food Standards Programme. [ Links ]
De Leonardis, A.; Macciola V. 2012. Heat – oxidation stability of palm oil blended with extra virgin olive oil. Food Chemistry 135: 1769-1776. [ Links ]
Fanali, C.;Dugo, L.; Cacciola, F.; Beccaria, M.; Grasso, S.; Dachà, M. 2011. Chemical characterisation of sacha inchi (Plukenetia volubilis L.) oil. Journal of Agricultural and Food Chemistry 59: 13043–13049. [ Links ]
Farhoosh, R.; Niazmand, R.; Rezaei, M.; Sarabi, M. 2008. Kinetic parameter determination of vegetable oil oxidation under Rancimat test conditions. European Journal of Lipid Science and Technology 110: 587–592. [ Links ]
Farhoosh, R.; Seyedeh, Z.; Hoseini, Y. 2013. Shelf life prediction of olive oils using empirical models developed at low and high temperatures. Food Chemistry 141: 557–565. [ Links ]
Follegatti, R.; Piantino, C.; Grimaldi, R. 2009. Supercritical CO2 extraction of omega-3 rich oil from SachaInchi (Plukenetia volubilis L.) seeds. Journal of Supercritical Fluids 49: 323–329. [ Links ]
Frankel, E. 1998. Lipid oxidation. The Oily Press, Dundee, UK. [ Links ]
Frankel, E. 2005. Lipid oxidation (2nd ed.). Bridg water, UK: The Oily Press Ltd. [ Links ]
Gharby, S.; Harhar, H.; El Monfalouti, H.; Kartah, B.; Maata, N.; Guillaume, D.; Char-rouf, Z. 2011. Chemical and oxidative properties of olive and Argan oils sold on the Moroccan market. A comparative study. Med. J. Nutr. Metab. 44: 1–8. [ Links ]
García, M.; Pérez, G., Antonio, G.; Emilia, M. 2013. Influence of the parameters of the Rancimat test on the determination of the oxidative stability index of cod liver oil. LWT - Food Science and Technology 51: 303-308 [ Links ]
Garcia, O.; Romer, A.; Querol, A. 1989. Modeling of the Thermal n-Octane Oxidation in the Liquid Phase. Industrial and Engineering Chemical Research 28: 43–48. [ Links ]
Guillén, M.; Ruiz, A.; Cabo, N.; Chirinos, R.; Pascual, G. 2003. Characterization of Sacha Inchi (Plukenetia volubilis L.) oil by FTIR spectroscopy and 1H NMR. Comparison with linseed oil. Journal of the American Oil Chemists Society 80: 755–762. [ Links ]
Gutiérrez, L.; Rosada, L.; Jiménez, A. 2011. Chemical composition of Sacha inchi (Plukenietia volúbilis L.) seeds and characterisation of their lipid fraction. Grasas y Aceites 62: 76–83. [ Links ]
Gogus, U.; Smith, C. 2010. n-3 Omega fatty acids: a review of current knowledge. Int. J. Food Sci. Technol 45: 417–436. [ Links ]
Hanssen, H.; Schmitz, H.; Preedy, R.; Watson, R.; Vinood, B. 2011. Sachai inchi (Plukentia volubilis L.) Nut oil and its therapeutic and nutritional uses. Nuts and seeds in health and disease prevention. Hamburgo, Germany. [ Links ]
Hamaker, B.;Valles, C.; Gilman, R.; Hardmeier, R.; Clark, D.; Garcia, H. 1992. Amino acid and fatty acid profiles of the inca peanut (Plukenetia volubilis). Cereal Chemistry 69: 436–461. [ Links ]
Hurtado, O. 2013. Análisis composicional de la torta y aceite de semillas de sacha inchi (Plukenetia volubilis) cultivada en Colombia. Tesis de Maestría. Universidad Nacional de Colombia, Facultad de Ciencias Agropecuarias, Escuela de Posgrados Palmira, Colombia. [ Links ]
Juarez, V.; De Carvalho, M.; Garcia, E. 2015. Fatty acids profile of sacha inchi oil and blends by 1H NMR and GC–FID. Food Chemistry 181: 215–221. [ Links ]
Krichene, D.; Allalout, A.; Mancebo-Campos V.; Salvador M.; Zarrouk M.; Fregapane G. 2010. Stability of virgin olive oil and behaviour of its natural antioxidants under medium temperature accelerated storage conditions. Food Chemistry 121: 171–177. [ Links ]
Longjian, N.; Jialong, L.; Mao, C.; Zeng, X. 2014. Determination of oil contents in sacha inchi (Plukenetia volubilis) seeds at different developmental stages by two methods: Soxhlet extraction and time-domain nuclear magnetic resonance. Industrial Crops and Products 56: 187–190 [ Links ]
Lutterodt, H.; Luther, M.; Slavin, M.; Yin, J.; Parry, J.; Gao, J.; Yu, L. 2010. Fatty acid profile, thymo quinone content, oxidative stability, and antioxidant properties of cold-pressed black cumin seed oils. LWT-Food Sci. Technol 43: 1409–1413. [ Links ]
Mancebo, V.; Salvador, M.; Fregapane, G. 2007. Comparative study of virgin olive oil behavior under rancimat accelerated oxidation conditions and long – term room temperature storage. Journal of Agricultural and Food Chemistry 55: 8231-8236. [ Links ]
Marquez, R.; Martin, P.; Velasco, J.; Dobarganes, C. 2008. Formation of oxidation compounds in sunflower and olive oils under oxidative stability index conditions. European Journal of Lipid Science and Technology 110: 1-6. [ Links ]
Martín, D.; Terrón, A.; Fornari, T.; Reglero, G.; Torres, C. 2012. Oxidative stabilization of ultra-high omega-3 concentrates as ethyl esters or triacylglycerols. Food Research International 45: 336-341. [ Links ]
Mendez, E.; Sanhueza, J.; Speisky, H.; Valenzuela, A. 1996. Validation of the Rancimat test for the assessment of the relative stability of fish oils. Journal of the American Oil Chemists Society 73: 1033–1037. [ Links ]
Metrohm. 2009. Programa para PC, 743 Rancimat 1.0 SR1. Herisau/ Suiza. [ Links ]
Nakatani, N.; Tachibana, Y.; Kikuzaki, H. 2001. Establishment of a model substrate oil for antioxidant activity assessment by oil stability index method. Journal of the American Oil Chemists Society 78: 19–23. [ Links ]
Navas, H. 2010. Componentes minoritarios y propiedades antioxidantes de aceites vírgenes y tortas residuales obtenidos por presión en frío a partir de fuentes vegetales convencionales y no convencionales. Tesis Doctoral. Universidad de Castilla La Mancha, Facultad de Ciencias Químicas. España. [ Links ]
Navas, H.; Carrasquero, D. 2012. Estudio cinético y termodinámico de la auto oxidación del aceite refinado de soya en presencia de un extracto de Ponsigué (Ziziphus mauritiana). Interciencia 37: 757-761. [ Links ]
Papaseit, T.; Cabre, C.1988. Relación entre las características de calidad y las medidas de estabilidad Rancimat en aceites de oliva. Arxius de Esc. Sup. De Agricultura de Barcelona 11: 33- 42. [ Links ]
Pascual G. 2000. Extracción y caracterización de aceite de sacha inchi (Plukenetia volubilis L.). Anales Científicos UNALM 42: 146-160. [ Links ]
Rauen, M.; Esteves, W.; Barrera, A. 1992. Determinación del periodo de inducción del aceite de soya – correlación del Rancimat y otros índices. Grasas y Aceites 43: 119 – 122. [ Links ]
Sargis, R.; Subbaiah, P. 2003. Trans unsaturated fatty acids are less oxidizable than cis unsaturated fatty acids and protect endogenous lipids from oxidation in lipoproteins and lipid bilayers. Biochemistry 42: 11533-11543. [ Links ]
Schmidt, Š.; Pokorny´, J. 2005. Potential application of oilseeds as sources of antioxidants for lipids – A review. Czech Journal of Food Science 23: 93–102.
Shahidi, F.; Wanasundara, U. 2002. Methods for measuring oxidative rancidity in fats and oils. In C. C. Akoh, & D. B. Min (Eds.), Food lipids, chemistry, nutrition and biotechnology. New York, EEUU. [ Links ]
Sherwin, E. 1978. Oxidation and antioxidants in fat and oil processing. J. Am. Oil Chem. Soc. 55: 809–814. [ Links ]
Swinbourne, E. 1985. Analysis of Kinetic Data. 1a ed. Appleton-Century-Crofts. Nueva York, EEUU. [ Links ]
* Autor para correspondencia
E-mail: giropape@yahoo.com (G. Rodríguez).
Recibido 04 agosto 2015
Aceptado 01 septiembre 2015.