Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Scientia Agropecuaria
versión impresa ISSN 2077-9917
Scientia Agropecuaria vol.6 no.4 Trujillo oct. 2015
http://dx.doi.org/10.17268/sci.agropecu.2015.04.05
ARTÍCULOS ORIGINALES
Estudio comparativo de las características físico-químicas del aceite de sacha inchi (Plukenetia volubilis l.), aceite de oliva (Olea europaea) y aceite crudo de pescado
Comparative study of physical-chemical features of sacha inchi oil (Plukenetia volubilis l.), olive oil (Olea europaea) and fish oil
Luz María Paucar-Menacho*; Rebeca Salvador-Reyes; Jhoseline Guillén-Sánchez; Juan Capa-Robles; Cesar Moreno-Rojo
Departamento de Ingeniería Agroindustrial, Facultad de Ingeniería, Universidad Nacional del Santa, Ancash-Perú.
Resumen
Los aceites vegetales tales como el aceite de sacha inchi (ASI) y oliva (AO) contienen ácidos grasos mono-insaturados (omega-9) y poliinsaturados (omega-6), y pequeñas cantidades de omega-3. Por el contrario, los aceites de origen marino como el aceite crudo de pescado (ACP) se caracterizan por su alto contenido en omega-3. El objetivo de la presente investigación fue determinar y comparar las características físico-químicas de estos tres aceites a fin de establecer cuál es el mejor para el uso alimentario. El Índice de acidez, índice de refracción y densidad relativa se determinó por métodos oficiales AOAC, y el tiempo de vida útil por el método Rancimat, a tres temperaturas (100 °C; 120 °C y 150 °C), extrapolando los resultados a 25 °C. Los resultados obtenidos en la caracterización fisicoquímica indican que estos aceites son significativamente diferentes. Los índices de acidez en % de ácido oleico fueron de 1,08, 1,14 y 1,561 para ASI, AO y ACP respectivamente. Los índices de refracción (20 °C) fueron 1,475, 1,469 y 1,481 para ASI, AO y ACP respectivamente, la densidad relativa fue 0,9283, 0,9152 y 0,9308 para ASI, AO y ACP respectivamente. La vida útil para ASI, AO y ACP fue de 93, 137 y 2 días respectivamente. La composición de ácidos grasos tanto en los aceites de origen vegetal y marino además de su vida útil, imparte gran importancia desde el punto de vista nutricional, ya que están contenidos significativamente en los aceites estudiados. Los resultados indican la importancia de este tipo de aceites en la alimentación humana.
Palabras clave: Aceite de sacha inchi, aceite de oliva, aceite de pescado, ácidos grasos, omega-3; 6 y 9.
Abstract
Vegetable oils such as sacha inchi (ASI) and oliva (AO) contain mono-unsaturated fatty acids (omega-9) and polyunsaturated (omega-6), and small amounts of omega-3. By contrast, marine oils such as fish oil crude (ACP) are characterized by their high content in omega-3. The objective of this research was to determine and compare the physicochemical of these three oils in order to establish which is the best for food use features. The acidity index, refractive index and specific gravity was determined by AOAC official methods, and the lifetime by the Rancimat method at three temperatures (100 °C, 120 °C and 150 °C), extrapolating the results at 25 °C. The results of the physicochemical characterization indicate that the three oils are significantly different. The acid values in% oleic acid were 1.08, 1.14 and 1.561 for ASI, AO and ACP respectively. The refractive indices (20 °C) were 1.475, 1.469 and 1.481 for ASI, AO and ACP respectively, relative density was 0.9283; 0.9152 and 0.9308 for ASI, AO and ACP respectively. The lifespan for ASI, AO and ACP was 93, 137 and 2 days respectively. The composition of fatty acids in oils from both plant and marine life besides, gives great importance from the nutritional point of view, as they are contained in the oils studied significantly. The results indicate the importance of this type of oils in food.
Keywords: Sacha inchi oil, olive oil, fish oil, fatty acids, omega-3; 6 and 9.
1. Introducción
Durante los últimos 20 años el consumo mundial de aceites ha aumentado notablemente, lo que no es extraño ya que estos productos son casi un requisito fundamental para la preparación de una buena receta culinaria (Valenzuela et al., 2012). La industria oleo-química se ha preocupado de proveernos de una gran variedad de grasas y aceites para nuestros requerimientos alimentarios y nutricio-nales. No es difícil encontrar en los anaqueles de los centros de abastecimiento diferentes aceites, margarinas, mantecas, mayonesas, salsas, entre otros, a precios muy convenientes. Sin embargo, no hay un estudio que compare las características fisicoquímicas de tres de los aceites más comerciales tales como el aceite de oliva, aceite de sacha inchi y aceite crudo de pescado, y determine cuál es el de mejor calidad.
Desde el punto de vista nutricional, los aceites vegetales y grasas suponen una importante fuente de energía (9 kcal/g) (Granados et al., 2006). Todas las grasas están compuestas por ácidos grasos, si bien difieren entre ellas por el grado de saturación o instauración de dichos ácidos. Las grasas compuestas por ácidos grasos saturados se caracterizan por ser las menos saludables, estando presentes en gran cantidad en los alimentos grasos de origen animal. Por otro lado, los aceites vegetales presentan un mayor contenido de ácidos grasos insaturados que resultan saludables (Cabarcas et al., 2014).
El aceite de oliva (AO) es un aceite vegetal de uso principalmente culinario extraído del fruto del Olivo (Olea europaea) también conocido como acei-tuna (Ávila, 2000). Tiene una alta demanda en el mediterráneo, cuya cultura está basada en los hábitos alimenticios correlacionados con los beneficios a la salud (Allalout et al., 2011), presenta un alto contenido en ácido oleico (60-80%) y riqueza en componentes menores, inclu-yendo tocoferoles y compuestos fenólicos, que otras semillas aceites carecen (Cicerale et al., 2009). El ácido oleico se caracteriza por reducir el nivel de LDL o “colesterol malo” y aumentar el HDL o “colesterol bueno” responsable de la acción protectora frente a la arteriosclerosis, por lo que resulta más saludable (Innis et al., 2008).
El sacha inchi (Plukenetia volúbilis L.) es una planta nativa de la Región amazónica peruana y es conocida por varios nombres, tales como “Oro Inka”, “Inca Inchi” o “Maní del Inca”. Es la fuente vegetal más rica en ácido graso linoléico Omega-6 (32 - 37%) y alfa-linolénico Omega-3 (42 - 48%) los cuales el organismo humano no puede sintetizar, a pesar de que deben estar presentes en su dieta para mantener la salud. El aceite de sacha inchi (ASI) por tanto ofrece importantes beneficios para la salud y la nutrición, tales como proporcionar protección contra las enfermedades cardiovasculares (Guillen et al., 2003)
El aceite crudo de pescado (ACP) es un producto industrial de alto valor nutricional por su contenido de ácidos grasos omega-3 de cadena larga del tipoeicosapentaenoico (EPA, C20:5), docosapentaenoico (DPA, C22:5) y docosahexaenoico (DHA, C22:6). Estos ácidos grasos, particularmente el EPA y el DHA, son hoy día altamente valorados por sus propiedades profilácticas y terapéuticas, en diversas situaciones nutricionales y enfermedades, lo que ha sido ampliamente demostrado por la literatura científica y médica (Uauy et al., 2000; Sanhueza et al., 2004; Lee et al., 2008).
Según el modelo de la norma ISO 9001-2015, la calidad es el conjunto de características de un producto o servicio que le confieren la aptitud para satisfacer las necesidades del cliente.
En la actualidad se habla mucho de las bondades de ASI, AO y ACP, las personas y en especial las amas de casa tienen a su disposición la compra de estos aceites, sin embargo, es difícil escoger uno en especial cuando no hay algún estudio que compare los tres aceites y determine cuál es el mejor según lo que el público requiere.
Por lo expuesto, el presente estudio tuvo por objetivo comparar las características fisicoquímicas del aceite de sacha inchi, aceite de oliva y aceite crudo de pescado con la finalidad de evidenciar sus componentes y el potencial beneficio en la salud de quienes los consumen.
2. Materiales y métodos
Las muestras de aceite de oliva extra virgen y aceite de sacha inchi utilizadas en este estudio fueron de la marca Olivos del Sur, la cual se comercializa en los mercados peruanos y se adquirieron en un supermercado local. Por otro lado, la muestra de aceite crudo de pescado nos fue facilitada una empresa pesquera local de Chimbote-Perú.
Determinación de la composición de ácidos grasos
Se realizó de acuerdo la AOCS método oficial Ce 1b-89, aprobado nuevamente en el 2009, para el cual se utilizó el cromatógrafo de grases con sistema de inyección capilar CGC AGILENT 6850 SISTEMA DE GC SERIES, con columna capilar AGILENT TECHNOLOGIES 7890 A GC-System (sílice fundida) de 25mm de tamaño y 0,35 mm de diámetro interno. Las condiciones de funciona-miento del cromatógrafo fueron: temperatura del detector = 210 °C; temperatura del inyector = 170 °C; temperatura del horno 110 °C - 5 minutos, 110 °C - 215 °C (5 °C / min) 21% °C durante 45 minutos; gas de arrastre = helio; volumen inyectado = 1,0 L; Split: 01:50.
Determinación de la densidad relativa (DR): Método del picnómetro
Se realizó la medición de la Densidad Relativa de los aceites de acuerdo a la Norma CODEX para aceites vegetales especificados (CODEX STAN 210-1999). Para ello se pesó el picnómetro (10 mL) vacío, luego con agua y finalmente lleno con cada muestra de aceite en la balanza analítica marca PRECISA MOD-LX220A (± 0,0001). El cálculo se realizó de acuerdo a la ecuación 1 y por triplicado.
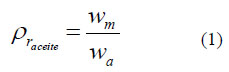
Wm es la masa del aceite (muestra) y Wa la masa de agua en el picnómetro, asimismo se utilizaron los factores de corrección correspondientes por temperatura.
Determinación del índice de refracción en aceites (IR)
Se realizó por triplicado siguiendo el método normado por la AOCS 28 Cc-7-25, (2002). Se utilizó el refractómetro digital marca Rudolph Research (Modelo J157). Para los cálculos se aplicó el factor de corrección 0,000385 para aceites a temperaturas menores de 40 °C.
Determinación del índice de acidez (IA)
De conformidad con el Método de la UIQPA 2.201 o ISO 660: 1996, se realizó por titulación directa y con tres repeticiones. Para ello se pesaron 5g de cada muestra de aceite en un matraz Erlenmeyer (250 mL), se añadieron 50mL de alcohol etílico neutralizado y dos gotas de indicador de fenolftaleína. Posterior-mente, se tituló con una solución de hidróxido de sodio (NaOH) 0,1 N hasta que la mezcla se tornó de un ligero color rosa. Posteriormente se realizó el cálculo de la acidez con la siguiente formula:
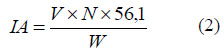
Donde IA expresa los miligramos de NaOH requeridos para neutralizar los ácidos grasos libres (oleico) de la muestra; V es el volumen en mL de la solución valorada de NaOH utilizada; N es la concentración normal de NaOH; y W el peso en gramos de la muestra de aceite utilizada.
Determinación del índice de iodo (II)
La medición del índice de Iodo de realizó por el método de Wijs, de conformidad con ISO 3961:1996 o NMKL 39 (2003) por triplicado. Primero se pesó aproximadamente 0,15 g de aceite, el cual se mezcló en un matraz Erlenmeyer (250 mL) con 20 mL de tetracloruro de carbono (CL4C) y 25 mL de reactivo de Wijs. El reactivo de Wijs se preparó con CL4C al cual se le añadió un exceso de monocloruro de iodo (CLI) disuelto en una mezcla de ácido glacial y tetracloruro de carbono (Nielsen, 2003). Se dejó reposar la mezcla en la oscuridad por 30 minutos, a continuación, se añadieron 20 mL de Ioduro de Potasio (KI 15%) y 100 mL de agua destilada. Por último, se tituló con una solución de Tiosulfato de Sodio 0,1 N, empleando almidón como indicador. Para el cálculo final empleamos la siguiente formula:
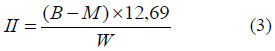
Siendo II el Índice de Iodo expresado en gramos de Iodo que reaccionan con 100 gramos de muestra; B y M son los gastos en mL de la solución de tiosulfato de sodio en la titulación del blanco y la muestra respectivamente; N es la normalidad de la solución de tiosulfato y W el peso de la muestra en gramos.
Determinación del color instrumental de los aceites
Se utilizó el colorímetro digital marca KONICA MINOLTA (CR-400T), por el método CIELAB y con 5 repeticiones en tres puntos diferentes por muestra. Se vertió parte de la muestra de aceite en una superficie blanca, a fin de crear una capa lisa y homogénea, la cubrimos con una lámina de acrílico delgada y transparente, apoyamos el visor del colorímetro encima, y se realizó la lectura de la cual se obtuvo tres parámetros: L (luminosidad), a* (color entre magenta y verde) y b* (color entre amarillo y azul). Con estos datos se calcularon la luminosidad, saturación y tono del color de los aceites, según las siguientes formulas.
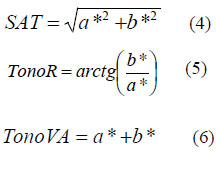
Estimación de la vida útil por el índice de estabilidad oxidativa (OSI)
Para la American Oil Chemists Society Cd 12b-92 (AOCS, 2013) el método oficial para la medición del índice de estabilidad oxidativa (OSI) es el Rancimat el cual se basa en la inducción de la oxidación de la muestra por exposición a elevadas temperaturas y flujo de aire (Velazco et al., 2009).
La determinación del OSI se realizó por triplicado, donde se utilizó un equipo Rancimat 743 Metrohm, con 3 ± 0,2 g de muestra y un flujo de aire 9 L/h. Para los aceites vegetales ASI y AO se utilizaron las temperaturas de 100, 120 y 150 °C, mientras que para ACP se utilizaron las temperaturas de 80, 100 y 120°C; éstas se establecieron de tal manera que no se permita que el tiempo OSI sea menor a 4 horas resultara en una variación más amplia en la determinación del punto terminal (García-Moreno et al., 2013).
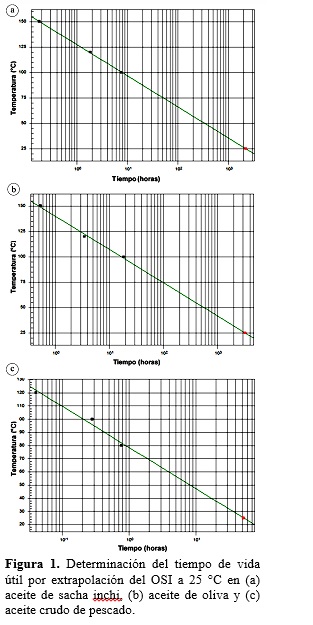
Para la determinación de la vida útil de cada muestra se realizó una extrapolación de la relación entre el tiempo de inducción y la temperatura de acuerdo a la ley de Van’t Hoff, obteniendo un estimado del tiempo de almacenamiento en condiciones normales.
Análisis estadístico
Cada muestra de aceite fue analizada en tres repeticiones. Los resultados fueron tratados estadísticamente mediante el cálculo de medias y desviaciones estándar. Además, se aplicó la prueba de ANOVA de Tukey de comparaciones múltiples de los valores medios de los resultados para determinar las posibles diferencias significativas en el resultado para cada compuesto de DR, IR, IA, II, color y OSI entre los aceites investigados utilizando el software Statgraphic Centurion (versión 2014, USA). Las diferencias se consideraron estadísticamente significativas al nivel de p < 0,05.
3. Resultados y discusión
Determinación de la composición de ácidos grasos por cromatografía de gases
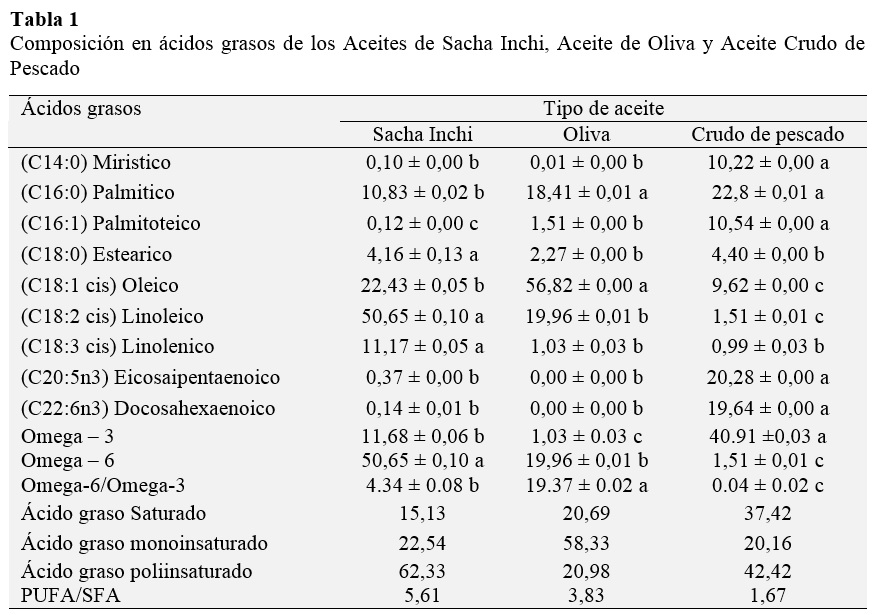
La composición de ácidos grasos se muestra en la Tabla 1. Se puede observar su alto contenido de ácidos grasos insaturados (70 - 80%). El más abundante de los ácidos grasos en el ASI es el ácido linoleico (~50%), el cual cumple la función de controlar y reducir el colesterol que las grasas saturadas acumuladas, además de ser fundamental en la formación de tejido nervioso y del tejido ocular (Mensink y Katan, 1992). Asimismo, ASI es rico en ácido linolénico (~11%), Más de la mitad de la grasa del cerebro es omega-3 (Martínez, 1992); por lo tanto, este aceite permite el desarrollo de la inteligencia del hombre desde la etapa fetal (Uauy et al., 1996). En AO es el ácido oleico (~56%) el más abundante, el cual es mono-insaturado, lo que significa que tiene un doble enlace, por lo tanto, es mucho menos susceptible a la oxidación, alta estabilidad, y larga vida útil del AO (Owen et al., 2000). Por último, en el ACP predominan los ácidos grasos EPA (~20%), y DHA (~20%), los cuales ayudan a reducir el riesgo de enfermedades cardiovasculares, además bajan la presión vascular y tienen efectos antitrombóticos y antiinflamatorios (Calder, 2006).
Por lo tanto, en función a su composición rica en ácidos grasos insaturados podemos afirmar que estos aceites tienen un buen potencial beneficio a la salud de sus consumidores. Además, se puede observar en la Tabla 1 el total de ácidos grasos saturados, mono-insaturados, poliinsaturados donde el ASI, ACP y AO en ese orden tienen altos contenidos de ácidos grasos poliinsaturados, los que tienen comprobados beneficios a la salud de sus consumidores (Rodríguez-Cruz et al., 2005).
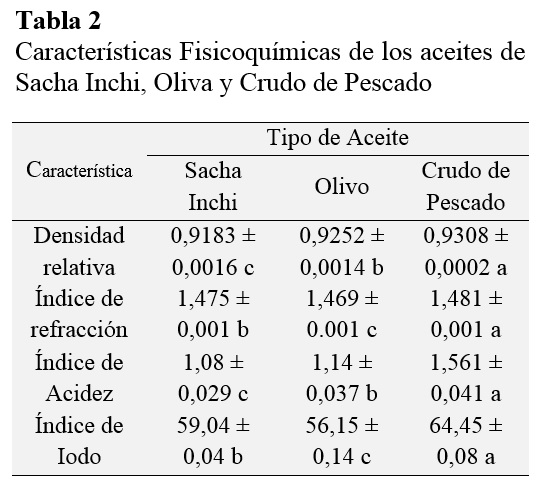
Observando la Tabla 2 es claro que no se presentaron diferencias significativas entre las propiedades físicas entre ASI y AO, por otro lado, ACP presentó valores de DR, IR, IA e II mayores en comparación de los dos anteriores.
Densidad relativa de los aceites
En el caso del AO se determinó su DR en 0,9152 ± 0,0014 valor que se encuentra en el rango de lo normado por el CODEX Stan 33-1981, que establece un intervalo de <0,910 - 0,916>. Asimismo, el ASI, con DR 0,9283 ± 0,0016 coincide con la Norma Técnica Peruana (NTP) 151.400 (2009) cuyo intervalo está fijado en <0,926 – 0,931>; nuestros resultados también coinciden con los obtenidos por Castaño et al. (2012), quien aproximó la densidad de este aceite en el rango de < 0,92 y 0,93 >. En cuanto al ACP, la NTP 312.010 (1985) señala que su DR se encuentra entre <0,92 – 0,93>, el cual incluye nuestro resultado de 0,9308 ± 0,0002.
ACP tuvo una alta densidad comparada con los otros dos aceites, para Manawwer (2014) la densidad de un aceite es el producto de la densidad de sus componentes por el porcentaje presente en la mezcla de cada uno. Según Conchillo et al. (2006) una de las principales diferencias entre el aceite de pescado y los aceites vegetales es la desigualdad en la proporción de los ácidos grasos, pues los aceites de animales marinos tienen una elevada proporción de ácidos grasos de cadena larga (20 - 22 carbonos) con un extenso número de insaturaciones (5 - 6 dobles enlaces) (Graciani, 2006), entre estos ácidos se encuentra el Omega-3 (Valenzuela et al., 2014). Por otro lado, ASI presentó la menor densidad por tanto se trata de un aceite mucho más ligero debido a su composición rica en ácidos linolénico y linolénico (Tabla 1) (Guillén et al., 2003; Fanali et al, 2011; Gutiérrez et al., 2011; Maurer et al., 2012).
La densidad es una medida de calidad de los aceites. A medida que un aceite es menos denso es mejor, pues es más digerible y posee un punto de fusión muy bajo. En base a ello, se recomienda el consumo de ASI para su consumo diario en frio.
Índice de refracción (IR)
El índice de refracción es una propiedad utilizada para controlar la pureza y la calidad de los aceites tanto a nivel laboratorio como industrial. Se relaciona con su grado medio de instauración, y también es útil para observar el progreso de las reacciones tales como hidrogenación e isomerización (Karabulut et al., 2003).
ASI tuvo un IR de 1,475 ± 0,001, la NTP 151.400 (2009) establece un IR a 20 °C entre <1,475 – 1,481>, este dato también se ajusta a un estudio del perfil de los ácidos grasos del ASI realizado por Juárez et al. (2015) quienes determinaron un IR para ASI de 1,47514 ± 0,00008. En cuanto al AO el CODEX Stan 33-1981 establece un IR de <1,4677 – 1,4705>, el cual incluye a 1,469 ± 0,001 resultado de nuestro estudio. En cuanto al ACP, la NTP 312.010 (1985) indica que su IR se encuentra entre <1,470 – 1,477>, intervalo que no incluye nuestro resultado obtenido de 1,481 ± 0,001, asimismo al aplicar la prueba t al 5% de significancia el valor p = 0.00000972618 por tanto si existe diferencia estadísticamente significativa. Esto último se puede discutir debido a que las características físico-químicas de cualquier aceite depende del tipo de materia prima utilizada para su obtención (López et al., 2014). Según Castro-Gonzales (2002) la variación en el contenido de AG Omega-3 de los alimentos marinos dependerá de la especie de pescado, el lugar y época de captura aun cuando se trate del mismo pescado. Conforme la temperatura del agua disminuye, aumenta el grado de insaturación de los AG en los tejidos animales. (Aubourg et al., 1996; Aro et al., 2000; Refsgaard et al., 2000). Esta variación en la composición probablemente influenció en variación obtenida en este estudio.
El IR en aceites y grasas va aumentando conforme aumenta el grado de instauración y el porcentaje de ácidos insaturados (MPA, 2010). Según la Tabla 2, ASI tiene un alto IR (1,475) en comparación con AO y ACP. Bailey (1961) menciona que el IR aumenta proporcionalmente a la longitud de las cadenas de hidrocarburos y el número de enlaces dobles de las cadenas, el ASI es altamente insaturado (91%) pues es rico en ácidos grasos largos como el Linoleico y el Linolénico.
Los ácidos grasos insaturados son conocidos por combatir grandes problemas relacionados a la obesidad y control del peso. Es recomendable su consumo, pues contribuyen a la disminución de los niveles de colesterol en los conductos sanguíneos, asimismo ayudan a la construcción de tejidos cerebrales en los niños, por lo que se recomienda su consumo durante la infancia y niñez. En base a lo mencionado, recomendamos el aceite de pescado para niños en edad de crecimiento.
Índice de acidez (IA)
El IA es considerado como uno de los principales parámetros que reflejan la calidad de los aceites vegetales, el grado de refinación, así como el cambio de calidad durante el almacenamiento (Hui, 1996; Osawa et al., 2007; Tasan et al., 2011).
Los IA (% de ácido oleico) del ASI, AO y ACP, obtenidos en esta investigación fueron 1,08 ± 0,029 (%); 1,14 ± 0,035 (%) y 1,561 ± 0,041 (%) respectivamente. En ASI no sobrepasa lo establecido por la NTP 151.400 – 2009, quien señala un máximo de 1% para el aceite extra virgen y 2% para aceite virgen; por tanto, nuestra muestra al tener un bajo contenido de ácidos grasos libres, se infiere ha llevado un buen tratamiento fitosanitario y manejo post-cosecha de la materia prima.
En tanto para el CODEX STAN 33 (1981), el valor de acidez máxima para el AO virgen es de 0,8%, un valor por debajo del determinado en este estudio (1,14 ± 0,035 %), nuestro resultado tampoco coincide con Osawa et al. (2007) quien considera 1% como el IA máximo. Cuando un aceite posee alto IA apunta al uso de materia prima de baja calidad y mal manejo o almacenamiento, por lo que no se recomienda su consumo. Sin embargo, Rondanini et al. (2014) mediante un estudio de los cultivos de olivo en tres suelos diferentes confirmó que la calidad del AO puede ser bastante diferente, así como sus propiedades físico-químicas dependiendo del clima y lugar donde se cultive el fruto (Mailer, 2010; Ceci y Carelli, 2010). Entre los aspectos de la calidad del AO que parece ser más afectados por el medio ambiente es la composición de ácidos grasos. Bajos porcentajes de ácido oleico (< 55%), junto con el ácido palmítico alto (> 16%) y ácido linoleico (> 21%) son características comunes de los perfiles de ácidos grasos de algunas variedades de la Cuenca del Mediterráneo cuando se cultiva en las regiones de Sudamérica (Ravetti, 1999; Mailer et al., 2010; Rondanini et al., 2011).
El IA para el ACP según su NTP es del 5% como máximo, debido a que aún mantiene en su composición pigmentos, impurezas y compuestos que deben ser eliminados por refinación y blanqueamiento. En nuestro estudio, el IA del ACP fue 1,561 ± 0,041, es decir se trabajó con una muestra de aceite dentro del rango permitido según la norma. El ACP tuvo el mayor IA de los tres aceites y ello se debe a su composición rica en ácidos grasos (Tabla 1), especialmente ácidos grasos poliinsaturados de cadena larga, los que le confieren efectos saludables en la salud de las personas que lo consumen (Valenzuela et al., 2014).
Índice de Iodo (II)
Para Benatmane et al. (2011) el II es una propiedad química relacionada con la insaturación, con el IR y con la densidad: a mayor II, mayor IR y mayor densidad. Esta relación quedo comprobada también en este estudio pues el ACP fue el aceite que tuvo mayor II (64,45 ± 0,08), IR (1,481 ± 0,001) y densidad (0,9308 ± 0,0002); mientras que AO presentó el menor valor de II (56,15 ± 0,14); IR (1,469 ± 0,001) y densidad (0,9152 ± 0,0014) de los tres aceites. Por su parte, el ASI tuvo un II de 59,04 ± 0,04, un valor intermedio al igual que su IR 1,475 ± 0,001.
Los valores de II obtenidos en este estudio para las tres muestras de aceite no coinciden con los datos bibliográficos y normas establecidas. La NTP 151.400 (2009) para el ASI enuncia un II entre <176 – 186>. El CODEX establece un intervalo de <75 – 94> para el AO. Finalmente, la NTP 312.010 (1985) menciona un intervalo de II <175 – 196> para ACP. El II es una propiedad química característica y puede ser utilizada como una medida de identificación y calidad (Zumbado, 2002). Mientras más bajo es II, más alto es el grado de saturación de una grasa o aceite, es por ello que el ACP, que es rico en ácidos grasos poliinsaturados tuvo el mayor II; mientras que el AO, que es rico en acido mono-insaturado (oleico) tuvo el menor valor.
Color instrumental en los aceites
El color es una propiedad importante por dos razones: su relación con otras propiedades químicas y físicas de alimentos (madurez, técnicas de procesamiento, condiciones de almacenamiento, etc.), y su fuerte influencia en las preferencias de los consumidores (Cui et al., 2002). Es por ello que mucha investigación se ha llevado a cabo con el objetivo de evaluar cambios de color de los alimentos en el procesamiento industrial (Chen et al., 1995; Steet y Tong, 1996; Ayhan et al., 2001;), almacenamiento (Ferrer et al., 2005; Goncalves et al., 2007; Lee y Coates, 2002), la cocina (Dubois et al., 2007; Moyano et al., 2002), etc. En los aceites, el color es uno de los factores admitidos para determinar su valor, pues aceites oscuros necesitan de tratamientos costosos para clarificarlos, además de perder sus propiedades biológicas (valores nutritivos, funcionales, medicinales, etc.) en el proceso (McCaig, 2002; Meléndez-Martinez et al., 2005; Yam y Papadakis, 2004).
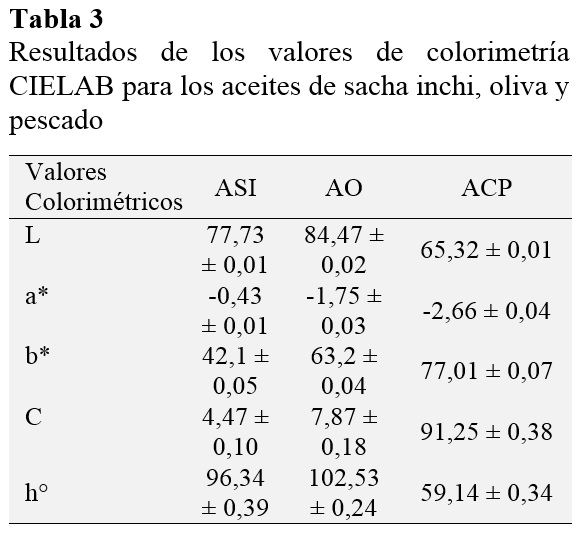
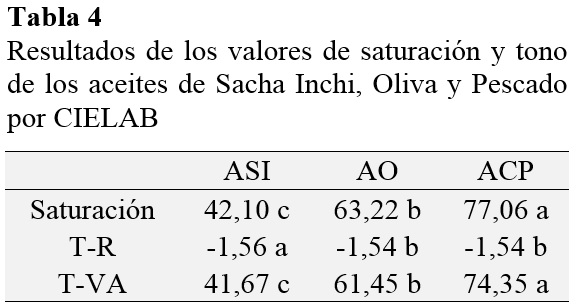
En la Tabla 3 se recogen los valores medios y desviación estándar de las muestras de los aceites analizados en esta investigación, mientras que en la Tabla 4, se observan los resultados respecto a los valores de saturación y tono de los aceites, obtenidos aplicando las ecuaciones (4), (5) y (6).
En cuanto a luminosidad, AO tiene un valor L: 84,47 ± 0,02, el mayor de los tres, por tanto, es el más claro, en contraste el ACP tiene un L: 65,32 ± 0,01 es decir, posee un color más oscuro debido a su naturaleza como residuo industrial del procesamiento de harina de pescado posee gran cantidad de pigmentos y residuos de su extracción.
En cuanto a su posición entre rojo y verde (a*) y su posición entre amarillo y azul (b*). ASI cuenta con un valor a*: -0,43 ± 0,01 y b*: 42,1 ± 0,05; por tanto, es de un amarillo dorado ligeramente verdoso, este valor concuerda con el color reportado por Guillen et al. (2003), esto y se debe a que ASI se produce con semillas seleccionadas y se obtiene mediante la técnica de prensado en frío, por lo que mantiene algunos de los pigmentos presentes en sus semillas, las cuales son verdes cuando son tiernas y marrones una vez maduran.
El color del AO virgen puede variar del dorado al verde oscuro, dependiendo de la variedad de aceituna empleada y su estado de madurez, pero ello no indica que su calidad sea mejor o menor (Cui et al., 2002). De acuerdo con nuestros valores obtenidos el AO posee un color amarillo verdoso. El color verde se debe a que entre los componentes minoritarios del AO virgen se encuentran colorantes como el ß-Caroteno (precursor del retinol o vitamina A) y la clorofila, la cual posee un comportamiento antioxidante si el aceite se conserva en lugar oscuro (Eiro y Heinonen, 2002).
ACP presentó un color amarillo oscuro con tendencia al marrón rojizo. Según la NTP 312.010 (1985) el ACP debe ser marrón / amarillento pues aun contiene pigmentos, impurezas, entre otros que se eliminarán durante su refinación para dar paso a un aceite más claro. Según Valenzuela (2009) el color del aceite de pescado también depende de la materia prima que se utilice para su elaboración, en este caso el tipo de pescado.
Estabilidad oxidativa de los aceites: tiempo de vida útil
La estabilidad oxidativa, se define como la resistencia a la oxidación bajo condiciones establecidas (Velasco et al., 2009; Guillén y Nerea, 2002) y se expresa como el periodo de tiempo necesario para alcanzar un punto final, el cual es seleccionado conforme a diferentes criterios (por ejemplo, desarrollo de la rancidez), pero usualmente corresponde a un inesperado incremento en la reacción de oxidación (Velasco et al., 2009). Como la oxidación normalmente procede lentamente hasta que este punto se alcance, este periodo de tiempo es conocido como Tiempo de Inducción (TI). El método del índice de estabilidad del aceite (OSI), también comúnmente conocido como el método Rancimat, permite determinar automática-mente el TI oxidativo (AOCS, 1992).
El tiempo de vida útil La estabilidad oxidativa en los aceites analizados se determinó por extrapolación (Figura 1), éste fue de 92,62 días y 136,54 días, para los aceites vegetales ASI y AO respectivamente. Donde ASI fue el que presento una oxidación más rápida en comparación con AO, ello es debido a que los ácidos grasos insaturados son más susceptibles a la oxidación. Si comparamos la composición en ácidos grasos de ambos, ASI está compuesta en un 91% por ácidos grasos polinsaturados (linoleico y linolénico) mientras que AO tiene 50-80% de ácidos grasos monoinsaturados (oleico).
En cuanto a ACP, éste presentó un tiempo de vida útil muy corto de 2,19 días. Según Valenzuela (2009) ACP correctamente refinado tiene un tiempo de vida útil entre dos a tres años; sin embargo, el aceite con el que se trabajo fue aceite crudo de pescado, es decir, aceite cuya composición incluye pigmentos, elementos trazas, alta acidez, entre otros. Debido a que el aceite de pescado es una fuente rica en ácidos grasos insaturados omega-3 (DHA y EPA), y también cuenta con la presencia de lipasas (Valenzuela et al., 2012), por lo que se deteriora con mucha más facilidad que los aceites vegetales.
Debido a su contenido rico en ácidos grasos insaturados, estos tres aceites son susceptibles al deterioro y tienen una vida útil relativamente baja (comparada con aceites refinados comerciales). Sin embargo, su consumo es necesario, pues el cuerpo humano es capaz de producir todos los ácidos grasos que necesita, excepto dos: el ácido linoléico (LA), un ácido graso omega-6, y el ácido alfa-linolénico (ALA), un ácido graso omega-3, ambos son necesarios para el crecimiento y la reparación de las células y además pueden utilizarse para producir otros ácidos grasos (Ácido Araquidónico) (Davidson et al., 2004).
Sin embargo, como la conversión en ciertos ácidos grasos es limitada, se recomienda incluir fuentes de ácido eicosapentanoico (EPA) y ácido docosahexanoico (DHA). El LA y el ALA se encuentran en los aceites vegetales y de semillas. Aunque en general la cantidad de LA sea muy superior a la de ALA, el aceite de colza y el de nuez son excelentes fuentes de este último. El EPA y el DHA se encuentran en el pescado graso.
4. Conclusiones
Los tres aceites de: sacha inchi, oliva y pescado son fuente rica en ácidos grasos insaturados (70 - 80 %), los cuales poseen potenciales beneficios a la salud, no obstante, cada uno es recomendable según sus características para un público específico.
La composición del perfil de ácidos grasos obtenido por medio de cromatografía de gases, del aceite de las especies en estudio, se encontró mayor proporción de ácidos grasos insaturados en AO, aunque ligeramente más denso los principales ácidos grasos presentes en dicho aceite son ácido oleico, ácido linoleico y ácido palmítico. ASI es muy ligero, de acuerdo con los valores obtenidos en las propiedades fisicoquímicas y el alto contenido de ácido linoleico (50,64%), siendo este un ácido graso esencial (omega 6) se puede decir que ASI podría ser utilizado en la industria alimenticia. En cuanto al ACP, en comparación con los aceites vegetales, éste es más denso y susceptible, por lo que su vida útil más es la corta en comparación con ASI y AO. El índice de yodo fue mayor al obtenido por los otros dos aceites en estudio, sin embargo, presento menor proporción de ácidos mono y poliinsaturados. Respecto al índice de acidez, el valor obtenido (1,56% referida al ácido oleico) estuvo dentro del rango considerado para aceites de pescado.
Agradecimientos
A la empresa pesquera HAYDUK, por el apoyo brindado en la realización del análisis de la composición de ácidos grasos mediante el uso del cromatógrafo CGC AGILENT 6850.
5. Referencias bibliográficas
Allalout, A.; Krichène, D.; Methenni, K.; Taamalli, A.; Daoud, D.; Zarrouk, M. 2011. Behavior of super-intensive spanish and greek olive cultivars grown in northern Tunisia. Journal of Food Biochemistry 35: 27– 43. [ Links ]
AOAC Método de Análisis. 1970. Oils and fats. Index of refraction-Official final action. Association of Official Analytical Chemists, Washington. [ Links ]
AOCS. 1992. Official methods and recommended practices of the American Oil Chemists’ Society. Champaign, Illinois: American Oil Chemists Society. [ Links ]
AOCS. 2002. Official Methods and Recommended Practices of the American Oil Chemists' Society. Champaign, Illinois: American Oil Chemists Society ed. Firestone. [ Links ]
AOCS. 2009. Fatty Acid Composition of Marine Oils by GLC. Champaign, Illinois: American Oil Chemists Society ed. Firestone. [ Links ]
AOCS Official Method Cd 12b-92. 2013. On oil stanility index (OSI). Disponible en: http://search.aocs.org/methods/search_methods_view_method.cfm?method=cd12b_92.pdf [ Links ]
Aro, T.; Tahvonen, R.; Mattila, T.; Nurmi, J.; Sivonen, T.; Kallio H. 2000. Effects of season and processing on oil content and fatty acids of Baltic herring (Clupea harengus membras). Journal of Agricultural and Food Chemistry 48: 6085 - 6093. [ Links ]
Aubourg, S.P.; Medina, I.; Pérez-Martín, R. 1996. Polyunsaturated fatty acids in tuna phospholipids: distribution in the sn-2 location and changes during cooking. Journal of Agricultural and Food Chemistry 44: 585-589. [ Links ]
Ávila, J. 2000. Enciclopedia Del Aceite De Oliva. 1° Edición. Editorial Planeta. Barcelona, España. [ Links ]
Ayhan, Z.; Yeom, H.; Zang, K.; Min, D. 2001. Flavor, color and vitamin C retention of pulse electric fields processed orange juice in differents packaging material. Journal of Agricultural and Food Chemistry 49: 669 – 674. [ Links ]
Bailey, A. 1961. Química de los Alimentos. 3° Edición. Editorial Addison Wesley Longman. México. [ Links ]
Benatmane, F.; Kouba, M.; Youyou, A.; Mourot, J. 2011. Effect of a linseed diet on lipogenesis, fatty acid composition and stearoyl-CoA-desaturase in rabbits. Animal 5: 1993–2000. [ Links ]
Cabarcas O; Núñez, J.; Vergara, J.; Villalba, A.; Suárez, F.; Albis, A.; Cervera, S. 2014. Determinación de Ácidos Grasos Trans en Productos Fritos que se Expenden en la Ciudad de Barranquilla-Colombia. Rev.Fac.Nal.Agr.Medellín 67(2): 1060-1062. [ Links ]
Calder, F. 2006. n−3 Polyunsaturated fatty acids, inflammation, and inflammatory diseases1,2,3. American Society for Clinical Nutrition 83(6) 1505-1519. [ Links ]
Castaño, D.; Valencia, M.; Murillo, P.; Mendez, A.; Eras, J. 2012. Composición de ácidos grasos de sacha inchi (Plukenetia volúbilis Linneo) y su relación con la bioactividad del vegetal. Revista Chile Nutrición 39: 45-52. [ Links ]
Castro-Gonzales, M. 2002. Ácidos Grasos Omega 3: Beneficios y Fuentes. INCI 27: 128-136. [ Links ]
Ceci, L.; Carelli, A. 2010. Compositional data review ofmonovarietal Argentinean olive oils. In: Tomas, M.B. (Ed.), Advances in Fats and Oil Research. Transworld Research Network: 71– 97. [ Links ]
Chen, B.; Peng, H.; Chen, H. 1995. Changes of carotenoids, color and vitamin A content during processing of carrot juice. Journal of Agricultural and Food Chemistry 43: 1912–1918. [ Links ]
Cicerale, S.; Conlan, X.; Sinclair, A.; Keast, R. 2009. Chemistry and health of olive oil phenolics. Critical Reviews in Food Science and Nutrition 49: 218–236. [ Links ]
CODEX STAN 33. 1981. Norma para los aceites de oliva y aceites de Orujo de oliva. Lima, Perú [ Links ].
CODEX STAN 210. 1999. Codex Standard for Named Vegetable Oils. Food and Agriculture Organization of the United Nations. Roma. [ Links ]
Conchillo, A.; Valencia, I.; Puente, A.; Ansorena, D.; Astiasarán, I. 2006. Componentes funcionales en aceites de pescado y de alga. Nutrición Hospitalaria 21(3): 369-373. [ Links ]
Cui, G.; Luo, M.; Rigg, B.; Roesler, G.; Witt, K. 2002. Uniform colour spaces based on the DIN99 colour-difference formula. Color Research and Application 27: 282– 290. [ Links ]
Davidson, L.; Nguyen, D.; Hokanson, R,; Callaway, E.; Iseff, R.; Turne, N. 2004. Chemopreventive n–3 polyunsaturated fatty acids reprogram genetic signatures during colon cancer initiation and progression in the rat. Cancer Research 64: 6797–804. [ Links ]
Dubois, M.; Savage, G.; Martin, R. 2007. The effect of cooking on the composition and colour of New Zealand grown oca. Food Chemistry 104(2): 768–773. [ Links ]
Eiro, M; Heinomen, M. (2002). Anthocyanin color behavior and stability during storage: effect of intermolecular copigmentation. Journal of Agricultural and Food Chemistry 50(25): 7461-7466. [ Links ]
Ferrer, E.; Alegria, A.; Farre, R.; Clemente, G.; Calvo, C. 2005. Fluorescence, browning index, and color in infant formulas during storage. Journal of Agricultural and Food Chemistry 53(12): 4911–4917. [ Links ]
Fanali, C.; Dugo, L.; Cacciola, F.; Beccaria, M.; Grasso, S.; Dachà, M. 2011. Chemical characterization of Sacha Inchi (Plukenetia volubilis L.) oil. Journal of Agricultural of Food Chemistry 59(4): 13043–13049. [ Links ]
García-Moreno, P.; Pérez-Gálvez, R.; Guadix, A.; Guadix, E. 2013. Influence of the parameters of the Rancimat test on the determination of the oxidative stability index of cod liver oil. Food Science and Technology 51: 303–308. [ Links ]
Goncalves, B.; Silva, A.; Moutinho-Pereira, J.; Bacelar, E.; Rosa, E.; Meyer, A. 2007. Effect of ripeness and postharvest storage on the evolution of colour and anthocyanins in cherries (Prunus avium L.). Food Chemistry 103(3): 976–984. [ Links ]
Graciani, E. 2006. Los aceites y grasas: composición y propiedades. AMV Ed. y Mundi-Prensa, Madrid; p. 171. [ Links ]
Granados, S.; Quiles, J.; Gil, A.; Ramírez, M. 2006. Lípidos de la dieta y cáncer. Nutrición Hospitalaria. 21: 44-54. [ Links ]
Moyano, P.; Ríoseco, V.; González, P. 2002. Kinetics of crust color changes during deep-fat frying of impregnates French fries. Journal of Food Engineering 54: 249–255. [ Links ]
Guillén, M.; Ruiz, A.; Cabo, N.; Chirinos, R.; Pascual, G. 2003. Characterization of Sacha inchi (Plukenetia volubilis L.) oil by FTIR spectroscopy and HNMR Comparison with linseed oil. Journal of Oil & Fat Industries 80: 755-762. [ Links ]
Gutiérrez, L.; Rosada, L.; Jiménez, A. 2011. Chemical composition of Sacha Inchi (Plukenetia volúbilis L.) seeds and characteristics of their lipid fraction. Grasas y aceites 62: 76-83. [ Links ]
Hui, Y. 1996. Bailey’s industrial oil & fat products. Vol. 3. John Wiley & Sons. New York, Estados Unidos. [ Links ]
Innis, S. 2008. Dietary omega 3 fatty acids and the developing brain. Brain Research 1237: 35-43. [ Links ]
ISO 660. 1996. Animal and vegetable fats and oils: Determination of acid value and acidity. [ Links ]
ISO 3961. 1996. Animal and vegetable fats and oils: Determination of iodine value. [ Links ]
ISO 9001. 2015. Normas y Requisitos de un Sistema de Gestión de la Calidad. [ Links ]
Karabulut, I.; Kayahan, M.; Yaprak, S. 2003. Determination of changes in some physical and chemical properties of soybean oil during hydrogenation. Food Chemistry 81: 453-456. [ Links ]
Lee, H.; Coates, G. 2002. Characterization of color fade during frozen storage of red grapefruit juice concentrates. Journal of Agricultural and Food Chemistry 50: 3988–3991. [ Links ]
Lee, J.; 0'Keefe, J.; Lavie, C.; Marchioli, R.; Harris, W. 2008. Omega-3 fatty acids for cardioprotection. Mayo Clinic Proc. 83(3): 324-32. [ Links ]
López, S; Bermudez, B.; Montserrat-Delapaz, S. 2014. Membrane composition and dynamics: A target of bioactive virgin olive oil constituents. Biochimica et Biophysica Acta 1838: 1638–1656. [ Links ]
Mailer, R.; Ayton, J.; Graham, K. 2010. The influence of growing region, cultivar and harvest timing on the diversity of Australian olive oil. J. Am. Oil Chem. Soc. 87: 877–884 [ Links ]
Maurer, N.; Hatta-Sakoda, B.; Pascual-Chagman, G.: Rodriguez-Saona, L. 2012. Characterization and authentication of a novel vegetable source of omega-3 fatty acids, Sacha Inchi (Plukenetia volubilis L.) oil. Food Chemistry 134(2): 1173–1180. [ Links ]
Manawwer, A.; Naser, M. 2014. Corn oil based polyether amide urethane coatingmaterial—Synthesis, characterization and coating properties. Industrial Crops and Products 57: 17–28 [ Links ]
Martínez M. 1992. Tissue levels of polyunsaturated fatty acids during early human development. J Pediatr 120: 129S–138S. [ Links ]
McCaig, T. 2002. Extending the use of visible/near-infrared reflectance spectrophotometers to measure colour of food and agricultural products. Food Research International 35: 731–736. [ Links ]
Mensink, R.P.; Katan, M.B. 1992. Effect of dietary fatty acid on serum lipids and lipoproteins: a meta–analysis of 27 trials. J Arterioacl Thromb 12: 911–9. [ Links ]
Meléndez-Martínez, A.; Vicario, I.; Heredia, F. 2005. Instrumental measurement of orange juice colour: A review. Journal of the Science of Food and Agriculture 85: 894–901. [ Links ]
Moyano, P.; Ríoseco, V.; González, P. 2002. Kinetics of crust color changes during deep-fat frying of impregnates French fries. Journal of Food Engineering 54: 249–255. [ Links ]
MPA. 2010. Ministério da Pesca e Aquicultura. Produção pesqueira e aquícola: Estatística 2008 e 2009. Brasilia, DF. [ Links ]
NTP 151.400: 2009. Norma Técnica Peruana para Aceite de Sacha Inchi del género Plukenetia. Requisitos. (Norma Peruana) [ Links ]
NTP 312.010:1985. Norma Técnica Peruana para Aceite de Crudo de Pescado. Requisitos. (Norma Peruana) [ Links ]
Osawa, C.; Goncalves, L.; Ragassi, S. 2007. Correlation between free fatty acids of vegetable oils evaluated by rapid tests and by the official method. Journal of Food Composition and Analysis 20: 523-528. [ Links ]
Ravetti, L. 1999. Caracterización preliminar de variedades y aceites de oliva vírgenes de la provincia de Catamarca. Aceites y Grasas 36: 361–369. [ Links ]
Refsgaard, H.; Brockhoff, P.M.B.; Jensen, B. 2000. Free polyunsaturated fatty acids cause taste deterioration of salmon during frozen storage. Journal of Agricultural and Food Chemistry 48: 3280-3285. [ Links ]
Rodríguez-Cruz, M.; Tovar, A.; del Prado, M.; Torres, N. 2005. Molecular mechanisms of action and health benefits of polyunsaturated fatty acids. Revista de investigación clínica 57(3): 457-472. [ Links ]
Rondanini, D.; Castro, D.; Searles, P.; Rousseaux, M. 2011. Fatty acid pro-files of varietal virgin olive oils (Olea europaea L.) from mature orchards in warm arid valleys of Northwestern Argentina (La Rioja). Grasas y Aceites 62, 399–409. [ Links ]
Rondanini, D.; Castro, D.; Searles, P.; Rousseaux, C. 2014 Contrasting patterns of fatty acid composition and oil accumulation during fruit growth in several olive varieties and locations in a non-Mediterranean region. Europe. Journal Agronomy 52: 237–246. [ Links ]
Sanhueza, J.; Nieto, S.; Valenzuela, A. 2004. Ácido docosa-hexaenoico (DHA), desarrollo cerebral, memoria y aprendizaje. Rev Chil Nutr 31: 84-92. [ Links ]
Steet, J.; Tong, C. 1996. Quantification of Color Change Resulting from Pheophytinization and Nonenzymatic Browning Reactions in Thermally Processed Green Peas. J. Agric. Food Chem. 44 (6): 1531–1537. [ Links ]
Tasan, M.; Gecgel, U.; Demirci, M. 2011. Effects of storage and industrial oilseed extraction methods on the quality and stability characteristics of crude sun- flower oil (Helianthus annuus L.). Grasas y Aceites 62: 389-398. [ Links ]
Uauy, R.; Peirano, P.; Hoffman, D.; Mena, P.; Birch, D.; Birch, E. 1996. Role of essential fatty acids in the function of the developing nervous system. Lipids 31: 167S –176S. [ Links ]
Uauy, R.; Valenzuela, A. 2000. Marine oils: The health benefits of n-3 fatty acids. Nutrition 16: 680 – 684. [ Links ]
Valenzuela, A. 2009. Aceites de origen marino y su importancia en la nutrición humana y en la ciencia de alimentos. Rev Chil Nutr 36: 246-57. [ Links ]
Valenzuela, A.; Sanhueza, J.; De la Barra, F. 2012. El aceite de pescado: ayer un desecho industrial, hoy un producto de alto valor nutricional. Rev. Chil. Nutr. 39: 201-209. [ Links ]
Valenzuela, R.; Morales, G.; González, M.; Morales, J.; Sanhueza, J.; Valenzuela, A. 2014. Ácidos grasos poliinsaturados de cadena larga ω-3 y enfermedad cardiovascular. Revista chilena de nutrición 41(3): 319-327. [ Links ]
Velasco, J.; Dobarganes, C.; Holgado, F.; Marquez-Ruiz, G. 2009. A follow-up oxidation study in dried microencapsulated oils under the accelerated conditions of the Rancimat test. Food Research International 42(1) 56–62. [ Links ]
Yam, K.; Papadakis, S. 2004. A simple digital imaging method for measuring and analyzing color of food surfaces. Journal of Food Engineering 61(1): 137–142. [ Links ]
Zumbado, H. 2002. Análisis químico de los alimentos: Métodos clásicos. Editorial Universitaria. Ciudad de la Habana, Cuba. [ Links ]
* Autor para correspondência
E-mail: luzpaucar@uns.edu.pe (L. Paucar-Menacho).
Recibido 05 noviembre 2015
Aceptado 24 noviembre 2015