Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Scientia Agropecuaria
versão impressa ISSN 2077-9917
Scientia Agropecuaria vol.6 no.4 Trujillo out. 2015
http://dx.doi.org/10.17268/sci.agropecu.2015.04.07
ARTÍCULOS ORIGINALES
Modelación matemática del efecto de la temperatura en la actividad y la estabilidad térmica de la inulinasa de Kluyveromyces marxianus NRRL Y-7571
Mathematical modeling of the effect of temperature on the activity and thermal stability of the inulinase of Kluyveromyces marxianus NRRL Y-7571
Jesús Diestra Balta1; Lucas Margarito Aguilar1; Roberto Vega Paulino2; Augusto Castillo Calderón1, *
1 Laboratorio de Química Orgánica y Bioprocesos, Departamento Académico de Agroindustria, Universidad Nacional del Santa, Av. Universitaria s/n, Nuevo Chimbote, Perú.
2 Departamento de Bioquímica, Facultad de Farmacia y Bioquímica, Universidad Nacional Mayor de San Marcos, Jr. Puno 1002, Lima-Perú.
Resumen
Un modelo matemático se utilizó en este estudio para describir el efecto de la temperatura en la actividad y la estabilidad térmica (condiciones no reactivas) de la inulinasa de Kluyveromyces marxianus NRRL Y-7571. El modelo se tomó de la literatura, el cual se desarrolló utilizando la ecuación de Arrhenius y los datos experimentales. Una ecuación cinética de primer orden se asumió para la inactivación enzimática. Los parámetros del modelo se determinaron por regresión lineal y no lineal, reportando los intervalos de confianza. Los datos experimentales demostraron que la actividad máxima actuando en sacarosa e inulina se alcanzó a 55 °C y que estas actividades fueron altamente sensibles a temperaturas más altas. Además, la actividad inulolítica fue más estable térmicamente que la de invertasa en el rango de 48 a 60 °C. Utilizando el modelo, la temperatura del proceso para la hidrólisis de sacarosa e inulina se determinó en la intersección de las curvas de la actividad relativa y el tiempo de vida media relativo, resultando 49 °C para ambos procesos. Aunque este modelo se utilizó con referencia a la hidrólisis de la sacarosa e inulina, el enfoque es una herramienta útil que se puede aplicar a otros procesos enzimáticos para la determinación de la temperatura de operación, la que es últimamente determinada por una evaluación económica.
Palabras clave: inulinasa, estabilidad térmica, parámetros de Arrhenius, modelación matemática.
Abstract
A mathematical model was used in this study to describe the effect of temperature on the activity and thermal stability (non-reactive conditions) of the inulinase of Kluyveromyces marxianus NRRL Y-7571. The model was taken from the literature, which was developed using the Arrhenius equation and experimental data. A first-order kinetic equation was takenfor enzyme inactivation. The model parameters were determined by linear and nonlinear regression, reporting confidence intervals. The experimental data showed that the maximum activity acting on sucrose and inulin was reached at 55 °C and that these activities were highly sensitive to higher temperatures. Furthermore, inulolytica activity was more thermally stable than the invertase activity in the range from 48 to 60 °C. Using the model, the process temperature for the hydrolysis of sucrose and inulin was determined at the intersection of the curves of the relative activity and relative half-life, resulting 49 °C for both processes. Although this model was used with reference to the sucrose and inulin hydrolysis, the approach is a useful tool that can be applied to other enzymatic processes for determining the operating temperature, which is ultimately determined by an economic evaluation.
Keywords: inulinase, thermal stability, Arrhenius parameters, mathematical modeling.
1. Introducción
Las inulinasas (2,1-β-D-fructano fructano-hidrolasas, E.C.3.2.1.7) catalizan la hidrólisis de la inulina, produciendo inulooligosacáridos, fructosa y glucosa como principales productos (Neagu y Bahrim, 2011). Las inulinasas microbianas tienen muchas aplicaciones, incluyendo la producción industrial de jarabes de alto contenido de fructosa (JACF), inulooligosacáridos, etanol, aceite y proteína unicelular; y la producción de algunos químicos tales como alcoholes, ácido cítrico y ácido láctico (Castillo y Chamy 2010; Chi et al., 2011; Kango y Jain, 2011).
La D-fructosa está en una posición importante en el mercado mundial como edulcorante, ya que ofrece varias ventajas, incluyendo – pero no limitando a – su presencia natural en la mayoría de las frutas (azúcar libre) y en varias plantas (polímero), su poder edulcorante más alto, su metabolismo fisiológico en el cuerpo humano, y sus efectos insulinogénicos insignificantes (Pandey et al., 1999; Ricca et al., 2007). Por consiguiente, las inulinasas microbianas desempeñan un rol importante en la hidrólisis de la inulina para su explotación comercial. Las inulinasas hidrolizan la inulina en una sola etapa enzimática y alcanzan rendimientos del 95% de fructosa, en contraste, con las enzimas utilizadas para la producción de JACF desde almidón (Chi et al., 2011; Pandey et al., 1999).
Existen varios estudios que reportan las mejores condiciones de operación para la hidrólisis enzimática de la inulina en términos de la fuente de sustrato y enzima, la técnica de inmovilización enzimática y el tipo de reactor utilizado (Ricca et al., 2009). Sin embargo, son escasos los datos de estabilidad enzimática y su modelación en un amplio rango de condiciones de operación, los que son pre requisitos de un proceso biocatalítico para una operación de gran escala.
La temperatura de un proceso enzimático es un compromiso entre la actividad y la estabilidad enzimática, porque las altas temperaturas maximizan la actividad; mientras, la estabilidad se puede ver desfavorecida por la inactivación térmica (Illanes, 2008). Por lo tanto, la necesidad de contar con una enzima termoestable es vital, la que además puede favorecer la solubilidad de la inulina a temperaturas relativamente altas y contrarrestar la contaminación sin una significativa inactivación del biocatalizador (Dhiman, 2013; Ricca et al., 2007). Lamentablemente, son pocos los estudios que han reportado la información referente a la actividad y estabilidad de las inulinasas en función de la temperatura (Santos et al., 2007; Ricca et al., 2009).
El conocimiento de la actividad y la velocidad de inactivación a diferentes temperaturas, y su modelación son una herramienta útil para seguir mejorando el proceso de producción de fructosa a partir de la hidrólisis enzimática de la inulina. Un intento por cubrir estos aspectos fue reportado por Santos et al. (2007), quienes consideraron una velocidad de reacción de orden cero respecto del sustrato y determinaron la temperatura óptima de operación en la intercepción de las curvas de la actividad relativa y la vida media relativa utilizando la inulinasa de Kluyveromyce marxianus ATCC 16045. Sin embargo, estos autores no reportaron los intervalos de confianza, lo que son importantes para ensayar la calidad de los parámetros estimados (Vega y Zuniga-Hansen, 2014).
En este trabajo se propone una metodología sistemática para la determinación de los parámetros cinéticos con sus respectivos intervalos de confianza, utilizando como modelo la inulinasa de K. marxianus NRRL Y-7571.
2. Materiales y métodos
2.1 Materiales
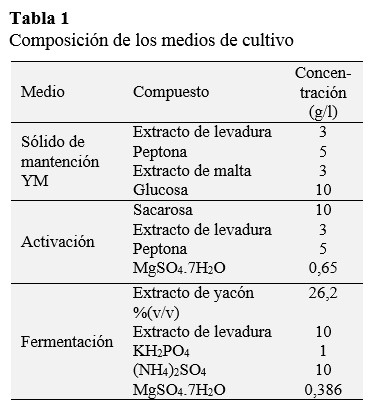
En este estudio se utilizó K. marxianus NRRL Y-7571. La cepa se mantuvo a 4 °C en tubos de ensayo inclinados con agar nutriente al 2% (p/v) y conteniendo los compuestos del medio YM (Tabla 1). La sacarosa, inulina, sales minerales y otros reactivos se adquirieron de Sigma Chemical (St. Louis, MO, Estados Unidos) y Merck (Darmstadt, Alemania).
Las raíces de yacón, proveniente del distrito de Pariacoto (región Ancash), se adquirieron en el Mercado Ecológico La Perla de la Ciudad de Chimbote, Perú.
2.1 Obtención del extracto de yacón
Las raíces de yacón se seleccionaron, se lavaron, se sanitizaron, se pelaron y se trozaron manualmente. Para la obtención del extracto se utilizó un extractor doméstico, en donde los trozos del tubérculo se adecuaron con agua caliente para disminuir el pardeamiento enzimático. Posteriormente, el extracto se filtró utilizando una tela de seda y se diluyó con agua destilada hasta alcanzar un contenido de sólidos solubles de 8 °Brix. Luego, el pH del extracto se ajustó a 4,0 con ácido fosfórico 0,01 M y se esterilizó por 15 min. Finalmente, el extracto se almacenó en refrigeración a 4 °C.
2.2 Fermentación
El inóculo inicial se preparó en matraces Erlenmeyer de 125 mL conteniendo 30 mL del medio de activación (Tabla 1). La fermentación se realizó en un agitador orbital a 180 rpm y a 30 °C por 10 h y, finalmente, se almacenó a 4 °C.
La cinética de producción de inulinasa se realizó en matraces Erlenmeyer de 500 mL conteniendo 100 mL del medio de fermentación (Tabla 1), incluyendo el inóculo (4,3% v/v). Los experimentos se realizaron por triplicado. El pH inicial del medio de fermentación se ajustó a 4,0. La fermentación se realizó por 30 h y a 30 ºC, y se agitó a150 rpm (Castillo, 2013).
2.3 Obtención del extracto enzimático
El caldo de cultivo se centrifugó a 1262xg por 30 min y a 5 °C para la recuperación del sobrenadante. Posteriormente, la enzima se precipitó a 5 °C con 10 mL/min de etanol absoluto hasta alcanzar una concentración del 55% (v/v). Seguida-mente, la mezcla se centrifugó a 4024xg en las mismas condiciones que se mencionaron anteriormente y, finalmente, el precipitado se resuspendió con tampón citrato-fosfato de 0,05 M a pH 5,0 hasta su volumen original (Castillo, 2013).
2.4 Ensayo de la actividad enzimática
La actividad se determinó midiendo la velocidad de reacción inicial de la liberación de azúcares reductores a partir de sacarosa o inulina. La mezcla de reacción consistió de 2,5 mL de solución de sacarosa (20 g/L) o inulina (10 g/L) en tampón citrato-fosfato de 0,05 M a pH 5,0 y 0,25 mL del extracto enzimático. La mezcla se incubó a 55 °C y la reacción se detuvo por calentamiento en agua hirviendo por 5 min. Finalmente, se determinó el contenido azúcares reductores por el método del ácido dinitrosalicílico (DNS).
Una unidad de actividad (UI) se definió como la cantidad de enzima requerida para liberar 1 µmol de azúcares reductores, expresados como fructosa, por min.
2.5 Efecto de la temperatura sobre la actividad enzimática
La actividad del extracto enzimático se ensayó en sacarosa e inulina en el rango de 35 a 60 °C.
2.6 Estabilidad térmica de la actividad enzimática
La estabilidad térmica en condiciones no reactivas se ensayó en el rango de 48 a 60 °C. Alícuotas del extracto enzimático de 0,25 mL se retiraron a diferentes tiempos y se midió la actividad residual en sacarosa e inulina.
2.6 Modelación de la velocidad de reacción enzimática y determinación de los parámetros
Se utilizó una ecuación cinética de orden cero respecto a la concentración del sustrato, tal como Santos et al. (2007) propusieron:
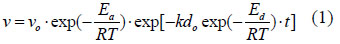
Donde Ea es la constante de la energía de activación para la reacción catalizada en cal/mol, R es la constante de los gases universales en cal/mol·K, T es la temperatura de la reacción en Kelvin, Ed es la constante de la energía de activación para la inactivación enzimática en cal/mol, t es el tiempo de la reacción en min, kdo es una constante en min-1 y vo = ko .eo es una constante en UI/mL de extracto enzimático.
La velocidad de reacción inicial (actividad enzimática) se puede determinar de la Ec (1) cuando t = 0 como se muestra a continuación:
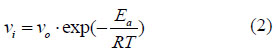
Donde Ea se determinó de la siguiente ecuación:
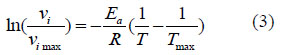
Donde V i max es la actividad máxima a una temperatura determinada (T max).
Posteriormente, Vo se determinó por regresión no lineal, ajustando la Ec (2) a los datos experimentales.
Para la inactivación enzimática se asumió una cinética de primer orden tomando en cuenta los datos experimentales como se muestra a continuación:
e = eo .exp (-Kdt) (4)
y
kd = kdo. exp (- Ed / RT) (5)
La Ed se determinó de la siguiente ecuación:
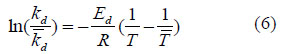
Donde T es la temperatura de referencia, 333,15 K (60 °C) y 328,15 K (55 °C) para la inactivación térmica en sacarosa e inulina, respectivamente.
La determinación de kd0 se realizó ajustando la Ec (7) a todos los datos experimentales de las cinéticas de inactivación térmica, utilizando el software Athena Visual Studio 14,2.
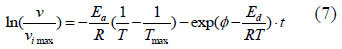
Donde kdo = exp (f) y f es una variable auxiliar.
El tiempo de vida media para la actividad enzimática en función de la temperatura se obtuvo de la Ec (4) y Ec (5) como se muestra a continuación:
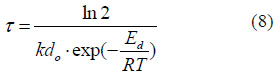
El tiempo de vida media relativo (ζ/Ť) se definió tomando como referencia 321,15 K (48 °C) para la inactivación térmica en sacarosa e inulina.
2.7 Determinación de la temperatura del proceso
La temperatura se determinó de la intersección de las curvas de la actividad relativa y el tiempo de vida media relativa, utilizando el modelo (sección 2.6) y el solver de la hoja de cálculo Excel de Microsoft 2007.
3. Resultados y discusión
3.1 Actividad del extracto enzimático
Las actividades volumétricas del extracto enzimático fueron 47 UI/mL y 3,1 UI/mL en sacarosa e inulina, respectivamente. Trabajando con el extracto enzimático crudo de K. marxianus NRRL Y-7571, Castillo (2013) determinó las actividades volumétricas de 87,2 UI/ml en sacarosa y 3,4 UI/ml en inulina en las mismas condiciones de reacción. Estos resultados indican que la etapa de purificación de la enzima con etanol tuvo un efecto negativo en la actividad catalítica de la enzima. Los resultados también demuestran que la inulinasa exhibió actividad hidrolítica hacia sacarosa, lo que es altamente deseable para la hidrólisis del enlace extremo entre los residuos de glucosa y fructosa de la inulina (Ricca et al., 2007). Es preciso que, varios autores (Pandey et al., 1999; Ricca et al., 2007) han reportado que la actividad de invertasa de las inulinasas de levaduras es más alta que la de mohos.
Es claro de los resultados obtenidos que la enzima de K. marxianus NRRL Y-7571 es una inulinasa más que una invertasa porque el cociente de las actividades de inulinasa e invertasa fue de 0,066. Ettalibi y Baratti (1987) designaron a una enzima como una inulinasa si dicho cociente es mayor de 0,01. Otros autores han reportado valores más altos de este cociente. Vandamme y Derycke (1983) reportaron cocientes de 0,29 y 0,8 para la inulinasa de Kluyveromyces fragilis y Aspergillus niger, respectivamente. Gupta et al. (1990) encontraron que el cociente I/S de la inulinasa de Fusarium oxysporum depende del tipo de fuente de nitrógeno utilizado y el tiempo de cultivación, resultado un cociente de 0,48 después de 9 días del cultivo utilizando NH4Cl o (NH4)2SO4 como fuente de nitrógeno. Como se puede ver, las enzimas tienen ambas actividades, pero en distintas magnitudes, lo que depende fuertemente del origen, las condiciones del cultivo y el método de purificación (Gupta et al., 1990, Vandamme y Derycke, 1983).
3.2 Efecto de la temperatura sobre la actividad enzimática
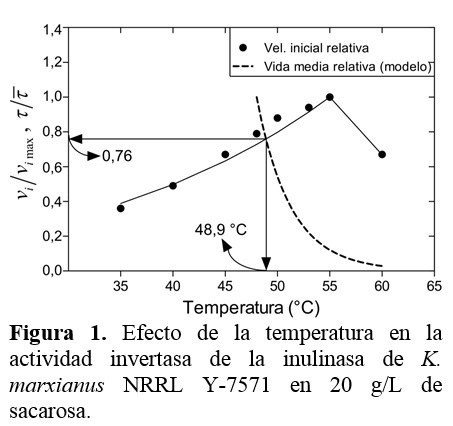
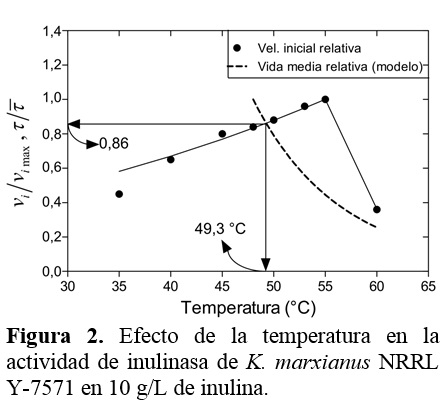
Como se muestra en las figuras 1 y 2, las actividades de la inulinasa fueron alta-mente sensibles a la temperatura. La actividad enzimática incrementó con la temperatura hasta 55 °C y luego disminuyó con temperaturas más altas.
De Paula et al. (2008) y Barthomeuf et al. (1991) también reportaron temperaturas óptimas de 55 °C para las inulinasas de K. marxianus var. bulgaricus y Penicillium rugulosum, respectivamente. Keto et al. (1999) demostraron que la inulinasa libre de Bacillus stearothermophilus KP1289 exhibe su actividad máxima a 60 °C.
Asimismo, Dhiman (2013) caracterizó bioquímicamente una inulinasa de Aspergillus sp. de la región de Punjab (India) y demostró que la actividad óptima es a 60 °C. No obstante, Cruz-Guerrero et al. (1995) reportaron que la temperatura óptima de la actividad invertasa (70 °C) es más alta que de la actividad inulolítica (50 °C) de K. marxianus CDBB-L-278, resultando interesante los diferentes perfiles que la enzima exhibe. Varios estudios han determinado la temperatura óptima para la actividad inulolítica de diferentes cepas (Kango y Jain, 2011; Negau y Bahrim, 2011; Pandey et al., 1999; Ricca et al., 2007), concluyendo que la actividad catalítica depende significa-tivamente de la cepa utilizada como fuente de producción.
Además, la información que se obtiene del perfil de la actividad versus temperatura es muy importante. Como se puede ver, la actividad enzimática después de 55 °C es altamente sensible a la temperatura, lo que significa que este rango es estrecho con poca flexibilidad operacional. Más aún, el valor de la temperatura óptima no es necesariamente aquella que se utiliza en el proceso industrial, muchos factores se deben tomar en cuenta, incluyendo la estabilidad térmica como se demostrará en la siguiente sección.
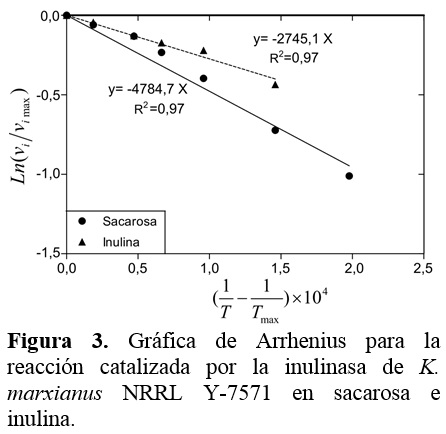
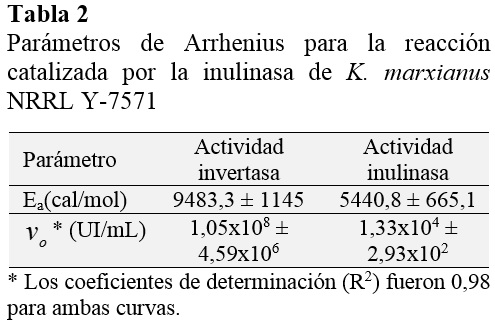
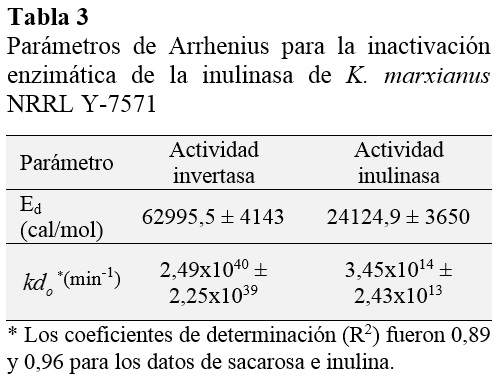
La constante de la energía de activación para la velocidad de reacción inicial en sacarosa e inulina se determinó ajustando la Ec. (3) a los datos experimentales como se muestra en la Figura 3. En la Tabla 2 se resumen los parámetros del modelo de Arrhenius.
Los resultados indican que la magnitud de la energía de activación para la actividad invertasa es más alta que para la actividad inulolítica, indicando que menos energía es requerida para promover la hidrólisis de la inulina. Trabajando con el extracto enzimático crudo de la inulinasa de K. marxianus NRRL Y-7571, Acuña y Espinoza (2013) han reportado valores de la energía de activación de 7508 cal/mol y 5460 cal/mol para las reacciones en sacarosa e inulina en las mismas condiciones experimentales que se reporta en este estudio. Estos resultados demuestran que la magnitud de la Ea es más alta para la reacción catalizada en sacarosa utilizando el extracto enzimático purificado. Este hallazgo se refiere que menos energía se requiere para que la reacción en sacarosa proceda utilizando el extracto enzimático crudo.
Valores de la energía de activación se han reportado en el mismo rango para la hidrólisis de sacarosa e inulina (Carniti et al., 1991; Cruz-Guerrero et al., 1995; Ettalibi y Baratti, 1990; Ettalibi y Baratti, 2001; Santos et al., 2007). De hecho, estas magnitudes de la energía de activación están dentro del rango que se reporta en la literatura (Illanes, 2008).
3.3 Estudio de la estabilidad térmica
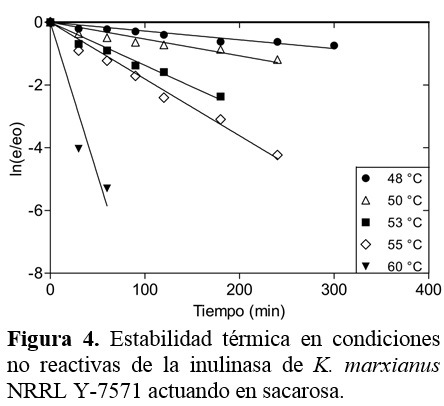
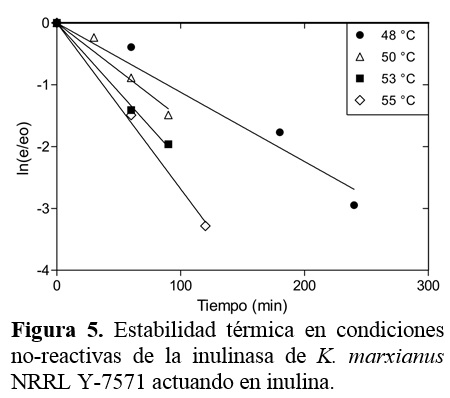
En las figuras 4 y 5 se observa que las cinéticas de inactivación térmica en condiciones no reactivas de la inulinasa obedecen una ecuación cinética de primer orden como se ha reportado en la literatura (Carniti et al., 1990; Ricca et al., 2009). Los resultados indican que el 42,6% y 18,8% de las actividades de invertasa e inulolítica se retuvieron después de 2 h de incubación en tampón citrato-fosfato de 0,05 M (pH 5,0) a 50 °C; mientras que las actividades residuales fueron insignificantes después de 30 min de incubación a 60 °C. Como se puede ver, la estabilidad térmica de la actividad de invertasa es más alta que de la inulolítica. La inactivación térmica es consecuencia del debilitamiento de las fuerzas intermoleculares responsables de la conservación de la estructura tridimensional de la enzima que conducen a una reducción de la capacidad catalítica (Illanes, 2008).
Cazetta et al. (2005) reportaron comportamientos similares de la estabilidad térmica de la inulinasa de K. marxianus en sacarosa. Ellos mostraron que esta enzima es estable por 3 h de incubación a 50 °C, mientras su actividad se perdió rápida-mente a 55 y 60 °C. Cruz-Guerreo et al. (1995) también reportaron que la inulinasa de K. marxianus tiene buena estabilidad a 50 °C. No obstante, Barthomeuf et al. (1991) reportaron que la inulinasa de Penicillium rugulosum solamente fue estable por 2 h a 50 °C y 12% de su actividad se perdió a 55 °C y totalmente se inactivó después de 30 min a 60 °C. Otros estudios han mostrado que las inulinasas del género Aspergillus son más termoestables que otras inulinasas microbianas (Dhiman, 2013; Zittan, 1981). Esta propiedad se puede relacionar al alto contenido de azúcares de las inulinasas fúngicas comparadas a las enzimas de levaduras o bacterias (Ettalibi y Baratti, 1990).
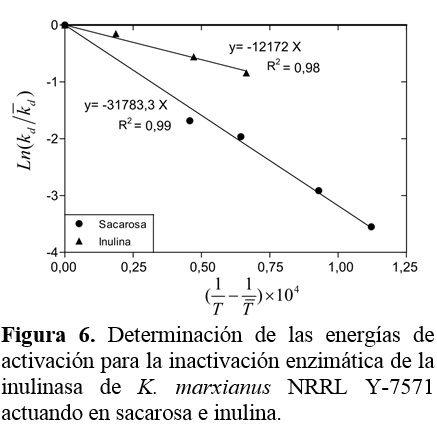
Los valores de las constantes Ed se determinaron del ajuste de la Ec. (6) a los datos experimentales como se muestra en la Figura 6 y se resumen en la Tabla 3.
La Ed es la mínima energía requerida para iniciar la inactivación térmica de la enzima. Para muchas reacciones cataliza-das por enzimas, su magnitud está en el rango de 20 a 200 kcal/mol (Illanes, 2008). Los resultados de las tablas 2 y 3 muestran que más energía es necesaria para promocionar la inactivación enzimática que para la formación de producto del complejo enzima-sustrato, así que ambos fenómenos responden a cambios diferentes de la temperatura. Resultados similares han sido reportados para la inulinasa de K. marxianus CDBB-L-278 (Ed = 28979 cal/mol en sacarosa y Ed = 10970 cal/mol en inulina, Cruz-Guerrero et al., 1995). Además, hay estudios en la literatura que reportan valores más altos de Ed para una preparación comercial actuando en inulina (74910 cal/mol, Ricca et al., 2009) y para la inulinasa de K. marxianus var. Bulgaricus actuando en sacarosa (126750 cal/mol, Santos et al., 2007), resultando estas enzimas interesantes desde un punto de vista industrial.
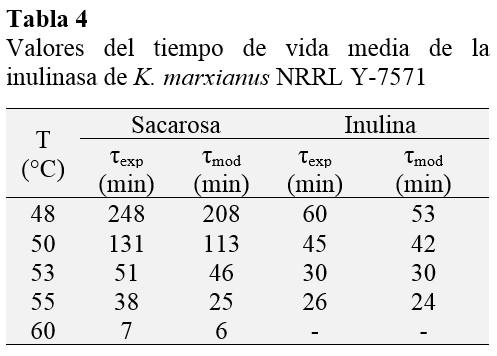
Un parámetro común utilizado en la caracterización de la estabilidad enzimática es el tiempo de vida media (Ec. 8). En la Tabla 4 se resumen los datos experi-mentales y los obtenidos del modelo para ambas actividades. Como se puede ver, los resultados experimentales y del modelo corroboran los datos mostrados en las figuras 1 y 2, en donde se muestra que la actividad inulolítica es más estable que la actividad invertasa. Así, 47,2% y 25% del tiempo de vida media a 48 °C se redujo cuando la temperatura de incubación se cambió a 50 °C.
3.4 Determinación de la temperatura del proceso
Zittan (1981) sugirió por razones cinéticas y desde un punto de vista higiénico que el proceso industrial de la hidrólisis enzimática de la inulina se debe realizar a 60 °C y varios autores desde entonces han recomendado esta temperatura (Ricca et al., 2007; Singh y Gill, 2006). Sin embargo, la mayoría de las inulinasas que se han reportadas pierden su actividad después de pocas horas a 60 °C y por lo tanto requieren reposición aumentando así el costo de producción (Dhiman, 2013). Por tal motivo, existe un creciente interés en la utilización de inulinasas con alta esta-bilidad térmica y la aplicación de modelos matemáticos para optimizar los procesos enzimáticos en función de la temperatura (Illanes et al., 2000; Ricca et al., 2009).
En las figuras 1 y 2 se observa que el tiempo de vida media decrece rápidamente con el incremento de la temperatura, por lo que la selección de una temperatura para el proceso es sumamente importante para disminuir la pérdida de la actividad enzimática, la que debe ser menor que la temperatura óptima de la actividad enzimática. Utilizando el modelo, la temperatura del proceso se estimó de la intercepción de las curvas que representan la actividad enzimática y la vida media relativa (Santos et al., 2007), resultando 49 °C para ambos procesos hidrolíticos (Figuras 1 y 2). A esta temperatura, el tiempo de vida media relativo fue 0,76 y 0.86 para las actividades de invertasa e inulinasa, respectivamente; lo que implica que la estabilidad térmica es significativamente alta.
La información que proporciona este modelo es muy útil para tener un criterio de selección de la temperatura de operación que proporcione altas productividades volumétricas y costos reducidos por el uso de la enzima, lo que es de vital importancia en las aplicaciones industriales de las inulinasas.
4. Conclusiones
La actividad y la estabilidad térmica en sacarosa e inulina de la inulinasa de K. marxianus NRRL Y-7571 fueron alta-mente sensibles a la temperatura y se describieron utilizando un modelo matemático. Las cinéticas de inactivación térmica obedecieron una ecuación cinética de primer orden como es el caso de muchas enzimas que catalizan en fase homogénea. La determinación de la temperatura del proceso, como un compromiso entre las altas temperaturas favoreciendo la velocidad de reacción y las bajas temperaturas disminuyendo las velocidades de inactivación, se realizó utilizando la metodología propuesta por Santos et al. (2007). El modelo matemático y la determinación de sus parámetros, los que se propusieron en este estudio, fueron procedimientos útiles para el cálculo de la temperatura de los procesos enzimáticos de hidrólisis de sacarosa e inulina, la que es últimamente determinada por una evaluación económica.
5. Referencias bibliográficas
Acuña, J.; Espinoza, D. 2013. Optimización del pH y la temperatura en la actividad de la inulinasa soluble de Kluyveromyces marxianus NRRL-Y7571 fermentado en extracto de yacón. Tesis para optar el título de ingeniero agroindustrial de la Universidad Nacional del Santa, Nuevo Chimbote, Perú [ Links ].
Barthomeuf, C.; Regerat, F.; Pourrat, H. 1991.Production of inulinase by a new mold of Penicillium rugulosum. Journal of Fermentation and Bioengineering 72: 491-494. [ Links ]
Carniti, P.; Beltrame, P.L.; Guardione, D.; Focher, B.; Marzetti, A. 1991. Hydrolysis of inulin: a kinetic study of the reaction catalyzed by an inulinase from Aspergillus ficuum. Biotechnology and Bioengineering 37: 575-579. [ Links ]
Castillo, A. 2013. Optimization of the environmental parameters of the fermentation of Kluyveromyces marxianus in yacon extract for the production of inulinase. Book of abstracts of the 9th World Congress of Chemical Engineering, Seoul, South Korea. [ Links ]
Castillo, A.; Chamy, R. 2010. Producción de inulinasa por levaduras de Kluyveromyces marxianus. Scientia Agropecuaria 1: 235-245. [ Links ]
Cazetta, M.L.; Martins, P.M.M.; Monti, R.; Contiero, J. 2005.Yacon (Polymnia sanchifolia) extract as a substrate to produce inulinase by Kluyveromyces marxianus var. bulgaricus. Journal of Food Engineering 66: 301-305. [ Links ]
Chi, Z.M.; Zhang, T.; Cao, T.S.; Liu, X.Y.; Cui, W.; Zhao, C.H.2011. Biotechnological potential of inulin for bioprocesses. Bioresource Technology 102: 4295-4303. [ Links ]
Cruz-Guerrero, A.; García-Peña, I.; Barzana, E.; García-Garibay, M.; Gomez-Ruiz, L. 1995. Kluyveromyces marxianus CDBB-L-278: a wild inulinase hyperproducing strain. Journal of Fermentation and Bioengineering 80: 159-163. [ Links ]
De Paula, F.; Cazetta, M.L.; Monti, R.; Contiero, J. 2008. Sucrose hydrolysis by gelatin-immobilized inulinase from Kluyveromyces marxianus var. bulgaricus. Food Chemistry 111: 691-695. [ Links ]
Dhiman, V. 2013. Optimization of thermostable inulinase production from Aspergillus isolated from Punjab region. Journal of Sustainable Biotechnology 1: 28-32. [ Links ]
Ettalibi, M.; Baratti, J. 1987. Purification, properties and comparison of invertase, exoinulinases and endoinulinases of Aspergillus ficuum. Applied and Microbiology Biotechnology 26: 13-20. [ Links ]
Ettalibi, M.; Baratti, J.C. 1990. Molecular and kinetic properties of Aspergillus ficuuminulinases. Agricultural and Biological Chemistry 54: 61-68. [ Links ]
Ettalibi, M.; Baratti, J.C. 2001. Sucrose hydrolysis by thermostable immobilized inulinases from Aspergillus ficuum. Enzyme and Microbial Technology 28: 596-601. [ Links ]
Gupta, A.K.; Rathore, P.; Kaur, N.; Singh, R. 1990. Production, thermal stability and immobilisation of inulinase from Fusarium oxysporum. Journal of Chemical Technology and Biotechnology 47: 245-257. [ Links ]
Illanes, A.; Wilson, L.; Tomasello, G. 2000. Temperature optimization for reactor operation with chitin-immobilized lactase under modulated inactivation. Enzyme and Microbial Technology 27: 270-278. [ Links ]
Illanes, A. 2008. Enzyme Biocatalysis. Principles and Applications. Editorial Springer-Verlag New York Inc., United States. [ Links ]
Kango, N.; Jain, S. 2011. Production and properties of microbial inulinases: recent advances. Food Biotechnology 25: 165-212. [ Links ]
Keto, K.; Araki, T.; Kitamura, T.; Morita, N.; Moori, M.; Suzuki, Y. 1999. Purification and properties of a thermostable inulinase (β-D-FructanFructohydrolase) from Bacillus stearothermophilus KP1289. Starch–Stärke 51: 253-258. [ Links ]
Neagu, C.; Bahrim, G. 2011. Inulinases - A versatile tool for biotechnology. Innovative Romanian Food Biotechnology 9: 1-11. [ Links ]
Pandey, A.; Soccol, C.; Selvakumar, P.; Soccol, V.; Krieger, N.; Fontana, J. 1999. Recent developments in microbial inulinases: its production, properties, and industrial applications. Applied Biochemistry and Biotechnology 81: 35-52. [ Links ]
Ricca, E.; Vincenza, C.; Curcio, S.; Iorio, G. 2007. The state of the art in the production of fructose from inulin enzymatic hydrolysis. Critical Reviews in Biotechnology 27: 129-145. [ Links ]
Ricca, E.; Calabrò, V.; Curcio, S.; Iorio, G. 2009. Optimization of inulin hydrolysis by inulinaseaccounting for enzyme time- and temperature-dependent deactivation. Biochemical Engineering Journal 48: 81-86. [ Links ]
Santos, A.M.P.; Oliveira, M.G.; Maugeri, F. 2006. Modeling thermal stability and activity of free and inmobilized enzymes as a novel tool for enzyme reactor design”. Bioresource Technology 98: 3142–3148. [ Links ]
Singh, P.; Gill, P.K. 2006. Production of inulinases: recent advances. Food Technology and Biotechnology 44: 151-162. [ Links ]
Vandamme, E.J.; Derycke, D. 1983. Microbial inulinases: fermentation process, properties, and applications. Advances in Applied Microbiology 29: 139-176. [ Links ]
Vega, R.; Zuniga-Hansen, M.E. 2014. A new mechanism and kinetic model for the enzymatic synthesis of short-chain fructooligosaccharides from sucrose. Biochemical Engineering Journal 82: 158-165. [ Links ]
Zittan, L. 1981. Enzymatic hydrolysis of inulin – an alternative way to fructose production. Starch-Stärke 33: 373-377. [ Links ]
* Autor para correspondência
E-mail: acascal2002@yahoo.es (A. Castillo).
Recibido 29 septiembre 2015
Aceptado 06 diciembre 2015