Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Scientia Agropecuaria
versión impresa ISSN 2077-9917
Scientia Agropecuaria vol.7 no.2 Trujillo abr./jun. 2016
http://dx.doi.org/10.17268/sci.agropecu.2016.02.02
10.17268/sci.agropecu.2016.02.02
ARTÍCULOS ORIGINALES
Aspectos biológicos y control de un gracilláriido (Gracillariidae: Lepidóptera) en Caesalpinia spinosa (Mol.) Kuntze (1898), en Cajamarca, Perú
Biological aspects and control of a Gracillariidae (Gracillariidae: Lepidoptera) in Caesalpinia spinosa (Mol.) Kuntze (1898), in Cajamarca, Peru
Hipólito Murga Orrillo1, *; Carlos Abanto Rodriguez2; Ana Rosa Polo Vargas3
1 Ingeniero Agrónomo, Prof. Auxiliar, Universidad Nacional Autónoma de Chota, (UNACH), Jr. Gregorio Malca Nº 875 Campus Colpa Matara, Chota, Perú.
2 Ingeniero Forestal, Investigador en el Instituto de Investigaciones de la Amazonía Peruana. Estación Experimental Dale E. Bandy Ucayali. Estrada Federico Basadre Km. 12.400, Pucallpa-Perú.
3 Ingeniero Agrónomo, Graduada en la Universidad Nacional de Cajamarca, Av. Atahualpa Nº 1050Carretera Cajamarca-Baños del Inca, Cajamarca, Perú.
Resumen
Se tuvo por objetivo determinar aspectos biológicos, identificar enemigos naturales, y establecer periodos oportunos de control de un gracillariido plaga de tara. Los aspectos biológicos y los enemigos naturales se evaluaron en campo y en laboratorio, los periodos oportunos de control se determinó por interacción hospedero-plaga. Los resultados, el huevo dura 7,8 días y mide 0,34x0,21mm; la larva presenta 4 instares y dura 35,7 días, variando de medidas entre 1o y 4o instar de 0,09 a 0,65 mm de diámetro de encéfalo; la pupa dura 14,3 días y mide 6,7mmx1,1mm; el adulto dura 7,5 días y mide 13,43 mm de expansión alar. Presenta enemigos naturales, familias Encyrtidae, Ichneumonidae, y géneros Chelonus sp., Chrysoperla sp., Hemerobius sp., Cicloneda sp., Hipodamia sp., y Zelus spp. Las mejores épocas de control ocurren cuando la fenología de la tara está entre R3.1 a R4 y R3.3 a R6.
Palabras clave: tara, plaga, biología, enemigos naturales.
Abstract
Determine biological target, identify natural enemies, and establish appropriate periods of controlling a pest gracillariid tare. The biological aspects and natural enemies in field and laboratory were evaluated, appropriate control periods was determined by host-pest interaction. The results, egg lasts 7.8 days and measured 0.34x0.21 mm; presents four instars larvae and lasts 35.7 days, ranging from measures between 1st and the 4th instar from 0.09 to 0.65 mm diameter brain; the pupa lasts 14.3 days and measured 6.7mmx1.1mm; adult takes 7.5 days and measured 13.43 mm wingspan. Presents natural enemies, family Encyrtidae, Ichneumonidae, and genres Chelonus sp., Chrysoperla sp., Hemerobius sp., Cicloneda sp., Hippodamia sp., and Zelus spp. The best times control occur when the phenology of the tara is between R3.1 to R3.3 and R4 to R6.
Keywords: tara, pest, biology, natural enemies.
1. Introducción
La tara (Caesalpinia spinosa (Molina) Kuntze) es un árbol leguminosa nativo de Perú, (Romero et al., 2012; Skowyra et al., 2014), de sus vainas y semillas se obtienen taninos, gomas, hidrocoloides y galactómanos, utilizados en industrias (Rojas et al., 2010) químicas, farmacéuticas, cosméticas, alimenticias (Romero et al., 2012; Skowyra et al., 2014), pintura y barnices (De La Cruz, 2004). Los taninos de tara son utilizados en la medicina popular por sus propiedades astringente, antiinflamatorios, antimicóticos, antibacterianas, antisépticas, antitumoral, antimicrobiana y antioxidantes (AguilarGalvez et al., 2014). La actividad antioxidante de los taninos se debe a sus polifenoles (Chambi et al., 2013; Romero et al., 2012), con aplicaciones actuales contra la leucemia (Castañeda et al., 2012) y cáncer de mama (Urueña et al., 2013). En Perú, la región Cajamarca es el primer productor de tara, con 40% de la producción nacional (Melo et al., 2013), en la provincia de San Marcos de esta región, el incrementando del área forestal y manejo productivo con eliminación de vegetación asociada, ha ocasionado ataques importantes de un gracilláriido (Lepidóptero: Gracillariidae) minador de vainas de tara (MVT). En el año 2010 se determinó daños del MVT, con ataques de 84% en las vainas. Se sabe que el ataque del MVT solo está ocurriendo en Cajamarca, generando riesgo que esta región sea foco de proliferación a otras regiones del país.
La familia de gracilláriidos es la más numerosa de microlepidopteros minadores de hojas y frutos, con 105 géneros y 1935 especies distribuidos en las regiones zoogeográficas del planeta; en la región Neotropical se han registrado 25 géneros y 185 especies, donde, en Perú están descrito 8 géneros y 21 especies (De Prins y De Prins, 2014). Las especies de gracilláriidos con hospedero en la familia Caesalpiniaceae, se encuentran en la región Oriental a Acrocercops hyphantica en Caesalpinia decapetala, a A. macroclina en Caesalpinia bonduc, a Cuphodes plexigrapha en Caesalpinia sp. (Robinson et al., 2001), a Phodoryctis caerulea en Caesalpinia pulcherrima (Kumata et al., 1988), y a Stomphastis chalybacma en Caesalpinia decapetala y Caesalpinia pulcherrima (Meyrick, 1912); en la región Etiópica a A. hyphantica en Caesalpinia decapetala (Coetzer y Neser, 1999; Byrne et al. 2011); y en la región Neartica a Marmara guilandinella en Caesalpinia bonduc (Busck, 1900); en la región Neotropical no se tiene registros de gracilláriidos con hospedero en la familia Caesalpiniaceae, siendo esta investigación el primer estudio de un gracillariido con hospedero en Caesalpinia spinosa en esta región.
El gracillariido MVT, al tratarse de una nueva plaga, realizar estudios de su biología, interacción con su hospedero y enemigos naturales asociados, es imperativo antes de tomarse cualquier medida de control, evitando impactos negativos, y direccionando a la tara hacia una producción ambientalmente sostenida. Mediante lo expuesto, este trabajo tuvo por objetivos, determinar aspectos biológicos, identificar sus enemigos naturales, y establecer periodos oportunos de control del gracillariido MVT, en los bosques de tara de la Provincia San Marcos, Cajamarca-Perú.
2. Materiales y métodos
El estudio se realizó en los bosques de tara de la Provincia San Marcos (PSM), ubicado entre 78°11'O 7°20'S a 2207 m de altitud, y 78°11'O 7°19'S a 2315 m de altitud, en el periodo de junio del 2010 a abril del 2011, con registro climáticos de temperatura (T) que varía de 10 ºC a 26 ºC, y humedad relativa (HR) de 70%. El laboratorio de cría de insectos fue de la ONG A. C. Tierra en San Marcos, con T promedio de 20,3 ºC y 68% de HR. La identificación de los incestos se realizó en el Laboratorio del Departamento de Entomología de la Universidad Nacional Agraria la Molina (UNALM), Lima, Perú.
Biología
El rápido deterioro por oxidación de vainas verdes de tara en laboratorio, condiciono que el tiempo de incubación de huevos e instares larvales del MVT se determinaran en campo, pero las medidas morfométricas se realizaron en laboratorio con destrucción de muestras; y los estadíos de pupa y adulto se determinaron en laboratorio. En todas los estadíos del MVT se evaluaron su viabilidad.
Estadíos de huevo y larva. En campo con lupa 20X se identificaron 213 posturas en 32 racimos de vainas de tara, estas posturas fueron rotuladas, y observadas cada 2 días hasta la eclosión. Se evaluaron 144 larvas, de las cuales cada 4 días, 10 muestras se colectaban y se llevaron a laboratorio, donde se extrajeron las larvas del interior de las semillas, se fijaron en solución de alcohol etilo (80%) y ácido acético por 48 h, y luego se transfirieron a una solución de alcohol etílico (80 %) y glicerina siguiendo la metodología de Holloway et al. (1987) y Stehr (1987), utilizada para realizar mediciones de larvas. Las medidas morfométricas de huevo, largo (L) y diámetro de encéfalo (ØE) de larvas se determinaron en estereoscopio con micrométrico a 50X.
Estadíos de pupa y adulto. Se colectaron vainas maduras de tara y fueron colocadas en cámaras de cría (50x40x30cm), se obtuvieron 93 larvas próximas a empupar, de las cuales 72 construyen cocón y empuparon. Mediante observaciones diarias se obtuvieron 44 adultos, los cuales fueron sexados, encontrándose 19 machos (♂) y 25 hembras (♀), éstos insectos adultos fueron aislados y alimentados con jarabe de miel de abeja al 10% en grupos de 4 (2 ♂ y 2 ♂) en frascos de vidrio (32 cm alto x 18 cm de Ø) acondicionados hasta obtener posturas. Las medidas morfométricas de largo (L) y ancho (A) de la pupa, y expansión alar (EA) y tamaño en reposo (TR) del adulto se determinaron en regla milimétrica.
Enemigos naturales. Los huevos, larvas (en campo 213 huevos y 144 larvas) y pupas (en laboratorio 93 larvas y 72 pupas) donde se determinó la biología del MVT, fueron también evaluados de manera paralela para determinar sus enemigos naturales; se consideraron algunos criterios donde se determinaron los predadores o parasitoides: a. Se evaluaron en campo, presencia de insectos predadores o parasitoides en los racimos de tara infestados con el MVT. b. Se determinaron en campo o en laboratorio actos de depredación o parasitismo, en los estadíos del MVT. c. Se consideraron restos de huevos, o larvas muertas sin o poco contenido endosomático (sobre las vainas verdes o dentro de las semillas), como evidencia de depredación. d. Se consideraron presencia de huevos, pupas, o emergencias de adultos parasitoides en las larvas y pupas del MVT. e. Se encontraron presencia de exuvias de parasitoides en restos de larvas o pupas del MVT. Los insectos controladores involucrados en estos criterios, así, los parasitoides fueron criados en cámaras de cría para obtención de adultos, y los predadores fueron colectados de campo. Estas muestras se montaron y enviaron a la UALM para su identificación taxonómica.
Interacción fenológica de la tara y estadíos del MVT
Para determinar los periodos oportunos de control del MVT, se realizaron evaluaciones de interacción inter específica plaga-hospedero, por lo cual fue necesario conocer la fenología reproductiva (R) de la tara. No existe referencias de la fenología R de la tara, las evaluaciones al respecto se realizaron en función a características específicas, por inspecciones visuales, percepción al tacto y mediciones, tales como, color, crecimiento y desarrollo, y apariencia al tacto de las semillas y vainas. Las evaluaciones de interacción interespecifica se realizaron cada 4 días, a partir de 32 inflorescencias hasta la madurez comercial de las vainas. Se consideraron niveles de intensidad de interacción de los estadíos del MVT, donde, interacción alta (A), ≥ 50% de vainas/racimo con estadío del MVT; interacción media (M), <50% a ≥20% de vainas/racimo con estadío del MVT; interacción baja (B) ≤ 20% de vainas/racimo con estadío del MVT.
3. Resultados y discusión Biología
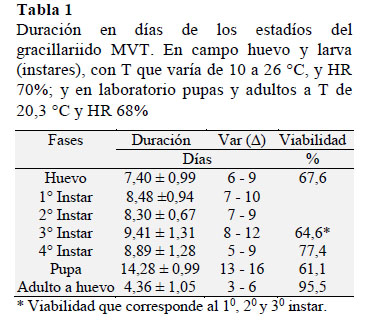
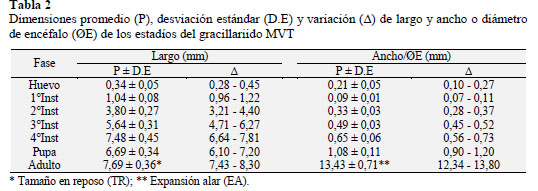
Los resultados de la biología del MVT, se presentan en la Tabla 1 y 2, que muestran el crecimiento, desarrollo y morfometría de cada estadío; y en la Figura 1 y 2 se muestran las características cualitativas morfológicas y daños en semillas de tara.
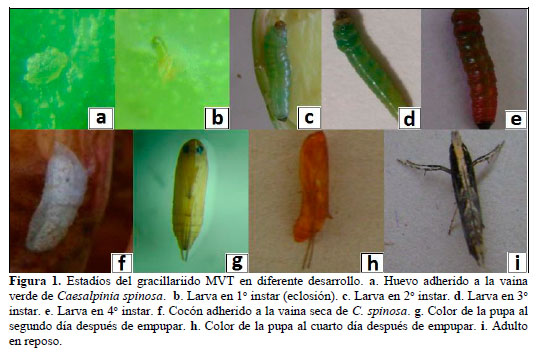
Huevo. El huevo es individual y son ovopositados en los bordes superiores de las vainas verdes, presenta un periodo de incubación de 7,8 días (Tabla 1), mide de 0,28-0,45x0,10-0,27 mm (Tabla 2), es ovalado, plano, varia de transparente a crema sutil (Figura 1a), próximo a la eclosión de la larva Figura 1b puede ser visto debido a su transparencia; en estudios hechos en gracilláriidos describen a huevos de colores translúcido a blanco (Brito et al., 2012), blanco verdoso, de forma oval, individual y miden 0,31 x 0,22 mm (Bentancourt y Scatoni, 2007), plano, vidrioso, con medidas de 0,21-0,34 x 0,36 44 mm (Davis y Wagner, 2005). De los 213 huevos evaluados, presentaron una viabilidad de 67,6% (Tabla 1), donde se determinaron la mortalidad por depredaciones de 16,4%, y por factores no determinados mortalidad de 16,0%.
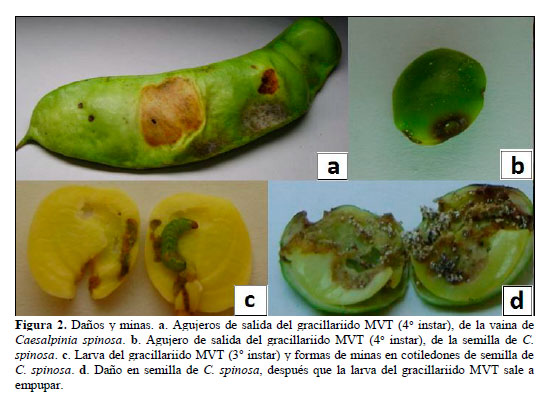
Larva. Se evaluaron 144 larvas, en base a las mediciones de capsula cefálica, se determinaron que presenta cuatro instares (Figura 1b-1e), con esta metodología en otros gracillárridos determinaron cinco instares (Davis y De Prins, 2011), seis instares (Kasch y Nicolai, 2002), y por observaciones morfológicas determinan cuatro instares (Davis y Wagner, 2005; Brito et al., 2012). El 1o instar Figura 1b mina desde la epidermis de la vaina hasta la semilla, donde se alimenta de los cotiledones (Figura 2b-2d), para crecer y desarrollar más 3 instares, en un periodo de 35,7 días (Tabla 1). Los instares 1o, 2o y 3o (Figura 1b-1d) varían de color blanco a verde claro, y el 4o instar (Figura 5) es de color rojo verdoso, estudios en otros gracilláriidos encontraron que la larva se desarrolla dentro de las minas (Bentancourt y Scatoni, 2007; Davis y De Prins, 2011; Mundaca et al., 2013), sin embargo, también pueden permanecer expuestas (Davis, 1987). Las medidas entre 1o y 4o instar varían de 1,04-7,48 mm de L a 0,09-0,65 mm de ØE (Tabla 2). La viabilidad del 1o, 2o y 3o instares se evaluó dentro de las vainas y fueron de 64,6% (Tabla 1); donde el 11,1% de mortalidad fueron por depredaciones, y 24,3% por factores no determinados, estos factores pueden ser mecanismos naturales de defensa de la planta contra insectos, como afirman investigaciones, que los taninos de las vainas y la lectina de semilla de tara, tienen propiedades insecticidas (Romani et al., 2012). La viabilidad del 4o instar se evaluó cuando se disponía a empupar fuera de la mina y fue de 77,4% (Tabla 1), la mortalidad fueron 7,5% por parasitismo, y 15,1% por factores no determinados.
Pupa. Las larvas construyen su cocón de color blanco fuera de las minas (Figura 1f), sobres las hojas, frutos y tallos de la tara. Dentro del cocón tiene lugar la pupación. La pupa varia de color crema a marrón a medida que se desarrolla (Figura 1g-1h) y a gris cuando emerge el adulto en un periodo de 14,3 días (Tabla 1). La pupa mide 6,7 mm x 1,1 mm (Tabla 2). En estudios los gracilláriidos presentan cocón (Brito et al., 2012; Davis y De Prins, 2011; De Prins et al., 2013) de colores blanco, marrón, naranja o chocolate (Davis y Wagner, 2005); sin embargo otros no presentan cocón (Mundaca et al., 2013). La pupación ocurre fuera de las minas (De Prins et al., 2013) o dentro de la mina (Bentancourt y Scatoni, 2007; Davis y De Prins, 2011), algunos que empupan dentro de la mina no presentan cocón (Mundaca et al., 2013), las pupas varian de color amarillenta a marrón (Brito et al., 2012) u oscuro cerca de la emergencia de los adultos (Bentancourt y Scatoni, 2007). Las pupas duran aproximadamente 10 a 14 días (Davis y Wagner, 2002). En este estadio el MVT presentó una viabilidad de 61,1% (Tabla 1), donde la mortalidad fue 16,7% por parasitismo y 22,2% por factores sin determinar.
Adulto.La hembra miden 8,3 mm de TR x 13,8 mm de EA (Tabla 2), con longevidad de 8 días, y el macho mide 7,4 mm de TR y 12,3 mm de EA (Tabla 2), con longevidad de 6 días. Son de color plomo o gris, con una franja dorsal de color crema (Figura 1i), presentan antenas filiformes más grandes que su cuerpo, y a las estrechas con flecos en los bordes. En condiciones de laboratorio, la copula y postura ocurrieron en la noche, las puestas fueron a los 4,36 días (Tabla 2), con 42,6 ±15,4 huevos. En campo se les puede ver en horas crepusculares. Otros investigadores de gracilláriidos presentan datos similares al afirmar que son de habito nocturnos, la hembra con longevidad de 6 a 14 días, con posturas de 33 a 113 huevos, el período de oviposición varía entre 5 a 12 días (Bentancourt y Scatoni, 2007). La viabilidad del adulto fue del 95,5%; la mortalidad se dio por malformaciones congénitas. Se trata de una especie polivoltina, la producción de tara es constante registrándose ataques todos los meses del año. En otros estudios de esta familia determinan que son bivoltino con la hibernación (De Prins et al., 2013) y univoltino (Mundaca et al., 2013).
Enemigos Naturales
Predadores. Los resultados (Tabla 3) de las evaluaciones de los 213 huevos, se obtuvieron que 16,4% fueron depredados, por Coleópteros, de los géneros Hippodamia sp. (Figura 3f) y Cicloneda sp. (Figura 3c), y Neurópteros, géneros Chrysoperla sp. (Figura 3b) y Hemerobius sp. (Figura 3a). Las 144 larvas evaluadas, el 11,1% fueron depredadas, por Hemípteros del género Zelus spp. (Figura 3d-3e), las larvas depredadas se encontraron con escaso contenido endosomático dentro de las semillas y vainas. Resultados de otras investigaciones también han determinado como depredadores del gracilláriido Phyllocnistis citrella a Neurópteros de los géneros Chrysoperla sp. (Legaspi et al., 2001; Gonzalez et al., 2010; Lioni y Cividanes, 2004) y Hemerobius sp. (Lioni y Cividanes, 2004), a Coleópteros de la familia Coccinellidae (Legaspi et al., 2001; Gonzalez et al., 2010) y al Hemíptero del género Zelus sp. (Lioni y Cividanes, 2004).
Parasitoides. Se evaluaron 93 larvas en el 4o instar (prepupa), donde se obtuvieron resultados que el 7,5% de larvas no empuparon por mostrar parasitismo y de las larvas que empuraron el 16,7% también estuvieron parasitadas. Los resultados (Tabla 3) de la identificación indican que son Himenópteros parasitoides de las familias Encyrtidae (poliembriónico: 33 individuos/huésped), Ichneumonidae y el género Chelonus sp. (Braconidae), actúan en complejos de parasitismos en larvas y pupas del MVT. Los gracillariidos tienen registros de 36 especies como hospederos de parasitoides de la familia Encyrtidae y 69 especies como hospederos de la familia Ichneumonidae (De Prins y De Prins, 2014). Estudios en Phyllocnistis citrella han determinado como importante parasitoide a los Encyrtidae (Legaspi et al.,2001; Lioni y Cividanes, 2004), porque son predominantes frente otros parasitoides (Sa et al., 2000), de amplia distribución (Gonzalez et al., 2010) y como especies exóticas genera cambios en las estructura de complejos de parasitoides (Jahnke et al., 2007). Los Ichneumonidea, también se han determinado como parasitoides en Cameraria ohridella (Tóth y Lukáš, 2005), estos parasitoides son diversificados y forman complejos con Braconidae y otros parasitoides (Tóth y Lukáš, 2005).Se ha determinado formación de complejos de parasitismo en otros gracillariidos a las familias Ichneumonidae, Encyrtidae, Eulophidae y Pteromalidae con parasitismo hasta de 92,6% en Phyllonorycter persimilis, a Ichneumonidae, Encyrtidae, y Eulophidae con parasitismo hasta de 81,7% en P. leucocorona (Nakamura y Kimura, 2009), a Ichneumonidae (Lymeon sp., Acrolyta n. sp., Isdromas spp., y Pimpla croceiventris) y Braconidae (Pholeteser sp., Orgilus spp.) con parasitismo del 40% en Leurocephala schinusae (Davis et al., 2011) a Ichneumonidae, Braconidae y Eulophidae en Parectopa robiniella y P. robiniella (Bolchi, 1990), a Eulophidae y Encyrtidae (Ageniaspis sp.) en Phyllocnistis sp. (Kawahara et al., 2009), a Ichneumonidae y la superfamilia Chalcidoidea en Callisto denticulella (Górska y Napiórkowska, 2009).
Estudios también mostraron que el género Chelonus (Braconidae) es un importante parasitoide larval de varias plagas de lepidópteros, y juega un papel efectivo en el equilibrio del ecosistema (Yousuf y Ray, 2009). Chelonus sp. es potencial agente de control de gracilláriidos minadores y barrenadores como Cramerella conopomorpha, Acrocercops globulifera, A. diffluella, A. caerulea, A. phaeospora, Epicephala chalybacma (Walker y Huddleston, 1987), en Conopomorpha sinensis, determinaron el 54,3% de larvas parasitadas, donde el 90,8% fueron por Chelonus sp., por eso, se sugiere utilizarlo en control de plagas por su eficacia y fácil cría en masa en laboratorio (Schulte et al., 2007).
Interacción fenológica de la tara y estadíos del MVT
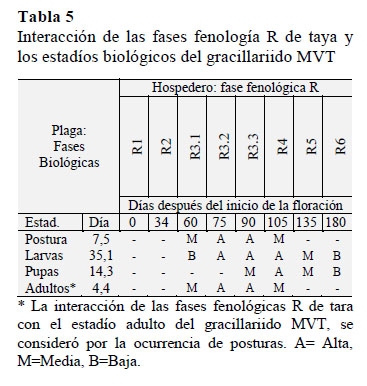
Los resultados de la fenología R de la tara, determinaron 8 fases (Tabla 4) entre la floración y la época de cosecha, en un tiempo 180 días. Resultados similares obtienen en un estudio en Ancash, Perú, a 3000 m de altitud, donde determinaron un periodo entre la floración y la madurez comercial de 195 días, también describen a las vainas maduras de color rojoanaranjado (Melo et al., 2013), amarillo a rojo-pálido o naranja, y con medidas de 8 10 cm de longitud (Chambi et al., 2013). La mejor oportunidad de control del MVT, ocurre cuando los estadíos están más expuestos a factores externos de mortalidad, estos factores pueden ser orientados, potenciando y complementando con otros factores para generar mayor inviabilidad de estos estadíos.
En la Tabla 5 los estadíos de huevo desde la fase fenología R3.1 hasta R4, y la pupa desde la fase fenología R3.3 hasta R6, se encontraron más expuestos a factores externos de mortalidad; las larvas se desarrollan dentro de las minas, donde al parecer, los factores de mayor mortalidad son mecanismos bioquímicos de defensa de la planta.
En evaluaciones de viabilidad (Tabla 1) se corrobora mayor mortalidad por factores externos, así: el estadío de huevo con viabilidad de 67,6%, la mortalidad fueron por depredación de 16,4%, y por factores no determinados 16,0%; en pupa con viabilidad de 61,1%, la mortalidad fueron por parasitismo de 16,7%, y por factores no determinados de 22,2%; sin embargo, en la larva con viabilidad de 64,6%, la mortalidad fueron por depredación 11,1% y por mecanismos no determinados de defensa de la planta 24,3%. La sobre-posición de posturas del MVT genera diferentes estadíos en una misma fase fenológica R de la tara (Tabla 5), provocando mayor intensidad de interacción. Por eso es necesario definir la frecuencia de control, teniendo en cuenta, el tipo de control y duración de días de cada estadío.
La tara es un producto natural, por lo cual el control del MVT debe orientarse a potenciar sus controladores naturales (Tabla 3) y complementar con otros métodos viables.
La incubación del huevo es de 7,5 días, sugiriendo una frecuencia de control menor a 7 días, iniciándose entre los 60 a 67 días en R3.1, hasta los 105 días en R4 (Tabla 5). Las pupas presentaron una duración de 14,3 días sugiriendo una frecuencia de control menor a 14 días, iniciándose entre los 90 a 104 días en R3.3 hasta los 180 días en R6 (Tabla 5).
4. Conclusiones
El minador de vainas de tara completa sus 4 estadíos de desarrollo en 62 días, donde el estadío larval se desarrolla específicamente dentro de las vainas, presentando 4 instares larvales.
Los enemigos naturales del minador de vainas de tara, forman complejos de parasitoides y predadores, realizando actividad de control biológico en las fases de desarrollo la plaga de huevo y larva.
Conociendo la interrelación de la biología de la plaga y la fenología del hospedero, se puede adoptar medidas de control oportunas y eficientes.
Agradecimientos
A la Asociación de Productores de Tara Cajamarca-San Marcos (ATP), Asociación Civil Tierra (A.C. Tierra), SENASA-San Marcos, Deutsche Gesellschft für Internationale Zusammenerbeit (GIZ) GmbH, Universidad Nacional de Cajamarca (UNC), y a la Universidad Nacional Agraria la Molina (UNALM).
Referencias bibliográficas
Aguilar-Galvez, A.; Noratto, G.; Chambi, F.; Debaste, F.; Campos D. 2014. Potential of C. spinosa (Caesalpinia spinosa) gallotannins and hydrolysates as natural antibacterial compounds. Food Chemistry 156(1): 301-304. [ Links ]
Bentancourt, C.; Scatoni I. 2007. Morphology and biology of Porphyrosela minuta Clarke 1953 (Lepidoptera: Gracillariidae, Lithocolletinae) in Uruguay. Neotrop. Entomol. Londrina 36(4): 514-519. [ Links ]
Bolchi, S. 1990. Parasitoids of Parectopa robiniella Clemens and Phyllonorycter robiniellus (Clemens) (Lepidoptera Gracillariidae). Bollettino di Zoologia Agraria e di Bachicoltura 22(2): 139-149. [ Links ]
Brito, R.; Gonçalves, G.; Vargas, H.; Moreira, G. 2012. A new species of Phyllocnistis Zeller (Lepidoptera: Gracillariidae) from southern Brazil, with life-history description and genetic comparison to congeneric species. Zootaxa 3582(1):1-16. [ Links ]
Busck, A. 1900. New species of moths of the superfamily Tineina from Florida. Proceedings of the United States National Museum 23(1208): 225-254. [ Links ]
Byrne, M.; Witkowski, E.; Kalibbala, F. 2011. A review of recent efforts at biological control of Caesalpinia decapetala (Roth) Alston (Fabaceae) in South Africa. African Entomology: Biological control of invasive alien plants in South Africa (1999-2010): Special. 19(2): 247-257. [ Links ]
Castañeda, D.; Pombo, L.; Urueña, C.; Hernandez, J.; Fiorentino, S. 2012. A gallotannin-rich fraction from Caesalpinia spinosa (Molina) Kuntze displays cytotoxic activity and raises sensitivity to doxorubicin in a leukemia cell line. BMC Complementary and Alternative Medicine 12(38):1-10. [ Links ]
Chambi, F.; Chirinos, R.; Pedreschi, R.; BetalleluzPallardel, I.; Debaste, F.; Campos, D. 2013. Antioxidant potential of hydrolyzed polyphenolic extracts from C. spinosa (Caesalpinia spinosa) pods. Industrial Crops and Products 47(1): 168-175. [ Links ]
Coetzer, W.; Neser, S. 1999. Biological control initiatives against the invasive Oriental legume, Caesalpinia decapetala (Roth) Alston (Mauritius thorn).Biological Control of Weeds in South Africa (1990–1998). African Entomology Memoir 1(1): 145-152. [ Links ]
Davis, D.; Mc Kay, F.; Oleiro, M.; Vitorino, M.; Wheeler, G. 2011. Biology and systematics of the leafmining Gracillariidae of Brazilian pepper tree, Schinus terebinthifolius Raddi, with descriptions of a new genus and four new species. Journal of the Lepidopterists’ Society 65(2): 61-93.
Davis, D.; De Prins, J. 2011. Systematics and biology of the new genus Macrosaccus with descriptions of two new species (Lepidoptera, Gracillariidae). ZooKeys. 1(98): 29. [ Links ]
Davis, D.; Wagner, D. 2005. Biology and systematics of the neotropical leafminer genus Eucosmophora (Lepidoptera: Gracillariidae). Biología y sistemática del género neotropical de minadores de hojas Eucosmophora (Lepidoptera: Gracillariidae). Tropical Lepidoptera 13(1-2): 1-40. [ Links ]
Davis, D.; 1987. Gracillariidae (Tineoidea), p.372-374. In F.W. Stehr (ed.), Inmature insects. 1 (Dubuque, Kendall/Hunt): 754. [ Links ]
De La Cruz, L. 2004. Aprovechamiento integral y racional de la tara Caesalpinia spinosa Caesalpinia tinctoria. Rev. Inst. Investig. Fac. Minas Metal Cienc. Geogr. 7(14): 1-2. [ Links ]
De Prins, J.; Davis, D.; De Coninck, E.; Sohn, J.; Triberti, P. 2013. Systematics, phylogeny and biology of a new genus of Lithocolletinae (Lepidoptera: Gracillariidae) associated with Cistaceae. Zootaxa 3741(2): 201-227. [ Links ]
De Prins, J.; De Prins, W. 2014. Global Taxonomic Database of Gracillariidae (Lepidoptera). Belgian Biodiversity Platform. Disponible en: http://www.gracillariidae.net. [ Links ]
Gonzalez, F.; Hernandez, E.; Rodriguez, T. 2010. Presencia y distribución de un complejo de biorreguladores de Phyllocnistis citrella Stt. (Lepidoptera: Gracillariidae) en cítricos de Cuba. Fitosanidad 14(4): 215-218. [ Links ]
Górska, D.; Napiórkowska, K. 2009. Parasitic hymenoptera reared from Callisto denticulella (Thnbg.) (Lepidoptera, Gracillariidae). Polish Journal of Entomology 78(2): 121-126. [ Links ]
Holloway, J.; Bradley, J.; Carter, D. 1987. Guides to insects of importance to man: I Lepidoptera. London, C. R. Betts. : 2621. [ Links ]
Jahnke, M.; Redaelli, R.; Diefenbach, M.; Dal Soglio, K. 2007. Structure and composition of the assemblage of parasitoids associated to Phyllocnistis citrella Pupae Stainton (Lepidoptera: Gracillariidae) in citrus orchards in Southern Brazil. Neotrop. entomol. 36(5): 746-751. [ Links ]
Kasch, K.; Nicolai, V. 2002. Phyllonorycter robiniella (Clemens) (Lepidoptera, Gracillariidae) – ein nordamerikanischer Schmetterling neu in Berlin. In: Kowarik I, Starfinger U (Hrsg): Biologische Invasionen.Herausforderung zum Handeln? Neobiota 1(1): 193-202. [ Links ]
Kawahara, A.; Nishida, K.; Davis, D. 2009. Systematics, host plants, and life histories of three new Phyllocnistis species from the central highlands of Costa Rica (Lepidoptera, Gracillariidae, Phyllocnistinae). ZooKeys 27(1): 7-30. [ Links ]
Kumata, T.; Kuroko, H.; Ermolaev, V. 1988. Japanese species of the Acrocercops-group (Lepidoptera: Gracillariidae). Part II. Insecta Matsumurana, N. S. 40 (1): 1-133 [ Links ]
Legaspi, L.; French, V.; Garza, Z.; Legaspi, J. 2001. Population Dynamics of the Citrus Leafminer, Phyllocnistis citrella (Lepidoptera: Gracillariidae), and Its Natural Enemies in Texas and Mexico. Biological Control 21(1): 84-90. [ Links ]
Lioni, S.; Cividanes, J. 2004. Tabela de vida ecológica do minador-dos-citros, Phyllocnistis citrella Stainton (Lepidoptera: Gracillariidae). Neotrop. Entomol. 33(4) 407-415. [ Links ]
Melo, F.; Glorio, P.; Spinosa, R. 2013. Efecto de la madurez em los componentes de valor comercial (taninos y goma) de C. spinosa Caesalpinia spinosa (Molina) Kuntze. Rev. Soc. Quím. Perú. 79(3): 218-228. [ Links ]
Meyrick, E. 1912. Exotic Microlepidoptera. Exotic Microlepidoptera. Marlborough 1(1): 1-32. [ Links ]
Mundaca, E.; Parra, L.; Vargas, H. 2013. A new genus and species of leaf miner (Lepidoptera, Gracillariidae) for Chile associated to the native tree Lithraea caustica. Revista Brasileira de Entomologia 57(2): 157-164. [ Links ]
Nakamura, T.; Kimura, M. 2009. Weak parasitoid‐mediated apparent competition between two Phyllonorycter (Lepidoptera: Gracillariidae) leaf miner species on a deciduous oak Quercus dentata. Entomological science 12(3): 227-231. [ Links ]
Robinson, G.; Ackery, P.; Kitching, I.; Beccaloni, G.; Hernández, L. 2001. Hostplants of the moth and >butterfly caterpillars of the Oriental Region. Southdene Sdn Bhd. 744pp. [ Links ]
Romani, A.; Campo, M.; Pinelli, P. 2012. HPLC/DAD/ESI-MS analyses and anti-radical activity of hydrolyzable tannins from different vegetal species. Food Chem. 130(1): 214-221. [ Links ]
Romero, N.; Fernández, A.; Robert, P. 2012. A polyphenol extract of C. spinosa pods (Caesalpinia spinosa) as a potential antioxidant in oils. European Journal of Lipid Science and Technology 114(8): 951-957. [ Links ]
Rojas, O.; Rojas, N.; Diaz, G. 2010. Forestación piloto con tara en Cajamarca. Ind. Data 13(1): 45-56. [ Links ]
Sa, N.; Costa, V.; Oliveira, P.; Almeida, R. 2000.Parasitoids of Phyllocnistis citrella in Jaguariúna, state of São Paulo, Brazil, before and after the introduction of Ageniaspis citricola. Sci. agric. 57(4): 799-801. [ Links ]
Schulte, M.; Martin, K.; Sauerborn, J. 2007. Biology and control of the fruit borer, Conopomorpha sinensis Bradley on litchi (Litchi chinensis Sonn.) in northern Thailand. Insect Science 14(6): 525-529. [ Links ]
Skowyra, M.; Falguera, V.; Gallego, G.; Peiró, S.; Almajano, M. 2014. Antioxidant properties of aqueous and ethanolic extracts of C. spinosa (Caesalpinia spinosa) pods in vitro and in model food emulsions. Journal of the Science of Food and Agriculture 94(5): 911-918. [ Links ]
Stehr, F. 1987. Techniques for collecting, rearing, preserving, and studying immature insects: 7-18. In F.W. Stehr (ed.), Inmature insects, v. 1. Dubuque, Kendall/Hunt.: 754p. [ Links ]
Tóth, P.; Lukáš, J. 2005. Parasitic Ichneumonoidea on the horse chestnut leaf miner, Cameraria ohridella (Lepidoptera: Gracillariidae) in Slovakia. Journal of Pest Science 78(3): 151-154.
Urueña, C.; Mancipe, J.; Hernandez, J.; Castañeda, D.; Pombo, L.; Gomez, A.; Asea, A.; Fiorentino, S. 2013. Gallotannin-rich Caesalpinia spinosa fraction decreases the primary tumor and factors associated with poor prognosis in a murine breast cancer model. BMC Complementary and Alternative Medicine. 13 (74): 1. [ Links ]
Walker, A.; Huddleston, T. 1987. Chelonus chailini sp. (Hymenoptera: Braconidae) from Malaysia, parasitizing gracillariid moths (Lepidoptera). Bulletin of entomological Research 77(03): 437-440. [ Links ]
Yousuf, M.; Ray, P. 2009. Record of Chelonus panzer (Braconidae: Cheloninae) from central India. Journal of Biopesticides 2(2): 145-149. [ Links ]
* Corresponding author
E-mail: leohmurga@gmail.com
Received October 16, 2015.
Accepted Jun 29, 2016.