Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Scientia Agropecuaria
versión impresa ISSN 2077-9917
Scientia Agropecuaria vol.7 no.3 Trujillo jul./set. 2016
http://dx.doi.org/10.17268/sci.agropecu.2016.03.20
ARTÍCULOS ORIGINALES
Respuesta de Phaseolus vulgaris a microorganismos promotores de crecimiento vegetal
Phaseolus vulgaris response to plant growth promoting microorganisms
Violeta Edith Romero-García1; Vanessa Ruby García-Ortiz1; Jaime Jesús Hernández-Escareño2; Juan Manuel Sánchez-Yáñez1,*
1 Laboratorio de Microbiología Ambiental, Instituto de Investigaciones Químico Biológicas, Ed-B3 C.U. Universidad Michoacana de San Nicolás de Hidalgo, Francisco J. Mujica S/N, Col. Felicitas del Rio C.P. 58000, Morelia, Mich., México.
2 Microbiología y Micología Veterinaria. Facultad de Medicina Veterinaria y Zootecnia, Universidad Autónoma de Nuevo León, Escobedo, N L. México.
Resumen
El objetivo de esta investigación fue analizar la respuesta de P. vulgaris a la inoculación individual y consorcio de MPCV a dosis reducida al 50% del FN. Para ello se inoculó P. vulgaris individualmente con: B. cereus, R. etli y T. harzianum y en consorcio de MPCV en jarras de Leonard tratada con NH4NO3 al 50 %, bajo un diseño experimental de bloques al azar; con variables respuestas: porcentaje y días a germinación, altura de planta y longitud radical, peso fresco/seco aéreo y radical (PFA/PSA/PFR/PSR) a plántula y floración; los datos experimentales se analizaron por Tukey, p ≤ 0,05. Los resultados mostraron que P. vulgaris inoculado con R. etli y T. harzianum tuvo un 100 % y 95,8% de germinación o emergencia en 4,8 y 4,5 días, respectivamente, valores con diferencia estadística en comparación con el 91,7% en 7,17 días en P. vulgaris sin inocular con el 100% de FN o testigo fertilizado (TF). En la etapa de plántula de P. vulgaris con T. harzianum y R. etli fue de 1,12 g y 0,72 g PSA, así como de 0,31 g y 0,21 de PSR, respectivamente, superior a P. vulgaris (TF) de 0,52 g de PSA y 0,19 g de PSR. Lo anterior apoya el potencial de R. etli y T. harzianum para la producción de P. vulgaris a dosis reducida de FN, comparado con el efecto positivo individual de B. cereus y en consorcio en la misma leguminosa.
Palabras clave: P. vulgaris, consorcio microbiano, optimización, fertilizante nitrogendo.
Abstract
The aim of this study was to analyze the response of P. vulgaris to single inoculation or to PGPM of dose reduced to 50% of NF. In that sense seeds of P. vulgaris were inoculated individually with B. cereus, R. etli or T. harzianum and as a PGPM consortium in a hydroponic system Leonard jars, fed with NH4NO3 (ammonium nitrate) 50%, reduced dose. Under an experimental randomized block design; response variables measured were: percentage and days to germination, plant height and root length, weight fresh/ dry air and root weight (AFW/ADW/RFW/RDW) to seedling and flowering, experimental data were validated by Tukey, p ≤ 0.05. Results showed that P. vulgaris inoculated with R. etli and T. harzianum had 100% and 95.8% germination in 4.8 and 4.5 days respectively and statistically different compared to 91.7% in 7.17 days of P. vulgaris not inoculated at 100% NF had as a Fertilizer Control (FC). At seedling stage of P. vulgaris with T. harzianum and R. etli had 1.12 g and 0.72 g of ADW and of 0.31 and 0.21 g RDW; while P. vulgaris response used as FC with 0.52 g and ADW and 0.19 g of RDW. This supports the positive potential of R. etli and T. harzianum for producing P. vulgaris reduced dose of NF, as well the positive effect of B cereus and microbial consortium in the legume.
Keywords: P. vulgaris, microbial consortium, optimize, nitrogen fertilizer.
1. Introducción
La leguminosa Phaseolus vulgaris L responde favorablemente a la aplicación de fertilizante nitrogenado (FN) como NH4NO3 (nitrato de amonio); sin embargo, cuando este se aplica en exceso causa la degradación del suelo y disminución de su fertilidad (Armenta et al., 2010). Una alternativa de solución para el problema de hiperfertilización en la producción de P. vulgaris, es la inoculación de sus semillas con Trichoderma harzianum individual y en consorcio con microbios promotores del crecimiento vegetal (MPCV) como Bacillus cereus y Rhizobium etli (CubillosHinojosa et al., 2009 Serna-Cock, et al., 2011) que aceleran su germinación y permiten la reducción y optimización del FN con lo que conserva la fertilidad del suelo. Los microorganismos promotores de crecimiento vegetal (MPCV) de forma individual o en consorcio inoculados a la semilla de P. vulgaris inducen su germinación, colonizan su raíz y transforman los exudados radicales en sustancias promotoras del crecimiento vegetal (SPCV); con lo que estimula una mayor proliferación de pelos radicales que aumentan la absorción de NH4NO3 a pesar de disminuir la dosis de este FN hasta un 50% (García-González et al., 2005; Armenta-Bojorquez et al., 2010). Una novedad para facilitar la disminución de la dosis del FN sin afectar su sano crecimiento es el empleo de MPCV como T. harzianum que normalmente es útil en el control de enfermedades de raíz causadas por fitopatógenos (Altomare et al., 1999); sin embargo, también Moreno-Sarmiento et al., 2007 señalaron su capacidad de promover el crecimiento vegetal. En tanto que también se ha referido al género Rhizobium spp, así como algunas especies de Bacillus spp, que tienen la capacidad de sintetizar SPCV, para facilitar una producción sustentable de P. vulgaris; tal es el caso también del efecto benéfico de B. cereus en Triticum. aestivum a dosis regulada de FN (García-Gónzalez et al., 2005). Con base a lo anterior se ha realizado extensiva investigación sobre la inoculación de MPCV de forma individual o en consorcio, dado que se sabe que sus miembros trabajan sinérgicamente, para facilitar y optimizar la absorción de nutrientes minerales como el FN en el sistema radical de plantas domesticas; mediante acciones como la solubilización de PO4 (fosfatos) o la síntesis de SPCV a partir de exudados de raíz. Por lo que el objetivo de este trabajo fue: analizar la respuesta de P. vulgaris a la inoculación individual con B. cereus R etli y T. harzianum y/o en consorcio a dosis reducida del FN al 50%.
2. Materiales y métodos
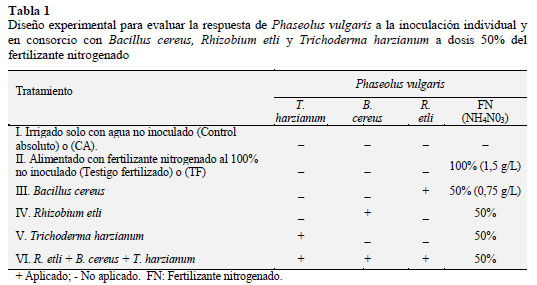
En la Tabla 1 se muestran los tratamientos en P. vulgaris sembrado en el sistema hidropónico de jarra de Leonard, sobre la base de un diseño de bloques al azar con 6 tratamientos y 6 repeticiones (GarcíaGonzález et al., 2005); con las variables respuesta: porciento y días a germinación o emergencia; incluso la fenología: altura de la planta (AP) y longitud radical (LR); y su biomasa: peso fresco/seco aéreo y radical a nivel de plántula y floración.
2.1 Solarización del suelo
El suelo se solarizó para reducir plagas y enfermedades; posteriormente se tamizó con una malla del No. 20. Este suelo se clasificó como lateritico; de textura franco arenosa, pobre en materia orgánica de 1,5% y N orgánico de 39 Kg·ha-1 y un pH 6,7 ligeramente ácido (Sánchez-Yáñez, 2007).
2.2 Origen de Bacillus cereus, Rhizobium etli y Trichoderma harzianum
Los géneros y especies de B. cereus 1 y R. etli 2, se tomaron de la colección de bacterias promotoras de crecimiento vegetal ambas aisladas de raíces Medicago sativa (cepas 1 y 2 respectivamente) del Laboratorio de Microbiología Ambiental, mientras que se usó de un producto comercial denominado TRICHO-HIPERMR en polvo a 5x109 esporas / g de T. harzianum para tratar el suelo de cultivo de P. vulgaris.
2.3 Activación del consorcio de microbios promotores de crecimiento vegetal e inoculación de Trichoderma harzianum en suelo
La cepa 1 B. cereus se activó en caldo nutritivo (CN) con la siguiente composición (g/L): peptona de caseína 5, extracto de levadura 3, agua destilada a pH 6,8 ± 0,2; con el anti fúngico Tecto 60MR (Syngenta) 2% (p/v). Para cepa 2 R. etli en caldo extracto de levadura manitol y Rojo Congo (CELMRC) (g/L): Manitol 10,0 g; K2HPO2 2,0; MgSO4 0,2; solución de Rojo Congo 1:400 10 ml; NaCl 0,1; extracto de levadura 10,0; solución de oligoelementos; agua destilada a pH 6,7; con anti fúngico Tecto 60 MR (Syngenta) 2% (p/v) 1,0 mL/L, ambas cepas 1 y 2 se incubaron por 30 ºC / size="2">24 48 h (Sánchez-Yañez, 2007). El inóculo de T. harzianum en agua (g/L): T. harzianum, agua destilada a pH 6,8 ± 0,2. T. harzianum se aplicó de forma directa sobre el suelo, 0,5 mL/kg de suelo previamente hidratado 24 h antes de la siembra de la semilla de P. vulgaris.
2.4 Inoculación de la semilla de Phaseolus vulgaris con Bacillus cereus y Rhizobium etli
Para ello las semillas de P. vulgaris se desinfectaron con hipoclorito de sodio (Clorox ®) 5% (p/v)/5 min, se enjuagaron 5 veces con agua potable estéril, se sumergieron en alcohol 70% / 5 min, se enjuagaron 5 veces con agua potable estéril; entonces 30 semillas se depositaron en una bolsa de plástico de 250 g, ahí las 10 semillas se inocularon con 1,0 mL de cultivo con los MPCV de forma individual o en consorcio de acuerdo al cuadro 1 (Sánchez-Yáñez, 2007); por cada tratamiento se emplearon 6 repeticiones.
2.5 Preparación del sistema hidropónico de jarras de Leonard y siembra e inoculación de Phaseolus vulgaris con Trichoderma harzianum y el consorcio microbiano
El experimento se realizó en invernadero del Laboratorio de Microbiología Ambiental del IIQB-UMSNH en jarras de Leonard que consiste en un sistema semihidropónico) para evaluar la respuesta de P. vulgaris a la inoculación individual con B. cereus, R etli y T. harzianum y consorcio con los MPCV. En la base de la jarra se colocó 250 mL de solución con NH4NO3 preparado a partir de fertilizante comercial ULTRASOL® en concentración de 1,5 y 0,75 g/L a pH 6,8 7,0 mientras que en la parte inferior de la jarra se unió con algodón que permitió el paso de la solución desde la base hasta la parte superior que contiene aproximadamente 1 kg de suelo. El suelo de cada jarra se hidrató con agua potable antes de sembrar 4 semillas de P. vulgaris, luego las jarras se llevaron al solárium donde permanecieron en oscuridad hasta su germinación o emergencia, con las primeras dos hojas verdaderas de P. vulgaris se trasladaron al invernadero para completar su ciclo vegetativo (GarcÃa-González et al., 2005).
2.6 Variables usadas para la respuesta de Phaseolus vulgaris a la inoculación individual y en consorcio con Bacillus cereus, Rhizobium etli y Trichoderma harzianum
Se consideró el porciento (%) de germinación o emergencia de las semillas de P. vulgaris a los 8 días después de la siembra, luego se realizó el raleo de plantas jovenes, que consistió en dejar 2 por jarra de Leonard. El primer muestreo de plantúla fue hecho a 20 días después de la siembra; mientras que el de floración a los 54 días posteriores. En P. vulgaris se midió la fenología aérea y radical; la altura de la planta (AP) y longitud radical (LR). Además de la biomasa; el peso fresco aéreo (PFA) y radical (PFR), se determinó el peso seco aéreo (PSA), y el radical (PSR) ambas se deshidrataron en horno por 48 / 70 °C según Sánchez-Yáñez (2007). Los datos experimentales se analizaron por ANOVA y comparativa de Tukey HSD, p < 0,05% (Walpole et al., 2007).
3. Resultados y discusión
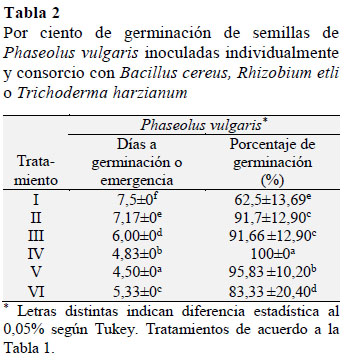
En la Tabla 2 se muestra la germinación de las semillas de P. vulgaris inoculadas individualmente con B. cereus, R. etli y T. harzianum y donde se observó un 91%, 100% y 95% de germinación en 6, 4,83 y 4,5 días, respectivamente. Estos valores fueron estadísticamente diferentes en comparación con el por ciento de germinación o emergencia en P. vulgaris (TF) con 91,7% en 7,17 dÃas. Los valores del por ciento de germinación en las semillas inoculadas sugieren que B. cereus, R. elti, y T. harzianum al sintetizar SPCV y degradar la capa que recubre el endos-permo de la semilla de P. vulgaris aceleraron su emergencia (Cupull et al., 2000).
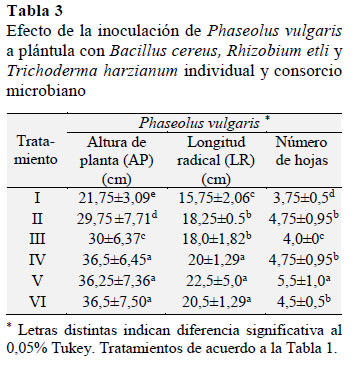
En la Tabla 3 se muestra la respuesta positiva de P. vulgaris a la inoculación con T. harzianum a nivel de plántula donde el hongo indujo una AP de 36,25 cm con 5,5 hojas y 22 cm de LR, en tanto que en P. vulgaris inoculado sólo con R. etli, registró una AP de 36,5 cm con 4,75 hojas y 20 cm; ambos valores a dosis reducida de FN o NH4NO3 al 50%. Estos valores tuvieron diferencia estadística en comparación a lo observado en P. vulgaris (TF) tratado con el FN al 100%; en el que valores registrados en la AP de fue de 29,75 cm, con 4,75 hojas. Lo anterior sugiere que tanto R. etli como T. harzianum mediante SPCV favorecieron una respuesta positiva de P. vulgaris (Sutton y Peng, 1993).
Esto mejoró la capacidad de absorción radical de la leguminosa para optimizar la dosis del FN al 50% (Altomare et al., 1999). Mientras que en lo referente a la LR no se observó diferencia estadística entre la inoculación de los MPCV, de manera individual o en consorcio, en comparación con las mismas variables en el P. vulgaris (TF). Lo que indica que algunas de las SPCV producidas en la raíz por los MPCV individualmente o en consorcio ejercen un efecto positivo independientemente de que provengan de un hongo o bacteria y que algunas funcionan sinérgicamente; como fue el caso del consorcio microbiano, excepto cuando la misma leguminosa sin aplicar la dosis del FN o inocular con MPCV (Börkman et al., 1998; ArmentaBojorquez et al., 2010).
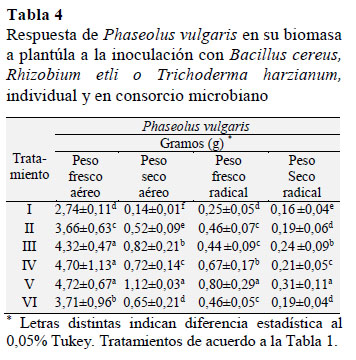
En la Tabla 4 se muestra la respuesta positiva de P. vulgaris a la inoculación con T. harzianum en función de la biomasa; con 4,72 g de PFA 1,12 g de PSA y 0,80 g de PFR con 0,31 g de PSR, en tanto que R. etli mostró un PFA de 4,70 g con 0,72 g de PSA y un PFR de 0,67 g, con 0,21 g de PSR a dosis de NH4NO3 al 50%, el valor de 0,21 g de PFR fue superior en comparación con P. vulgaris al 100% del FN; con un PFA de 3,66 y 0,52 de PSA en tanto que el PFR fue 0,46 g y de 0,19 g de PSR.
El efecto de B. cereus, R. etli y T. harzianum en P. vulgaris fue análoga a lo señalado Börkman et al. (1998) cuando Z. mays se inoculó con este hongo el cual estimulo positivamente su crecimiento, y se reflejó en su fenología y biomasa en comparación con el Z. mays (TF) tratado con el FN al 100%: con valores en estas variables respuesta estadísticamente diferentes, e inferiores a las que causaron B. cereus, R. etli y T. harzianum, individualmente e incluso en consorcio (Zapata et al., 2012; Neyra et al., 2013).
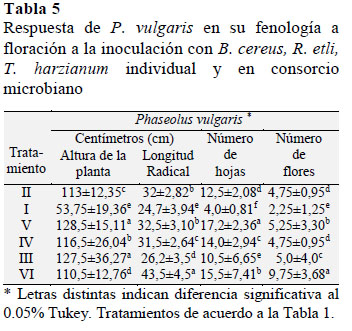
En Tabla 5 se muestra la respuesta positiva de P. vulgaris inoculado con B. cereus T. harzianum en su fenología a nivel de floración con AP de 127,5 cm y 128,5 cm, de 10,5 cm y 17,2 hojas y 5,0 y 5,25 flores, estos valores fueron superiores en comparación con los análogos de P. vulgaris inoculado con el consorcio microbiano con 110,5 cm de AP 15,5 hojas y 9,75 flores, en tanto que para la LR fue de 43,5 cm fue un valor estadísticamente diferente a los 31,5 cm de P. vulgaris inoculado sólo con T. harzianum,, estos valores fueron estadísticamente distintos en comparación con las misma variables en P. vulgaris (TF) con una AP de 113 cm, 12,5 hojas con 4,75 flores y 32 cm de LR a la dosis del 100% de FN.
Lo anterior indica que el efecto promotor de crecimiento vegetal de T. harzianum en P. vulgaris coincide con lo reportado por Cupull et al. (2000) que usaron T. harzianum a en Solanum lycopersicum observaron un incremento en su altura, en el diámetro del tallo, y en el número de hojas, debido a que tanto B. cereus como T. harzianum tienen en común la capacidad para convertir exudados de raíz en SPCV y explica porque es posible emplearlas como MPCV (CubillosHinojosa et al., 2009: Caicedo et al., 2010; Camelo et al., 2011 Zapata et al., 2012).
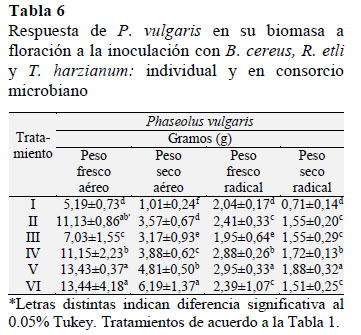
En Tabla 6 se muestra la respuesta positiva de P. vulgaris a la inoculación individual con T. harzianum y en consorcio con B. cereus y R. etli en función de su biomasa; con un PFA de 13,43 g, 4,81 g de PSA; con un PFR de 2,95 g y 1,88 g de PSR a dosis reducida de NH4NO3 al 50%; P. vulgaris tuvo una respuesta positiva de R. etli en su PFR con 2,88 g y 1,72 g de PSR, a dosis de 50% de NH4NO3, los valores de la biomasa superaron las mismas variables respuesta en P. vulgaris (TF), con 11,13 g con de PFA, 3,57 g de PSA y 2,4 g de PFR y con 1,55 de PSR. Lo anterior sugiere que T. harzianum mediante la síntesis de SPCV indujo la proliferación de raíces laterales y aumento de la absorción de minerales P. vulgaris a pesar de reducir el FN al 50% (Mohammed, 2004; Caicedo., et al. 2010; Prakash et al., 2013).
La respuesta positiva de P. vulgaris inoculado con R. etli en su raÃz, apoya la transformación de exudados en SPCV lo cual estimuló la proliferación de raÃces secundarias (Hernández et al., 2004; GarcÃa-González et al., 2005; Criollo, et al., 2012), las que aumentaron la capacidad de absorción del sistema de raÃces para evitar que la reducción del 50% FN pudiese causar un problema nutricional en la planta, esta acción fue más evidente cuando tanto R. etli como T. harzianum se aplicaron como consorcio microbiano lo que además es una forma de prevenir enfermedades de la raÃz por bacterias y hongos fitopatógenos (Börkman et al., 1998; Bécquer et al., 2011).
4. Conclusiones
Por lo anterior se concluye que R. elti como T. harzianum tienen afinidad por los exudados de semillas y raíces de P. vulgaris para transformarlos en sustancias promotoras del crecimiento vegetal, lo anterior explica su efecto positivo en la fenología y biomasa de esta leguminosa: tanto de manera individual como en consorcio, lo cual puede considerarse como una ventaja para evitar el uso de fungicidas químicos, al mismo tiempo que se permite regular y optimizar la dosis 50% del FN en P. vulgaris.
Agradecimientos
Al proyecto 2.7 (2016) de la Coordinación de Investigación Científica de la UMSNH, Morelia Michoacán, México.
Referencias bibliográficas
Armenta-Bojorquez, A.; García-Gutiérrez, C.; CamachoBáez, R.; Apodaca-Sánchez, M.; Montoya, L.; Nava-Pérez, E. 2010. Biofertilizantes en el desarrollo agrícola de México. Ra Ximbai 6: 51-56. [ Links ]
Altomare, C.; Norvell, W.A.; Björkman, T.; Harman, G.E. 1999. Solubilization of phosphates and micronutrients by the plant-growth-promoting and biocontrol fungus Trichoderma harzianum Rifai 1295-22. Applied and environmental microbiology 65: 2926-2933. [ Links ]
Börkman, T.; Blanchard, L.; Harman, G. 1998. Growth enhancement of shrunken-sweet corn by Trichoderma harzianum: effect of environmental stress. J. Amer. Soc. Hort. Sci. 23: 295-322. [ Links ]
Bécquer, C.; Salas, Á.; Palmero, L.; Nápoles, J. 2011. Efecto de la inoculación con rizobios procedentes de Alberta, Canadá, en sorgo (Sorghum bicolor L. Moench), en condiciones de campo. Pastos y forrajes 34: 303-311. [ Links ]
Caicedo, J.; Orellana, H.; Arahana, V. 2010. Influencia de microorganismos promotores de crecimiento y fijadores de nutrientes, en la producción de frijol (Phaseolus vulgaris L.). Tumbaco, Pichincha. Rumipamba 14:141-149. [ Links ]
Camelo, R.; Vera, S.; Bonilla, R. 2011. Mecanismos de acción de las rizobacterias promotoras del crecimiento vegetal. Ciencia y tecnología agropecuaria 12: 159166. [ Links ]
Criollo, P.; Obando, M.; Sánchez, M.; Bonill, R. 2012. Efecto de bacterias promotoras de crecimiento vegetal (PGPR) asociadas a Pennisetum clandestinum en el altiplano cundiboyacense. Ciencia y Tecnología Agropecuaria 13: 189-195. [ Links ]
Cubillos-Hinojosa, J.; Valero, N.; Mejía, L. 2009. Trichoderma harzianum como promotor del crecimiento vegetal del maracuyá (Passiflora edulis var. flavicarpa Degener). Agronomía Colombiana 27: 81-86. [ Links ]
Cupull, S.R.; Sánchez, C.C.; Andreu, C.; Cupull, M.D.C.; Pérez, N.C. 2000. Efecto de Trichoderma y Azotobacter en el control de Rhizoctonia solani y la estimulación del crecimiento de posturas de cafetos. Centro agrícola 1: 21-25. [ Links ]
García-González, M.M.; Farías-Rodríguez, R.; PeñaCabriales, J.J.; Sánchez-Yáñez, J.M. 2005. Inoculación del trigo var. Pavón con Azospirillum spp y Azotobacter beijerinckii. Terra Latinoamericana 23: 65-72. [ Links ]
Hernández, A.; Rives, N.; Caballero, A.; Hernández, A.; Heydrich, M. 2004. Caracterización de rizobacterias asociadas al cultivo de maíz en la producción de metabolitos del tipo AIA, sideroforos y ácido salicílico. Revista Colombiana de biotecnología 6: 613. [ Links ]
Moreno-Sarmiento, N.; Moreno-Rodríguez, L.; UribeVélez, D. 2007. Biofertilizantespara la agricultura en Colombia. pp. 38-45. En: Izaguirre-Mayoral, M.L.; C. Labandera; J. Sanjuán (eds.). Biofertilizantes en Iberoamérica: una visión técnica, científica y empresarial. Imprenta Denad Internacional, Montevideo Colombia. [ Links ]
Mohammed E. 2004. Trichoderma harzianum como biofungicida para el biocontrol de Phytophthora capsici en plantas de pimiento (Capsicum annuum L.). Anales de biología 26: 35-45. [ Links ]
Prakash, J.; Yadav, J.; Nath, K.; Kumar, A. 2013. Effect of indigenous Mesorhizobium spp and plant growth promoting rhizobacteria on yields and nutrients uptake of chickpea (Cicer arietinum L.) under sustainable agriculture. Ecological Engineering 51: 282–286. [ Links ]
Serna-Cock, L.; Arias-García, C.; Valencia-Hernández, L. 2011. Biofertilización, una alternativa al uso de fertilizantes químicos en caña de azúcar (Saccharum officinarum). Alimentos Hoy 20: 69-82. [ Links ]
Sánchez-Yáñez, J.M. 2007. Breve Tratado de Microbiología Agrícola, teoría y práctica, Ed. Instituto de Investigaciones Químico Biológicas. Universidad Michoacana de San Nicolás de Hidalgo. COSUSTENTA, SA de CV, CIDEM, SEDAGRO. Morelia, Michoacán, México. [ Links ]
Neyra, S.; Terrones, R.; Toro, C.; Zárate, G.; Soriano, B. 2013. Efecto de la inoculación de Rhizobium etli y Trichoderma viride sobre el crecimiento aéreo y radicular de Capsicum annum var. longum. REBIOLEST 1:11-71. [ Links ]
Walpole, R.; Myers, R.; Myers, S.; Keying, Y. 2007. Probabilidad y Estadística para Ingeniería y Ciencia. Editorial Pearson. México. [ Links ]
Zapata, R.; Quiroga, M.; Murillo, B.; Agüero, D.; Lisi. B.; Mena, P. 2012. Trichoderma spp biocontrolador y promotor de crecimiento: una alternativa al uso de agroquímicos en cultivos intensivos. Avances en energías renovables y medio ambiente 16: 47-55. [ Links ]
* Corresponding author
E-mail: syanez@umich.mx (J.M. Sánchez-Yáñez).
Received November 04, 2015.
Accepted July 31, 2016.