Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Scientia Agropecuaria
versão impressa ISSN 2077-9917
Scientia Agropecuaria vol.7 no.spe Trujillo out. 2016
http://dx.doi.org/10.17268/sci.agropecu.2016.03.02
ARTÍCULOS ORIGINALES
Eficiencia en la nodulación por rizobios nativos, procedentes de nódulos de Pisum sativum "arveja" colectados de diferentes Departamentos del Perú
Nodulation efficiency by native rhizobia from nodules of Pisum sativum "pea" collected from different Departments of Peru
Zoila E. Moreno-Chirinos1; Renzo A. Valdez-Núñez2; Bertha S. Soriano-Bernilla1,*; Nelson A. Ruesta-Campoverde3
1 Laboratorio de Microbiología Ambiental. Dpto. de Microbiología y Parasitología. Facultad de Ciencias Biológicas. Universidad Nacional de Trujillo.
2 Universidad Nacional de San Martín, Tarapoto.
3 Coordinador Subproyecto Desarrollo de Capacidades para el uso de la Fijación Biológica del Nitrógeno. Instituto Nacional de Investigación Agraria – Estación Experimental Vista Florida, Chiclayo.
Resumen
En la presente investigación se logró autenticar la capacidad nodulativa y evaluar la frecuencia de la eficiencia en la nodulación de 50 cultivos aislados de nódulos radiculares de arveja, colectados de los Departamentos: La Libertad, Lambayeque, Cajamarca y Lima. Para lo cual se inoculó 1mL de suspensión del cultivo aislado (1,2x109 cel / mL) en plántulas de Pisum sativum var. Selección Junín, manteniéndolas bajo condiciones de humedad relativa, 50–70% y temperatura/fotoperiodo, 28 °C - 24 °C / 14 h – 10 h (luz-oscuridad). A los 25 días post-inoculación se obtuvo que el 40% nodularon a la planta huésped. Para determinar la frecuencia en la eficiencia de nodulación, se tuvo en cuenta los parámetros de velocidad de nodulación (DN en mm) y el porcentaje de raíces noduladas (PRN%); el análisis Correlacional de Pearson al 5% de significancia, el MANOVA y el estadístico DHS de Tukey, permitieron establecer los rangos (alta, intermedia y baja) para DN y PRN% por cada cultivo, resultando que solo el 10% de los cultivos evaluados (Ra 218-01 y Ra 212-01) presentaron alta eficiencia en la nodulación, ya que obtuvieron alta DN y alto PRN%.
Palabras clave: Rhizobium, Pisum sativum, autenticación, eficiencia en la nodulación.
Abstract
In the present investigation was able to authenticate the ability to nodulate and to evaluate the frequency of nodulation efficiency of 50 isolate strains of pea nodules, collected from the departments: La Libertad, Lambayeque, Cajamarca and Lima. Which was inoculated to 1 mL of culture suspension alone (1.2x109 cel /mL) in seedlings of Pisum sativum var. Selection Junín, keeping them under conditions of relative humidity,50-70% and temperature / photoperiod, 28 °C – 24 °C / 14 h – 10 h (light-dark). At 25 days post-inoculation was obtained that 40% nodulated the host plant. To determine the frequency of nodulation efficiency, we took into account the parameters of speed of nodulation (DN in mm) and the percentage of roots nodulated (PRN%); pearson correlational analysis of the 5% significance, MANOVA and Tukey statistical DHS, allowed to establish the ranges (high, medium and low) for DN and PRN% for each crop, resulting in only 10% of all crops (Ra Ra 218-01 and 212-01) showed high efficiency in nodulation, as DN were high and high PRN%.
Keywords: Rhizobium, Pisum sativum, authentication, nodulation efficiency.
1. Introducción
Las leguminosas o "menestras" como se les conoce en el Perú, constituyen un conjunto de diez especies que cubren 173 mil ha, de las que se obtiene aproximadamente 184 mil t de grano seco y 25 mil t de grano verde. Phaseolus vulgaris "frijol común", Vicia faba "haba", Pisum sativum "arveja", Vigna unguiculata "caupí", Cajanus cajan "frijol de palo" y Phaseolus lunatus "pallar", son las especies de mayor importancia (Valladolid y Voysest, 2006). Agronómicamente, las leguminosas for- man parte de diversos sistemas de produc- ción cumpliendo una función mejoradora del suelo, dada su capacidad de fijar nitrógeno atmosférico a través de la simbiosis con bacterias de la familia Rhizobiaceae (Valladolid y Voysest, 2006). La relación entre los rizobios y sus plantas huéspedes es mutualista; se requiere de la integración de las vías metabólicas de la fijación (bacteroides) y de la asimilación (planta hospedera) del nitrógeno (Marcano et al., 2001).
Sin embargo, no todos los rizobios pueden formar nódulos y/o fijar nitrógeno con todas las leguminosas; por ejemplo, Rhizobium leguminosarum biovar trifoli solo fija nitrógeno en especies de Trifolium (trébol) o Sinorhizobium meliloti que es la bacteria específica para alfalfa (Pueppke y Broughton, 1999), esto permite diferenciar a los rizobios por su infectividad o capacidad de nodulación. Además, también existen algunas excepciones, entre especies de Rhizobium y especies de leguminosas, como es el caso de Rhizobium leguminusarum, que nodula tanto en lenteja, como en arveja y vicia (Abad, 2008).
Entonces es necesario contar con cepas efectivas y competitivas en la fijación biológica de nitrógeno, seleccionadas de una amplia variedad de aislamientos obtenidos de diferentes lugares (Thies et al, 1992); pero para ello, tendrán que pasar por diferentes fases de selección como la autenticación (habilidad de un cultivo rizobiano para hacer simbiosis con su respectiva planta huésped) y eficiencia simbiótica (capacidad de los rizobios de fijar simbióticamente de manera óptima el nitrógeno atmosférico) (Somasegaran y Hoben, 1994).
A nivel nacional los principales problemas que afectan la competitividad de las cadenas productivas, están relacionadas con la escasez de tecnologías eficientes de producción y de variedades altamente productivas, con tipos de grano requerido por el mercado para reducir costos de producción y lograr productos de mejor calidad. Por lo tanto, con el propósito de promover el desarrollo de la agricultura sostenible adoptando alternativas que estén al alcance de todos los agricultores, que mantengan y recuperen la capacidad productiva de la tierra y por ende que cuiden el ambiente es conveniente utilizar al máximo los mecanismos de la fertilización biológica promovida por la asociación simbiótica Rhizobium – leguminosa.
Es así que la presente investigación pretende iniciarse en la selección de cepas de rizobios nativos; teniendo como objetivos: autenticar la capacidad nodulativa y evaluar la frecuencia de la eficiencia en la nodulación de cultivos aislados de nódulos de arveja, colectados de los Departamentos de La Libertad, Lambayeque, Cajamarca y Lima, en simbiosis con Pisum sativum var Selección Junín.
2. Materiales y métodos
2.1 Material biológico
50 cultivos de rizobios nativos procedentes de nódulos de Pisum sativum "arveja", colectados en los Departamentos de La Libertad, Lambayeque, Cajamarca y Lima – Perú. Semillas certificadas de "arveja" var. Selección Junín, proporcionadas por la Estación Experimental INIA - Vista Florida. Chiclayo.
2.2 Procedimientos
Caracterización fenotípica de los cultivos nativos
Para la caracterización de los cultivos se siguió las metodologías sugeridas por Somasegaran y Hoben (1994); Fernández et al. (2003); Pinto et al. (2007) y Zúñiga (2012).
Caracterización por velocidad de crecimiento
Se registró el número de días en que una colonia alcanzó 1 mm de diámetro en condiciones óptimas de crecimiento (Temperatura: 28 °C, pH: 6,8) (Fernández, 2003).
Caracterización morfológica
Se realizó en Agar ELMAR (Agar Extracto de Levadura Manitol Rojo de Congo al 0,025%) (Pinto et al., 2007)
Caracterización Bioquímica
Los cultivos fueron sometidos a dos pruebas: Crecimiento en agar Peptona- Glucosa-Púrpura de Bromocresol (PG- PBC, 100 µg PBC / L) (Somasegaran y Hoben, 1994; Zúñiga, 2012) y la producción de 3-cetolactosa en el medio Extracto de Levadura Lactosa (LLA) (Zúñiga, 2012).
Caracterización Fisiológica
Para observar la producción de álcali o acidez en medio extracto de levadura- manitol, conteniendo Azul de Bromotimol (ELMA-ABT, ABT al 0,00125 %) (Somasegaran y Hoben, 1994; Zúñiga, 2012).
Autenticación de cultivos nativos
La autenticación tiene por finalidad confirmar la capacidad nodulativa de los cultivos nativos sobre la leguminosa de la que fueron aislados; para esto se utilizó la metodología sugerida por Somasegaran y Hoben (1994) y CIAT (1988).
Preparación de bolsas de crecimiento (CIAT, 1988)
Se utilizó paños de papel toalla con un doblez en la parte superior dentro de bolsas de polipropileno de primer uso (26 cm x 18 cm). Las bolsas fueron cargadas con 49 mL de solución nutritiva de Jensen modificada libre de nitrógeno y selladas al calor. Finalmente las bolsas fueron autoclavadas durante 15 minutos a 121 ºC.
Selección, desinfección y germinación de semillas
Cada lote de semilla, fue seleccionada por su tamaño, calidad y porcentaje de germinación (no menor del 85%). La desinfección, se realizó por traspaso sucesivo en etanol al 70 % durante 1 minuto e hipoclorito de sodio al 5 % por 3 minutos, enjuagando 6 veces con agua destilada estéril (ADE). Las semillas fueron colocadas a germinar sobre papel toalla humedecido dentro de tapers plásticos estériles en condiciones de oscuridad a 28 °C durante 48 horas. Siembra de semilla en bolsas de crecimiento Las semillas que presentaron radículas 1,5 cm, fueron sembradas en las bolsas de crecimiento (1 semilla/bolsa) dentro de una cámara de esterilidad.
Preparación y estandarización del inóculo
Se realizó la propagación de cada cultivo en Agar ELMA incubándose a 28 °C durante 3 días. Se realizó una suspensión bacteriana utilizando buffer fosfato pH 7,4. El inóculo se estandarizó con el tubo N° 4 del Nefelómetro de Mac Farland (1,2 x 109 cel / mL). El conteo total de la población a inocular se verificó mediante el método Miles/Misra o método de la gota.
Inoculación de semillas
Las plántulas más saludables y de tamaño uniforme fueron inoculadas con 1mL de la suspensión bacteriana estandarizada por cada bolsa, obteniendo así una concentración final de 2,4x107 cel / mL, similar al número de rizobios presentes en suelos agrícolas. Luego de la inoculación, se procedió a elegir 10 raíces secundarias, las cuales fueron marcadas (MR) sobre la bolsa de crecimiento. Cada bolsa se cubrió con una funda de color negro y fueron llevadas a la cámara de crecimiento, bajo las siguientes condiciones: humedad relativa, 50–70% y temperatura/foto- periodo, 28 °C – 24 °C/14 h – 10 h (luz - oscuridad). Se realizaron 4 repeticiones por cada cultivo (4 plántulas/repetición, obte- niendo un total de 16 plántulas/cultivo).
Análisis de resultados
Los datos obtenidos fueron colectados y especificados según los efectos de los tratamientos dentro de los objetivos del experimento.
Lectura de la autenticación
La lectura de la autenticación se realizó a los 25 días post-inoculación, para la observación de los nódulos. Los cultivos inoculados fueron considerados auténticos (NOD +), cuando se observó la formación de los nódulos y aquellos que no formaron nódulos, no auténticos (NOD -). Para la evaluación de la autenticación se realizaron 4 repeticiones, además de un control blanco (sin inocular) y un control positivo (inoculado con una cepa caracterizada: Rhizobium leguminosarum bv. Viciae, proporcionada por el CIAT de Colombia). De los cultivos considerados como NOD- se realizó una repetición adicional para confirmar el resultado obtenido. La autenticación de los cultivos de rizobios se evaluaron mediante el porcentaje de cultivos NOD + y NOD –. Evaluación de la eficiencia de nodulación La eficiencia de la nodulación de los cultivos se determinó a los 25 días post- inoculación, para lo cual se utilizó la metodología sugerida por McDermott y Graham (1990) y Bernal et al. (2004), teniendo en cuenta los siguientes parámetros:
Velocidad de nodulación: Distancia del primer nódulo formado en relación a la marca (DN) Se procedió a registrar la distancia del primer nódulo formado (por encima o por debajo de la marca) con respecto a la marca (MR: marca realizada en el ápice radical al momento de la inoculación) de todos los sistemas nodulados, estos fueron promediados, asignando un valor positivo (+) a la distancia de los nódulos formados por encima de la marca y un valor negativo (-) a las distancias de los nódulos formados por debajo de la marca.
Porcentaje de raíces noduladas (PRN%) Se determinó el porcentaje de raíces noduladas (por encima o por debajo de la marca) tomando como 100% el total de raicillas marcadas (10 raicillas) al momento de la inoculación.
Determinación de la frecuencia de eficiencia de nodulación
Para determinar la frecuencia de eficiencia en nodulación, los datos de DN y PRN% fueron ploteados en una gráfica XY (Bernal et al., 2004), usando el software GraphPad Prism versión 5.0 (disponible en www.graphpad.com). Una vez construida la gráfica, se procedió a categorizar las cepas de la siguiente manera: Alto, Intermedio y Bajo, para las dos dimensiones, obteniendo 9 categorías para los diferentes cultivos evaluados (Bernal et al., 2004).
Análisis estadístico
Se realizó el análisis estadístico de los resultados, se utilizó el Análisis Correlacional de Pearson para cada uno de los parámetros evaluados (DN, PRN%, NNE, PPN%), además el análisis multivariante (MANOVA) para encontrar si existe diferencias significativas entre los parámetros DN, PRN%, NNE Y PPN%, y el estadístico DHS de Tukey para encontrar si existe diferencia significativa entre los cultivos con respecto a dichos parámetros; y también se calculó el error estándar (SE) para cada cultivo con respecto a los parámetros en estudio, todos los análisis fueron realizados con el software SPSS versión 15 y el GraphPad Prism versión 5.0.
3. Resultados y discusión
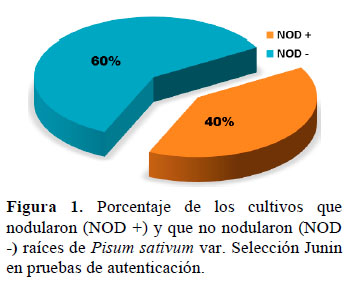
En relación a la autenticación de los 50 cultivos evaluados, el 40% (20 cultivos) formaron nódulos en simbiosis con Pisum sativum var. Selección Junín, por lo que se les consideró como NOD+; mientras que el 60% (30 cultivos) no formaron nódulos sobre el mismo huésped, considerándolos como NOD-; tal como se muestra en la Figura 1.
Sin embargo, el criterio fundamental para identificar a los rizobios es la autenti- cación: habilidad de los rizobios para hacer simbiosis con su respectiva planta huésped (Somasegaran y Hoben, 1994), teniendo como base los postulados de Koch (Norris, 1968). Este bioensayo de inoculación in vitro, bajo condiciones de laboratorio, permite verificar si realmente el aislamiento corresponde a un cultivo de rizobio y, además, si ésta es efectiva en la nodulación. Para esto se tuvieron en cuenta el grupo experimental (50 cultivos), el con- trol positivo (Rhizobium leguminosarum bv. viciae que forma nódulos en Pisum sativum (Young, 1996) y el blanco (sin inocular). De los 50 cultivos evaluados, se observó que el 40% (20 cultivos) formaron nódulos en simbiosis con Pisum sativum var. Selección Junín, por lo que se les consideró como NOD+; mientras que el 60% (30 cultivos) no fueron capaces de nodular en condiciones de laboratorio a la misma leguminosa, considerándolos como NOD- (Figura 1). Teniendo en cuenta que los cultivos NOD- fueron aislados de nódulos radiculares de arveja y además que los resultados obtenidos en la carac- terización fenotípica concuerdan con Rhizobium; no se les puede descartar, ni afirmar que no se trate de rizobios; ya que como se sabe los elementos genéticos bacterianos cuyos productos intervienen en la infección simbiótica pueden estar colocados en megaplásmidos (como en el género Rhizobium) o ser de localización genómica (como en los géneros Bradyrhizobium y Azorhizobium). Los plásmidos que contienen la información para la asociación se llaman plásmidos pSym y en ellos se encuentran los genes responsables de la nodulación (genes nod) y los de la fijación de nitrógeno (genes nif y fix) (Vanderleyden y Pieternel, 1995). Por lo tanto se podría decir que cabe la posibilidad de que estos cultivos mermaron su capacidad simbiótica y a la vez nodulativa debido a que perdieron su plásmidos simbióticos, por diversas razones: el método de conservación empleado (Bernal, 2004) o las sucesivas resiembras realizadas para poder obtener aislamientos de cultivos puros e inóculo.
No obstante Caldwell (1969) y Dazzo (1980) relacionaron la infectividad a algún grado de especificidad antigénica entre los rizobios y las paredes celulares de la raíz del huésped. Los cultivos analizados aquí fueron aislados de nódulos de Pisum sativum lo que sugiere que la especificidad podría darse también a nivel de la variedad de arveja.
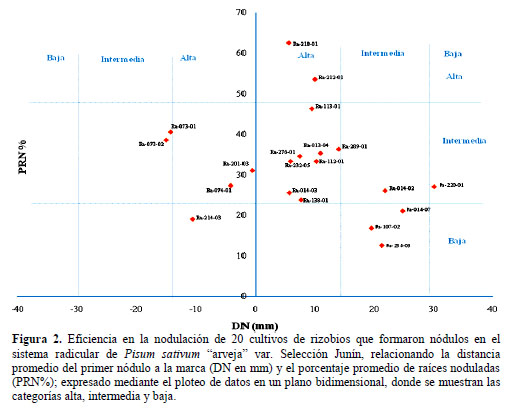
En cuanto a la eficiencia de la nodulación, para los 20 cultivos auténticos (NOD+), se obtuvieron los datos de la medición de la distancia del primer nódulo (DN) en relación a la marca realizada después de la inoculación y los de la cuantificación del porcentaje de raíces noduladas (PRN%); y se plotearon en un plano bidimensional XY, donde DN fue representado en el eje de las abscisas y PRN% en el eje de las ordenadas, tal como se muestra en la Figura 2.
El plano bidimensional muestra la ubicación de cada cultivo evaluado, observándose que el cultivo Ra 218-01 es el más eficiente ya que la DN fue la más cercana (5,58 mm) y además presentó un alto PRN% (62,5%), seguido del cultivo Ra 212-01 (DN = 9,98 mm y PRN% = 53,5%); mientras que el cultivo menos eficiente fue Ra 254-03 (DN = 21,25 mm y PRN% = 12,5%). En cuanto a la eficiencia en la nodulación por parte de los cultivos aislados, se tuvieron en cuenta los parámetros de velocidad de nodulación (VN) y porcentaje de raíces noduladas (PRN%). La VN es intrínseco para cada rizobio; por lo tanto es un parámetro útil para diferenciarlos, debido a que se pueden encontrar rizobios que infecten y nodulen la raíz de una misma leguminosa hospedera a la vez, pero que unos sean más veloces que otros (Thies et al., 1991).
Esta depende exclusivamente del lugar de infección y aparición de los nódulos y es determinado a través de la distancia (DN en mm) del primer nódulo formado con relación a la marca realizada en el ápice radical al momento de la inoculación (Bernal et al., 2004).
De los datos obtenidos se pudo observar que la mayoría de los sistemas presentaron nodulación por encima de la marca (asignando un valor positivo), es decir tuvieron una velocidad de nodulación alta; sin embargo en algunos sistemas se observó nódulos formados por debajo de la marca (asignando un valor negativo), velocidad de nodulación baja; lo que hace pensar que algunos cultivos rizobianos son más rápidos nodulando que otros. El parámetro Porcentaje de Raíces Noduladas (PRN%), puede ser relacionada con una mayor capacidad de infectividad que es intrínseco a cada cultivo rizobiano. Prevost et al. (1987) refiere que las variaciones en la infectividad pueden considerarse como inherentes a la constitución genética de los rizobios, lo que justificaría haber encon- trado rizobios con diferente velocidad y porcentaje de nodulación.
Se evaluó la eficiencia en la nodulación a los 20 cultivos considerados como NOD+; ésta fue determinada por el ploteo de datos en un plano bidimensional XY, obtenidos de la velocidad de nodulación y el porcentaje de raíces noduladas, categori- zándolos (A-I) según la frecuencia en la eficiencia de la nodulación por los cultivos rizobianos autenticados (Bernal et al., 2004) (Figura 2).
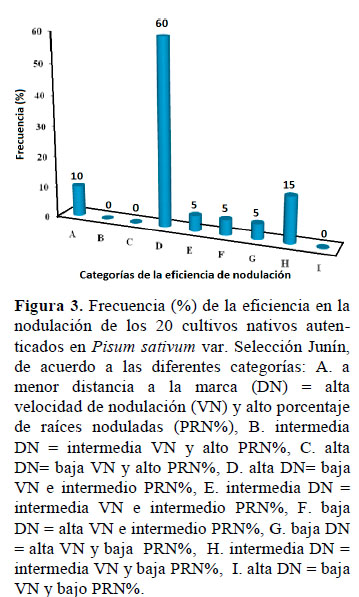
Asimismo, en lo que respecta a la frecuencia de la eficiencia en la nodulación de los 20 cultivos NOD+, se observó que el 10% presentaron alta velocidad de nodulación (VN) y alto PRN%, mientras que cultivos con alta VN e intermedio PRN% presentaron una frecuencia de 60%, no existiendo cultivos con baja VN y bajo PRN%, tal como se muestra en la Figura 3.
El cultivo Ra 218-01 obtuvo la categoría A (alta velocidad de nodulación y alto porcentaje de raíces noduladas), seguido de Ra 212-01; estos parámetros si bien indican un buen desempeño de los cultivos en el proceso de nodulación, son relativos, ya que se observó que a pesar de haber cultivos que han formado nódulos en más del 40% de las raíces marcadas, no presentaron una adecuada velocidad de nodulación, como es el caso de los cultivos Ra 073-01, Ra113-01 y Ra 212-01.
El 60% de los cultivos evaluados obtu- vieron la categoría D, es decir baja velocidad de nodulación e intermedio porcentaje de raíces noduladas; el 5% obtuvieron las categorías E (intermedia VN e intermedio PRN%), F (alta VN e intermedio PRN%) y G (alta VN y bajo PRN%); el 15% obtuvieron la categoría H (intermedia VN y bajo PRN%); y ningún cultivo obtuvo las categorías B (intermedia VN y alto PRN%), C (baja VN y alto PRN%) e I (alta VN y bajo PRN%) (Figura 3).
El análisis correlacional de Pearson al 5% de significancia, muestra que no existe correlación entre los parámetros DN Y PRN% de los 20 cultivos evaluados (r =- 0,2786; P-value = 0,2343), esto debido a que posiblemente falta repeticiones, pues trabajos como el de McDermott y Graham (1990), utilizan 120 plántulas por cada cultivo evaluado. Se sabe que el coefi- ciente de correlación de Pearson, es un índice que mide el grado de covariación entre distintas variables relacionadas linealmente; por lo que un valor reducido no indica necesariamente que no exista relación sino que podría ser que las variables estén fuertemente relacionadas, pero no de forma lineal. Del análisis correlacional para cada grupo de variables, ninguna agrupación (DN-NNE, DN- PPN%, PRN%-NNE) resultó ser significa- tiva a excepción de las variables NNE y PPN%, que se encuentran muy relacio- nadas (r = 0,7791, P-value = < 0,0001), sin embargo una correlación elevada y estadísticamente significativa no tiene que asociarse a causalidad. Al encontrarse que casi todas las variables están relacionadas y además que esa relación no es signi- ficativa, se aceptó la hipótesis nula (Ho: Las variables se encuentran relacionadas). El MANOVA (análisis multivariante) realizado mediante el estadístico Lambda de Wilks muestra que existen diferencias significativas (P < 0,05) entre los pará- metros (DN, PRN%, NNE y PPN%), al igual que en el análisis individual, y mediante el estadístico DHS de Tukey se encontró que existe diferencia significativa entre los cultivos con respecto a dichos parámetros; por lo que se pudo establecer los rangos (alta, intermedia y baja) para la velocidad de nodulación y el porcentaje de raíces noduladas por cada cultivo de rizobio. También se realizó la determi- nación del error estándar para los parámetros de nodulación (DN, PRN%, NNE y PPN%), los que fueron graficados mediante barras. Para los parámetros PRN% y PPN%, se pudo observar heterogeneidad entre los resultados, lo que indica mayor variabilidad; mientras que para los parámetros DN y NNE hubo más homogeneidad entre sus resultados, lo que indica menor variabilidad, por consi- guiente mayor confiabilidad de los datos y menos diferencias entre las réplicas.
4. Conclusiones
De los 50 cultivos evaluados en la auten- ticación, el 40% (20 cultivos) formaron nódulos en simbiosis con Pisum sativum var. Selección Junín, por lo que se les consideró como NOD+; mientras que el 60% (30 cultivos) no fueron capaces de nodular en condiciones de laboratorio a la misma leguminosa, considerándolos como NOD-.
La frecuencia de la eficiencia en la nodulación por los cultivos autenticados en Pisum sativum var Selección Junín fue variable y se observó que solamente el 10% de los cultivos evaluados presentaron alta eficiencia en la nodulación, por presentar alta velocidad de nodulación y alto porcentaje de raíces noduladas.
Referencias
Abad, J. 2008. Generación de una mutateca en Rhizobium leguminosarum para el análisis de proteínas de exportación Tat-dependientes. Departamento de Biotecnología. Escuela Técnica superior de Ingenieros Agrónomos. Universidad Politécnica de Madrid. 63 pp. [ Links ]
Bernal, G.; Tlusty, B.; Estevez de Jensen, C.; Van Berkum, P.; Graham, P. 2004. Characteristics of rhizobia nodulating beans in the central region of Minnesota. Can.J. Microbiol. 50: 1023–1031. [ Links ]
Caldwell, B.E. 1969. Initial competition of root nodule bacteria on soybeans in a field environment. Agron. J. 61: 813-815. [ Links ]
CIAT (Centro Internacional de Agricultura Tropical). 1988. Simbiosis Leguminosa-Rizobio. Manual de Métodos de Evaluación, Selección y Manejo Agronómico. Cali. 178 pp. [ Links ]
Dazzo, F. 1980. Determinants of host specificity in the Rhizobium-clover symbiosis: 165-188. In: Nitrogen Fixation. Symbiotic Association and Cyanobacteria. N. Newton y W. Orane-Johnson (eds.). Ed. University Park Press. Baltimore. [ Links ]
Fernandes, M.; Fernandes, R.; Hungria, M. 2003. Seleção de Rizobios nativos para guandu, caupí e feijão-de- porco nos tabuleiros costeiros de Sergipe. Pesq. agropec. bras. 38(7): 835-842. [ Links ]
McDermott, T.R.; Graham, P.H. 1990. Competitive ability and efficiency in nodule formation of strains of Bradyrhizobium japonicum. Appl. Environ. Microbiol. 56: 3035–3039. [ Links ]
Marcano, L.; Gonzáles, M.; Leal, A.; V. Michelena. 2001. Fijación biológica de nitrógeno por Pachecoa venezuelensis en dos suelos de Sabana del Oriente Venezolano. Revista UDO Agrícola 1(1): 64-69.
Norris, D. 1968. Techniques used in work with Rhizobium. Common. Bur. Past.Fld.Crop. 47: 186-198. [ Links ]
Prevost, D.; Bordeleau, L.; Antoun, H. 1987. Symbiotic effectiveness of indigenous artic rhizobia on a temperate forage legume: Saifon (Onobrychis viciifolia). Plant Soil 104: 63-69. [ Links ]
Pinto, F.G.S.; Hungria, M.; Mercante, F.M. 2007. Polyphasic characterization of Brazilian Rhizobium tropici strains effective in fixing N2 with common bean (Phaseolus vulgaris L.). Soil Biology & Biochemistry 39(8): 1851-1864. [ Links ]
Pueppke, S.G.; Broughton, W.J. 1999. Rhizobium sp. strain NGR234 and R. fredii USDA257 share exceptionally broad, nested host ranges. Mol. Plant-Microbe Interact 12: 293-318. [ Links ]
Somasegaran, P.; H, Hoben. 1994. Handbook for rhizobia: methods in legume-Rhizobium technology. New York: Springer- Verlag. 450 pp. [ Links ]
Thies, J. E.; Singleton, P.W.; Bohlool, B.B. 1991. Influence of the size of indigenous rhizobial popu- lations on establishment and symbiotic performance of introduced rhizobia on field-grow legumes, Appl. Environ. Microbiol. 57: 19. [ Links ]
Thies, J.; Singleton, P.; Bohlool, B. 1992. Environmental effects on competition for nodule occupancy between introduced strains. Can. J. Microbiol 38: 493. [ Links ]
Valladolid, C.A.; Voysest, V.O. 2006. Clases comerciales de leguminosas de grano: Catálogo para orientar la comercialización en los mercados Nacionales e Internacionales. Promenestras Tex. Chiclayo, Perú. 112 pp. [ Links ]
Vanderleyden, J.; Pieternel, R. 1995. The Rhizobium-Plant symbiosis. Microbiol Rev. 59: 124-142.
Young, J.P.W.; Haukka, K. 1996. Diversity and phylogeny of rhizobia. J. Phytol. 133: 87-94. [ Links ]
Zúñiga, D. 2012. Manual de microbiología agrícola: Rhizobium, PGPR, indicadores de Fertilidad e Inocuidad. Universidad Agraria La Molina. Lima – Perú. 112 pp. [ Links ]
* Corresponding author
E-mail: bsoriano@unitru.edu.pe (B.S. Soriano-Bernilla).
Received May 08, 2016.
Accepted June 22, 2016.