Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Scientia Agropecuaria
versión impresa ISSN 2077-9917
Scientia Agropecuaria vol.7 no.spe Trujillo oct. 2016
http://dx.doi.org/10.17268/sci.agropecu.2016.03.06
ARTÍCULOS ORIGINALES
Análisis de la dinámica de poblaciones microbianas durante las fermentaciones espontánea y controlada del Ají "Charapita" (Capsicum frutescens)
Analysis of the microbial population dynamics during spontaneous and controlled fermentation of Chili "Charapita" (Capsicum frutescens)
Carlos Vegas*; Diego Gonzáles; Salomón Sueros; Abad Hurtado; Amparo I. Zavaleta
Laboratorio de Biología Molecular. Facultad de Farmacia y Bioquímica. Universidad Nacional Mayor de San Marcos. Jr. Puno N° 1002, Lima, Perú.
Resumen
Los ajíes son ingredientes básicos de la gastronomía peruana. El ají "Charapita" (Capsicum frutescens) destaca por su amplio uso en la comida amazónica. En la última década, el "boom gastronómico" ha incrementado su demanda por lo que es necesario desarrollar nuevas tecnologías para su conservación de forma sostenible, saludable, sin afectar el medio ambiente. El objetivo del presente trabajo fue analizar la dinámica de las poblaciones microbianas durante la fermentación espontánea (FE) y controlada (FC) del ají "Charapita". Las fermentaciones se realizaron a escala piloto y a temperatura ambiente con ajíes de la ciudad de Iquitos. Para la FC se utilizó la cepa tipo de bacteria ácido láctica (BAL), Lactobacillus plantarum ATCC14917. Las fermentaciones fueron monitoreadas mediante la determinación de azúcares reductores, acidez y pH. Las pruebas microbiológicas fueron contaje al microscopio y viables en medios de cultivos: MRS, YPD, McConkey y Cetrimide para BAL, levaduras, enterobacterias y pseudomonas, respectivamente. Ambas fermentaciones finalizaron a los 47 días, los azúcares reductores estuvieron por debajo de 0,5 g/L, 3,07 3,11 de pH. Sin embargo la acidez en la FE fue mayor a la FC (1,58% vs. 1,20%). A nivel microbiológico, las BAL y levaduras fueron responsables de la FE. Sin embargo, la cepa inoculada no fue la adecuada para la FC, siendo sustituida por levaduras y enterobacterias. Se concluye que para un mejor control de la fermentación es necesaria la inoculación de microorganismos propios de la fermentación.
Palabras clave: fermentación espontánea, fermentación controlada, Capsicum frutescens, BAL, levaduras.
Abstract
Chilies are the main ingredients of the Peruvian gastronomy. Chili "Charapita" (Capsicum frutescens) is very used in amazon food. The last decade, "the gastronomic boom" has increased their demand, so it is necessary to develop new technologies for their preservation sustainably, healthy, without affecting the environment. The aim of the present work was to analyze the microbial population dynamics during Chili "Charapita" fermentation using spontaneous (SF) and controlled (CF) fermentation. Fermentations were conducted at pilot scale and room temperature with chilies from Iquitos city. A lactic acid bacteria (LAB) strain type belonging to Lactobacillus plantarum ATCC 14917 was used in FC. Fermentations were monitored through reducing sugars, acidity and pH determinations. Microbial tests were performed: total cells count by microscopy and microbial growth in culture media. LAB, yeasts, enterobacteriaceae and pseudomonas were recovered in MRS, YPD, McConkey and Cetrimide media, respectively. Both fermentations finalized at 47 days, reducing sugars were below 0.5 g/L and 3.07 3.11 of pH. However, the acidity in SF was higher than CF (1.58% vs. 1.20%). At microbiological level, LAB and yeasts were microorganisms responsible for SF. However, starter LAB was not suitable for CF. In fact, it was replaced by yeasts and enterobacterias. So, the use of autochthonous microorganisms of the fermentation as starter is important for a better fermentation control.
Keywords: spontaneous fermentation, controlled fermentation, Capsicum frutescens, LAB, yeasts.
1. Introducción
La tendencia del mercado mundial por la demanda de productos naturales, mínimamente procesados y de fácil uso (Di Cagno et al., 2009); y el auge de la gastronomía peruana han incrementado el interés de desarrollar nuevas tecnologías para la conservación de productos naturales como los ajíes, entre estos, el ají "Charapita" (Capsicum frutescens) utilizado ampliamente en la Amazonía peruana. En este aspecto, la fermentación láctica del ají es una buena alternativa, puesto que la fermentación además de conservar el alimento por la producción de ácido láctico, mejora la calidad sensorial, digestibilidad, biodisponibilidad, incrementa los niveles de vitamina del alimento y a su preservación por la producción de sustancias antimicrobianas (DeVuyst y Vandamme, 1994; Kalantzopoulos, 1997). Diversos trabajos sobre el estudio de la microbiota implicada en el proceso de fermentación de alimentos se realizaron con el propósito de optimizar y ejercer un mayor control del proceso fermentativo (Torija et al., 2001; Vegas et al., 2010; Cocolin et al., 2013). En la actualidad, las fermentaciones de las materias primas pueden ser realizadas de forma 1) espontánea usando la microbiota autóctona, 2) semicontinua a partir de la inoculación de la materia prima con una pequeña cantidad de un lote previamente fermentado con éxito y 3) controlada a partir de la inoculación de una alta concentración de microorganismos previamente seleccionados. Los microorganismos responsables de la fermentación láctica son las bacterias ácido lácticas (BAL). Sin embargo, las levaduras y otros microorganismos pueden estar presentes en el proceso, dependiendo de la concentración de sal y otros factores ambientales (Arroyo-López et al., 2008). El objetivo del presente trabajo fue determinar la dinámica de las poblaciones microbianas tanto en la fermentación espontánea (FE) como controlada (FC) del ají "Charapita".
2. Materiales y métodos
Ají "Charapita"
Los ajíes fueron recolectados de una finca de la Comunidad de Zungarococha, ubicada en la ciudad de Iquitos, Región Loreto. Luego, estos se transportaron en contenedores refrigerados.
Preparación de las fermentaciones
Las FE y FC se realizaron en condiciones estériles y en contenedores de vidrio. A los ajíes se añadieron cloruro de sodio al 5% (p/v) (Calbiochem, Darmstadt, Germany) y glucosa 2,5% (p/v) (Amresco, Ohio, USA), a un volumen final de 1,8 L y a temperatura ambiente. Para la FC se inoculó la cepa tipo Lactobacillus (L.) plantarum subsp. plantarum (ATCC® 14917™) a una concentración de 7 log cél/mL. Ambas fermentaciones fueron realizadas por triplicado.
Muestreo
Durante el proceso de fermentación del ají "Charapita" se realizaron los muestreos a 0, 3, 12, 18, 27, 37 y 47 días. En cada uno de ellos, se realizaron análisis físico- químicos y microbiológicos.
Análisis fisicoquímicos
Se determinaron la acidez total por titulación (Holmes y Peck, 1993) y los azúcares reductores por el método del DNS (Miller, 1959) y pH.
Análisis microbiológicos
Se realizó el contaje total de células por microscopio (Beltec Scientific, Lima, Perú) usando la cámara de Neubauer y el recuento de colonias viables usando cuatro medios de cultivos específicos. Así, se utilizaron el medio MRS (Merck, Darmstadt, Alemania) para la recuperación de BAL suplementado con nistatina (Merck, Darmstadt, Alemania) para la inhibición de hongos y levaduras, y ázida sódica (Merck, Darmstadt, Alemania) para la inhibición de bacterias gram negativas. Además, se usó el medio YPD (2% de glucosa, 2% de peptona, 1% de extracto de levadura, 2% de agar; p/v) para la recuperación de levaduras, suplementado con cloranfenicol (Applinchen GmbH, damstardt, Alemania) para la inhibición de bacterias. También se utilizó el medio McConkey (Oxoid, Basingstoke, Reino Unido) para la recuperación de enterobacterias y Cetrimide (Merck, Darmstadt, Alemania) para la recuperación de pseudomonas. Los medios de cultivo fueron incubados a 30 °C y en aerobiosis, a excepción del MRS que fue incubada en anaerobiosis, empleando Anaerocult A (Merck, Darmstadt, Alemania), bolsas de anaerobiosis e indicador anaeróbico (Oxoid, Basingstoke, Reino Unido). Los tiempos de incubación para los cuatro medios de cultivo fueron en un rango de 1- 3 días.
3. Resultados y discusión
En este estudio se quiere evaluar la dinámica de las poblaciones microbianas del ají "Charapita" durante el proceso de fermentación y compararla con otro proceso fermentativo inoculando una cepa tipo de L. plantarum (ATCC® 14917™). Las fermentaciones se consideraron terminadas cuando el contenido de azúcares reductores fue menor a 0,5 g/L. En este sentido, tanto las FE como FC finalizaron a los 47 días (Tabla 1). El contenido de acidez total titulable en la FE 1,58 ± 0,16 y en la FC 1,20 ± 0,13. El pH de ambas fermentaciones estuvo en un rango de 5,47 al inicio de la fermentación y 3,27 3,07 al final de la FE y FC, respectivamente.
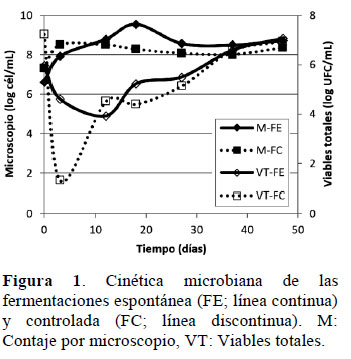
A nivel microbiológico, el contaje por microscopio de ambas fermentaciones estuvo en un rango 8 9,55 log cél/mL (Figura 1). El Recuento total de viables representó la suma de los cuatro medios de cultivo utilizados en este trabajo. En este sentido, el total de viables de ambas fermentaciones fue menor que el 5% de lo observado por microscopio; a excepción del inicio donde se observó una mayor recuperación. La baja recuperación se puede explicar al estado viable no cultivable de los microorganismos que ocurre cuando estos cambian de su hábitat natural a medios de cultivos de laboratorio (Oliver et al., 2005).
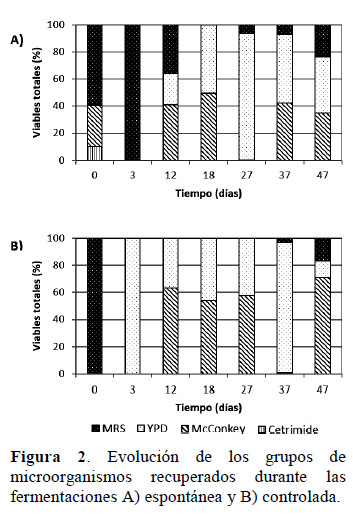
Las poblaciones microbianas responsables de la FE fueron las BAL y levaduras, siendo las BAL mayormente recuperadas entre los 0 3 días, mientras que las levaduras entre los 18 47 días. Enterobacterias sólo fue mayormente recuperado en el 12 día (Figura 2A). En la FC, a pesar de la inoculación de L. plantarum (ATCC® 14917™), los microorganismos responsables fueron las levaduras y enterobacterias, siendo las levaduras mayormente recuperadas en el 3 y 37 días, mientras que enterobacterias entre los 12, 18, 27 y 47 días (Figura 2B). En ambas fermentaciones, las pseudomonas se recuperaron en bajas poblaciones al inicio, así en la FE fue ≤ 10% y en la FC ≤ 0,02%.
La mayor recuperación de BAL y levaduras durante la FE es beneficiosa para el proceso debido a que ambos microorganismos son generalmente reconocidos como seguros (GRAS). Estos resultados coinciden con lo descrito por Fleming (1982), donde la fermentación de vegetales es primariamente realizada por las BAL con o sin presencia de levaduras. El cometabolismo entre las BAL y levaduras puede ser debido a que la proliferación de levaduras en alimentos es favorecido por el ácido producido por las BAL mientras que el crecimiento de las bacterias es estimulado por la presencia de levaduras, que puede proveer factores de crecimiento, como vitaminas y compuestos de nitrógeno soluble (Nout, 1991). Esta interacción de BAL y levaduras también fue observado en las fermentaciones de la col, aceitunas y kimchi (Park et al., 2009; Pundir y Jain, 2010; Abriouel et al., 2011). Diversos estudios sustentan el uso de levaduras como co-inóculos debido a que tienen la capacidad de producir aromas que incrementan la calidad del producto y de inhibir el crecimiento de otros microorganismos patógenos (Psani y Kotzekidou, 2006).
La inoculación de microorganismos puros acelera y favorece el proceso de fermen- tación (Holzapfel, 2002). Sin embargo, en este trabajo la inoculación de L. plantarum (ATCC® 14917™) no mejoró el proceso de fermentación, posiblemente debido a que este microorganismo fue aislado de la fermentación de la col. Por ello, la importancia de estudiar los microorganismos responsables de la FE con el fin de seleccionar los microorganismos más adecuados para realizar procesos controlados. Por ejemplo, en la fermentación de las aceitunas "Azeiteira" tipo verde, estilo sevillano, la inoculación de Lactobacillus pentosus DSM 16366 (aislado de la fermentación de aceitunas de mesa) mejoró el bioproceso (Peres et al., 2008). Por lo tanto, la FC del ají "Charapita" debe ser a partir de microorganismos propios de la fermentación, de manera que puedan adaptarse rápidamente al medio de fermentación y por tanto reducir el tiempo de fermentación, así como, extender la vida útil del alimento inhibiendo el crecimiento de microorganismos patógenos relacionados con los alimentos.
La presencia de enterobacterias y pseudomonas en la fermentación de alimentos está relacionado con la seguridad y calidad alimentaria (Baylis et al., 2011), por lo que su desarrollo durante las fermentaciones se considera perjudicial para el proceso.
En la FE, la presencia de BAL mantuvo a las enterobacterias en bajos niveles
poblacionales. Sin embargo, cuando las levaduras predominaron, las enterobacte- rias se incrementaron. Se ha descrito que algunas especies de enterobacterias pueden producir ácido (Baylis et al., 2011).
Así, la producción de ácido en la FC puede ser atribuida a las enterobacterias, puesto que es la población de microorganismos mayormente recuperado durante el proceso. En la fermentación de otros alimentos se ha descrito la presencia de enterobacterias en poblaciones constantes durante el proceso (Idoui et al., 2009; Nout, 1991; Mohammed et al., 1991). A la vez, también se han reportado la disminución de la población de enterobacterias durante la fermentación (Idoui et al., 2009; Pérez et al., 2005).
Las enterobacterias y pseudomonas pueden formar parte de la microbiota de frutos y vegetales frescos dependiendo de su procedencia y cultivo (Di Cagno et al., 2009; Pérez-Días et al., 2014), por lo que la presencia de ambos microorganismos durante las fermentaciones pueden atribuirse al ají, puesto que las fermentaciones se realizaron en condiciones estériles.
4. Conclusiones
Los microorganismos responsables de la FE del ají "Charapita" son las BAL y levaduras, siendo las primeras responsables de iniciar la fermentación y las segundas de finalizar el proceso. Para la mejora del proceso fermentativo del ají "Charapita", se propone la co-inoculación de BAL y levaduras propios de la fermentación como cultivos mixtos.
Agradecimientos
Este trabajo ha recibido el apoyo financiero de INNÓVATE PERÚ contrato 230-FINCyT-IA- >2013 y CIENCIACTIVA contrato 007FONDECYT-2014.
Referencias
Abriouel, H.; Benomar, N.; Lucas, R.; Gálvez, A. 2011. Culture-independent study of the diversity of microbial populations in brines during fermentation of naturally fermented Aloreña green table olives. International Journal of Food Microbiology 144: 487–496. [ Links ]
Arroyo-López, F.; Querol, A.; Bautista-Gallego, J.; Garrido-Fernández, A. 2008. Role of yeasts in table olive production. International Journal of Food Microbiology 128: 189-196. [ Links ]
Baylis, C.; Uyttendaele, M.; Joosten, H.; Davies, A. 2011. The enterobacteriaceae and their significance to the food industry. ILSI Europe Report Series. 17–28. [ Links ]
Cocolin, L.; Alessandria, V.; Dolci, P.; Gorra, R.; Rantsiou, K. 2013. Culture independent methods to assess the diversity and dynamics of microbiota during food fermentation. International Journal of Food Microbiology 167: 29–43. [ Links ]
DeVuyst, L.; Vandamme, E. 1994. Antimicrobial potential of lactic acid bacteria, p. 91–142. In L. DeVuyst and E.J. Vandamme (ed.), Bacteriocins of Lactic acid Bacteria. Blackie Academic and Professional, London, United Kingdom. [ Links ]
DiCagno, R.; Surico, R.F.; Minervini, G.; De Angelis, M.; Rizello, C.G., Gobbetti, M. 2009. Use of autochthonous starters to ferment red and yellow peppers (Capsicum annum L.). International Journal of Food Microbiology 130: 108–116. [ Links ]
Fleming, H. 1982. Fermented vegetables. In A.H. Rose (ed.), Economic microbiology. Fermented foods, vol. 7. Academic Press, New York. 227 pp. [ Links ]
Holmes, D.; Peck, H. 1993. Analytical Biochemistry. Longman Scientific and Technical, London. [ Links ]
Holzapfel, W. 2002. Appropriate starter culture technologies for smallscale fermentation in developing countries. International Journal of Food Microbiology 75: 197–212. [ Links ]
Idoui, T.; Boudjerda, J.; Leghouchi, E.; Karam, N.E. 2009. Naturally fermented Jijelian black olives: microbiological characteristics and isolation of lactic acid bacteria. Grasas y Aceites 60 (5): 514-518. [ Links ]
Kalantzopoulos, G. 1997. Fermented products with probiotic qualities. Anaerobe 3: 185-190. [ Links ]
Miller, G. 1959. Use of Dinitrosalisyc Acid Reagents for determination of reducing sugar. Anal Chem. 31: 426-428. [ Links ]
Mohammed, S.; Steenson, L.; Kirleis, A. 1991. Isolation and characterisation of microorganisms associated with the traditional sorghum fermentation for production of Sudanese Kisra. Applied and Environmental Microbiology 57: 2529-2533. [ Links ]
Nout, M.J.R. 1991. Ecology of accelerated natural lactic fermentation of sorghum-based infant food formulas. International Journal of Food Microbiology 12: 217-224. [ Links ]
Oliver, J. 2005. Viable but nonculturable bacteria in food environments. In: Fratamico, P.M., Bhunia, A.K., Smith, L. (Eds.), Foodborne Pathogens. Microbiology and Molecular biology. Caister Academic Press, UK. [ Links ]
Park, S.; Chang, J.; Cha, S.; Moon, G.; 2009. Analysis of the bacterial composition during Kochujang, a Korean traditional fermented hot pepper-soybean paste, fermentation. Food Science and Biotechnology 18: 1035–1037. [ Links ]
Peres, C.; Catulo, L.; Brito, D.; Pintado, C. 2008. Lactobacillus pentosus DSM 16366 starter added to brine as freeze-dried and as culture in the nutritive media for Spanish style green olive production. Grasas y Aceites 59(3): 234-238. [ Links ]
Pérez, R.; Ben Omar, N.; Abriouel, H.; Lucas, R.; Martínez, M.; Gálvez, A. 2005. Microbiological Study of Lactic Acid Fermentation of Caper Berries by Molecular and Culture-Dependent Methods. Applied and Environmental Microbiology 71 (12): 7872-7879. [ Links ]
Pérez-Díaz, I.; Breidt, F.; Buescher, R.; Arroyo-López, F.; Jiménez-Díaz, R.; Garrido, A.; Bautista, J.; Yoo, S..; Johanningsmeier, S. 2014. Fermented and Acidified Vegetables.F. Pouch Downes, K.A. Ito (Eds.), Compendium of Methods for the Microbiological Examination of Foods (5th ed.), American Public Health Association (Chapter 51). [ Links ]
Psani, M.; Kotzekidou, P. 2006. Technological characteristics of yeast strains and their potential as starter adjuncts in Greek-style black olive fermentation. World Journal of Microbiology and Biotechnology 22: 1329–1336. [ Links ]
Pundir, R.; Jain, P. 2010. Change in microflora of sauerkraut during fermentation and storage. World Journal of Dairy and Food Science 5: 221-225. [ Links ]
Torija, M.J.; Rozes, N.; Poblet, M.; Guillamón, J.M.; Mas, A. 2001. Yeast population dynamics in spontaneous fermentations: comparison between two different wine areas during three consecutive years. Antonie van Leeuwenhoek 79: 345 – 352. [ Links ]
Vegas, C.; Mateo, E.; González, A.; Jara, C.; Guillamón, J.; Poblet, M.; Torija, M.; Mas, A. 2010. Population dynamics of acetic acid bacteria during traditional wine vinegar production. International Journal of Food Microbiology 138: 130–136. [ Links ]
Corresponding author:
E-mail: carlosvegas@hotmail.com (C. Vegas)
Received May 02, 2016.
Accepted June 21, 2016.













