Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Scientia Agropecuaria
versión impresa ISSN 2077-9917
Scientia Agropecuaria vol.7 no.spe Trujillo oct. 2016
http://dx.doi.org/10.17268/sci.agropecu.2016.03.12
ARTÍCULOS ORIGINALES
Regulación del ciclo celular (CC) de Vicia faba L por el extracto alcohólico de Annona cherimola Mill "chirimoya"
Regulation of the cell cycle (CC) of Vicia faba L by the alcoholic extract of Annona cherimola Mill "cherimoya"
Raúl A. Beltrán Orbegoso*; Paola M. Beltrán Casana
Facultad de Ciencias Biológicas, Universidad Nacional de Trujillo (UNT), Av. Juan Pablo II s/n. Ciudad Universitaria. Peru.
Resumen
El probable efecto antineoplásico del extracto de Annona cherimola Mill "chirimoya", es controversial. Por tanto, como la neoplasia implica una alteración del ciclo celular (CC) del tejido afectado; una aproximación para evaluar el efecto antineoplásico del extracto sería exponiéndolo ante una población celular con el CC alterado. El objetivo del estudio fue valuar el efecto del extracto alcohólico de la pulpa del fruto de A. cherimola Mill en el CC del biosensor Vicia faba L. "haba" expuesto al colorante alimentario tartrazina al 0,1%, 0,3% y 0,5%. Se usó un diseño experimental al azar, con seis tratamientos. La población celular estudiada fue de V. faba L. (2n = 12), sometida inicialmente a la tartrazina para inducir la alteración del CC y luego expuesta al extracto del fruto de A. cherimola Mill para evaluar la probable regulación del CC. El indicador de la alteración y regulación celular fue el índice mitótico (IM) de V. faba L. Para determinar el IM, las células se sometieron al protocolo de Tjio y Levan (1968), luego se observó un promedio de 1500 células por tratamiento, en un microscopio de luz, de campo claro, a 400X y 1000X. Los datos se sometieron a las pruebas de Anova y Tukey (α = 0,05). Se halló que el extracto alcohólico de la pulpa del fruto de A. cherimola Mill si regula el ciclo celular de V. faba L., alterado por tartrazina, al generar un IM de 19,2 ± 2,0 hallándose diferencia significativa. Así, el extracto presentaría componentes que coadyuvan en mecanismos de recuperación celular.
Palabras clave: Annona cherimola M., regulación celular, tartrazina, Vicia faba L.
Abstract
The likely antineoplastic effect of extract of Annona cherimola Mill "chirimoya", is controversial. Therefore, such as neoplasia involves an alteration of the cell cycle (CC) of the affected tissue; an approach to evaluate the antineoplastic effect of extract would be exposing it to a cell population with the altered CC. The aim of this study was to evaluate the effect of alcoholic extract from the pulp of the fruit of A. cherimola Mill on the CC of the biosensor Vicia faba L. "bean" exposed to the food coloring tartrazine 0.1%, 0.3% and 0.5%. An experimental design was random, with six treatments. The cell population studied was of V. faba L. (2n = 12), initially submitted to tartrazine to induce the alteration of CC and then exposed to the extract of the fruit of A. cherimola Mill to assess the likely regulation of the CC. The indicator of alteration and cellular regulation was the mitotic index (MI) of V. faba L. To determine the MI, cells were subjected to the protocol Tjio and Levan (1968), then it was observed an average of 1500 cells by treatment, in a light, field microscope light, 400 x and 1000 X. The data were submitted to Anova and Tukey tests (α = 0.05). It was found that the alcoholic extract of the pulp of the fruit of A. cherimola Mill if it regulates the cell cycle of V. faba L., altered by tartrazine, by generating an MI of 19.2 ± 2.0 finding significant difference. Therefore the summary would provide components that contribute in cell recovery mechanisms.
Keywords: Annona cherimola M., cellular regulation, tartrazine, Vicia faba L.
1. Introducción
En Perú, la medicina popular, medicina folklórica o folk medicine se practica en las comunidades andina y selvática desde la época prehispánica. Inicialmente se basó en el uso de plantas medicinales autóc- tonas; luego, la irrupción española del siglo XVI y la reciente globalización aperturó el ingreso de vegetales foráneos en nuestro país, algunos de los cuales pasaron también a formar parte de dicha práctica popular.
Una de las plantas ícono usadas por las comunidades nacionales ancestrales en el tratamiento de enfermedades es Uncaria tomentosa Wild "uña de gato"; cuyo efecto benéfico para la salud se ha demostrado científicamente al reportarse su acción en la actividad mitótica, antitumoral y antioxidante (Dreyfuss et al., 2010; Kurás et al., 2009). De otro lado, uno de los vegetales foráneos más promocionado por sus propiedades benéficas es Morinda citrifolia L. "noni", la cual ha generado la aparición de numerosas empresas nutracéuticas nacionales e internacionales. De M. citrifolia L. se reporta la acción de su fruto y raíces en células humanas malignas (Hirazumi et al., 1996; Kamiya et al., 2010) y de su fruto en la úlcera gástrica y actividad anti-inflamatoria (Mahattanadu et al. 2011; Nitteranon et al., 2011).
Pero, en los últimos años se ha difundido en la medicina popular las propiedades curativas de dos plantas autóctonas perte- necientes a la familia anonáceas: Annona muricata L. "guanábana" y Annona cherimola Mill "chirimoya", existiendo una profusa información virtual sobre las bondades medicinales de estas dos espe- cies. Recientes investigaciones realiza-das en A. muricata L. evidencian que sus hojas y el fruto tienen efecto analgésico, antiespasmódico, antiulcerogénico e inclu- so anticancerígeno (Beneval et al., 2016; Gavamukulya et al., 2014; Jiménez et al., 2014). Así mismo, trabajos realizados en A.cherimola Mill evidencian un alto poder antioxidante, reducidor de radicales libres, actividad citoprotectiva y acción quelante de metales, de su cáscara y pulpa del fruto (Barreca et al., 2011; Goñi et al., 2010; Gupta-Elera et al., 2011; Loizzo et al., 2012).
Se afirma incluso que el fruto de A.cherimola Mill tendría efecto anti- cancerígeno, sin embargo, la información científica es escasa y controversial, por lo que se consideró de interés investigar dicho efecto. El cuadro cancerígeno se caracteriza por presentar una manifestación neoplásica (tumor) debido a la pérdida del control del ciclo celular (CC) del tejido afectado. Por tanto, como la neoplasia es una evidencia de la alteración del ciclo celular (CC); una aproximación para evaluar el efecto antineoplásico del extracto del fruto de A.cherimola Mill sería exponiéndolo ante una población celular modelo con el CC alterado.
Una población celular modelo es la de Vicia faba L. "haba", la cual por presentar un genoma diploide de sólo doce cromosomas (2n = 12) metacéntricos y acrocéntricos de gran tamaño y alta sensibilidad, permite una fácil lectura de su CC en términos de índice mitótico (IM) e índice de fases mitóticas. Esta cualidad del vegetal lo ha convertido en uno de los bioindicadores de citotoxicidad y geno- toxicidad ante agentes físicos y químicos más importantes junto con Allium cepa L. (2n = 16) (Andrioli et al., 2006; Beltrán, 2009; Beltrán, 2013; Castillo et al., 2000; Fiskesjö, 1993; Guevara, 2015; Leme y Marín, 2009; Ma et al., 2012; Srivastava y Mishra, 2009).
En el estudio se usó como agente inductor de la alteración del CC al colorante tartrazina, una de las sustancias químicas más usadas en la industria alimentaria, a pesar de una serie de controversias sobre su citotoxicidad (Mpountoukas et al., 2010; Patterson y Blutter, 1982; Kashanian y Zeidali, 2011).
El objetivo de la investigación fue evaluar el efecto del extracto alcohólico de la pulpa del fruto de A. cherimola Mill en el ciclo celular del biosensorVicia faba L. "haba" var. minor expuesto al colorante alimentario tartrazina 0,1%, 0,3% y 0,5%, por cuatro horas.
2. Materiales y métodos
2.1 Material biológico y químico
Los frutos de A. cherimola Mill y las semillas de V. faba L. var. minor fueron adquiridos en un supermercado de la ciudad de Trujillo (Perú) y catalogados por el Herbarium Truxillense de la Universidad Nacional de Trujillo (UNT). Los frutos de A. cherimola Mill se adquirieron refrigerados, verdes y turgentes, luego se mantuvieron a la temperatura ambiental (23 ºC) hasta lograr su maduración avanzada. Se usaron semillas de V. faba L. secas y envasadas. El colorante tartrazina Sigma se adquirió en un centro de expendios de productos químicos de Trujillo (La Libertad, Perú).
2.2 Obtención del extracto alcohólico de la pulpa del fruto de Annona cherimola Mill "chirimoya"
Para obtener el extracto alcohólico, el fruto en estado de madurez avanzada fue sometido a los siguientes pasos: a) Retiro de la cáscara y semillas; b) Extracción manual de la pulpa; c) Secado de la pulpa en estufa y al ambiente por cinco días; d) Exposición de la pulpa seca al alcohol etílico 90º durante cuatro días; e) Vaporación del alcohol para obtener el extracto; f) Disolución del extracto en agua destilada 1/100; g) Obtención de 500 ml de disolución madre del extracto alcohólico de la pulpa del fruto de A.cherimola Mill. De esta disolución base se prepararon las diversas concentraciones usadas en el diseño experimental.
2.3 Germinación de las semillas de V. faba L.
Las semillas secas de V. faba L. se mantuvieron en algodón humedecido con agua destilada para inducir la germinación de las raicillas primarias y secundarias. A los cuatro días, se seleccionaron 18 semillas con las raicillas secundarias más turgentes, abundantes y de 1 cm de longitud.
2.4 Diseño experimental
Se usó un diseño experimental al azar con seis tratamientos: T1 (control, testigo negativo, raicillas en agua destilada); T2 (testigo positivo, raicillas en tartrazina 0,1%); T3 (testigo positivo, raicillas en extracto de chirimoya al 5%); T4 (raicillas en 0,1% de tartrazina, luego en extracto de chirimoya 0,5% ); T5 (raicillas en 0,3% de tartrazina, luego en extracto de chirimoya 0,5%) y T6 (raicillas en 0,5% de tartrazina, luego en extracto de chirimoya 0,5%). Cada tratamiento tuvo tres repeticiones, la duración del tratamiento fue de cuatro horas.
2.5 Ejecución del protocolo de Tjio y Levan (1968)
Luego de mantener las raicillas de V. faba L por cuatro horas en cada tratamiento, se disectaron los ápices y se sometieron al protocolo de Tjio y Levan (1968): a) fijación de los ápices en solución de Carnoys; b) coloración e hidrólisis de los ápices en una mezcla de orceína acética 2% + HCl 1N; c) aplastamiento en monocapa sobre laminillas portaobjeto de vidrio; d) observación microscópica de la población celular modelo de V. faba L., las células meristemáticas se observaron, contaron en número de 1500 y analizaron en un microscopio de luz Olympus, de campo claro, a 400X y 1000X.
2.6 Análisis citológico de V. faba L. y evaluación del ciclo celular (CC)
El indicador de la inicial alteración del ciclo celular (CC) por acción de la tartrazina y su posterior regulación por efecto del extracto alcohólico de la pulpa del fruto de Annona cherimola Mill de la "chirimoya" fue el índice mitótico (IM) de V. faba L.
La fórmula para determinar el índice mitótico (IM) fue: IM =NCM/NTC x 100 ; donde NCM: Número de células en mitosis y NTC: Número total de células meristema- ticas. Se contaron un promedio de 1500 células por raicilla en cada tratamiento.
2.7 Tratamiento estadístico
Los porcentajes promedio de los IM de Vicia faba L. hallados en los seis tratamientos fueron sometidas a la prueba de Anova para determinar diferencia significativa en algún tratamiento. Posteriormente, los promedios fueron analizados con la prueba de comparaciones múltiples de Tukey para determinar en cuál o cuáles de los tratamientos estaría la diferencia estadísticamente significativa.
3. Resultados y discusión
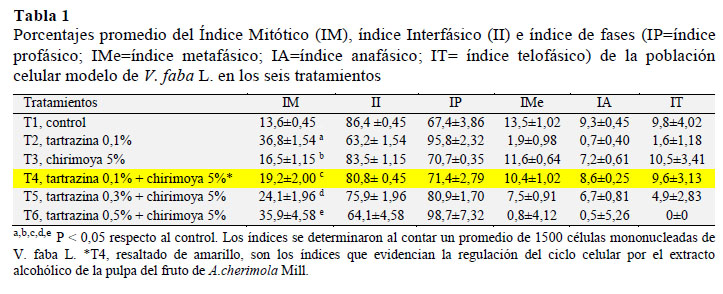
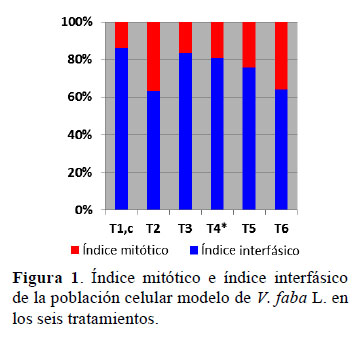
En la Tabla 1 se presentan los porcentajes promedios del índice mitótico (IM) y de los índices de fase (IP = índice profásico; IMe = índice metafásico; IA = índice anafásico; IT = índice telofásico) de la población celular modelo del biosensor Vicia faba L. en los seis tratamientos estudiados. Los valores del tratamiento T1, corresponden a los índices de la población celular de V. faba L. usados como control para realizar la comparación con los tratamientos restantes. La población celular control presenta un índice mitótico (IM) de 13,6% ± 0,45 y un índice inter- fásico de 86,4% ± 0,45 (Tabla 1, Figura 1). A su vez, las células mitóticas presentan un índice profásico (IP) de 67,4% ± 3,86; índice metafásico (IMe) de 13,5% ± 1,02; índice anafásico (IA) de 9,3 ± 0,45 e índice telofásico (IT) de 9,8% ± 4,02 (Tabla 1, Figura 2). Los índices mitóticos e índices de fases hallados en T1 son similares a los determinados por Beltrán (2009) y Guevara (2015).
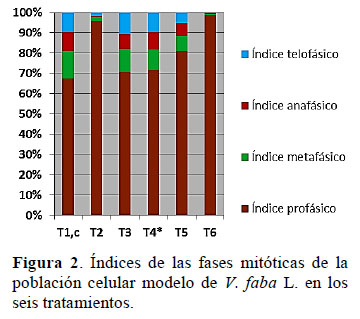
En la población celular de T1, se observaron todas las fases mitóticas (Figura 3); lo cual evidencia que las proporciones celulares del ciclo celular (CC) y la dinámica del flujo celular del biosensor V. fava L. usados en el presente estudio son adecuadas.
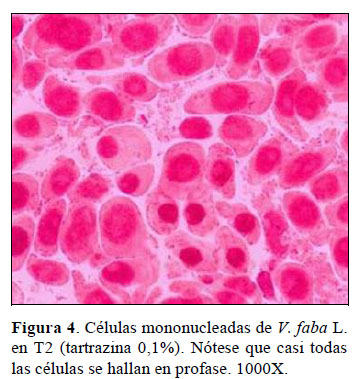
En T2, correspondiente a la población celular de V. faba L. sometida a la tartrazina 0,1%, observamos que las células presentan un índice mitótico (IM) de 36,8% ± 1,54; esto significa que el colorante alimentario altera el ciclo celular de V. faba L. al originar un incremento de casi tres veces del número de células que ingresa a mitosis, con respecto a la población celular control de T1. En la Figura 1 se puede apreciar el tamaño desproporcionado de la barra color rojo correspondiente al IM de T2, en comparación con el resto de tratamientos.
Pero, la alteración no solo es a nivel de IM sino también a nivel de los índices de fases mitóticos (IP = índice profásico; IMe = índice metafásico; IA = índice anafásico; IT = índice telofásico); el caso más llamativo es el índice profásico (IP) en donde el promedio de células es de 95,8% 2,32. En la Figura 2 se aprecia el notable incremento de la barra color marrón en comparación con los trata- mientos restantes.
En la Figura 4 se evidencia lo afirmado, vemos que casi todas las células mitóticas están en profase, el resto de fases mitóticas no se observa, al menos en esta figura. Este resultado demuestra un alto efecto citostá- tico de la tartrazina 0,1% debido proba- blemente a que el colorante alimentario bloquea el paso de las células de profase a metafase al actuar sobre las moléculas de ciclina que "ordenan" la progresión de la profase (Beltrán, 2009) o porque el colorante estaría inhibiendo la disgre- gación de la envoltura nuclear o carioteca.
La citotoxicidad estaría relacionado con los dos radicales SO3, que presenta la tartrazina en su estructura química, la cual estaría conllevando a una inhibición de la perdida de fósforo (Alberts et al., 2002; Lodish et al., 2012).
En T2, como es de esperarse, se observa una drástica disminución de los índices metafásicos, anafásicos y telofásicos llegando los valores a 1,9%, 0,7% y 1,6%, reducciones que se explican porque el efecto citostático en el ÍP es muy alto. En cuanto a la disminución del Índice Metafásico (IMe), se debería a que la tartrazina al inhibir el complejo CdK1- Ciclina B, actúa cobre los centros de organización de microtúbulos, disminu- yendo el ensamblaje del huso mitótico. Ello desencadenarían un cambio súbito en la funcionalidad de los cinétocoros, dejando de inducir la polimerización de microtúbulos que se elaboran perpendi- cularmente al eje mayor del cromosoma y se anclan por una de sus extremidades en el cinétocoro, logrando solo pasar a metafase un número reducido de células (Lodish et al., 2012).
Asimismo, la disminución en el Índice Anafásico (IA), estaría ocurriendo debido a que la tartrazina actuaría inhibiendo la actividad catalítica de las proteínas deno- minadas cohesinas, MAPs y catastrofinas; las cuales a su vez se encargan de llevar a cabo el proceso de segregación de cromá- tidas, originando que las células transiten normalmente hacia anafase y telofase (Alberts et al., 2002; Lodish et al., 2012). Los resultados evidencian un efecto citotóxico y citostático de la tartrazina similares a los hallados en otras investigaciones (Mpountoukas et al., 2010; Patterson y Blutter, 1982; Kashanian y Zeidali, 2011). En síntesis, la tartrazina 0,1% si induce una importante alteración del ciclo celular (CC) de V. faba L.
Los resultados obtenidos en T3 y mostrado en la Figura 2 evidencian que el Índice Mitótico (IM) de 16,5 ± 1,15 y los índices de fase mitóticos tienden a ser similares con el control. Esto indica que el extracto alcohólico de la pulpa del fruto de Annona cherimola Mill "chirimoya" 5 % no tiene efecto citostático como el manifestado por la tartrazina; lo cual corrobora que si podría tener un efecto regulador en el ciclo celular (CC) de la población mono- nucleada V. faba L.
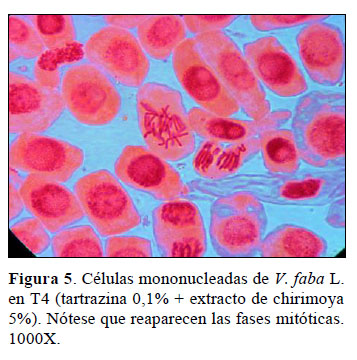
T4 es el tratamiento en donde se va a evidenciar el efecto regulador del ciclo celular (CC) de V. faba L. por el extracto alcohólico de la pulpa del fruto de Annona cherimola Mill "chirimoya" 5%, pues la población celular mononucleada de V. faba L. se está enfrentando al citotóxico tartrazina y luego al extracto. Si se comparan los IM y los índices de fase mitóticos de T1 o control (13,6% ± 0,45) con los del tratamiento T4 (19,2 ± 2,00) vemos que los valores de T4 tienden a acercarse a T1, con lo cual se demuestra que el extracto alcohólico de la pulpa del fruto de Annona cherimola Mill "chirimoya" 5%, a pesar de hallarse en un medio con 0,1% de tartrazina, ha coadyuvado en la regulación del IM de la población celular de V.faba L., lo cual se evidencia por la reaparición de los índices de fases mitóticas de IP, IMe, IA e IT en proporciones similares a T1 (Tabla 1) y por la presencia de todas las figuras mitóticas en la población celular de V.faba L. (Figuras 2 y 5).
Los resultados de T4 evidencian un efecto regulador del extracto de Annona cherimola Mill en el índice mitótico de V. faba L. sometido a tartrazina, lo cual sugiere que el fruto presentaría compo- nentes moleculares que coadyuvarían en la regulación del ciclo celular de V. faba L. en vías metabólicas aún no definidas.
En T5 y T6 se obtuvieron porcentajes promedios del Índice Mitótico (IM) y de los Índices de fases muy alejados de los promedios normales del T1 control debido a que la acción conjunta de la tartrazina y del extracto de Annona cherimola Mill afectan la dinámica y morfología celular, hecho que se caracterizó por la desecación y lisis de un alto porcentaje de la población celular.
4. Conclusiones
El extracto alcohólico de la pulpa del fruto de A. cherimola Mill si regula el ciclo celular de la población mononucleada de V. faba L., alterado por tartrazina, al generar un IM de 19,2 ± 2,00, cercano al IM control de 13,6 ± 0,45.
Referencias
Alberts, B.; Johnson, A.; Lewis, J.; Raff, M.; Roberts, K.; Walter, P. 2002. Molecular biology of the cell (2º ed.). New York: Garland Science. 1616 pp. [ Links ]
Andrioli, N.; Wulff, A.; Mudry, M. 2006. Allium cepa como biomonitor de toxicidad y genotoxicidad de metronidazol. Theoria 15: 9-16. [ Links ]
Barreca,D.; Laganà, G.; Ficarra,S.; Tellone, E.; Leuzzi, U.; Galtieri, A.; Bellocco, E. 2011. Evaluation of the antioxidant and cytoprotective properties of the exotic fruit Annona cherimola Mill. (Annonaceae) Food Research International 44: 2302-2310. [ Links ]
Beltrán, O.R. 2009. Perfiles ecotoxicológicos de solventes de la industria del calzado y de plaguicidas agroquímicos mediante los biomonitores Vicia faba y Allium cepa en la región La Libertad. Libro de resúmenes, Cong. Intern. de Ecología y Medio Ambiente. pp 152. [ Links ]
Beltrán, O.R. 2013. Acción genocontaminante del agroquímico metamidofos y del saborizante glutamato monosódico en el ciclo nucleolar de Allium cepa L. Conocimiento para el desarrollo 4(2): 109-116. [ Links ]
Beneval, B.E.; Elizaudo, de B.F.; Rakelly, de O.D.; Fernandes, C.N. 2016. Antiulcerogenic activity of the hydroalcoholic extract of leaves of Annona muricata Linnaeus in mice Saudi. Journal of Biological Sciences (En prensa). [ Links ]
Castillo, L.E.; Pinnock, M.; Martínez, E. 2000. Evaluation of a battery of toxicity tests for use in the assessment of water quality in a Costa Rican Laboratory. Environm Toxicol (15): 312-321. [ Links ]
Dreifuss, A.A.; Bastos-Pereira, A.L.; Ávila, T.B.; Silva, B.; Rivero, A.J.; Aguilara, J.L.; Accob, A. 2010. Antitumoral and antioxidant effects of a hydroalcoholic extract of cat’s claw (Uncaria tomentosa) in an in vivo carcinosarcoma model. Journal of Ethnopharmacology 130: 127–133.
Fiskesjö, G. 1993. Technical Methods Section. Allium test I: A 2-3 day plant test for toxicity assessment by measuring the mean root growth of onions (Allium cepa L.). Environm Toxicol and Water Quality 8: 461-470. [ Links ]
Gavamukulya, Y.; Abou-Elella, F.; Wamunyokoli, F.; AElShemy, H. 2014. Phytochemical screening, antioxidant activity and in vitro anticancer potential of ethanolic and water leaves extracts of Annona muricata (Graviola). Asian Pac J Trop Med; 7(Suppl 1): S355-S363. [ Links ]
Goñi, O.; Sánchez-Ballesta, M.T.; Merodio, C.; Escribano, M.I. 2010. Ripening-related defense proteins in Annona fruit. Postharvest Biology and Technology 55: 169-173. [ Links ]
Guevara, V.R.N. 2015. Efecto de Morinda citrifolia L. noni en el ciclo celular de Vicia faba L. Tesis Bach. Universidad Nacional Trujillo, Perú [ Links ].
Gupta-Elera, G.; Garrett, A.R.; Martinez, A.; Robison, R.A.; O'Neill, K.L. 2011. The antioxidant properties of the cherimoya (Annona cherimola) fruit. Food Research International 44: 2205- 2209. [ Links ]
Hirazumi, A.; Furusawa, E.; Chou, S.; Hokama, T. 1996. Inmuno modulation contributes to the anticancer activity of Morinda citrifolia (noni) fruit juice. Proc. West Pharmacol. Soc. 39: 7-9. [ Links ]
Jiménez, V.M.; Gruschwitz, M.; Schweiggert, R.M.; Carle,R.; Esquivel, P. 2014. Identification of phenolic compounds in soursop (Annona muricata) pulp by high-performance liquid chromatography with diode array and electrospray ionization mass spectrometric detection. Food Research International 65: 42-46. [ Links ]
Kamiya, K.; Hamabe, W.; Tokuyama, S.; Hiranoc, K.; Satakea, T.; Kumamoto, Y.; Yoshida, H.; Mizushina, Y. 2010. Inhibitory effect of anthraquinones isolated from the Noni (Morinda citrifolia) root on animal A-, B- and Y-families of DNA polymerases and human cáncer cell proliferation. Food Chemistry 118: 725–730. [ Links ]
Kashanian, S.; Zeidali, S.H. 2011. DNA binding studies of tartrazine food additive. DNA Cell Biol. 30(7): 499-505. [ Links ]
Kuras, M.; Pilarskib, R.; Nowakowskac, L.; Zobeld, A.; Brzosta, K.; Antosiewicze, J.; Gulewiczb, K. 2009. Effect of Alkaloid-Free and Alkaloid-Rich preparations from Uncaria tomentosa bark on mitotic activity and chromosome morphology evaluated by Allium Test. Journal of Ethnopharmacology 121: 140–147. [ Links ]
Lodish, H.; Baltimore, D.; Berk, S.; Ziopursky, S.L.; Matsudaira, P.; Darnell, J. 2012. Molecular Cell Biology. New York: Edit. Scientific American Books. INC. [ Links ]
Loizzo, M.R.; Tundis, R.; Bonesi, M.; Menichini, F.; Mastellone, V.; Avallone, L.; Menichini, F. 2012. Radical scavenging, antioxidant and metal chelating activities of Annona cherimola Mill. (cherimoya) peel and pulp in relation to their total phenolic and total flavonoid. Journal of Food Composition and Analysis 25: 179-184. [ Links ]
Ma, X.; Wang, X.; Liu, Y. 2012. Cytotoxicity and genotoxicity evaluation of urban surface waters using freshwater luminescent bacteria Vibrio-qinghaiensi sp.-Q67 and Vicia faba root tip. Journal of Environmental Sciences 24(10): 1861–1866. [ Links ]
Mahattanadul, S.; Ridtitid, W.; Nima, S. 2011. Effects of Morinda citrifolia aqueous fruit extract and its biomarker scopoletin on reflux esophagitis and gastric ulcer in rats. J Ethnopharmacol 134: 243-250. [ Links ]
Mpountoukas, P.; Pantazaki, A.; Kostareli,E.; Christodouloub, P.; Kareli, D.; Polilioua, S.; Mourelatos, C.; Lambropouloua, V.; Lialiaris, T. 2010. Cytogenetic evaluation and DNA interaction studies of the food colorants amaranth, erythrosine and tartrazine. Food and Chemical Toxicology 48 2934–2944. [ Links ]
Nitteranon, V.; Zhang, G.; Darienb, B.; Parkina, K. 2011. Isolation and synergism of in vitro anti-inflammatory and quinone reductase (QR) inducing agents from the fruits of Morinda citrifolia (noni). Food Research International 44: 2271–2277. [ Links ]
Patterson, R.M; Butler, J.S. 1982. Tartrazine-induced chromosomal aberrations in mammalian cells. Food Chem. Toxic. 20: 461- 465. [ Links ]
Srivastava, K.; Mishra, K.K. 2009. Cytogenetic effects of commercially formulated atrazine on the somatic cells of Allium cepa and Vicia faba. Pesticide Biochemistry and Physiology 93: 8–12. [ Links ]
Received May 18, 2016.
Accepted July 12, 2016.