Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Scientia Agropecuaria
versión impresa ISSN 2077-9917
Scientia Agropecuaria vol.8 no.1 Trujillo 2017
http://dx.doi.org/10.17268/sci.agropecu.2017.01.02
ARTÍCULOS ORIGINALES
Influencia de antioxidantes en la estabilidad oxidativa del aceite de chia (Salvia hispanica L.) por rancimat
Influence of antioxidants on oxidative stability of the oil Chia (Salvia hispanica L.) by rancimat
Eudes Villanueva; Gilbert Rodríguez*; Elza Aguirre; Víctor Castro
Universidad Nacional del Santa, Urb. Bellamar s/n, Chimbote, Perú.
Resumen
La rancidez oxidativa, conocida como autooxidación, es la principal causa de deterioro de aceites y grasas, la que puede controlarse mediante el empleo de antioxidantes incrementando la estabilidad oxidativa y vida en anaquel. El aceite de chía es rico en ácidos grasos poli-insaturados (PUFAs), particularmente en omega-3 (ω-3) y omega-6 (ω-6) beneficiosas para la salud humana, pero también los PUFAs favorecen a la reacción de autooxidación. El objetivo de este trabajo fue determinar el efecto de antioxidantes sintéticos y de origen natural a concentración de 200 ppm de etoxiquina (EQ), butilhidrixianisol (BHA), butilhidroxitolueno (BHT) y fortium (FT), sobre el índice de estabilidad oxidativa (OSI) del aceite de chía por rancimat a diferentes temperaturas (90, 100 y 110 °C). El método rancimat está incluido en los estándares AOCS Cd 12b-92, debido a su facilidad de uso y reproducibilidad permite evaluar el OSI en un periodo relativamente corto. Los resultados muestran que entre el BHT y EQ, así como entre el BHA y FT no presentan diferencia estadísticamente significativa (p ≤ 0,05). Siendo el BHT el antioxidante que incrementó en mayor proporción el OSI del aceite de chía, con un factor de protección (FP) de 1,30, 1,26 y 1,29 para las diferentes temperaturas aplicadas y con una energía de activación (Ea) de 82,75 kJ/mol, por lo tanto, se recomendaría su uso.
Palabras clave: aceite de chía; índice de estabilidad oxidativa; factor de protección; energía de activación; rancimat.
Abstract
Oxidative rancidity, known as autoxidation, is the main cause of deterioration of oils and fats, which can be controlled by the use of antioxidants increasing oxidative stability and shelf life. Chia oil is rich in polyunsaturated fatty acids (PUFAs), particularly omega-3 (ω-3) and omega-6 (ω-6) beneficial to human health, but PUFAs also favor the reaction of Autoxidation. The aim of this work was to determine the effect of natural and synthetic antioxidants at the concentration of 200 ppm of ethoxyquin (EQ), butylhydrixyanisol (BHA), butylhydroxytoluene (BHT) and fortium (FT), on the oxidative stability index (OSI) of chia oil per rancimat at different temperatures (90, 100 and 110 °C). The rancimat method is included in the AOCS Cd 12b-92 standards, because of its ease of use and reproducibility allows evaluating the OSI in a relatively short period. The results show that between BHT and EQ, as well as between BHA and FT, did not present a statistically significant difference (p ≤ 0.05). The BHT being the antioxidant that increased the chia oil OSI, with a protection factor (PF) of 1.30, 1.26 and 1.29 for the different temperatures applied and with an activation energy (Ea) of 82.75 kJ / mol, therefore, its use would be recommended.
Keywords: chia oil; oxidative stability index; protection factor; activation energy; rancimat.
1. Introducción
El aceite de la semilla de chía es una interesante fuente de PUFAs, particularmente el ácido α-linolénico (56,9% a 64,8%) que pertenece a la familia ω-3 (Ayerza y Coates, 2011); estos ácidos grasos son esenciales y ofrecen importantes beneficios para la salud y nutrición, como la protección contra enfermedades cardiovasculares, prevención de artritis, cáncer, enfermedades coronarias, diabetes, entre otros (Gogus y Smith, 2010). La oxidación de los PUFAs genera compuestos volátiles que imparten sabores y aromas indeseables poniendo en peligro la calidad nutricional del aceite y limitando su vida útil (Ixtaina et al., 2012). El proceso de autooxidación inicia cuando un átomo de hidrógeno (H•) es abstraído de un ácido graso insaturado (R:H) formando un radical alquilo (R•). La generación de este radical lipídico es termodinámicamente desfavorable y se inicia por la presencia de un iniciador como los radicales libres, el oxígeno singlete (1O2) o pigmentos que actúan como fotosensibilizadores (Ecuación 1). Con el fin de estabilizar, el radical alquilo (R•), por lo general se somete a un cambio en la posición del doble enlace (cis a trans) y la producción de un sistema dieno conjugado. El R• puede reaccionar con O2 para formar el radical peroxilo (ROO•) de gran energía, el que puede entonces abstraer un (H•) de otro ácido graso insaturfado para formar un hidro-peróxido (ROOH) y un nuevo radical (R•) (ecuación 2 y 3). Este proceso se propaga entonces a otro ácido graso (Srinivasan et al., 2008). El hidroperóxido forma los radicales alcoxi (RO•) e hidroxilo (HO•) que pueden abstraer H• de los ácidos grasos insaturados o reaccionar con sistemas conjugados continuando la reacción en cadena descrito en la ecuación 4 y 5 (Decker, 2002; Srinivasan et al., 2008). Finalmente, las reacciones 6, 7 y 8 indican la terminación de la reacción, cuando 2 especies de radicales se combinan para formar una especie no radical (ROOR).
R:H + O::O + Iniciador → R•+ HOO• (1)
R• + O::O→ ROO• (2)
ROO• + R:H→ ROOH + R• (3)
RO:OH→ RO• + HO• (4)
R::R + HO•→ R:R-O• (5)
R• + R•→R:R (6)
R• + ROO•→ ROOR (7)
ROO• + ROO•→ ROOR +O2 (8)
La presencia de PUFAs determina en gran medida la estabilidad oxidativa del aceite.
Por ello, en los últimos años se ha implementado la adición de antioxidantes a fin de extender la vida útil de los mismos (Guiotto et al., 2014; Bodoroina et al., 2017). Los antioxidantes (A:H) son compuestos o sistemas que retrasan la auto oxidación mediante la inhibición de la formación de radicales libres o mediante la interrupción de la propagación del radical libre en uno (o más) de varios mecanismos como por ejemplo: el barrido de las especies que inician la peroxidación, la inhibición de iones quelantes metálicos que no son capaces de generar especies reactivas o descomponer los peróxidos un iniciador como los radicales libres, el lipídicos, el bloqueo del •O2 para prevenir la formación de peróxidos, la ruptura de la reacción en cadena de la autooxidación y/o la reducción de las concentraciones de O2 localizadas (Nawar, 1996). La ecuación 9 y 10 describen la donación de átomos de hidrógeno (H•) del antioxidante a los radicales libres formando un compuesto peroxi-antioxidante (ROOA) que es estable e inocuo (Brewer, 2011).
ROO• + AH→ ROOH +A• (9)
ROO• + A• → ROOA (10)
El BHT y BHA son los antioxidantes fenólicos monovalentes más comunes de origen sintético, fuertemente solubles en grasas e insolubles en agua, el BHA se encuentra en el comercio como copos de cera blanca y el BHT como compuesto cristalino de color blanco (Shahidi y Wanasundara, 1992). La EQ (6-etoxi2,2,4-trimetil-l,2-dihydroquinolein) es un antioxidante usado en los productos alimenticios de origen animal y para evitar quemaduras superficiales en algunas frutas, es uno de los antioxidantes más comunes usados en los alimentos para bovinos y aves, es efectiva en aceites vegetales manteniendo bien su calidad como antioxidante durante el procesamiento; su uso es limitado en alimentos para humanos y algunas mascotas y, por motivos de seguridad, se pueden adicionar máximo 150 mg/kg de dieta (Codex Alimentarios, 2001). La exposición a EQ en animales y seres humanos a elevadas concentraciones debe ser evitada ya que tiende a acumularse en la corteza renal durante varios días después de una sola dosis; las lesiones renales inducidas por la administración crónica de una dieta que contiene EQ son zonas irregulares de la fibrosis, atrofia tubular, dilatación tubular focal, infiltración linfocítica, depósitos de material calcificado en el bulbo raquídeo y zonas de necrosis del tejido renal (Hernández et al., 1993).
El fortium (FT) está constituido de tocoferoles mixtos que son usados como aditivos en muchas categorías de alimentos, incluyendo productos lácteos, cereales, verduras verdes congeladas, margarina, embutidos frescos y congelados, aceites vegetales, refrescos, snacks y frutos secos, aderezos para ensaladas, bases de sopa, condimentos, patatas deshidratadas, carnes procesadas y productos horneados (Shahidi y Wanasundara, 2002). La determinación de la estabilidad oxidativa de los aceites se realiza por métodos estáticos tales como el índice de peróxidos, p-anisidina dienos y trienos conjugados o métodos dinámicos que están estandarizados como el Índice de Estabilidad Oxidativa (OSI) por rancimat (AOCS,Cd 12b-92). El método Rancimat se realiza bajo condiciones aceleradas de almacenamiento a altas temperaturas, es ampliamente utilizado por ser confiable, reproducible, no demanda consumo de reactivos y las medidas pueden ser monitoreadas automáticamente a través del tiempo (Frankel, 2005; Lutterodt et al., 2010; Gharby et al., 2011; Krichene et al., 2010; García-Moreno et al., 2013; de Leonardis y Macciola, 2012); hasta el momento no se han publicado estudios de la influencia de diferentes temperaturas en la estabilidad oxidativa del aceite de chía con adición de antioxidantes y por consiguiente no se ha establecido su energía de activación. Estudios de aceite de chía con adición de antioxidantes sintéticos y naturales en rancimat han sido evaluados solo a temperatura de 100 °C por Bodoroina et al. (2017) y a 98 °C por Ixtaina et al. (2012). La temperatura representa un efecto estadísticamente significativo (p ≤ 0,05) sobre la determinación del OSI (GarcíaMoreno et al., 2013), por ello este trabajo tuvo por objetivo determinar la influencia de los antioxidantes de origen natural y sintético a temperaturas de 90, 100 y 110 °C, así mismo estimar la influencia de los antioxidantes sobre la energía de activación de la reacción de autooxidación.
2. Materiales y métodos Materiales
Materiales
El aceite de chía fue extraído por prensado en frio (Prensa SEW-EURODRIVE modelo FA57/G, Alemania) con una velocidad de tornillo de 40 rpm. Las semillas se cosecharon en la región Ancash, provincia de Yungay, Perú (09° 08′ 20″ S de altitud y 77° 44′ 40″ W de latitud), las cuales presentaron una humedad del 9,01 ± 0,03 %. El aceite se mantuvo durante 30 días en un frasco obscuro bajo atmosfera de nitrógeno en un refrigerador (BOCSH, modelo KAN58A, Corea del Sur) a temperatura de (4,00 ± 0,5 °C) en las instalaciones del Instituto de Investigación Tecnológica Agroindustrial de la Universidad Nacional del Santa. Los antioxidantes sintéticos utilizados fueron: butilhidroxitolueno (BHT Ph., Lot #8170741000, Merck KGaA, Germany), butilhidrixianisol (BHA, Lot # ABH011L052, Omnichem CFS/USA) y etoxiquina (Rhonda, CAS N°#91-53-2, China) con una pureza del 94%; El antioxidante natural fue el fortium MT95 (RM 15515, Lot #1307109107; Kemin Industries, Inc.).
Caracterización de aceite
La composición de ácidos grasos del aceite de chía se determinó de acuerdo al método de los esteres metílicos de ácidos grasos (AOAC, 2000), el cual consistió en pesar 0,025 g de aceite y hacer reaccionar con 1,5 ml de NaOH 0,5 N a temperatura de 90 °C en un baño maría (Foos, modeloWB1024) por 5 minutos, posteriormente se enfrió a temperatura de 30 °C agregándose 2,0 ml de trifluoruro de boro calentándose a 100 °C por 30 min, nuevamente se enfrío añadiéndose 1 ml de iso-octano y 5 ml de solución saturada de NaCl, todo bajo agitación y cubierto constantemente con Nitrógeno. La identificación de los componentes se determinó en el cromatógrafo de gases (Shimadzu, modelo GC-2010, Japón), equipado con un detector de ionización de llama (FID) y un automuestreador Shimadzu AOC-20Si. Una columna capilar de sílice SP Rt™ 2560 (100 m x 0,25 mm con 0,20 µm film) se utilizó helio como gas portador a una velocidad de flujo de 30 ml/min y presión de 261,5 kPa. El Volumen de inyección fue de 1 µl. Temperatura del inyector fue programada a 225 °C y el detector a 250 °C. La temperatura del horno fue programada: temperatura inicial 100 °C por 4 min, luego a 240 °C con una velocidad de 3 °C/min por 10 min. El valor de peróxido (PV) se calculó conforme al método AOAC Cd 8-53. El valor de p-anisidina (p-AnV) según el método AOCS Cd 18-90 en espectrofotómetro Jasco (modelo V-670). El valor de oxidación total (TOTOX) fue calculado de acuerdo a Shahidi y Wanasundara (2002) como: TOTOX= (2×PV) + p-AnV. La densidad se realizó en un densímetro digital automático Rudolph Research Analytical DOM 2911.
Análisis rancimat
Los antioxidantes fueron adicionados en alícuotas al aceite de chía a concentraciones de 200 ppm. El BHA y BHT en estado sólido se disolvieron en un medio con etanol al 98% de pureza y luego se añadieron al aceite, para el caso del FT y EQ su adición fue directa debido a su estado líquido.
El índice de estabilidad oxidativa (OSI) fue expresado en horas y se determinó en el equipo rancimat (Metrohm, modelo 743, Switzerland), incluido en los estándares internacionales AOCS Cd 12b-92. Un flujo de aire de 15 L/h filtrado y seco se burbujeo en una muestra de 5,0 ± 0,1 g de aceite contenida en un tubo de reacción posteriormente fijada en un bloque de calefacción a temperaturas de 90, 100 y 110 °C, estas temperaturas fueron escogidas de acuerdo a la naturaleza del aceite y su resistencia a oxidarse, una temperatura muy elevada originaria tiempos de análisis muy cortos y una temperatura muy baja demandaría muchas horas de estudio (Bodoroina et al., 2017; Prasad-Timilsena et al., 2016; Martínez et al., 2015); además se ha establecido un rango de separación de 10°C, dado que la velocidad de reacción tiende a duplicarse (Navas, 2010). El flujo efluente del tubo de reacción que contienen los ácidos orgánicos volátiles de la muestra en proceso de oxidación se recogen en un recipiente de policarbonato con 60 ml de agua destilada, registrando por intermedio de un electrodo de forma continua su conductividad (µS/cm) (Metrohm, 2009). Finalmente, el factor de protección (FP) se determinó con la relación entre los períodos de inducción (OSI) de la muestra tratada con antioxidantes y el control (sin adición de antioxidantes) [FP = (OSI de antioxidante / OSI de control)].
Energía de activación (Ea)
Se determinó a partir de la pendiente de la recta que resulta de representar el logaritmo natural de los valores de OSI contra el inverso de la temperatura absoluta (Villanueva et al., 2013):
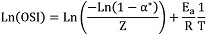
Donde α* representa el grado de transformación de moléculas insaturadas para el tiempo de inducción, R representa la constante universal de los gases (8,314 kJ/mol) y Z es el factor pre-exponencial de la ecuación de Arrhenius.
Análisis estadístico
Se realizó un diseño de bloques com- pletamente al azar y las medias de los tratamientos fueron contrastadas mediante la prueba de comparación múltiple Tukey a un nivel de significancia del 5% (p ≤ 0,05) y se utilizó el siguiente modelo estadístico: Yij = µ + τi + βj + εij; donde Yij es OSI con el antioxidante i en la temperatura j, µ es el promedio general del OSI; τi es el efecto del antioxidante i, βj es el efecto de la temperatura j y εij es el error experimental antioxidante i en la tempe-ratura j. Los datos fueron analizados usando el Statgraphics Plus statistical package v. 4 for Windows (Manugistics Inc., USA).
3. Resultados y discusión
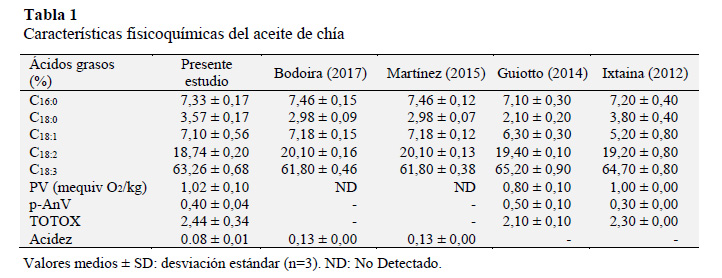
Composición fisicoquímica de aceite de chía
La composición en ácidos grasos del aceite de chía (Tabla 1) está constituido principalmente de 7,1% de ácidos grasos monoinsaturados y un 82% por ácidos grasos poliinsaturados. Se encontró 10,9% de ácidos grasos saturados y en ácido αlinolénico el resultado es semejante a los reportados por Martínez et al. (2015) con 61,8%, Guiotto et al. (2014) con 65,2% y por Ixtaina et al. (2012) con 64,7%.
El PV encontrado está dentro del límite permitido para aceites vírgenes y prensados en frío (PV ≤ 15 meq O2 / kg) (Codex Alimentarius, 2001). El p-AnV concuerda con lo reportado por Ixtaina et al. (2012); resumiéndose en un TOTOX bajo, lo cual indica la alta calidad del aceite utilizado.
Índice de estabilidad oxidativa en rancimat
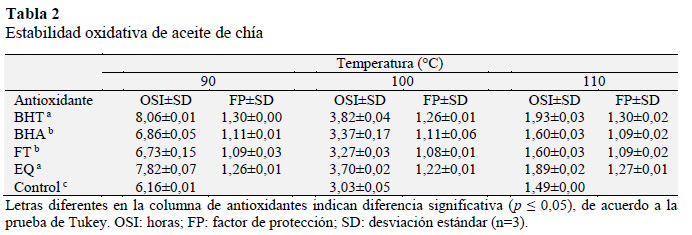
Los OSI del aceite virgen de chía y con adición de antioxidantes (Tabla 2) mostraron en todos los casos que la temperatura ejerció un efecto importante, lo que era predecible ya que es conocido que la velocidad de las reacciones químicas tiende a duplicarse por cada 10 °C de aumento de la temperatura a la cual ellas ocurren (Navas, 2010). Por lo tanto, los valores más altos de OSI se obtuvieron a medida que la temperatura decrece en orden de: 110, 100 y 90 °C. La presencia de los elevados niveles de ácidos grasos insaturados en el aceite de chía juega un papel fundamental y determinante en su estabilidad oxidativa, altos grados de insaturaciones están directamente asociados con un menor OSI. Sin embargo, el más bajo OSI no siempre corresponde con el más alto PUFA, lo que sugiere que otros factores, por ejemplo, el contenido de polifenoles y otros antioxidantes de origen natural en el aceite también contribuyen a la estabilidad oxidativa (Lutterodt et al., 2010).
Los OSI del aceite de chía control fueron 6,16, 3,03 y 1,49 h a 90, 100 y 110 ºC, respectivamente; al comparar estos resultados se encontró que para aceite de chía no encapsulado, los OSI a 90 °C fue de 3,2 h (Prasad-Timilsena et al., 2016) a 100 ºC de 2,4 h (Gonzales et al., 2016) y a 110 ºC de 1,4 h (Martínez et al., 2015); los OSI determinados en la presente investigación son similares al reportado por Martínez et al. (2015) a 110 ºC, pero son mayores cuando se comparan con los reportados a 90 y 100 ºC, posiblemente porque en la presente investigación el flujo de aire en rancimat fue de 15 L/h mientras que los demás investigadores utilizaron 20 L/h.
En la Tabla 2 se resume la estabilidad oxidativa del aceite de chía, se puede observar que el BHT muestra el mayor incremento del OSI con un factor de protección FP entre 1,26 y 1,30 para todas las temperaturas, superando a la EQ (FP entre 1,27 y 1,22), asimismo al BHA (FP entre 1,09 y 1,10), y al fortium (FP, entre 1,08 y 1,09); lo que nos indica que los antioxidantes sintéticos tuvieron mayor FP que el antioxidante natural (FT) a la misma concentración (200 ppm). Las comparaciones de Tukey muestran que no se ha encontrado diferencias significativas entre los tratamientos de BHT y EQ, de la misma forma entre el BHA y FT tampoco presentan diferencias significativas, mostrando de esta manera que todos los tratamientos fueron diferentes al control a un nivel de significancia del 5% (p ≤ 0,05). Una ventaja de los antioxidantes naturales sobre los sintéticos es que sus límites máximos permitidos son superiores al de los sintéticos, por ejemplo, la dosis normal de tocoferoles en aceites que contienen elevados PUFAs son de hasta 2000 ppm (Lampi et al., 2002). En tanto que el BHA y BHT son efectivos para la estabilización de aceites vegetales a la concentración máxima permitida de 200 ppm; con respecto a la EQ la concentración máxima permitida es de 500 ppm en alimentos y aceites, a excepción de harina de pescado donde solo se permite 200 ppm (Codex alimentarius, 2001).
Existen diversos antioxidantes de origen natural que han sido estudiados para incrementar la estabilidad oxidativa del aceite de chía en rancimat, entre ellos el extracto de romero a concentración de 250 ppm ejerce un FP de 1,60 y a 5000 ppm su factor de protección se incrementa a 3,40; el té verde a las mismas concentraciones ejerce un FP de 1,2 y 2 respectivamente, también los tocoferoles a 250 ppm tienen un FP de 1,2 y a 1500 ppm su FP de 2,1. Finalmente el palmitato de ascorbilo a 250 ppm tiene un FP de 1,1 y a 5000 ppm un FP de 4,3; por lo tanto, la adición de antioxidantes naturales aumenta el tiempo de estabilidad, dependiendo de su tipo y concentración (Ixtaina et al., 2012).
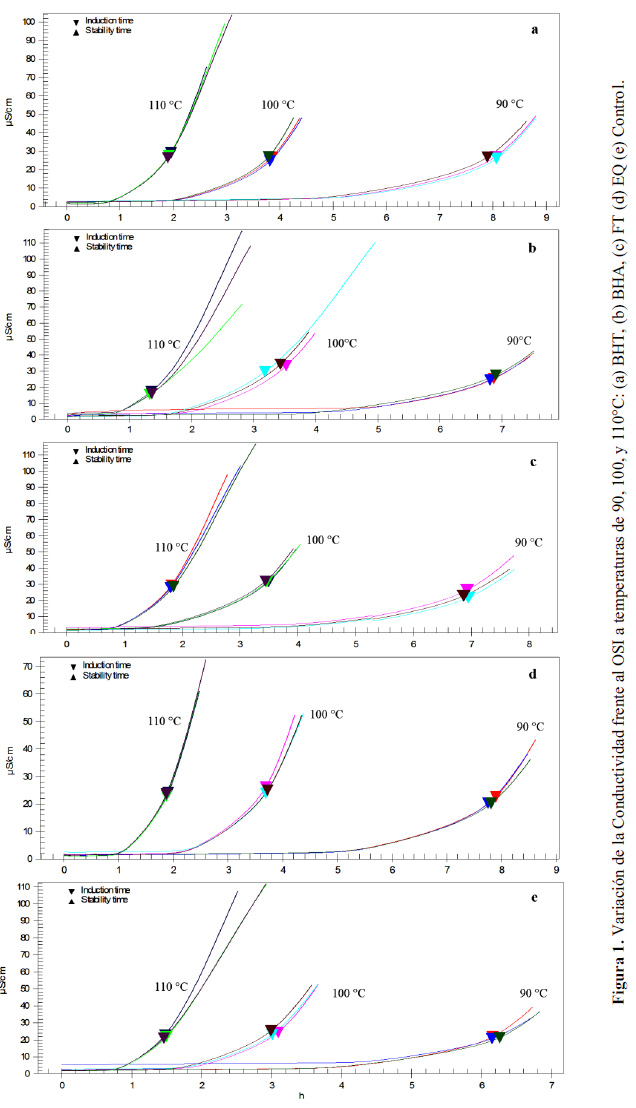
En la Figura 1 se observa el comportamiento de la curva "conductividad vs tiempo" y la determinación del OSI como resultado de la aplicación del método de la segunda derivada sobre la curva, dividiendo a esta en dos partes (Focke, 2016). Esta división en todos los casos, ya sea diferentes temperaturas y diferentes antioxidantes se encuentra entre 20 y 40 µS/cm, siendo un rango de conductividad crítico en procesos de autooxidación para la identificación de la formación de ácidos volátiles, principalmente ácido fórmico, a gran velocidad el cual determinara el OSI (García-Moreno et al., 2013). Los valores de Q10 (extraídos de la Figura 1) son: BHT 2,04; BHA 2,07; FT 2,05; EQ 2,03 y Control 2,03. Estos valores confirman que la velocidad de reacción tiende a duplicarse con el incremento de la temperatura por cada 10 °C (Navas, 2010).
Energía de Activación
La Ea para el control fue de 82,75 kJ/mol (Tabla 2), superior a los presentados por Guiotto et al. (2014) (71,95 kJ/mol) y Ixtaina et al. (2012) (69,5 kJ/mol).
El aceite de chía presenta menor Ea con respecto a otros aceites vegetales insaturados como el sacha inchi 137,90 kJ/mol (Rodríguez et al., 2015) y saturados como el aceite de oliva 104,9 kJ/mol (Márquez et al., 2008), además de Navas (2010) quien obtuvo 99,2 kJ/mol para aceite virgen de girasol, 96,2 kJ/mol para sésamo y 84,5 kJ/mol para uva.
La Ea es de interés en la caracterización de aceites ya que indica la demora del proceso de oxidación inicial, debido a la escisión de la unión en la cadena del ácido graso que tiene lugar para formar productos de oxidación primarios (Farhoosh et al., 2008). Se ha sugerido que la Ea es influida por el grado de poliinsaturación de aceites, la Ea parece ser menor para aceites con altos niveles de ácidos grasos poliinsaturados (Adhvaryu et al., 2000), considerándose excepciones como el aceite de sacha inchi cuyo grado de insaturación es elevado y los valores de Ea también resultan elevados, esto debido a la actividad antioxidante que pueden ejercer los tocoferoles en la matriz olea (Rodríguez et al., 2015). Considerándose por tanto al aceite de chía sensible frente a la oxidación acelerada, debido a los altos niveles de ácidos grasos poliinsaturados y la baja cantidad de antioxidantes que presenta en α-tocoferol (69 μg/g) γtocoferol (539 μg/g) y δ-tocoferol (110 μg/g) (Martínez et al., 2015).
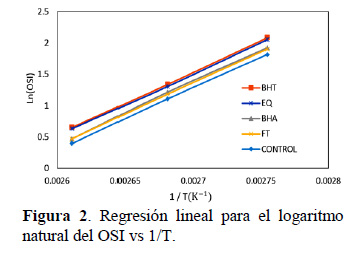
La adición de antioxidantes incrementó la Ea con respecto al control, para el BHT fue de 82,75 kJ/mol; EQ 82,07 kJ/mol; BHA 83,70 kJ/mol y finalmente el FT 82,90 kJ/mol, respectivamente (Figura 2).
4. Conclusiones
La adición de antioxidantes de origen natural y sintético incrementaron la estabalidad oxidativa de aceite de chía en el orden BHT > EQ > BHA > FT a un nivel de significancia del 5% (p ≤ 0,05), contribuyendo a la disminución del deterioro del aceite sometido a una oxidación acelerada en rancimat, por lo que puede utilizarse como una alternativa los antioxidantes sintéticos especialmente el BHT y BHA bajo las concentraciones permitidas por el Codex Alimentarius. Así mismo el estudio termodinámico revelo que la Ea del aceite de chía fue de 81,98 kJ/mol. La adición de los antioxidantes modifico las relaciones energéticas con el leve incremento de la energía de activación del aceite, para alcanzar el estado activado, que viene representado por la formación de hidroperóxidos luego de la adición de una molécula de O2 a los dobles enlaces de los ácidos grasos insaturados.
Agradecimientos
Los autores agradecen a las ingenieras: Mirella Colchado Ircañaupa, Diana Cortez Ibáñez y Julissa Estrada Talexio, por los análisis físicoquímicos prestados a la investigación en el Instituto de Investigación Tecnológico Agroindustrial (IITA).
Referencias bibliográficas
Adhvaryu, A.; Erhan, S.; Liu, Z.; Perez, J. 2000. Oxidation kinetic studies of oils derived from unmodified and genetically modified vegetables using pressurized differential scanning calorimetry and nuclear magnetic resonance spectroscopy. Thermochemica Acta 364: 87–97. [ Links ]
AOAC 991.39. 2000. Official Methods of Analysis of AOAC International.17th ed.; Chapter 41, p26, 2000. [ Links ]
Ayerza, R.Jr.; Coates, W. 2011. Protein content, oil content and fatty acid profiles as potential criteria to determine the origin of commercially grown chia (Salvia Hispanica L.). Industrial Crops and Products 34:1366–1371. [ Links ]
Bodoroina, R.M.; Penci C.M.; Ribotta P.D.; Martinez L.M. 2017. Chia (Salvia hispánica L.) oil stability: study of the effect of natural antioxidants. LWT Food Science and Technology 75: 107-113. [ Links ]
Brewer, M.S. 2011. Natural Antioxidants: Sources, Compounds, Mechanisms of Action, and Potential 851 Applications. Comprehensive Reviews in Food Science and Food Safety 10: 221–247. [ Links ]
Codex Alimentarius. 2001. Fats, oils and related products (2nded.). Rome, Italy: FAO/WHO Food Standards Programme. [ Links ]
Decker, E.A. 2002. Antioxidant mechanisms. In: Akoh, D.; Min, D.B. Editors. Food Lipids: Chemistry, Nutrition, and Biotechnology. 2nd ed. New York: Marcel Dekker, Inc. pp. 530–556. [ Links ]
De Leonardis, A.; Macciola V. 2012. Heat – oxidation stability of palm oil blended with extra virgin olive oil. Food Chemistry 135: 1769-1776. [ Links ]
Farhoosh, R.; Niazmand, R.; Rezaei, M.; Sarabi, M. 2008. Kinetic parameter determination of vegetable oil oxidation under Rancimat test conditions. European Journal of Lipid Science and Technology 110: 587– 592. [ Links ]
Frankel, E. 2005. Lipid oxidation (2nd ed.). Bridgwater, UK: The Oily Press Ltd. P. 187 – 208. [ Links ]
Focke, W.; Westhuizen,I.; Oosthuysen, X. 2016. Biodiesel oxidative stability from Rancimat data. Thermochimica Acta 633: 116–121. [ Links ]
Gharby, S.; Harhar, H.; El Monfalouti, H.; Kartah, B.; Maata, N.; Guillaume, D.; Char-rouf, Z. 2011. Chemical and oxidative properties of olive and Argan oils sold on the Moroccan market. A comparative study. Med. J. Nutr. Metab. 44: 1–8. [ Links ]
García-Moreno, P.; Pérez-Gálvez, R.; Antonio, G.; Emilia, M. 2013. Influence of the parameters of the Rancimat test on the determination of the oxidative stability index of cod liver oil. LWT Food Science and Technology 51: 303-308. [ Links ]
Gogus, U.; Smith, C. 2010. n-3 Omega fatty acids: a review of current knowledge. Int. J. Food Sci. Technol 45: 417–436. [ Links ]
González, A.; Marcela, L.; Martínez, A.J.; Paredes, A.E. León, Pablo D. Ribotta, 2016. Study of the preparation process and variation of wall components in chia (Salvia hispanica L.) oil microencapsulation. Powder Technology 301: 868–875 [ Links ]
Guiotto, E.N.; Ixtaina, V.Y.; Nolasco, S.M.; Tomás, M.C.M. 2014. Effect of Storage Conditions and Antioxidants on the Oxidative Stability of Sunflower– Chia Oil Blends. J Am Oil ChemSoc 91: 767-776 [ Links ]
Hernández, M.E.; Reyes, J.L.; Gomez-Lojero, C.; Sayavedra, M.S.; Melendez, E. 1993. Inhibition of the renal uptake ofp-aminohippurate and tetraethylammoniumby the antioxidant ethoxyquin in the rat. Food and Chem. Toxic. 31: 363–36. [ Links ]
Ixtaina, V.Y.; Nolasco, S.M.; Tomás, M.C. 2012. Oxidative stability of chia (Salvia hispanica L.) seed oil: effect of antioxidants and storage conditions. J Am Oil Chem Soc 89: 1077–1090 [ Links ]
Krichene, D.; Allalout, A.; Mancebo-Campos V.; Salvador M.; Zarrouk M.; Fregapane G. 2010. Stability of virgin olive oil and behaviour of its natural antioxidants under medium temperature accelerated storage conditions. Food Chemistry 121: 171–177. [ Links ]
Lampi, A.-M.; Kamal-Eldin, A.; Piironen, V. 2002. Tocopherols and Tocotrienols from Oil and 1020 Cereal Grains. In: Functional Foods, Biochemical and Processing Aspects. Vol. 2 (Eds. J. Shi, G. 1021 Mazza, M. Le Maguer). CRC Press, Boca Raton, FL, p. 1-38. [ Links ]
Lutterodt, H.; Luther, M.; Slavin, M.; Yin, J.; Parry, J.; Gao, J.; Yu, L. 2010. Fatty acid profile, thymoquinone content, oxidative stability, and antioxidant properties of cold-pressed black cumin seed oils. LWT-Food Sci. Technol 43: 1409–1413. [ Links ]
Martínez, M.L.; Curti, M.I.; Roccia, P.; Llabot, J.M.; Penci, M.C.; Bodoira, R.M.; Ribotta, P.D. 2015. Oxidative stability of walnut (Juglans regia L.) and chia (Salvia hispanica L.) oils microencapsulated by spray drying. Powder Technology 270: 271–277 [ Links ]
Marquez, R.; Martin, P.; Velasco, J.; Dobarganes, C. 2008. Formation of oxidation compounds in sunflower and olive oils under oxidative stability index conditions. European J. of Lipid Science & Technology 110: 1-6. [ Links ]
Metrohm, 2009. Programa para PC, 743 Rancimat 1.0 SR1. Herisau/ Suiza. [ Links ]
Navas, H. 2010. Componentes minoritarios y propiedades antioxidantes de aceites vírgenes y tortas residuales obtenidos por presión en frío a partir de fuentes vegetales convencionales y no convencionales. Tesis Doctoral. Univ. de Castilla La Mancha, Facultad de Ciencias Químicas. España. [ Links ]
Nawar, W.F. 1996. Lipids. In: Fennema O, editor. Food chemistry. 3rd ed. New York: Marcel Dekker, Inc. p 225–320. [ Links ]
Prasad-Timilsena, Y.; Adhikari, R.; Barrowc, C.J.; Adhikari, B. 2016. Microencapsulation of chia seed oil using chia seed protein isolate-chia seed gum complex coacervates. International Journal of Biological Macromolecules 91: 347–357. [ Links ]
Rodríguez, G.; Villanueva, E.; Glorio, P.; Baquerizo, M. 2015. Oxidative stability and estimate of the shelf life of sacha inchi (Plukenetia volubilis L.) oil. Scientia Agropecuaria 6: 155–163. [ Links ]
Shahidi, F.; Wanasundara, U. 2002. Methods for measuring oxidative rancidity in fats and oils. In C. C. Akoh, & D. B. Min (Eds.), Food lipids, chemistry, nutrition and biotechnology. New York, EEUU. [ Links ]
Shahidi, F.; Wanasundara, P.K. 1992. Phenolic antioxidants. Crit Rev Food Sci Nut 32(1): 67–103. [ Links ]
Srinivasan, O.; Parkin, K.L.; Fennema, O.; editors. 2008. Fennema’s food chemistry. 4th ed. Boca Raton, Fla.: CRC Press. 1144 pp.
Villanueva, E.; Castillo, D.; Rodríguez, G. 2013. Influence of the Rancimat parameters on the determination of oxidative stability index of Sesamum Indicum L. Oil. Scientia Agropecuaria 4: 173–180. [ Links ]
Corresponding author
E-mail: giropape@yahoo.com (G. Rodríguez)
Received August 25, 2016.
Accepted January 09, 2017.